Статья опубликована на с. 162-169
Введение
В системе антиоксидатной защиты условно различают первую и вторую линии «обороны». Первая линия «обороны» представлена супероксиддисмутазами, каталазой, тиоредоксиновой, глутаредоксиновой и пероксиредоксиновой системами. Инактиватором первичного биорадикала — супероксида аниона являются супероксиддисмутазы, которые передают эстафету каталазе. Однако функционирование ферментов первой линии «обороны» не гарантирует полной защиты от некоторых высокореактивных вторичных и третичных радикальных соединений — их инактивируют компоненты второй линии антиоксидантной «обороны» — фазы детоксикации. Вторая линия представлена такими ферментами детоксикации, как глутатионпероксидазы, глутатионтрансферазы, альдокеторедуктазы, альдегиддегидрогеназы. Метаболиты, образуемые в результате функционирования этих ферментов детоксикации, элиминируются из клетки в межклеточную жидкость, как правило, в виде глутатионовых S-конъюгатов. Глутатион и глутатион-зависимые ферменты, которые участвуют в обеих линиях «обороны» от агрессивного действия активированных кислородсодержащих метаболитов (АКМ) и активированных азотсодержащих метаболитов, играют центральную роль в функционировании антиоксидантной системы [30].
Индукция синтеза ферментов антиокислительной системы
Основными индукторами экспрессии антиоксидантных ферментов являются АКМ. Экспрессия генов антиоксидантных ферментов регулируется на уровне транскрипции через cis-активную последовательность, которая известна как элемент антиоксидантого ответа (АRЕ). Ключевую роль в активации антиоксидантных генов, взаимодействуя с АRЕ, играет фактор транскрипции NRF2 (NFE2L2 — nuclear factor (erythroid-derived 2)-like 2). Протеин NRF2 принадлежит к семейству Cap-N-Collar-регуляторных белков, которое также включает NRF1, NRF3 и p45NFE2 (рис. 1). Фактор транскрипции NRF2 контролирует трансактивность ряда генов, кодирующих как антиоксидантные протеины, так и ферменты детоксикации, которые определяют выживаемость клетки [33].
/163.jpg)
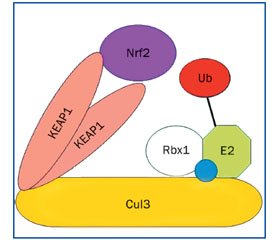
При физиологическом состоянии клетки цитоплазматически расположенный фактор транскрипции NRF2 находится в тесной связи с протеином KEAP1 (kelch-like ECH-associated protein 1). Молекулярное строение протеина KEAP1 позволяет ему одновременно взаимодействовать с NRF2 и протеином куллин-3 (CUL3). Молекула KEAP1 состоит из следующих доменов: NTR (N-терминального региона), BTB (bric-a-brac, tramtrack, and broad complex), IVR (промежуточная область), DC-домена, содержащего шесть Kelch-повторов и CTR (С-терминального региона). NTR- и BTB-домены протеина KEAP1 участвуют в гомодимеризации и во взаимодействии с CUL3, DC-домен связывается с Neh2 регионом протеина NRF2 (рис. 2) [15, 35, 41].
/163_2.jpg)
Протеин KEAP1 в цитоплазме крепится к актиновым нитям цитоскелета клетки. Он, физически взаимодействуя с NRF2, вступает в связь с CUL3 и, как адаптерная молекула, сближает протеин NRF2 с убиквитин-E3-лигазой, обусловливая его убиквитинирование и последующую протеасомную деградацию. В цитоплазме с низкой концентрацией АКМ фактор транскрипции NRF2 быстро деградирует, демонстрируя короткий период полураспада от 13 до 21 минуты. Цистеин-богатый протеин KEAP1 является не только ингибитором NRF2, но и сенсором АКМ. При развитии оксидантного стресса у протеина KEAP1 резко снижается функциональная активность. Несколько цистеиновых остатков, содержащихся в аминокислотной последовательности молекулы KEAP1, представляют собой молекулярный сенсор внутриклеточного окислительно-восстановительного состояния. Повышение внутриклеточного уровня АКМ приводит к окислению данных цистеиновых остатков молекулы KEAP1, в результате которого протеин KEAP1 теряет способность содействовать передаче молекулы NRF2 протеасоме, обусловливая увеличение продолжительности периода полураспада NRF2 до 100 ~ 200 минут. Фактор транскрипции NRF2 перемещается в ядро клетки, гетеродимеризуется и связывается с промоторами генов, содержащими элемент антиоксидантного ответа (antioxidant response element — ARE: 5′-NTGAG/CNNNGC-3′) (рис. 3).
/164.jpg)
От воздействия АКМ до ядерного импорта NRF2 проходит не более 15 минут. При взаимодействии с ARE фактор транскрипции NRF2 может связываться с различными транскрипционными факторами, в том числе с AP-1, активирующими транскрипционными факторами (ATF-1, ATF-2, ATF-3 и ATF-4), sMaf, PMF-1; рецепторами эстрогенов α и β (ERα и ERβ); рецептором γ, активирующим пролиферацию пероксисом (PPARγ). Посттрансляционное ацетилирование NRF2 и его транскрипционного коактиватора p300/CBP способствует связыванию NRF2 с промоторами конкретных генов. Также последовательность ядерного экспорта (NES) молекулы NRF2 в 138-й позиции содержит цистеиновый остаток, который высокочувствителен к действию АКМ. Его окисление ингибирует ядерный экспорт NRF2, способствуя накоплению данного фактора транскрипции в ядре клетки [13, 26, 27, 29, 33, 36, 40, 42].
Фактор транскрипции NRF2 активирует экспрессию генов некоторых антиоксидантных ферментов и транскрипционных факторов, НАДФ, шаперонов, факторов роста, рецепторов. Под его положительным влиянием находится транскрипция генов, кодирующих протеины, участвующие в детоксикации ксенобиотиков, транспорте лекарственных веществ, репарации клетки (табл. 1). В то же время фактор транскрипции NRF2 ингибирует экспрессию циклооксигеназы-2, iNOS, продукцию провоспалительных цитокинов IL-1β, IL-6, TNF-α [7, 14, 21, 32, 39].
В регуляции продукции антиоксидантных ферментов принимает участие и NRF1, который регулирует активность протеасомной деградации протеинов и транскрипцию генов глобина. Так, фактор транскрипции NRF1 индуцирует транскрипцию GCLC, GCLM, GS и металлотионеины-1, -2, защищающие клетку от повреждения тяжелыми металлами [5].
Активация продукции SOD связана не только с активностью фактора транскрипции NRF2, она также зависит от возбуждения внутриклеточных сигнальных путей, ассоциированных с факторами транскрипции АР-1 и NF-κB (табл. 2).
Инактивация первичных радикалов
Инактивация супероксида анион-радикала обусловлена функционированием супероксиддисмутаз, в результате каталитической активности которых супероксид анион-радикал дисмутирует до перекиси водорода, а последняя под влиянием каталазы восстанавливается до воды.
Супероксиддисмутазы
Как отмечает Ник Лейн [18], открытие Joe M. Mccords и Irwin Fridovich в 1939 году супероксиддисмутазы, «...по мнению многих, является самым важным открытием современной биологии, которое достойно награждения Нобелевской премией».
Краткая характеристика супероксиддисмутаз
Супероксиддисмутаза (SOD) человека относится к семейству металлоферментов, катализирующих реакцию дисмутации супероксидных радикалов. Различают три основные изоформы супероксиддисмутазы: Cu/ZnSOD, SOD1, которая содержит ионы цинка и меди и локализуется в цитоплазме клетки; MnSOD, SOD2, которая содержит ионы железа и марганца и локализуется в митохондриях; ECSOD, SOD3, которая содержит ионы цинка и меди и обычно локализуется на внешней поверхности мембраны клетки и в экстрацеллюлярном пространстве (табл. 3). Изоформы SOD различаются по чувствительности к Н2О2 и цианату. MnSOD устойчива к действию перекиси водорода, а Cu/ZnSOD необратимо ингибируется Н2О2. И в этом случае Cu/ZnSOD проявляет пероксидазную и гидроксил- и супероксидгенерирующую активность [6, 17].
Вклад Cu/ZnSOD составляет до 80–90 % от всего результата внутриклеточной супероксиддисмутазной активности. Данный энзим преимущественно располагается в цитоплазме клетки, но также присутствует в лизосомах, пероксисомах, ядре и межмембранном пространстве митохондрии. Супероксиддисмутаза MnSOD выполняет 10 % работы внутриклеточных SOD и экспрессируется в основном в матриксе митохондрий [8].
Первичная форма мономера Cu/ZnSOD представляет последовательность из 153 аминокислотных остатков. Протеин является гомодимером, который состоит из двух субъединиц (16 кДа), каждая из которых содержит по 8 антипараллельных цепей, образующих гладкий цилиндр и петли. В активном центре располагается ион меди, взаимодействующий с атомами азота имидазольных колец четырех остатков гистидина, и ион цинка, взаимодействующий с атомами азота имидазольных колец и карбоксильной группой аспарагина [11, 37].
Первичная форма мономера MnSOD представляет последовательность из 196 аминокислотных остатков. Протеин MnSOD является гомотетрамером [35]. Пространственная структура тетрамера устроена таким образом, что в каждой из четырех субъединиц N-терминальные спиральные шпильки и С-терминальные α/β домены содействуют приближению лигандов к атому марганца каталитического сайта [31, 38].
Индукция синтеза супероксиддисмутаз, каталитический цикл и физиологические функции
Несмотря на то что промотор гена Cu/ZnSOD содержит регуляторные элементы транскрипционных факторов ядерного фактора 1 (NF-1), специфичного протеина-1 (SP-1), NF-κB, AP-1 и AP-2, а также глюкокортикоид-, шаперон- и металл-регуляторные элементы, в респираторном тракте экспрессия мРНК Cu/ZnSOD не индуцируется цитокинами или АКМ. По всей вероятности, в органах дыхания основной функционирующей формой SOD является не Cu/ZnSOD, а митохондриальная MnSOD [16, 20].
Промотор ген MnSOD содержит регуляторные элементы транскрипционных факторов NF-κB, AP-1 и AP-2, Sp-1, в связи с чем индукторами экспрессии мРНК MnSOD в эпителиоцитах, альвеолярных макрофагах, фибробластах респираторного тракта являются: окислители, LPS, асбестовые волокна, TNF, IFN-γ, IL-1β, IL-6, VEGF. Начальная экспрессия мРНК MnSOD отмечается уже через 2 часа и достигает максимума через 24–48 часов. В среднем индуцибельное увеличение концентрации MnSOD в респираторном тракте составляет 520 %. Острая гипоксия приводит к значительному (32 %) снижению активности MnSOD в тканях органов дыхания [16].
Основной поток электронов в электрон-транспортной цепи, восстанавливающий кислород до воды, в физиологических условиях клетки используется для генерации энергии, которая аккумулируется в АТФ, и только небольшая их часть используется для генерации O2–, который дисмутируется SOD. В цепи переноса электронов происходит передача электронов в направлении роста окислительно-восстановительного потенциала переносчиков. Следовательно, у последнего акцептора электронов — О2 — этот потенциал наибольший. В то же время молекула кислорода (в отличие от системы цитохромов) не фиксирована и может случайным образом контактировать с любым членом цепочки и окислять его. Но обеспечить четырехэлектронное восстановление кислорода до воды может только последний цитохром аа3, в то время как все предыдущие переносчики приводят к восстановлению кислорода до свободнорадикальных форм.
Как уже упоминалось выше, супероксид анион-радикал может быть сгенерирован и другими оксиредуктазами (например, протеинами Nox-семейства, ксантиноксидазами).
Процесс инактивации супероксидного анион-радикала протекает в два этапа. Первоначально основным антиоксидантным активным компонентом выступает SOD, которая дисмутирует O2– до H2O2. Дисмутация, как и большинство химических реакций в живых системах, характеризуется двухэлектронным переносом, так как одноэлектронные переносы заряда могут привести к генерации цитотоксических свободных радикалов. Для нейтрализации супероксид анион-радикала необходим одномоментный перенос двух электронов, что и обеспечивает SOD [1]. В одноэлектронном переносе заряда принимают участие ионы металлов (Men): меди, марганца, железа, которые являются важнейшими составляющими активных центров многих ферментов, в том числе и SOD. На первом этапе O2– вступает в реакцию с металл-содержащим активным каталитическим центром SOD в качестве восстановителя. В связи с этим происходит редукция иона металла с выделением молекулы кислорода, а затем в качестве окислителя, обусловливая окисление иона металла с образованием H2O2 [6]. Этапы дисмутации O2– представлены следующими формулами [37]:
1) SOD-Men + O2– → SOD-Men–1 + O2;
2) SOD-Men–1 + O2– + 2H+ → SOD-Men + H2O2.
Однако MnSOD преимущественно функционирует как инактиватор супероксид анион-радикала. Показано, что каталитическая активность MnSOD сопряжена с накоплением перекиси водорода [2]. Основной внутриклеточной функцией MnSOD является защита митохондрий от повреждающего действия O2– [4, 24].
Особенности процесса дисмутации указывают, что MnSOD находится в точке бифуркации окислительно-восстановительных путей, обусловленных как одноэлектронным, так и двухэлектронным переносом заряда. С учетом того, что O2– преимущественно связывается с Fe-содержащими каталитическими центрами ферментов и белков, а H2O2 — с тиольными группами протеинов, по всей вероятности, данные формы АКМ являются элементами различных механизмов регуляции внутриклеточного метаболизма. Так, O2– регулирует внутриклеточный уровень содержания HIF-1α, который влияет на трансактивность множества генов, определяющих метаболизм, пролиферацию клеток, активность ангиогенеза. В то время как накопление H2O2 обусловливает увеличение внутриклеточного содержания окисленной формы глутатиона, обладающей цитотоксической активностью. В связи с этим биологической ролью MnSOD является не столько нейтрализация O2–, сколько контроль за балансом O2– и H2O2 во внутриклеточном пространстве клетки и в конечном счете — регуляция основных сигнальных путей жизнедеятельности [2, 6].
В частности, установлено, что мыши с нокаутом гена MnSOD погибают в эмбриональном периоде и гиперэкспрессия генов других форм SOD не предупреждает летальный исход [9]. У мышей с нокаутом гена MnSOD наблюдается ингибиция экспрессии генов P21, Myc, 14-3-3 zeta, циклина A, циклина В1 и GADD153, продукты которых участвуют в сигнальных каскадах, ответственных за выживаемость и защиту клетки от радиационно-индуцированного апоптоза [22]. MnSOD может блокировать высвобождение из митохондрий цитохрома С и белков Bcl-2 семейства в цитоплазму клетки, тем самым предотвращая развитие апоптоза [25].
Фермент MnSOD обладает выраженным противовоспалительным эффектом, который, вероятно, обусловлен снижением уровня образования пероксинитрита [24]. АКМ митохондриального происхождения участвуют в активации NLRP3-инфламмасомы, которая является макромолекулярным образованием, преобразующим пре-IL-1β в зрелую форму. Поэтому весьма вероятно, что инактивация O2– митохондриального происхождения при помощи MnSOD снижает активность инфламмасомы [3]. Также Kiichi Nakahira и соавт. [3] показали, что активация инфламмасомы связана с аутофагией. Удаление поврежденных митохондрий при помощи аутофагии препятствует активации инфламмасом. Подавление аутофагии при помощи химических ингибиторов приводит к увеличению митохондриального образования АКМ и соответствующему увеличению активации каспазы-1 и секреции IL-1β. Нокаут гена MnSOD в Т-клетках сопровождается развитием иммунодефицита и высокой восприимчивостью экспериментальных мышей к вирусу гриппа H1N1 [10].
Список литературы
1. Чупахин О.Н. Одноэлектронный перенос в органической химии // Соросовский образовательный журнал. — 2001. — Т. 7, № 10. — С. 33-37.
2. A new paradigm: manganese superoxide dismutase influences the production of H2O2 in cells and thereby their biological state / G.R. Buettner, C.F. Ng, M. Wang et al. // Free Radic. Biol. Med. — 2006. — Vol. 41, № 8. — P. 1338-1350. PMID: 17015180.
3. Autophagy proteins regulate innate immune responses by inhibiting the release of mitochondrial DNA mediated by the NALP3 inflammasome / K. Nakahira, J.A. Haspel, V.A. Rathinam et al. // Nat. Immunol. — 2011. — Vol. 12, № 3. — P. 222-230. doi: 10.1038/ni.1980.
4. Bayir H. Bench-to-bedside review: Mitochondrial injury, oxidative stress and apoptosis — there is nothing more practical than a good theory / H. Bayir, V.E. Kagan // Crit. Care. — 2008. — Vol. 12, № 1. — P. 206. doi: 10.1186/cc6779.
5. Biswas M. Role of Nrf1 in antioxidant response element-mediated gene expression and beyond / M. Biswas, J.Y. Chan // Toxicol. Appl. Pharmacol. — 2010. — Vol. 244, № 1. — P. 16-20. doi: 10.1016/j.taap.2009.07.034.
6. Buettner G.R. Superoxide dismutase in redox biology: the roles of superoxide and hydrogen peroxide // Anticancer Agents Med. Chem. — 2011. — Vol. 11, № 4. — P. 341-346. PMID: 21453242.
7. Cho H.Y. Nrf2 protects against airway disorders / H.Y. Cho, S.R. Kleeberger // Toxicol. Appl. Pharmacol. — 2010. — Vol. 244, № 1. — P. 43-56. doi: 10.1016/j.taap.2009.07.024.
8. Comhair S.A. Redox control of asthma: molecular mechanisms and therapeutic opportunities / S.A. Comhair, S.C. Erzurum // Antioxid. Redox Signal. — 2010. — Vol. 12, № 1. — P. 93-124. doi: 10.1089/ARS.2008.2425.
9. Copin J.C. Overexpression of copper/zinc superoxide dismutase does not prevent neonatal lethality in mutant mice that lack manganese superoxide dismutase / J.C. Copin, Y. Gasche, P.H. Chan // Free Rad. Biol. Med. — 2000. — Vol. 28, № 10. — P. 1571–1576. PMID: 10927183.
10. Elevated mitochondrial superoxide disrupts normal T-cell development, impairing adaptive immune responses to an influenza challenge / A.J. Case, J.L. McGill, L.T. Tygrett et al. // Free Radic. Biol. Med. — 2011. — Vol. 50, № 3. — P. 448-458. doi: 10.1016/j.freeradbiomed.2010.11.025.
11. Folding of human superoxide dismutase: disulfide reduction prevents dimerization and produces marginally stable monomers / M.J. Lindberg, J. Normark, A. Holmgren, M. Oliveberg // Proc. Natl. Acad. Sci. USA. — 2004. — Vol. 101, № 45. — P. 15893-15898. doi: 10.1073/pnas.0403979101.
12. Gene expression profiling of NRF2-mediated protection against oxidative injury / H.Y. Cho, S.P. Reddy, A. Debiase et al. // Free Radic. Biol. Med. — 2005. — Vol. 38, № 3. — P. 325-343. PMID: 15629862.
13. Kaspar J.W. Nrf2: INrf2 (Keap1) signaling in oxidative stress / J.W. Kaspar, S.K. Niture, A.K. Jaiswal // Free Radic. Biol. Med. — 2009. — Vol. 47, № 9. — P. 1304-1309. doi: 10.1016/j.freeradbiomed.2009.07.035.
14. Kensler T.W. Cell survival responses to environmental stresses via the Keap1-Nrf2-ARE pathway / T.W. Kensler, N. Wakabayashi, S. Biswal // Annu. Rev. Pharmacol. Toxicol. — 2007. — Vol. 47. — P. 89-116. doi: 10.1146/annurev.pharmtox.46.120604.141046.
15. Kensler T.W. Nrf2: friend or foe for chemoprevention? / T.W. Kensler, N. Wakabayashi // Carcinogenesis. — 2010. — Vol. 31, № 1. — P. 90-99. doi: 10.1093/carcin/bgp231.
16. Kinnula V.L. Superoxide dismutases in the lung and human lung diseases / V.L. Kinnula, J.D. Crapo // Am. J. Respir. Crit. Care Med. — 2003. — Vol. 167, № 12. — P. 1600-1619. doi: 10.1164/rccm.200212-1479SO.
17. Landis G.N., Tower J. Superoxide dismutase evolution and life span regulation / G.N. Landis, J. Tower // Mech. Ageing. Dev. — 2005. — Vol. 126, № 3. — P. 365-379. doi: 10.1016/j.mad.2004.08.012.
18. Lane N. Oxygen: The Molecule that Made the World. — Oxford University Press; USA, 2003. — 384 р.
19. Leonardo C.C. Dietary flavonoids are neuroprotective through Nrf2-coordinated induction of endogenous cytoprotective proteins / C.C. Leonardo, S. Doré // Nutr. Neurosci. — 2011. — Vol. 14, № 5. — P. 226-236. doi: 10.1179/1476830511Y.0000000013.
20. Li C., Zhou H.M. The role of manganese superoxide dismutase in inflammation defense / C. Li, H.M. Zhou // Enzyme Res. — 2011. — Vol. 2011. — P. 387176. doi: 10.4061/2011/387176.
21. Maher J. The rise of antioxidant signaling — the evolution and hormetic actions of Nrf2 / J. Maher, M. Yamamoto // Toxicol. Appl. Pharmacol. — 2010. — Vol. 244, № 1. — P. 4-15. doi: 10.1016/j.taap.2010.01.011.
22. Manganese superoxide dismutase-mediated gene expression in radiation-induced adaptive responses / G. Guo, Y. Yan-Sanders, B.D. Lyn-Cook et al. // Mol. Cell. Biol. — 2003. — Vol. 23, № 7. — P. 2362-2378. PMID: 12640121.
23. Miao L. Regulation of superoxide dismutase genes: implications in disease / L. Miao, D.K. St Clair // Free Radic., Biol., Med. — 2009. — Vol. 47, № 4. — P. 344-356. doi: 10.1016/j.freeradbiomed.2009.05.018.
24. Miriyala S. Mitochondrial superoxide dismutase — signals of distinction / S. Miriyala, A.K. Holley, D.K. St Clair // Anticancer. Agents Med. Chem. — 2011. — Vol. 11, № 2. — P. 181-190. PMID: 21355846.
25. Mitochondria protection of baicalein against oxidative damage via induction of manganese superoxide dismutase / I.K. Lee, K.A. Kang, R. Zhang et al. // Environ. Toxicol. Pharmacol. — 2011. — Vol. 31, № 1. — P. 233-241. doi: 10.1016/j.etap.2010.11.002.
26. Miyata T. Hypoxia. Intracellular sensors for oxygen and oxidative stress: novel therapeutic targets / T. Miyata, S. Takizawa, C. van Ypersele de Strihou // Am. J. Physiol. Cell. Physiol. — 2011. — Vol. 300, № 2. — P. C226-C231. doi: 10.1152/ajpcell.00430.2010.
27. Nguyen T. The Nrf2-antioxidant response element signaling pathway and its activation by oxidative stress / T. Nguyen, P. Nioi, C.B. Pickett // J. Biol. Chem. — 2009. — Vol. 284, № 20. — P. 13291-13295. doi: 10.1074/jbc.R900010200.
28. Nrf2 signaling and cell survival / S.K. Niture, J.W. Kaspar, J. Shen, A.K. Jaiswal // Toxicol. Appl. Pharmacol. — 2010. — Vol. 244, № 1. — P. 37-42. doi: 10.1016/j.taap.2009.06.009.
29. Oxidative stress, inflammation, and cancer: how are they linked? / S. Reuter, S.C. Gupta, M.M. Chaturvedi, B.B. Aggarwal // Free Radic. Biol. Med. — 2010. — Vol. 49, № 11. — P. 1603-1616. doi: 10.1016/j.freeradbiomed.2010.09.006.
30. Polifenoli e difese antiossidanti endogene: effetti sul glutatione e sugli enzimi ad esso correlati / C. Giovannini, C. Filesi, M. D'Archivio et al. // Ann. Ist. Super Sanita. — 2006. — Vol. 42, № 3. — P. 336-347. PMID: 17124358.
31. Purification, crystallization and X-ray structures of the two manganese superoxide dismutases from Caenorhabditis elegans / C.H. Trinh, T. Hunter, E.E. Stewart et al. // Acta Crystallogr. Sect. F. Struct. Biol. Cryst. Commun. — 2008. — Vol. 64, Pt. 12. — P. 1110-1114. doi: 10.1107/S1744309108037056.
32. Surh Y.J. Nrf2 as a master redox switch in turning on the cellular signaling involved in the induction of cytoprotective genes by some chemopreventive phytochemicals / Y.J. Surh, J.K. Kundu, H.K. Na // Planta Med. — 2008. — Vol. 74, № 13. — P. 1526-1539. doi: 10.1055/s‑0028-1088302.
33. Sykiotis G.P. Stress-activated cap'n'collar transcription factors in aging and human disease / G.P. Sykiotis, D. Bohmann // Sci. Signal. — 2010. — Vol. 3, № 112. — P. re3. doi: 10.1126/scisignal.3112re3.
34. Taguchi K. Molecular mechanisms of the Keap1–Nrf2 pathway in stress response and cancer evolution / K. Taguchi, H. Motohashi, M. Yamamoto // Genes Cells. — 2011. — Vol. 16, № 2. — P. 123-140. doi: 10.1111/j.1365-2443.2010.01473.x.
35. The primary structure of human liver manganese superoxide dismutase / D. Barra, M.E. Schinina, M. Simmaco et al. // J. Biol. Chem. — 1984. — Vol. 259, № 20. — P. 12595-12601. PMID: 6386798.
36. The role of the antioxidant and longevity-promoting Nrf2 pathway in metabolic regulation / G.P. Sykiotis, I.G. Habeos, A.V. Samuelson, D. Bohmann // Curr. Opin. Clin. Nutr. Metab. Care. — 2011. — Vol. 14, № 1. — P. 41-48. doi: 10.1097/MCO.0b013e32834136f2.
37. The structural biochemistry of the superoxide dismutases / J.J. Perry, D.S. Shin, E.D. Getzoff, J.A. Tainer // Biochim. Biophys. Acta. — 2010. — Vol. 1804, № 2. — P. 245-262. doi: 10.1016/j.bbapap.2009.11.004.
38. The structure of human mitochondrial manganese superoxide dismutase reveals a novel tetrameric interface of two 4-helix bundles / G.E. Borgstahl, H.E. Parge, M.J. Hickey et al. // Cell. — 1992. — Vol. 71, № 1. — P. 107-118. PMID: 1394426.
39. Transcriptional regulation of the AP‑1 and Nrf2 target gene sulfiredoxin / F.X. Soriano, P. Baxter, L.M. Murray et al. // Mol. Cells. — 2009. — Vol. 27, № 3. — P. 279-282. doi: 10.1007/s10059-009-0050-y.
40. Uruno A. The Keap1-Nrf2 system as an in vivo sensor for electrophiles / A. Uruno, H. Motohashi // Nitric Oxide. — 2011. — Vol. 25, № 2. — P. 153-160. doi: 10.1016/j.niox.2011.02.007.
41. Villeneuve N.F. Regulation of the Nrf2-Keap1 antioxidant response by the ubiquitin proteasome system: an insight into cullin-ring ubiquitin ligases / N.F. Villeneuve, A. Lau, D.D. Zhang // Antioxid. Redox Signal. — 2010. — Vol. 13, № 11. — P. 1699-1712. doi: 10.1089/ars.2010.3211.
42. Wu K.C. Nrf2 Protects Against Diquat-Induced Liver and Lung Injury / K.C. Wu, Y. Zhang, C.D. Klaassen // Free Radic. Res. — 2012. — 46 (10). — Р. 1220-1229. doi: 10.3109/10715762.2012.700709.
/163_2.jpg)
/164.jpg)

/163.jpg)
/165.jpg)
/166.jpg)