Статья опубликована на с. 15-22
Вопрос рационального применения антимикробных средств является одной из наиболее острых проблем не только отечественной педиатрии, но и мировой медицины в целом. Сегодня на долю антимикробных средств приходится 25 % всех врачебных назначений в мире, а затраты на закупку этих лекарственных препаратов составляют до 50 % расходов стационаров на медикаменты. Несмотря на широту арсенала антибактериальных средств и инновационные технологии их применения, проблемы рационального использования этих препаратов по-прежнему актуальны: по данным Всемирной организации здравоохранения (ВОЗ), только от 25 до 50 % больных получают адекватную антимикробную терапию. В Украине ситуация усугубляется наличием безрецептурного отпуска антибиотиков через аптечные сети, что приводит к частому бесконтрольному и порой необоснованному применению данных препаратов даже без врачебной рекомендации. Неоправданно широкое использование антибактериальных препаратов, частое стартовое назначение так называемых антибиотиков резерва, эмпирическое применение антимикробных препаратов, особенно у детей, страдающих респираторной патологией (самое большое число ошибок в назначении антибиотиков отмечается именно при лечении острых респираторных инфекций, острого тонзиллофарингита, острых кишечных инфекций, острого синусита, инфекций мочевыводящих путей, инфекций кожи и мягких тканей, внебольничной пневмонии и др.), приводят как к уменьшению эффективности антибиотикотерапии, так и к увеличению числа детей с очагами хронической инфекции, что, в свою очередь, требует повторных курсов лечения.
Закономерно, что одной из основных причин пристального внимания к проблеме необоснованного применения антибиотиков, без сомнения, является драматической рост резистентности микроорганизмов к антимикробным препаратам, и именно этот аспект остается приоритетным для Всемирной организации здравоохранения. Наряду с этой проблемой существует и ряд других негативных аспектов — возможно, менее глобальных с точки зрения всемирной значимости и возможных грядущих катастрофических последствий наступления «постантибиотической эры», но весьма существенных с точки зрения здоровья каждого конкретного ребенка, подвергшегося лечению (тем более необоснованному) антибактериальными средствами — отрицательному воздействию антибиотика на желудочно-кишечный тракт (ЖКТ) ребенка, на иммунную систему и особенно на кишечный микробиом [2].
Человеческий микробиом представляет собой совокупность всех микроорганизмов во всех его биотопах. Биотопов в человеческом организме множество — бактерии колонизируют все поверхности организма, контактирующие с внешней средой, в том числе кожу, полости рта/носа, мочеполовой системы и ЖКТ. Кроме того, установлено, что в некоторых органах, долгие годы считающихся стерильными, в том числе легких, молочных железах и плаценте, содержатся уникальные динамические сообщества микроорганизмов. В последнее время изучение микробиома и его влияния на состояние здоровья и развитие заболеваний признано одним из 10 величайших открытий начала XXI века, на сегодняшний день сформулирована концепция, согласно которой человек и его микробиом представляют собой суперорганизм со взаимодействующими генно-метаболическими связями, которые изучает новая наука — метаболомика. Одним из величайших прорывов, совершенных в области понимания значения микробиома, является реализация глобального международного Проекта по изучению роли микробиома в поддержании здоровья человека (Human Microbiome Project, стартовавший в 2007 г.), результаты которого убедительно показали, что микробиом формирует так называемые биопленки — прочную уникальную систему, которая сохраняет стабильность в меняющихся условиях внутренней и внешней среды. Она имеет единую генетическую систему (плазмиды) — кольцевые ДНК, определяющие поведенческий код членов биопленки, пищевые и энергетические связи, так называемое социальное поведение — микробный консорциум, зависящий от quorum sensing (чувства достаточности), который находится под контролем определенных генов [3].
Более того, новейшие данные, полученные в результате реализации этого проекта, доказывают влияние метагенома (генов микробиоты) на экспрессию генов человека с формированием тех или иных позитивных влияний микробиома на состояние здоровья человека, т.е. получены доказательства того, что от состояния микробиома зависят почти все жизненно важные параметры, характеризующие наше здоровье: качество и продолжительность жизни, склонность к частым заболеваниям, физическое и даже психическое состояние индивида [4].
На сегодняшний день благодаря использованию методов секвенирования установлено, что на поверхности тела человека и внутри него находится до 30 тыс. видов и свыше 70 тыс. штаммов микроорганизмов. При этом из всех биотопов именно кишечник, в особенности толстая кишка, населен наиболее обильно и содержит приблизительно 1000 различных видов известных распространенных бактерий — около 1014 бактериальных клеток, что в десять раз превышает количество всех клеток человеческого организма, составляющих разностороннюю, динамическую экосистему микроорганизмов. В кишечнике каждого человека содержатся группы, насчитывающие приблизительно по 160 видов бактерий, как комменсальные (резидентные), так и временно пребывающие в кишечнике бактерии, сосуществующие в состоянии комплексного симбиоза и равновесия. Согласно обзору, опубликованному Римским фондом в 2013 году, помимо газов, эти микроорганизмы продуцируют большое количество биологически активных веществ, способствующих усилению кишечной проницаемости, влияющих на моторику, восприятие боли, а также вызывающих микровоспаление [3, 5].
Научные достижения последних лет и проведенные множественные клинические наблюдения свидетельствуют, что микробиоценоз хозяина является его интегральной частью, своеобразным экстракорпоральным органом, играющим важную роль в физиологии человека. Связь с хозяином настолько специфична, что любое изменение в балансе между микрофлорой и организмом может привести к микроэкологическим нарушениям и, соответственно, болезни [6].
К числу наиболее существенных факторов, обусловливающих микроэкологические нарушения у человека, и особенно ребенка, в порядке их значимости можно отнести лекарственные средства, инфекции и ксенобиотики. Также изменению микробной флоры кишечника косвенно способствуют любые погрешности в питании: голодание, переход на новый пищевой рацион, введение прикорма, назначение парентерального питания, использование элементных диет (с преобладанием аминокислот, липидных фракций). Оперативные вмешательства на органах брюшной полости, желудочно-кишечные кровотечения, сопровождающиеся даже незначительной кровопотерей, также отражаются на состоянии микробной флоры кишечника. Нарушения микробиоценоза усугубляются гормональными изменениями, стрессом, радиацией [7].
Однако наиболее значительные микроэкологические нарушения, приводящие к развитию ятрогенных диарей, которые являются самым частым клиническим следствием страдания микробиома, вызываются различными лекарственными средствами. Сегодня описано более 700 препаратов, способных провоцировать послабление стула (около 7 % от общего числа побочных реакций лекарственных средств). К ним, в частности, относятся слабительные средства, магнийсодержащие антациды, антисекреторные препараты. В рекомендациях IV Маастрихтского консенсуса (2010) подчеркивалось наличие риска развития C.difficile-ассоциированной диареи (Сd-АД) у лиц, длительно принимающих ингибиторы протонной помпы, затем в феврале 2012 г. о возможной связи приема ингибиторов протонной помпы и ятрогенной диареи предупредило Управление по контролю качества продуктов питания и лекарственных средств США (FDA). Однако безусловными лидерами и по частоте провоцирования ятрогенных диарей, и по степени их выраженности, несомненно, являются антибактериальные препараты [8].
В организм человека антибиотики вводятся различными путями и способами: внутримышечно, внутривенно, интраназально, накожно, перорально, внутрь полостей и т.д. Однако наиболее распространенным и эффективным способом их введения является пероральный прием. В процессе транзита антибиотиков происходит их всасывание либо местное воздействие в том или ином отделе ЖКТ. Оказывая свое специфическое влияние на патогенный возбудитель, антибактериальные препараты одновременно действуют и на индигенную микрофлору. Вводимые парентерально антибиотики также способны влиять на микробную флору кишечника, выделяясь со слюной, желчью, секретами тонкой и толстой кишок [7].
Среди современных антибактериальных средств весьма сложно найти препараты, которые бы не обладали негативным действием на ЖКТ. Согласно официальной позиции FDA, «все классы антибиотиков широкого спектра действия в той или иной степени угнетают нормальную микрофлору толстого кишечника, что может привести к избыточному росту Clostridium difficile, последующему высвобождению токсинов А и В и развитию антибиотик-ассоциированной диареи. Клинические проявления нарушения кишечного микробиоценоза могут варьировать по степени тяжести от легкой диареи до тяжелейшего колита со смертельным исходом и проявляться отсроченно: зафиксированы случаи развития псевдомембранозного колита спустя два месяца после завершения курса антибактериальной терапии» [2].
Под термином «антибиотик-ассоциированная диарея» (ААД) в настоящее время, согласно критериям ВОЗ, понимают 3 и более эпизода неоформленного или водянистого стула в течение 2 или более дней подряд, связанных с приемом антибактериальных препаратов. ААД развивается у 5–35 % пациентов на фоне лечения антибиотиками или в течение 8 недель после их отмены. По данным разных авторов, в Украине у детей, получавших перорально антибактериальные средства широкого спектра действия, частота регистрации ААД составляет приблизительно 5–15,5 % (повышаясь в отдельных клиниках до 62 % и увеличиваясь в 3 раза при носительстве токсигенных штаммов C.difficile) [9].
Развитие ААД обусловлено нарушением качественного и количественного состава микрофлоры кишечника фармакологическим, токсическим и аллергическим действием антибактериального препарата. В зависимости от ведущего патогенетического механизма выделяют следующие виды диарей: осмотическая, секреторная, гипермоторная, инфекционная. В развитии ААД, как правило, реализуется несколько механизмов развития диареи, которые часто взаимосвязаны [9].
Вследствие подавления роста индигенной и усиления роста условно-патогенной микробной флоры, что отражается на метаболизме углеводов, происходит нарушение образования молочной кислоты и короткоцепочечных монокарбоновых жирных кислот, приводящее к развитию осмотической диареи с потерей больших объемов жидкости. При этом нарушается энтерогепатическая рециркуляция холевой и дезоксихолевой желчных кислот, что усугубляет диарею вследствие стимуляции секреции хлоридов и воды, характерной для секреторной диареи [9].
Спектры действия антибиотиков имеют существенные различия, однако в той или иной степени каждый из них отрицательно влияет на аэробную и анаэробную микрофлору, относящуюся к индигенной. Наиболее часто диарея возникает у пациентов при приеме клиндамицина и линкомицина (20–30 % случаев), амоксициллина/клавуланата (10–25 %), цефиксима (15–20 %). Реже причиной ААД становятся другие цефалоспорины (2–5 % случаев), ампициллин (5–10 %), макролиды (2–5 %), фторхинолоны (2–5 %) и тетрациклины, оказывающие энтеротоксическое действие на слизистую оболочку желудочно-кишечного тракта [9].
Помимо инфекционных причин развития ААД следует учитывать и побочные действия самих антибактериальных средств, патологически влияющих на моторику и функцию ЖКТ. Так, например, помимо прямого антибактериального эффекта на микробиом, входящая в состав некоторых антибиотиков пенициллинового ряда клавулановая кислота, являющаяся важным компонентом ряда защищенных антибиотиков, как и ее метаболиты, повышает перистальтическую активность тонкого кишечника (усиление моторной функции кишечника приводит к формированию гипермоторного характера диареи). Макролиды (в частности, эритромицин) способны стимулировать мотилиновые рецепторы кишечника, что также обычно способствует повышению моторной функции толстой кишки. При назначении антбиотиков из группы цефалоспоринов развитие диареи связано с неполным их всасыванием из просвета кишечника (гиперосмолярный тип диареи), а цефтриаксон и цефоперазон, помимо развития гиперосмолярного типа диареи, приводят к билиарной недостаточности и, как следствие, мальдигестии и усилению кишечной перистальтики. При этом следует отметить, что ААД наиболее часто наблюдается у новорожденных и детей в возрасте до 5 лет, что связывают с процессом становления микрофлоры кишечника [7].
Этиологические факторы антибиотик-ассоциированной диареи разнообразны, наиболее часто ее связывают с нарушением качественного и количественного состава микрофлоры кишечника, сопровождающимся снижением защитных функций слизистой оболочки кишечника и приводящим к росту патогенных и условно-патогенных микроорганизмов Clostridium perfringens (тип А), Staphylococcus aureus, Salmonella spp., Klebsiella oxytoca, Candida spp., Clostridium difficile. При этом токсинпродуцирующие штаммы Clostridium difficile — облигатной аэробной грамположительной спорообразующей бактерии, обладающей устойчивостью к большинству антимикробных средств, являются довольно распространенной и наиболее грозной причиной диареи (в среднем до 15–25 % случаев всех антибиотик-ассоциированных диарей). С появлением новых высоковирулентных штаммов C.difficile (риботипы 027, 078, 106), имеющих высокую резистентность к фторхинолонам и цефалоспоринам 2–3-го поколения, связывают увеличение частоты и тяжести ААД. Сd-АД развивается только при снижении колонизационной резистентности нормофлоры кишечника, что способствует адгезии возбудителя к клеткам слизистой оболочки кишечника. Популяция C.difficile в составе нормальной микрофлоры кишечника не должна превышать 0,001–0,01 %, в случае же приема антибиотиков, угнетающих рост штаммов кишечной флоры, которые в норме подавляют жизнедеятельность C.difficile, популяция ее может возрасти до 15–40 %. Диареи, ассоциированные с этим возбудителем, характеризуются тяжелым течением с развитием жизнеугрожающих осложнений и нередко летальным исходом (особенно в случае неадекватной терапии) [10].
Свое патогенное действие микроорганизм оказывает за счет продукции в просвете кишечника различных патологических веществ: энтеротоксина (токсин А), цитотоксина (токсин Б) и белка, угнетающего перистальтику кишечника. Их воздействие на слизистую оболочку кишечника пациента способствует возникновению воспалительных изменений, повышению проницаемости сосудов, выбросу нейропептидов (нейротензин, субстанция Р) и провоспалительных цитокинов (лейкотриены, простагландин Е2, интерлейкин-1 (ИЛ-1), ИЛ-6, фактор некроза опухоли a), развитию повышенного апоптоза эпителиальных клеток, образованию псевдомембран, гиперсекреции воды и электролитов. Следует отметить, что поражения кишечника, обусловленные C.difficile, возникают у большинства пациентов, находящихся на стационарном лечении (особенно в нефрологических, хирургических отделениях и отделениях для новорожденных), а также при нарушении состава эндогенной микрофлоры и снижении ее колонизационной резистентности. Необходимо учитывать преморбидный фон детей, принимающих антибиотики, а также наличие сопутствующей патологии: кишечной непроходимости различного генеза, хронических воспалительных болезней кишечника (неспецифический язвенный колит и болезнь Крона), стафилококковой инфекции, врожденных и приобретенных иммунодефицитов, оперативных вмешательств на органах брюшной полости.
Также существует ряд факторов, не просто способствующих, а значительно повышающих риск развития ятрогенной диареи на фоне приема антибактериального препарата. К таким факторам относят: возраст младше 7 лет, склонность к послаблению стула, применение антибиотика широкого спектра действия, длительные госпитализации, парентеральное питание, использование ингибиторов протонной помпы и противоопухолевых препаратов, частые клизмы, а также хирургические операции на брюшной полости в анамнезе [10].
Учитывая негативное влияние антибактериальной терапии на микробиом кишечника и, следовательно, здоровье ребенка в целом, принимая во внимание значительное ухудшение состояния пациента, вызываемое учащением случаев развития ААД, а также не забывая о неуклонном росте резистентности патогенных микроорганизмов к современным антибактериальным препаратам, в 2015 году Всемирная организация здравоохранения создала план действий по борьбе с устойчивостью к антибиотикам, направленный на повышение осведомленности о проблеме антибиотикорезистентности и пропаганду рационального использования антибиотиков среди общественности, медицинских работников и политиков. Главной целью реализации этого проекта, наряду с замедлением темпов антибиотикорезистентности, является также развитие педиатрической клинической фармакологии и приоритетное использование в рутинной практике препаратов, среди терапевтических преимуществ которых значатся не только высокая клиническая эффективность и высокий профиль безопасности, но и способность минимизировать токсичность ятрогенного воздействия на кишечную микробиоту. Препаратами, отвечающими всем вышеуказанным параметрам, являются пробиотики [11].
Целесообразность применения пробиотиков как средств, способных если не полностью закрыть вопрос развития ААД, то, во всяком случае, значительно снизить вероятность ее возникновения, на сегодняшний день очевидна. Так, эксперты Кокрановского сообщества, исследовавшие целесообразность профилактики ААД с помощью пробиотиков в педиатрической популяции, сделали вывод, что «…несмотря на применение различных пробиотических штаммов, использование разнообразных схем и длительности их применения, а также неоднородное качество проведенных РКИ, суммарный статистический анализ свидетельствует о несомненном протекторном эффекте пробиотиков в отношении ААД» [12]. Представители Всемирной гастроэнтерологической организации, суммируя все имеющиеся на тот момент данные доказательной медицины, еще в 2011 г. опубликовали глобальное руководство «Пробиотики и пребиотики», в котором перечислили показания для назначения пробиотиков, указали вид и дозировку пробиотических штаммов, доказавших свою эффективность в профилактике ААД [13].
Впоследствии в течение трех последних лет дополнительно было проведено большое количество рандомизированных клинических исследований (РКИ), рассматривавших эффективность различных пробиотических штаммов при ААД. В подавляющем большинстве случаев результаты РКИ чрезвычайно оптимистичны, лишь в небольшом проценте случаев эффективность назначения пробиотиков оценивается сдержанно, и крайне редко констатируется полное фиаско живых микроорганизмов в профилактике и лечении ААД. Так, в одном из самых крупных метаанализов, посвященных проблеме профилактики ААД, пробиотики получили весьма высокую оценку [14]. Проанализировав результаты 34 РКИ с общим количеством пациентов 4138 человек, E.J. Videlock и соавт. (2012) установили, что суммарный относительный риск (ОР) развития ААД при приеме пробиотика был гораздо ниже, чем при применении плацебо (ОР 0,53; количество больных, которых необходимо пролечить для получения одного благоприятного исхода (number need to treat, NNT), — 8).
В метаанализ, выполненный R. Pattani и соавт. (2013), вошли результаты 16 РКИ, при этом 4 РКИ были высокого качества, 5 РКИ — среднего, а 7 РКИ — низкого качества [15]. Обобщенный анализ результатов указанных РКИ показал, что прием пробиотиков позволяет снизить риск как ААД (ОР 0,61), так и Cd-АД (ОР 0,37). Показатель NNT при ААД был равен 11, а при Cd-АД — 14. При проведении подгруппового анализа исследователи отметили, что наиболее значимое снижение указанных показателей имело место в хорошо спланированных исследованиях, в РКИ с длительным периодом наблюдения (не менее 4 нед.), а также в РКИ с комбинированной конечной точкой (ААД + Cd-АД) [15].
Несмотря на устоявшееся мнение относительно того, что отсутствие пробиотической поддержки может спровоцировать появление ААД, дискуссии не прекращаются и сегодня. Среди ряда таких публикаций следует особо выделить работу G. Micklefield и соавт. (2014), в которой изучалась эффективность Saccharomyces boulardii в профилактике ААД [16]. Отобрав результаты 17 РКИ, отвечавших условиям включения в метаанализ, немецкие ученые установили, что эффективность пробиотика колебалась от 43,7 до 87,3 % (данные 14 РКИ, n = 4627). Метаанализ 5 РКИ с общим количеством пациентов 1076 человек продемонстрировал достоверное уменьшение риска развития ААД при применении Saccharomyces boulardii с 17,2 до 6,7 %. В метаанализе 4 РКИ, в которых пробиотик использовался при проведении эрадикации хеликобактерий (n = 1215), зафиксировано снижение вероятности ААД с 12,2 до 5,6 %. Основываясь на полученных данных, G. Micklefield и соавт. рекомендуют использовать Saccharomyces boulardii для профилактики ААД.
Когда оценивается эффективность пробиотика, нужно помнить о рекомендациях Всемирной гастроэнтерологической ассоциации, которая рекомендует производителям указывать класс, вид и штамм каждого пробиотика [13]. Ведь исследование определенного пробиотического рода и штамма не может быть использовано для другого.
По сути, в отношении пробиотического препарата не существует понятия «генерик», ведь повторяемость эффективности пробиотика обеспечивается изготовлением из того же штамма, по тому же «рецепту» производства.
Так, когда мы рассматриваем доказательную базу по Saccharomyces boulardii, в подавляющем большинстве случаев речь идет о Saccharomyces boulardii СNCM I-745, который в Украине представлен лекарственным препаратом Энтерол®. Энтерол® (лиофилизированная форма Saccharomyces boulardii CNCM I-745) назван пробиотиком с уровнем клинических доказательств А в журнале World Journal of Gastroenterology (McFarland, 2010), зарегистрирован в Институте Пастера в г. Париже и был изучен в многочисленных штамм-специфических исследованиях, которые свидетельствуют о высокой эффективности и безопасности этого штамма [17].
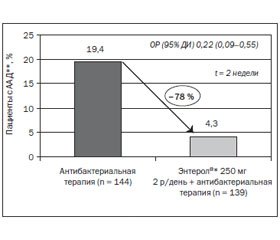
Эффективность препарата Энтерол® в профилактике ААД доказана также исследованиями в педиатрической популяции. Так, в работе L.S. Shan, 2013 [18], на протяжении 1-й фазы исследования дети принимали антибактериальные препараты по поводу острого инфекционного заболевания нижних дыхательных путей (n = 333). Детей рандомизировали для проведения монотерапии антибиотиком (группа В; n = 166) либо для комбинированного назначения антибактериального препарата и пробиотика (группа А; 500 мг/сут Saccharomyces boulardii, n = 167) на протяжении 2 нед. Пациентов из группы В, у которых развился диарейный синдром в течение 2-недельного курса антибиотикотерапии или 2 нед. спустя, дополнительно рандомизировали для проведения пероральной регидратационной терапии (группа В2) или для приема Saccharomyces boulardii одновременно с регидратационными препаратами (группа В1). Оказалось, что распространенность диареи у детей, получавших пробиотик, была значительно ниже, чем в группе сравнения (7,9 vs 29,2 %; ОР 0,27), а прием Saccharomyces boulardii уменьшал риск развития ААД (4,3 vs 19,4 %; ОР 0,22) (рис. 1).
У 42 детей, вошедших в состав группы В, развился диарейный синдром. Назначение им Saccharomyces boulardii на протяжении 5 дней позволило уменьшить частоту стула (р < 0,05) и увеличить темпы выздоровления (91,3 % в группе В1 vs 21,1 % в группе В2; р < 0,001). Средняя продолжительность диареи в группе В1 была короче, чем в группе сравнения (2,31 ± 0,95 дня vs 8,96 ± 1,07 дня; р < 0,01) (рис. 2).
По мнению L.S. Shan и соавт., назначение Saccharomyces boulardii детям, получающим антибиотики, является эффективным методом профилактики ААД.
Несомненным преимуществом использования Saccharomyces boulardii для защиты кишечника при приеме антибактериальной терапии является возможность Saccharomyces boulardii профилактировать риск развития такого непредсказуемого и грозного осложнения, как Clostridium difficile-ассоциированная диарея [19].
Таким образом, назначение пробиотических штаммов для профилактики ААД как у взрослых пациентов, так и у детей на данный момент является стандартной схемой отечественных и европейских протоколов лечения, при этом основанием для выбора штамма являются данные о его антибиотикорезистентности. К сожалению, значительная часть пробиотиков, представленных на мировом рынке, чувствительна к большинству имеющихся антибиотиков. Данные литературы свидетельствуют о том, что некоторые Lactobacіllі, Enterococcі, Bacіllus cereus и Bіfіdobacterіa не являются резистентными к таким повсеместно используемым антибиотикам, как амоксициллин, доксициклин, фторхинолоны и цефалоспорины. Этот существенный недостаток бактериальных препаратов значительно ограничивает их использование, так как применение их наряду с антибиотикотерапией или непосредственно после нее неизбежно сопровождается инактивацией введенных штаммов. Определенным выходом из ситуации является использование антибиотикорезистентных штаммов микроорганизмов — такие полирезистентные пробиотики могут применяться одновременно с антибиотиками для профилактики возникновения побочных явлений со стороны пищеварительного тракта, вызванных пероральными антибиотиками. Одним из таких пробиотических штаммов является род Saccharomyces boulardii.
Являясь сахаромицетами, Saccharomyces boulardii относятся к эукариотам — высшим одноклеточным организмам, так как обладают истинными ядрами, окруженными ядерными мембранами. Их принципиальным отличием от бактерий-прокариотов, имеющих более простое строение, является устойчивость к действию антибиотиков и других антимикробных агентов, причем эта стойкость генетически детерминирована и не подвергается модификации или передаче другим микроорганизмам. Подобная устойчивость проявляется ко всем группам антибиотиков в концентрациях намного более высоких, чем обычно применяются в терапевтической практике, что является фактором, определяющим врачебный выбор Saccharomyces boulardii в качестве пробиотика.
В то время как антибиотикорезистентность Saccharomyces boulardii не передается патогенным бактериям, у бактериальных пробиотиков такой потенциал существует за счет наличия плазмид. Если на этапе производства пробиотика плазмиды с генами резистентности не были замечены, они могут быть переданы патогенным бактериям, делая их нечувствительными к антибиотикам.
На сегодняшний день накоплен значительный научный материал, базирующийся на современных принципах доказательной медицины относительно эффективности и безопасности препарата Энтерол® в профилактике и лечении ААД у детей и взрослых. Saccharomyces boulardii защищают структуру плотных контактов, предупреждая выделение воды и электролитов в просвет кишечника, препятствуют патогенному действию энтеротоксинов вследствие блокирования рецепторов — мишеней энтероцитов, повышают продукцию местного IgA, обладают трофическим эффектом в отношении слизистой оболочки кишечника вследствие стимуляции высвобождения полиаминов (спермин и спермидин). Они могут восстанавливать естественную микрофлору кишечника, оказывая антагонистический эффект в отношении патогенных и условно-патогенных микроорганизмов, а также грибов, повышать ферментную активность дисахаридаз в тонком кишечнике, нормализуя усвояемость углеводов.
Доказано противомикробное действие, обусловленное антагонистическим эффектом в отношении патогенных и условно-патогенных микроорганизмов: Clostridium difficile, Klebsiella pneumoniae, Staphylococcus aureus, Pseudomonas aeruginosa, Candida krusei, Candida albicans, Candida pseudotropicalis (in vitro также в отношении Salmonella typhi, Escherichia coli, Shigella dysenteriae, Yersinia enterocolitica). Препарат ингибирует рост этих микроорганизмов, а также Entamoeba histolytica, Lambliae. Saccharomyces boulardii оказывают антитоксическое действие, особенно в отношении токсинов Clostridium difficile, вызывающих псевдомембранозный колит, а также энтеротоксинов. Механизм антитоксического действия связан с выработкой нейтрализующего фактора, который влияет на интестинальные клетки через рецептор, соединенный с G-протеином, а также с адгезией к энтероцитам и снижением активации аденилатциклазы энтеротоксинами и вследствие этого — уменьшением секреции воды и солей. Попав в пищеварительный канал, сахаромицеты оказывают биологическое защитное действие на нормальную кишечную микрофлору. Кислота желудка не действует на Saccharomyces boulardii, они не перевариваются и при ежедневном приеме сохраняют жизнеспособность во всех отделах пищеварительной системы. При этом дрожжевые грибы не колонизируют кишечник, и он освобождается от них через несколько дней после окончания лечения.
Для Saccharomyces boulardii характерен микробный антагонизм: они ингибируют рост различных патогенных микроорганизмов в пищеварительном тракте, способствуют активации противоинфекционной защиты — усиливают образование секреторного IgА и секреторного компонента Ig в тонком кишечнике, оказывают антитоксическое действие в отношении холерного вибриона и токсинов, выделяемых Clostridium difficile. Эффективность Saccharomyces boulardii изучалась в эксперименте при клиндамицин-индуцированных колитах, поражении кишечника, вызванном Саndidа, в том числе и при кандидозе, связанном с лечением антибиотиками. Установлено, что Saccharomyces boulardii in vitro ингибируют рост патогенных микроорганизмов, а in vivo в эксперименте выявлен выраженный антагонизм Saccharomyces boulardii к Candida albicans.
Клиницисту необходимо помнить, что высокая эффективность и безопасность препарата Энтерол® — Saccharomyces boulardii СNCM I-745 (уровень доказательности I, A), которая не может быть экстраполирована на другие пробиотики; генетически обусловленная устойчивость Saccharomyces boulardii к действию антибактериальных препаратов; антитоксическое, противовоспалительное действие сахаромицет, возможность повышения локального иммунитета — все это обосновывает возможность их широкого использования с целью профилактики ААД в клинической практике при антибиотикотерапии различных инфекционных заболеваний.
Следует отметить, что данные о Saccharomyces boulardii, которыми мы располагаем, базируются на клинических и экспериментальных исследованиях с тщательно спланированным дизайном, отвечающим высоким требованиям доказательной медицины. Результаты этих исследований позволяют экспертным организациям рекомендовать именно Saccharomyces boulardii для профилактики и лечения различных состояний, связанных с нарушением микрофлоры кишечника: Маастрихт IV — при применении Saccharomyces boulardii в качестве адъювантной к антихеликобактерной терапии показаны снижение побочных эффектов и возможность улучшения уровня эрадикации [20]; Европейское общество детской гастроэнтерологии, гепатологии и нутрициологии рекомендует использование Saccharomyces boulardii при остром гастроэнтерите (с регидратацией) [21]; в 2015 году в Journal of Clinical Gastroenterology опубликованы рекомендации Йель/Гарвард по использованию пробиотиков: профилактика ААД для Saccharomyces boulardii — уровень доказательств А [19]. В этом же документе эксперты рекомендуют Saccharomyces boulardii и для профилактики Clostridium difficile-ассоциированной диареи.
При назначении пробиотика для профилактики и лечения врач (как терапевт, так и педиатр) должен четко понимать преимущества использования препарата с доказанной эффективностью, которые заключаются в получении предсказуемого и ожидаемого эффекта в определенные сроки и в определенной дозировке.

/20.jpg)