Журнал «Здоровье ребенка» 5 (73) 2016
Вернуться к номеру
Діагностичний алгоритм патології підшлункової залози у дітей з алергічними захворюваннями
Авторы: Карпушенко Ю.В. - Харківський національний медичний університет, м. Харків, Україна
Рубрики: Гастроэнтерология, Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
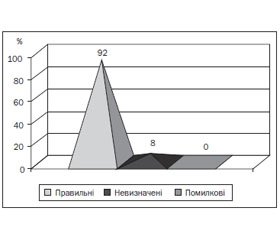
Актуальність. Збільшення випадків алергічних захворювань у всьому світі, безпосередній їх зв’язок з ураженням органів травлення з формуванням функціональних порушень і запальних процесів, більш рання їх маніфестація обумовлюють актуальність вивчення та необхідність якомога ранньої діагностики цих захворювань у дітей. Мета. Підвищення якості діагностики патології підшлункової залози у дітей з алергічними захворюваннями. Матеріали та методи. Обстежено 169 дітей віком від 3 до 17 років, основну групу становлять 105 дітей з алергічними захворюваннями, контрольну — 64 дитини. Верифікація алергії: шкірні тести, специфічні імуноглобуліни та загальний імуноглобулін E. Обстеження підшлункової залози: визначення рівня α-амілази, трипсину, ліпази крові, розширена копроцитограма, постпрандіальна гіперемія при ультразвуковому її дослідженні. Алгоритм діагностики створений за допомогою неоднорідної послідовної процедури Вальда — Генкіна. Результати. Визначений діагностичний коефіцієнт, згідно з яким на користь патології підшлункової залози свідчать: постпрандіальна гіперемія 5–15 %, неоднорідна ультразвукова структура підшлункової залози з підвищеною чи зниженою ехогенністю; запор чи нестійке випорожнення з ознаками амілореї та йодофільної флори; у ранньому анамнезі ексудативно-катаральна аномалія конституції; скарги на біль помірної інтенсивності після прийому їжі або не пов’язаний із ним, з локалізацією навколо пупка або в правому підребер’ї; диспептичний синдром; помірна пальпаторна больова чутливість в епігастрії, проекції підшлункової залози та за ходом товстого кишечника; наявність шкірних і відсутність респіраторних проявів алергії; дошкільний вік; підвищений рівень трипсину та амілази крові; обтяжена спадковість за захворюваннями органів травлення; астеновегетативний синдром; патологія вагітності та пологів, нераціональне харчування, супутня соматична патологія; жіноча стать, нормальний рівень загального імуноглобуліну E. Висновки. Алгоритм дозволяє діагностувати патологію підшлункової залози із 95-відсотковою вірогідністю, диференційовано підходити до терапії та запобігти хронізації.
Актуальность. Увеличение частоты аллергических заболеваний в мире, их связь с поражением органов пищеварения с формированием функциональных и воспалительных нарушений, более ранняя манифестация обусловливают актуальность изучения и необходимость ранней диагностики этих заболеваний у детей. Цель. Повышение качества диагностики патологии поджелудочной железы у детей с аллергическими заболеваниями. Материалы и методы. Обследованы 169 детей в возрасте от 3 до 17 лет, основную группу составили 105 детей с аллергическими заболеваниями, контрольную — 64 ребенка. Верификация аллергии: кожные тесты, специфические иммуноглобулины и общий иммуноглобулин E. Обследование поджелудочной железы: определение уровня α-амилазы, трипсина, липазы крови, расширенная копроцитограмма, постпрандиальная гиперемия при ультразвуковом обследовании. Алгоритм диагностики создан при помощи неоднородной последовательной процедуры Вальда — Генкина. Результаты. Определен диагностический коэффициент, согласно которому о патологии поджелудочной железы свидетельствуют: постпрандиальная гиперемия 5–15 %, неоднородная ультразвуковая структура поджелудочной железы с повышенной или сниженной эхогенностью; запор или неустойчивый стул, амилорея, йодофильная флора; в раннем анамнезе экссудативно-катаральная аномалия конституции; жалобы на боль умеренной интенсивности после еды или не связанная с ней, с локализацией вокруг пупка или в правом подреберье, диспептический синдром, умеренная болевая чувствительность в эпигастрии, проекции поджелудочной железы, по ходу толстого кишечника; наличие кожных и отсутствие респираторных проявлений аллергии; дошкольный возраст; повышенный уровень трипсина, амилазы крови; отягощенная наследственность по заболеваниям органов пищеварения; астеновегетативный синдром; фоновые состояния, нерациональное питание. сопутствующая соматическая патология; женский пол, нормальный уровень общего иммуноглобулина E. Выводы. Алгоритм позволяет диагностировать патологию поджелудочной железы с 95-процентной вероятностью, дифференцированно подходить к терапии, создать группу риска и предупредить хронизацию процесса.
Introduction. An increase in the incidence of allergic diseases worldwide, their direct relationship with the defeat of the digestive organs with the formation of functional disorders and inflammatory processes, their earlier manifestation determine the relevance and necessity of studying early diagnosis of these diseases in children. Objective. Improving the quality of the diagnosis of pancreatic pathology in children with allergic diseases. Materials and methods. The study involved 169 children aged 3 to 17 years, the main group consisted of 105 children with allergic diseases, control one — of 64 children. Verification of allergy: skin tests, specific immunoglobulins and total immunoglobulin E. Examination of the pancreas: determining the levels of α-amylase, trypsin, blood lipase, extended coprotest, postprandial hyperemia during ultrasound study. Diagnostic algorithm has been created using heterogeneous consistent procedures by Wald-Genkin. Results. We have determined the diagnostic coefficient, according to which pancreatic pathology is confirmed: by postprandial hyperemia 5–15 %, inhomogenous ultrasound structure of the pancreas with increased or decreased echogenicity; constipation or stool with signs of amylorrhea and iodofilic flora; in the early medical history — exudative-catarrhal anomaly constitution; complaints of moderate pain after a meal or not-related to it, with localization around the umbilicus or in the right upper quadrant; dyspeptic syndrome; moderate palpable pain sensitivity in the epigastrium, in the projection of the pancreas and along the colon; the presence of skin and the absence of respiratory allergy manifestations; pre-school age; elevated levels of trypsin and blood amylase; family history of digestive diseases; asthenovegetative syndrome; pathology of the pregnancy and labor, poor nutrition, concomitant somatic pathology; female gender, normal levels of total immunoglobulin E. Conclusions. The algorithm enables to diagnose pancreatic pathology with 95% probability, to approach the therapy differentially, to create risk group and to prevent the development of chronic process.
підшлункова залоза, харчова сенсибілізація, діагностика.
поджелудочная железа, пищевая сенсибилизация, диагностика.
pancreas, food sensitization, diagnosis.
Статтю опубліковано на с. 115-119
Актуальність
Матеріали та методи
Результати та обговорення
Висновки
1. Белоусов Ю.В. Панкреатит и панкреатопатия: классификационные характеристики, принципы диагностики и лечения у детей / Ю.В. Белоусов // Здоровье ребенка. — 2012. — № 8(43). — С. 25-27.
2. Гасилина Т.В. Болезни поджелудочной железы у детей. Первичная и вторичная экзокринная панкреатическая недостаточность / Т.В. Гасилина, С.В. Бельмер // Лечащий врач. — 2010. — № 6. — С. 30-34.
3. Гасилина Т.В. Панкреатиты у детей / Т.В. Гасилина, С.В. Бельмер // Лечащий врач. — 2009. — № 1. — С. 7-8.
4. Денисов М.Ю. Клиническая симптоматика и лечение детей с дисфункцией сфинктера Одди / М.Ю. Денисов // РМЖ. — 2011. — № 22. — С. 12-14.
5. Казначеева Л.Ф. Гастроинтестинальная форма пищевой аллергии у детей / Л.Ф. Казначеева, Н.С. Ишкова, К.С. Казначеев // Практическая медицина. — 2010. — № 6(10). — С. 34-37.
6. Клиническая аллергология и иммунология: руководство для практикующих врачей / Под ред. Л.А. Горячкиной и К.П. Кашкина. — М.: Практика, 2009. — 432 с.
7. Особенности состояния поджелудочной железы и печени у детей с аллергическими заболеваниями и дермореспираторным синдромом / С.Н. Недельская, В.И. Мазур, И.В. Солодова [и др.] // Запорожский медицинский журнал. — 2009. — Т. 11, № 5. — С. 33-36.
8. Ультразвуковое исследование органов брюшной полости у детей с аллергией / Г.М. Дворяковская, С.Г. Макарова, И.В. Дворяковский [и др.] // Ультразвуковая и функциональная диагностика. — 2009. — № 1. — С. 32.
9. Функциональные нарушения органов пищеварения у детей / С.В. Бельмер, Т.В. Гасилина [и др.] // Педиатрия и неонатология. — 2009. — № 6. — С. 47-49.

/116.jpg)
/117.jpg)
/118.jpg)