Статтю опубліковано на с. 125-129
Запальні захворювання кишечника (ЗЗК) — група ідіопатичних мультисистемних хронічних захворювань, що характеризуються специфічними клінічними ознаками, наявністю неспецифічного запалення в кишечнику й можливістю розвитку позакишкових проявів та ускладнень [11]. Останніми роками спостерігається значний приріст поширеності ЗЗК серед дитячого населення в усьому світі [9]. Згідно з даними Британської спілки дитячих гастроентерологів, гепатологів і нутриціологів, захворюваність на ЗЗК за 10 років зросла вдвічі й становить 5,2 випадка на 100 000 дитячого населення у рік (60 % становить хвороба Крона, 28 % — виразковий коліт, 12 % — недиференційований коліт) [7].
ЗЗК, що дебютують у дітей та підлітків, мають більш тяжкий перебіг і гірший прогноз порівняно із захворюваннями, що зазнають клінічної маніфестації в дорослому віці [9]. Екстраінтестинальні прояви ураження різних органів і систем, що розвиваються у 21–47 % дітей із ЗЗК, часто передують появі шлунково-кишкових симптомів і чинять потенційно згубний вплив на якість життя пацієнтів [2, 7, 8].
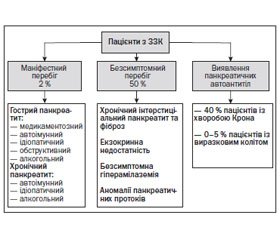
Частота ураження підшлункової залози у дітей, хворих на ЗЗК, коливається в межах 0,7–1,6 % [6]. Панкреатичні порушення у пацієнтів із ЗЗК являють собою гетерогенну групу станів, що об’єднує гострий, хронічний, автоімунний панкреатит, безсимптомну екзокринну недостатність, безсимптомну ферментну елевацію (рис. 1) [6].
Безсимптомна панкреатична елевація (безсимптомна гіперферментемія, гіперамілаземія) — патологічний стан, що супроводжується підвищенням рівнів панкреатичних ферментів (амілази, ліпази) у сироватці без характерних клінічних симптомів панкреатиту й структурних змін підшлункової залози.
За даними різних дослідників, безсимптомна елевація сироваткових ферментів підшлункової залози спостерігаєтьсяу 14–18 % пацієнтів із ЗЗК [1, 6]. Більше ніж 3-кратне перевищення верхньої межі нормального рівня амілази виявлено в 11 %, а 2-кратне — у 14 % асимптомних хворих на ЗЗК [6]. B. Heikius зі співавт. встановили, що поширеність безсимптомної елевації панкреатичних ферментів корелює з площею ураження слизової оболонки й ступенем активності запалення [3].
Поширеність безсимптомної гіперамілаземії та гіперліпаземії при хворобі Крона становить відповідно 17 і 9 %, при виразковому коліті — 9 та 7 %, при недиференційованому коліті — 10 і 5 %. Виявлено значуще збільшення рівня амілази, але не ліпази у хворих на первинний склерозуючий холангіт [3].
Існує кілька гіпотез, що пояснюють механізм виникнення елевації панкреатичних ферментів. По-перше, гіперферментемія спостерігається при високій активності ЗЗК внаслідок збільшеного всмоктування амілази та ліпази з просвіту кишечника в кров через підвищену проникність слизової оболонки в умовах запалення. По-друге, збільшення рівня ферментів пов’язане з панкреатичними ефектами медіаторів запалення і цитокінів, що вивільняються слизовою оболонкою кишечника. Цілком можливо, що епітеліальні клітини шлунково-кишкового тракту і тканини підшлункової залози мають подібні цільові молекулярні або клітинні структури, що схильні до ураження у разі розвитку ЗЗК [6].
Діагностичний алгоритм для хворого на ЗЗК з постійною безсимптомною гіперамілаземією включає в себе детальне вивчення скарг, анамнезу, даних фізикального обстеження і ретельний скринінг на можливі панкреатичні та непанкреатичні чинники гіперферментемії (рис. 2). Візуалізація органів черевної порожнини обов’язково повинна бути проведена для виключення злоякісного новоутворення, що секретує амілазу [6].
Для ілюстрації вищевикладеного наводимо клінічний випадок із нашої практики.
Клінічний випадок
Хлопчик М., 12 років, перебував у відділенні дитячої гастроентерології ДУ «Інститут гастроентерології НАМН України» м. Дніпро у 2016 році. Надійшов зі скаргами на біль у животі, що локалізується у нижніх відділах живота, нападоподібний, що турбує переважно ввечері, зменшується після акту дефекації, здуття живота, періодичне утруднення під час акту дефекації, наявність фрагментованого калу, епізодично з домішками рожевого слизу.
З анамнезу хвороби з’ясовано, що скарги спостерігаються протягом двох місяців. Погіршення стану відбулось протягом двох тижнів появою нападоподібного болю у лівій здухвинній ділянці, з приводу чого оглянутий лікарем-хірургом дитячим, виключена гостра хірургічна патологія. Після проведення очисної клізми біль купірувався, але періодично продовжували спостерігатись домішки рожевого слизу у калі. Відомо, що дитина харчується нерегулярно, з переважанням у дієті жирної, смаженої їжі, в тому числі у вечірній час. Тиждень тому дитина отримала травму — впала з велосипеда. На диспансерному обліку у лікаря-гастроентеролога не перебував.
З анамнезу життя з’ясовано, що хлопчик народився від V вагітності (2-га — 4-та вагітність — медичний аборт), що перебігала на фоні істміко-цервікальної недостатності, дифузного токсичного зоба, ІІ пологів, у термін 39 тижнів з масою тіла 4450 г, зростом 54 см. Перебіг періоду адаптації відбувався з синдромами дезадаптації та нейрорефлекторної гіперзбудливості. Тривалість грудного вигодовування — до 5 місяців. Перехворів на вітряну віспу. Алергологічний анамнез не обтяжений. Оперативні втручання, гемотрансфузії не проводились.
При надходженні стан середньої тяжкості внаслідок больового, диспептичного синдрому, метаболічних розладів. Фізичний розвиток середній, маса тіла 59,5 кг, зріст 159 см, ІМТ 23,4 (> 95 th). Шкіра рожева, помірно волога, чиста. На верхній лівій кінцівці одиничні екхімози та екскоріації. Підшкірна клітковина розвинена надмірно, розподілена за абдомінальним типом. Периферичні лімфатичні вузли не збільшені. Слизова ротоглотки рожева, чиста. Язик вологий, обкладений білим нальотом по всій поверхні. В легенях дихання везикулярне, хрипів немає. Серцеві тони гучні, ритмічні. Живіт правильної форми, симетричний, при пальпації м’який, болісний в гіпогастрії, по ходу товстого кишечника. Печінка у края реберної дуги. Селезінка не збільшена. Міхурові симптоми негативні. Панкреатичні точки безболісні. Селезінка не збільшена. Сечовипускання вільне, безболісне. Акт дефекації іноді утруднений. Дефекація 1 раз на 1–2 доби, кал періодично фрагментований, епізодично з домішками рожевого слизу.
У загальному аналізі крові: Hb 123 г/л, ерітроцити 4,5 × 1012, КП 0,82, ШОЕ 33 мм/год, лейк. 4,5 Г/л, сегм. 45 %, лімф. 41 %, мон. 5 %, еоз. 2 %, тромб. 288 Г/л.
Біохімічний аналіз крові: заг. білок 73 г/л, білірубін заг. 8,5 ммоль/л, АЛТ 13,3 Од/л, АСТ 26 Од/л, ГГТП 15,6 ммоль/л, ЛФ 269,4 ммоль/л, амілаза 260 ммоль/л, глюкоза крові 5 ммоль/л. При динамічному дослідженні спостерігалось підвищення рівня амілази крові до 319 ммоль/л.
Загальний аналіз сечі: питома вага 1020, білок — н/з, глюкоза — н/з, лейк. 1–2 у п/з, епіт. 1–3 у п/з, амілаза сечі 1852 Од/л.
Копрограма: рН нейтральний, нейтральний жир відсутній, м’язові волокна перетравлені: 1–2 у п/з, жирні кислоти відсутні, мила — відсутні, лейкоцити — 0 у п/з, еритроцити — 0 у п/з, реакція на приховану кров у калі негативна.
Ультразвукове дослідження органів черевної порожнини (ОЧП): печінка 124 × 57 × 34 мм, контури рівні, паренхіма неоднорідна, помірно підвищеної ехогенності. Ворітна вена 9 мм, нижня порожниста вена 15 мм. Жовчні протоки не ущільнені. Лімфатичні вузли не збільшені. Холедох 4 мм. Жовчний міхур 65 × 30 мм, V 31,5 см3, перегин у шийці, стінка 2 мм, стінка ущільнена, конкременти не визначаються. Селезінка не змінена, 100 × 49 мм, структура однорідна, ехогенність звичайна, селезінкова вена 5 мм. Підшлункова залоза 17 × 10 × 13 мм, контури рівні, нечіткі. Паренхіма неоднорідна, помірно підвищеної ехогенності. Висновок: дифузні зміни печінки, підшлункової залози.
У зв’язку з гіперамілаземією, що наростала при динамічному спостереженні (загальний стан дитини та самопочуття залишались стабільними), беручи до уваги травму в анамнезі (падіння з велосипеда), з метою виключення травматичного ураження підшункової залози призначено комп’ютерну томографію (КТ) ОЧП і позаочеревинного простору з внутрішньовенним підсиленням. За даними КТ ОЧП і заочеревинного простору: паренхіма печінки структурно однорідна, нормальної щільності, внутрішньопечінкові жовчні протоки не розширені, жовчний міхур, селезінка не змінені. Форма, будова та структура підшлункової залози звичайні. Нирки розташовані звичайно, чашково-мискова система не розширена. Лімфатичні вузли не збільшені. Висновок: патологічні зміни не виявлені. Повторно проконсультований лікарем-хірургом дитячим, травматичне ураження підшлункової залози виключено. До терапії включені спазмолітики, ферментні препарати, блокатори протонної помпи. Проведено повторне визначення ферментів підшлункової залози: ліпаза 1,21 нмоль/(с • л) (норма 0–470 нмоль/(с • л), трипсин 11,8 мкмоль/мл/хв (норма 1–4 мкмоль/мл/хв), амілаза 212 Од/л, амілаза сечі 2046,6 Од/л.
У зв’язку з наявністю епізодів появи домішок рожевого слизу у калі, безсимптомної гіперамілаземії, стабільного стану пацієнта за відсутності лабораторної динаміки (збереження високих рівнів амілази, підвищення ШОЕ) рекомендовано проведення фіброколоноскопії та фіброезофагогастродуоденоскопії (ФЕГДС) з метою виключенння запальних захворювань кишечника.
Фіброколоноскопія проведена під загальною анестезією в межах сигмоскопії у зв’язку з незадовільною підготовкою: апарат уведено до селезінкового згину. Слизова оболонка прямої, сигмоподібної кишок із помірною вогнищевою гіперемією, збереженим судинним рисунком. Ділянка слизової сигмоподібної кишки на відрізку 30–40 см від ануса з різким набряком, гіперемією, зі значними геморагіями, судинний рисунок стертий, просвіт кишки частково звужений, слизова вогнищево зерниста, вище 40 см слизова без патології. Висновок: сегментарний геморагічний коліт (хвороба Крона?) сигмоподібної кишки, проктосигмоїдит.
Цитологічне дослідження відбитків слизової сигмоподібної та прямої кишок: серед елементів запалення переважають лімфоїдні фолікули, густа круглоклітинна інфільтрація. Висновок: неможливо виключити хворобу Крона.
Патологогістологічне дослідження біоптатів слизової сигмоподібної та прямої кишок: хронічний коліт зі збереженою гістоструктурою слизової, загострення. ШИК-реакція бокалоподібних клітин негативна.
ФЕГДС: астральна еритематозна гастропатія, уреазний тест негативний.
На фоні системної (салофальк перорально) та локальної (супозиторії салофальку) терапії відбулась нормалізація кратності дефекації, форми калу та позитивна лабораторна динаміка у вигляді нормалізації ШОЕ та рівнів амілази крові, діастази сечі.
Заключний основний діагноз: недиференційований коліт з ураженням проктосигмоїдного відділу, з помірною активністю запалення, фаза загострення. Вторинний хронічний панкреатит, латентний перебіг, період загострення. Хронічний гастрит, не асоційований з Нр, період загострення. Ожиріння.
Виписаний з поліпшенням, дано рекомендацію щодо проведення контрольної фіброколоноскопії через 6 місяців.
Через 2 місяці дитина надійшла до міської дитячої клінічної лікарні зі скаргами на діарею до 9 раз на добу та у нічний час, домішки алої крові у калі, нападоподібний біль у животі, з локалізацією у нижніх відділах живота, що виникає перед актом дефекації. У зв’язку з неефективністю терапії салофальком призначено преднізолон з розрахунку 1 мг/кг/добу. При зниженні дози преднізолону до 7,5 мг/добу симптоми відновились, загальний стан дитини погіршився, констатовано загострення коліту. Проведено фіброколоноскопію: апарат уведено до печінкового згину ободової кишки. Слизова попереково-ободової кишки гіперемована, поверхня шорстка, дрібнозерниста з нальотами слизу, судинний рисунок стертий, відмічається локальна кровоточивість, згладження гаустрації, слизова оболонка низхідної кишки гіперемована, набрякла, на слизовій оболонці білі плями (мікроабсцеси). Слизова сигмоподібної та прямої кишок гіперемована, судинний рисунок стертий, нальоти слизу, шорстка, точкові крововиливи. Висновок: неспецифічний виразковий коліт, фаза помірної активності.
Патогістологічне дослідження біоптату попереково-ободової кишки та ділянки селезінкового згину: слизова оболонка має дрібні фокуси пошкодження поверхневого епітелію, помірно виражений інфільтрат, що складається з лімфоцитів, сегментоядерних лейкоцитів, гістіоцитів, еозинофілів, плазмоцитів, власної пластинки немає. Одиничні джерела крипт-абсцесів. Епітелій залоз без ознак дисплазії. Кількість бокалоподібних клітин достатня. Гранульомоподібних утворень не виявлено. Вогнищева гіперплазія лімфоїдних фолікулів.
Патогістологічне дослідження біоптату низхідної кишки: слизова оболонка має фокуси пошкоджень поверхневого епітелію, дифузний інфільтрат із лімфоцитів, сегментоядерних лейкоцитів, гістіоцитов, еозинофілів, плазмоцитів до власної пластинки слизової з дрібними вогнищами крипт-абсцесів. Висновок: морфологічна картина неспецифічного виразкового коліту.
Дитині призначено преднізолон 30 мг/добу, салофальк 1,5 г/добу. Переведений в ДУ «Інститут гастроентерології НАМН України» для корекції терапії. При лабораторному дослідженні зберігалось підвищення амілази сечі до 652 Од/л. Отримував преднізолон 30 мг внутрішньовенно протягом 5 діб з поступовим переходом на пероральну форму, салофальк 3,0 г/добу та антибактеріальну терапію з додаванням метронідазолу та ципрофлоксацину, місцеву терапію ректальною суспензією салофальку. Стан дитини поліпшився внаслідок зменшення інтоксикаційного, больового, диспептичного синдромів, нормалізації кратності та об’єму дефекацій, відсутності патологічних домішок у калі.
Заключний клінічний діагноз: виразковий коліт, середньотяжка форма, безперервно рецидивуючий перебіг з тотальним ураженням товстої кишки, з помірною активністю запалення, фаза загострення (PUCAI 45). Вторинний хронічний панкреатит, латентний перебіг, період загострення. Хронічний гастрит, не асоційований з Helicobacter pylori, період ремісії. Ожиріння (ІМТ 23,4).
Наведене клінічне спостереження ілюструє можливість дебюту виразкового коліту безсимптомною гіперамілаземією. Елевація панкреатичних ферментів без характерних клінічних ознак ураження підшлункової залози, відсутність структурних порушень залози при проведенні КТ, наявність системних маркерів запалення (підвищення ШОЕ), нормалізація рівня амілази після призначення аміносаліцилатів свідчать про підвищення проникності кишкової стінки у зв’язку з маніфестацією виразкового коліту та високою активністю запалення. Панкреатична гіперферментемія в даному випадку відіграє роль раннього маркера ЗЗК. Наявність сонографічних ознак дифузних змін структури підшлункової залози у поєднанні з ожирінням не дозволяє виключити у пацієнта патологію підшлункової залози дисметаболічного походження (стеатоз). У подальшому доцільним є проведення магнітно-резонансної холангіопанкреатографії, стеатометрії підшлункової залози та визначення рівня IgG4 після завершення прийому стероїдів для виключення автоімунного панкреатиту.
Висновки
1. Різноманітні позакишкові прояви ЗЗК у дітей можуть значно випереджати появу інтестинальних симптомів.
2. Ураження підшлункової залози при ЗЗК мають маніфестний перебіг лише у 2 % дітей, практично у половини хворих спостерігається безсимптомний перебіг.
3. Ізольована елевація панкреатичних ферментів вимагає ретельного скринінгу хворих для виключення панкреатичних і позапанкреатичних чинників гіперферментемії.

/126.jpg)