Журнал «Медицина неотложных состояний» 6 (77) 2016
Вернуться к номеру
Короткостроковий прогноз та гендерні особливості клінічних проявів тромбоемболії легеневої артерії
Авторы: Целуйко В.Й., Яковлева Л.М., Сухова С.М. - Харківська медична академія післядипломної освіти, м. Харків, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
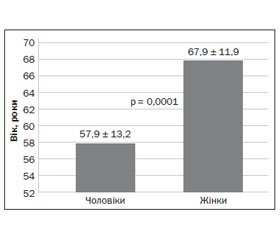
Актуальність. Венозний тромбоемболізм — третє за частотою захворювання серцево-судинної системи, з блискавичним розвитком, тяжким перебігом, високою летальністю і несприятливим прогнозом. Мета роботи: вивчення гендерних особливостей клініко-анамнестичних, інструментальних і лабораторних показників у зв’язку з короткостроковим прогнозом у хворих на тромбоемболію легеневої артерії (ТЕЛА). Матеріали та методи. Обстежені 104 хворі на гостру тромбоемболію легеневих артерій. Усім хворим проведено загальноклінічне обстеження, оцінено ризик і прогноз за загальноприйнятими шкалами, визначено у крові рівень тропоніну І, МВ-фракції креатинфосфокінази та креатиніну, проведено стандартну трансторакальну ехокардіографію, ультразвукове допплер-дослідження вен нижніх кінцівок та мультиспіральну комп’ютерну томографічну ангіографію легеневих артерій. Статистична обробка включала також багатофакторний регресійний аналіз. Результати. Встановлено, що у жінок вірогідно частіше зустрічаються такі фактори ризику венозного тромбоемболізму, як похилий вік та ожиріння. У жінок частіше спостерігається ураження судин більшого калібру, в той час як ураження дрібних артерій та інфаркт-пневмонії частіше зустрічається у чоловіків. У жінок частіше відзначається зниження швидкості клубочкової фільтрації менше за 60 мл/хв/1,73 м2, а рецидиви ТЕЛА були більш частими у чоловіків. За даними регресійного аналізу, рання лікарняна летальність у хворих на ТЕЛА асоціюється з наявністю ожиріння, артеріальної гіпотензії, збільшенням рівня креатиніну та частоти дихальних рухів, а також з жіночою статтю. Висновок. Враховуючи дані регресійного аналізу щодо зв’язку індексу маси тіла та швидкості клубочкової фільтрації з ранньою лікарняною летальністю, доцільно використовувати ці показники як додаткові критерії для уточнення індивідуального ризику ранньої смерті при ТЕЛА, особливо в осіб жіночої статі.
Актуальность. Венозный тромбоэмболизм — третье по частоте заболевание сердечно-сосудистой системы, с молниеносным развитием, тяжелым течением, высокой летальностью и неблагоприятным прогнозом. Цель работы: изучение гендерных особенностей клинико-анамнестических, инструментальных и лабораторных показателей, связанных с краткосрочным прогнозом у больных тромбоэмболией легочной артерии (ТЭЛА). Материалы и методы. Обследовано 104 больных острой тромбоэмболией легочных артерий. Всем больным проведено общеклиническое обследование, оценен риск и прогноз по общепринятым шкалам, определен в крови уровень тропонина І, МВ-фракции креатинфосфокиназы и креатинина, проведена стандартная трансторакальная эхокардиография, ультразвуковое допплер-исследование вен нижних конечностей и мультиспиральная компьютерная томографическая ангиография легочных артерий. Статистическая обработка включала также многофакторный регрессионный анализ. Результаты. Установлено, что у женщин достоверно чаще встречаются такие факторы риска венозного тромбоэмболизма, как пожилой возраст и ожирение. У женщин чаще наблюдается поражение сосудов крупного калибра, в то время как поражение мелких артерий и инфаркт-пневмонии чаще встречается у мужчин. У женщин чаще отмечается снижение скорости клубочковой фильтрации менее 60 мл/мин/1,73 м2, а рецидивы ТЭЛА были более частыми у мужчин. По данным регрессионного анализа, ранняя больничная летальность у больных ТЭЛА ассоциируется с наличием ожирения, артериальной гипотензии, повышением уровня креатинина и частоты дыхательных движений, а также с женским полом. Вывод. Учитывая данные регрессионного анализа относительно связи индекса массы тела и скорости клубочковой фильтрации с ранней больничной летальностью, целесообразно использовать эти показатели в качестве дополнительных критериев для уточнения индивидуального риска ранней смерти при ТЭЛА, особенно у лиц женского пола.
Venous thromboembolism ranks the third place among of cardiovascular diseases, with a lightning development, severe course, high mortality and unfavorable prognosis. Purpose of the work was to study the gender characteristics of the clinical anamnesis, instrumental and laboratory parameters associated with the short-term prognosis in patients with pulmonary embolism. Materials and methods. The study involved 104 patients with acute pulmonary embolism. All patients were undergone general clinical examination, the risk and prognosis was assessed based on the conventional scales, the blood levels of troponin I, MB-fraction of creatine phosphokinase and creatinine were determined, a standard transthoracic echocardiography, ultrasound Doppler of the lower extremities veins and multislice computed tomographic angiography of the pulmonary arteries were performed. The statistical analysis also included a multivariate regression analysis. Results. It was determined, that the risk factors for venous thromboembolism as advanced age and obesity are more common among females. The lesions of larger vascular are more common among women, while the lesions of small arteries and heart attack pneumonia are more common among men. The glomerular filtration rate less than 60 mL/min/1.73 m2 is more common among females and the recurrent of pulmonary embolism was more frequent among men. According to regression analysis, the early hospital mortality among patients with pulmonary embolism is associated with the presence of obesity, hypotension, increased creatinine level and frequency of respiratory movements and female gender. Conclusion. Taking into account the regression analysis data on the relation between body mass index and the glomerular filtration rate and the early mortality, these figures should be used as additional criteria to specify individual risk of early death in pulmonary embolism, especially among females.
тромбоемболія легеневих артерій, гендерні особливості, короткостроковий прогноз.
тромбоэмболия легочных артерий, гендерные особенности, краткосрочный прогноз.
pulmonary embolism, gender characteristics, short-term prognosis.
Статтю опубліковано на с. 102-110
Вступ
Матеріали та методи дослідження
Результати та їх обговорення
/104.jpg)
/106_2.jpg)
/107_2.jpg)
/108.jpg)
Висновки
1. Венозний тромбоемболізм: діагностика, лікування, профілактика. Міждисциплінарні клінічні рекомендації. — К., 2013. — 63 c.
2. Медико-соціальні аспекти хвороб системи кровообігу (аналітично-статистичний посібник) / За ред. В.М. Коваленка, В.М. Корнацького. — К., 2009. — 147 с.
3. Матвійчук Б.О. Ризик венозного тромбоемболізму в пацієнтів загальної хірургії / Б.О. Матвійчук, Н.Р. Федчишин, В.В. Філюсь та ін. // Клінічна анатомія та оперативна хірургія. — 2010. — Т. 9, № 4. — С. 55-58.
4. 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism The Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology.
5. Heit A. The epidemiology of venous thromboembolism in the community / Heit A. // Arteriosclerosis, Thrombosis and Vascular Biology. — 2008. — Vol. 28. — P. 370-372. — doi: 10.1161/ATVBAHA.108.162545.
6. Rinde L.B. et al. Impact of Incident Myocardial Infarction on Risk of Venous Thromboembolism: the Troms Study / L.B. Rinde, C. Lind, B. Småbrekke, I. Njølstad, E.B. Mathiesen, T. Wilsgaard, M.-L. Løchen, E.M. Hald, A. Vik, S.K. Brækkan, J.-B. Hansen // Journal of Thrombosis and Haemostasis. — 8 Apr 2016. — doi: 10.1111/jth.13329.
7. Chew H.K. et al. Incidence of venous thromboembolism and its effect on survival among patients with common cancers / Chew H.K., Wun T., Harvey D., Zhou H., White R.H. // Archives of Internal Medicine. — 2006. — Vol. 166, № 4. — P. 458-464.
8. Sweetland S. et al. Reeves venous thromboembolism risk in relation to use of different types of postmenopausal hormone therapy in a large prospective study / Sweetland S., Beral V., Balkwill A., Liu B., Benson V.S., Canonico M., Green J., Reeves G.K.; Million Women Study Collaborators // Journal of Thrombosis and Haemostasis. — 2012 — V. 10, № 11. — P. 2277-2286. — doi: 10.1111/j.1538-7836.2012.04919.x.
9. Kearon C., Akl E.A. Duration of anticoagulant therapy for deep vein thrombosis and pulmonary embolism / Kearon C., Akl E.A. // Blood. — 2014. — Vol. 123, № 12. — P. 1794-1801. — doi: 10.1182/blood-2013-12-512681.
10. Pollack C.V. et al. Clinical characteristics, management of patients diagnosed with acute pulmonary embolism in the emergency department of EMPEROR (Multicenter Emergency Medicine Pulmonary Embolism in the Real World Registry) / Pollack C.V., Schreiber D., Goldhaber S.Z., Slattery D., Fanikos J., O’Neil B.J., Thompson J.R., Hiestand B., Briese B.A., Pendleton R.C., Miller C.D., Kline J.A. // Journal of the American College of Cardio–logy. — 2011. — Vol. 57. — P. 700-706.
11. Venous Thromboembolism: Reducing the Risk of Venous Thromboembolism (Deep Vein Thrombosis and Pulmonary Embolism) in Patients Admitted to Hospital // National Clinical Guideline Centre — Acute and Chronic Conditions (UK). — London: Royal College of Physicians (UK), 2010.
12. Le Gal G. et al. Prediction of pulmonary embolism in the emergency department: the revised Geneva score / Le Gal G., Righini M., Roy P.M., Sanchez O., Aujesky D., Bounameaux H., Perrier A. // Annals of Internal Medicine. — 2006. — Vol. 144, № 3. — P. 165-171. — doi: 10.7326/0003-4819-144-3-200602070-00004.
13. Donze J. et al. Prospective validation of the Pulmonary Embolism Severity Index. A clinical prognostic model for pulmonary embolism / Donzé J., Le Gal G., Fine M.J., Roy P.M., Sanchez O., Verschuren F., Cornuz J., Meyer G., Perrier A., Righini M., Aujesky D. // Journal of Thrombosis and Haemostasis. — 2008. — Vol. 100, № 5. — P. 943-948. — doi: 10.1160/TH08-05-0285.
14. Schück O. et al. A new method to estimate glomerular filtration rate based on serum concentration of creatinine, urea and albumin (MDRD, Modification of Diet in Renal Disease) / Schück O., Smrcková J., Teplan V., Stávek P., Skibová J., Stollová M. / Vnitr̆ní lékar̆ství — 2004. Jul. — Vol. 50, № 7. — P. 507-509. — PMID: 15323257.
15. Feigenbaum H. Echocardiography. — Lippincott Williams & Wilkins, 2010. — 785 р.
16. Mitkov V.V. Clinical guidelines for ultrasound. — Moscow, 2011. — 345 р.
17. Lindenbraten L.D., Koroljuk I.P. Medical radiology (bases of radiation diagnosis and radiotherapy). — Publisher Medicine, 2000. — 672 p.
18. Panigada G. et al. Thromboembolic burden, prognostic assessment and outcomes of females compared to males in acute pulmonary embolism / Panigada G., Masotti L., Rosi C., Teghini L., Cimolato B., Bertieri M.C., Angotti C., Romagnoli A.M., Cascinelli I., De Crescenzo V., Dainelli A., Levantino G., Raimondi L., Nassi R., Mastriforti R., Lambelet P., Carli V., Frullini A., Grazzini M., Ciucciarelli L., Bucherelli S., Petrioli A., Casati C.; TUSCAN-PE Study Investigators // Acta Clinica Belgica. — 2016 Feb. — Vol. 7. — P. 1-7. — PMID: 27075811.
19. Silverstein M.D. et al. Trends in the incidence of deep vein thrombosis and pulmonary embolism: a 25-year population-based study / Silverstein M.D., Heit J.A., Mohr D.N., Petterson T.M., O’Fallon W.M., Melton L.J. III / Archives of Internal Medicine. — 1998. — Vol. 158. — P. 585-593. — doi: 10.1001/archinte.158.6.585.
20. Anderson F.A. Jr et al. A population-based perspective of the hospital incidence and case-fatality rates of deep vein thrombosis and pulmonary embolism. The Worcester DVT Study / Anders on F.A. Jr, Wheeler H.B., Goldberg R.J. // Archives of Internal Medicine. — 1991. — Vol. 151. — P. 933-938. — doi: 10.1001/archinte.1991.00400050081016.
21. Walter A. et al. Cardiovascular Risk Factors and Venous Thromboembolism. A Meta-Analysis / Ageno W., Becattini C., Brighton T., Selby R., Kamphuisen P.W. // Circulation. — 2008. — Vol. 117. — P. 93-102. — doi: 10.1161/circulationaha.107.709204.
22. Altınsoy B. et al. Prognostic Value of Renal Dysfunction Indicators in Normotensive Patients with Acute Pulmonary Embolism / Altınsoy B., Öz İ.İ., Örnek T., Erboy F., Tanrıverdi H., Uygur F., Altintas N., Atalay F., Tor M.M. / Clinical and applied thrombosis hemostasis. — 26 Mar 2016. — doi: 10.1177/1076029616637440.

/103.jpg)
/105.jpg)
/106.jpg)
/107.jpg)
/109.jpg)