Резюме
Метою роботи стала порівняльна оцінка клініко-лабораторних і морфологічних проявів ниркової патології при геморагічному васкуліті Шенлейна — Геноха, що почався в дитячому та дорослому віці. Ураження нирок відзначено у 71 % від числа хворих (незалежно від віку пацієнтів у дебюті хвороби нефропатія зустрічалася з однаковою частотою), серед яких нефротичний синдром сформувався у 4 % випадків, хронічна хвороба нирок II, III, IV i V стадій — у 28 % спостережень (співвідношення 10 : 5 : 1 : 1), причому, за даними нефробіоптатів, у пацієнтів із трансформацією хвороби з ювенільної виявилися меншими ступені ураження ниркових артеріол, клубочків, канальців й строми, нижчими темпи прогресування ниркової недостатності, рівні артеріального тиску та периферійного судинного опору, а в цілому дебютний вік хворих впливає на подальшу частоту IV, V і VI класів генохівського гломерулонефриту, визначає рівень лімфогістіоцитарної інфільтрації судинних стінок й депозицій імуноглобулінів в клубочках та судинах.
Целью работы стала сравнительная оценка клинико-лабораторных и морфологических проявлений почечной патологии при геморрагическом васкулите Шенлейна — Геноха, начавшегося в детском и взрослом возрасте. Поражение почек отмечено у 71 % от числа больных (независимо от возраста пациентов в дебюте болезни нефропатия встречалась с одинаковой частотой), среди которых нефротический синдром сформировался в 4 % случаев, хроническая болезнь почек II, III, IV и V стадий — в 28 % наблюдений (соотношение 10 : 5 : 1 : 1), причем, по данным нефробиоптатов, у пациентов с трансформацией болезни из ювенильной оказались меньшими степени поражения почечных артериол, клубочков, канальцев и стромы, ниже темпы прогрессирования почечной недостаточности, уровни артериального давления и периферического сосудистого сопротивления, а в целом дебютный возраст больных влияет на последующую частоту IV, V и VI классов геноховского гломерулонефрита, определяет уровень лимфогистиоцитарной инфильтрации сосудистых стенок и депозиций иммуноглобулинов в клубочках и сосудах.
Introduction. Nephropathy is diagnosed in 30–60 % of patients with hemorrhagic vasculitis (HV) (Schönlein Henoch puprupa) and occurred in each fourth of them in the onset of the disease and with the same incidence at first recurrence of the pathological process. In recent years, the relative and absolute number of patients with this form of glomerular disease significantly increased. According to the results of the kidney biopsy in children, Henoch glomerulonephritis (HGN) is the most common variant of the secondary immunoglobulin (Ig) A nephritis. The nature of the clinical course and morphological manifestations of the HGN in patients with HV, which began in childhood and adulthood, remains unexplored. This was the purpose and objectives of this study. Materials and methods. The study included 174 patients with HV (83 % of men and 47 % of women). In 92 cases, vasculitis debuted in children (on average in 12 years), and in 82 — in the adults (on average in 25 years). I, II and III degree of activity of pathological process are set at a ratio of 1 : 2 : 2. Seropositivity for high levels of IgA occurred in 40 % of cases, by the presence of rheumatoid factor — in 27 %. At the time of the survey, cutaneous syndrome was diagnosed in 68 % of patients in the form of urticarial, hemorrhagic, papule-nodular, papule-necrotic, pustular-ulcerative, necrotic-ulcerative, nodose-ulcerative and polymorphic forms, and articular syndrome — in 48 %. In 24 cases, kidney biopsy was performed. Results. Renal disease was revealed in 71 % of patients with HV, while on the background of nephropathy the integral index of the severity of extrarenal pathology was significantly higher. According to the characteristics of the articular syndrome, patients with nephropathy and without it differed little among themselves. The severity of muscle syndrome has the impact on the development of the HV. In turn, renal pathology significantly influenced the development of changes in interphalangeal joints of the feet and ligamentosis of knee joints. There is a direct connection between the renal pathology and lesion of maxillary joints and formation of tendovaginitis. Nephrotic syndrome is diagnosed in 4 % of patients with HV, and chronic renal disease — in 28 % (the ratio of I, II, III and IV its stages was 10 : 5 : 1 : 1). The rate of progression of renal pathology has influenced by patients’ age at the onset of HV, the degree of disease activity, lesions of skin and gastrointestinal tract, the level of mean arterial pressure has been influenced by the involvement in the process of the pancreas, the peripheral vascular resistance — the liver, spleen and heart. Nephrotic syndrome and chronic kidney disease stage IV took place only in cases of onset of the disease in adulthood, hypertension was registered 1.6 times more likely, and decreased glomerular filtration rate — 2.4 times. IV and V morphological classes of HGN were found only in patients with the beginning of HV in adulthood, and VI — exceptionally in children. Morphology of the HGN in both groups resembled mesangioproliferative primary glomerulonephritis with tubulointerstitial component. In patients with disease onset in adulthood, lymphohistiocytic infiltration of blood vessels observed 2.3 times more frequently. Age at the onset glomerulonephritis affects the deposition in glomeruli IgM, and in vessels — IgA, IgG and IgM. And there are direct correlations between the age of the patients and glomerular deposition of IgA and vascular IgG. Conclusions. Regardless of the age of the patients, nephropathy occurs with the same frequency at the onset of HV, but in cases of onset of the disease in adulthood, the course of HGN is less favorable, followed by nephrotic syndrome, higher incidence of lesions of renal glomeruli and stroma in the process of studying of kidney biopsies data, as well as different rates of progression of renal failure, levels of the lymphohistiocytic infiltration of the vascular wall and deposition of immune complexes in the glomeruli and vessels.
Статтю опубліковано на с. 24-30
Введение
Геморрагический васкулит (ГВ) Шенлейна — Геноха является одним из наиболее частых вариантов системного васкулита [3, 5, 9], который у детей встречается в 1,4 раза чаще, чем другие нозологические формы сосудистой патологии вместе взятые [19]. Ежегодная заболеваемость ГВ достигает 2 чeловек на 10 тыс. населения, причем наблюдается повсеместный рост численности таких больных [6, 15].
У 30–60 % от числа пациентов, страдающих ГВ, диагностируется поражение почек [1, 2] (у детей несколько реже [26]). Так называемый геноховский гломерулонефрит (ГГН) возникает у каждого четвертого больного уже в дебюте ГВ [16] и с такой же частотой наблюдается при первом рецидиве заболевания [2, 4]. Подчеркнем, что за последние годы значительно возросло относительное и абсолютное количество лиц с этой формой почечной патологии [7, 25]. Как известно, ГГН может протекать в виде от преходящего мочевого синдрома до клинической картины злокачественного процесса с быстропрогрессирующей почечной недостаточностью [10, 22, 23].
Существуют данные, что распределение детей и взрослых с ГВ составляет обычно 8 : 1–9 : 1 [13]. Вместе с тем в Китае среди больных детей с хронической болезнью почек на долю ГГН приходится 10 % случаев, а среди взрослых — 18 % [9]. По результатам выполненных нефробиопсий у более чем 1500 детей ГГН оказался самым частым вариантом вторичного гломерулонефрита [25]. Необходимо отметить, что эволюция поражения почек при ювенильном ГВ остается неизученной [4, 8]. В связи с этим целью и задачами данного исследования стало изучить клинико-морфологические признаки поражения почек у больных ГВ и оценить особенности нефропатии при заболевании, начавшемся в детском и взрослом возрасте.
Материал и методы
Под наблюдением находилось 174 больных ГВ (52,9 % мужчин и 47,1 % женщин, средний возраст — 26,80 ± 0,76 года). Длительность заболевания от первых признаков его манифестации составила 8,90 ± 0,62 года. Больные были распределены на две группы: 1-ю составили 92 человека, у которых болезнь дебютировала в детском возрасте (до 18 лет), а 2-ю — остальные 82 пациента с более старшим возрастом начала ГВ. Средний возраст в дебюте болезни в 1-й группе составил 11,70 ± 0,41 года, а во 2-й — 24,90 ± 0,63 года. В 24,1 % случаев установлена І степень активности заболевания среди всех пациентов, ІІ и ІІІ — соответственно в 37,9 %. Серопозитивность по иммуноглобулину (Ig) A (> 3 ммоль/л) отмечена у 39,7 % от числа больных, а по ревматоидному фактору (> 14 мЕ/мл) — у 27 %. Уровни IgA, ревматоидного фактора и креатинина в сыворотке крови исследовали с помощью биохимического анализатора Olympus-AU-640 (Япония), скорость клубочковой фильтрации (СКФ) оценивали по формуле Кокрофта — Голта. Определяли индекс прогрессирования нефропатии (ИПН) по формуле: ИПН = S2 : Т, где S — стадия хронической болезни почек, Т — длительность ГГН.
На предыдущих этапах течения ГВ кожные высыпания имели место у всех без исключения больных, а на момент обследования — в 67,8 % случаев. Поражение суставов диагностировано в 48,3 %, сердца — в 33,3 %, печени — в 21,8 %, центральной нервной системы — в 18,4 %, желудочно-кишечного тракта — в 17,8 %, скелетных мышц — в 16,1 %, поджелудочной железы — в 10,9 %, селезенки — в 8,1 %, легких — в 5,8 %, увеит — в 3,5 %, лейкоцитокластная энантема — в 2,9 %, хейлит — в 1,7 % случаев. Индекс тяжести ГВ как частное от деления суммы выявленных признаков на общее их число составил 6,30 ± 0,25 о.е. Сугубо почечная форма заболевания диагностирована в 24,1 % случаев, кожно-суставно-почечная — в 16,1 %, кожно-почечная — в 13,2 %, кожная и кожно-суставная — соответственно в 9,2 %, суставно-почечная — в 7,5 %, кожно-суставно-абдоминально-почечная — в 6,9 %, кожно-суставно-абдоминальная — в 4 %, кожно-абдоминально-почечная — в 3,5 %, суставно-абдоминальная — в 2,9 %, суставно-абдоминально-почечная — в 2,3 %, абдоминально-почечная — в 1,2 %.
У 24 больных (15 мужчин и 9 женщин) в возрасте 27,50 ± 2,19 года с длительностью болезни 10,20 ± 1,77 года и с І–ІІ стадией хронической болезни почек выполнена нефробиопсия. Дебют болезни в детском возрасте отмечен в 15 наблюдениях, а во взрослом — в 9 (средний возраст при первых проявлениях ГВ составил 16,90 ± 1,84 года); І, ІІ и ІІІ степени активности заболевания установлены соответственно у 11, 7 и 6 пациентов. Артериальная гипертензия (среднее давление более 115 мм рт.ст.) констатирована у каждого второго обследованного (уровень — 111,00 ± 2,61 мм рт.ст., а показатель периферического сосудистого сопротивления — 2,30 ± 0,11 дин × с × см–8). Содержание в сыворотке крови IgA составило 4,20 ± 0,09 ммоль/л, ревматоидного фактора — 8,90 ± 1,69 мЕ/мл.
Нефробиопсию выполняли на фоне атаралгезии под контролем ультразвукового исследования почки. Использовалась методика True-Cut («настоящего среза») с применением высокоскоростного пистолета Biopty-Bard. Гистологические срезы почек окрашивали гематоксилином-эозином, альциановым синим (на гликопротеины) и по ван Гизону (коллагеновые и эластические волокна), ставилась PAS-реакция. Кроме того, проводили иммуноферментный (с пероксидазной меткой) и иммунофлюоресцентный методы исследования тканей почек. Изучали отложения IgA, IgG, IgM, C3- и Cq1-компонентов комплемента. Микроскопическое исследование осуществляли на микроскопах Olympus-AX40 и Olympus-AX70-Provis с цифровой видеокамерой Olympus-DP50. Поражение отдельных почечных структур (клубочков, канальцев, стромы, сосудов) оценивали в баллах (от 0 до 3). При этом подсчитывали средний показатель повреждений (СПП) по формуле: СПП = = (а + 2b + 3c) : (a + b + c + d), где а, b, c — число больных соответственно с 1, 2 и 3 баллами, а d — число больных с отсутствием данного признака.
Статистическая обработка полученных результатов исследований проведена путем компьютерного вариационного, непараметрического, корреляционного, регрессионного, одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы Microsoft Excel и Statistica Stat-Soft, США). Оценивали средние значения (M), стандартные отклонения (SD) и стандартные ошибки (m), коэффициенты параметрической корреляции Пирсона (r) и непараметрической Кендалла (τ), критерии дисперсии Брауна — Форсайта (BF), множественной регрессии (R), Стьюдента (t), Уилкоксона — Рао (WR), Макнемара — Фишера (χ2) и достоверность статистических показателей (р).
Как показал однофакторный дисперсионный анализ Брауна — Форсайта, на развитие ГГН оказывает воздействие тяжесть мышечного синдрома (BF = 3,67; p = 0,044). В свою очередь, по результатам выполненного многофакторного анализа Уилкоксона — Рао не установлено влияния почечной патологии на интегральный клинический характер артикулярного синдрома и рентгено-сонографические признаки поражения суставов.
ГГН оказывает воздействие на развитие изменений межфаланговых суставов стоп (BF = 5,68; p = 0,020) и лигаментоза коленных сочленений (BF = 3,66; p = 0,047), которые в случаях нефропатии встречаются чаще (p < 0,001), что подтверждает анализ Макнемара — Фишера (соответственно χ2 = 13,73 и χ2 = 19,77). По результатам непараметрического корреляционного анализа Кендалла, существуют прямые связи почечной патологии с поражением височно-нижнечелюстных и суставов пальцев стоп (соответственно τ = +0,175; p = 0,018 и τ = +0,255; p = 0,001), формированием лигаментоза и тендовагинитов (τ = +0,190; p = 0,011 и τ = +0,171; p = 0,022). С учетом представленных данных сделано заключение, что при ГВ артрит межфаланговых сочленений пальцев ног и лигаментоз являются факторами риска ГГН.
При наличии ГГН средние значения СКФ составили 102,70 ± 2,68 мл/мин, а ИПН — 0,830 ± 0,096 о.е. В случаях почечной патологии артериальная гипертензия зарегистрирована в 3,5 раза чаще (χ2 = 10,84; р = 0,001), что указывает на ее ренальный генез. Показатели среднего артериального давления при ГГН были на 8 % выше, чем у остальных пациентов (t = 3,66; p < 0,001), а периферического сосудистого сопротивления — на 11 % (t = 2,76; p = 0,007).
Нефротический синдром установлен у 5 больных (4,1 % от числа с ГГН), а соотношение II, III, IV и V стадий хронической болезни почек составило 10 : 5 : 1 : 1. Показатель ИПН ассоциируется с возрастом больных в дебюте ГВ (BF = 5,62; p < 0,001), степенью активности заболевания (BF = 7,81; p < 0,001), поражением кожи (BF = 5,55; p = 0,001) и желудочно-кишечного тракта (BF = 2,96; p = 0,023), уровень артериального давления — с вовлечением в процесс поджелудочной железы (BF = 2,23; p = 0,011), периферическое сосудистое сопротивление — печени (BF = 10,87; p < 0,001), селезенки (BF = 3,37; p = 0,038) и сердца (BF = 5,24; p = 0,007).
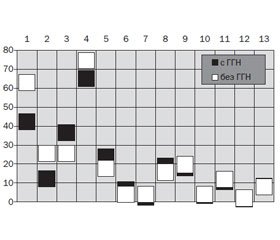
Нужно подчеркнуть, что больные 1-й и 2-й группы совершенно не отличались между собой по частоте поражения почек, тогда как нефротический синдром и хроническая болезнь почек V стадии имели место только в случаях начала заболевания во взрослом возрасте (соответственно χ2 = 5,84; р = 0,016 и χ2 = 18,54; p < 0,001) (рис. 2). Артериальная гипертензия зарегистрирована в 1-й группе в 1,6 раза реже (χ2 = 6,46; р = 0,011), а снижение СКФ — в 2,4 раза (χ2 = 10,35; р = 0,001). Уровни ИПН, среднего давления и сосудистого сопротивления у больных с трансформацией ГВ из ювенильного оказались меньшими на 64 % (t = 2,77; p = 0,007), 5 % (t = 2,73; p = 0,007) и 14 % (t = 3,77; p < 0,001), а величина СКФ — на 20 % большей (t = 2,16; p = 0,032).
/24-30/26-1.jpg)
При ГВ выполнение нефробиопсии показано для оценки прогнозирования течения хронической болезни почек [12]. Как хорошо известно, наиболее типичным морфологическим признаком ГГН является наличие депозитов IgA в эндотелии капилляров и мезангиуме клубочков [11], а также гломерулярные отложения IgG, IgM, С3, C1q [18] и инфильтрация почечных структур клетками с рецепцией CD45 (фодрина) и CD68 (гликопротеина макросиалина) [14]. У взрослых больных примерно в 1/4–1/3 случаев ГГН встречается III морфологический тип (класс), тогда как у детей превалирует ІІ [17, 24]. ГГН зачастую рассматривают как вариант IgA-нефропатии (системная форма IgA-нефропатии [21]), но прогноз патологии почек при ГВ значительно хуже, чем при первичном IgA-нефрите [20].
По нашим данным (рис. 3), IV и V классы ГГН встречались только у пациентов с началом ГВ во взрослом возрасте, а VI — исключительно в детском (χ2 = 100,08; p < 0,001). От возраста в дебюте заболевания существует дисперсионная зависимость Брауна — Форсайта тяжести поражения почечных канальцев (BF = 4,43; p = 0,047), а с выраженностью сосудистых изменений имеет место прямая параметрическая корреляционная связь Пирсона (r = +0,437; p = 0,042). Если у больных основной группы СПП сосудов, клубочков, стромы и канальцев соответственно составил 0,620 ± 0,075 о.е., 0,960 ± 0,061 о.е., 0,760 ± 0,062 о.е. и 0,600 ± 0,076 о.е., то в контрольной группе интегральные гломерулярные повреждения были большими на 25 % (t = 2,81; p = 0,010), а интерстициальные — на 30 % (t = 2,68; p = 0,014).
/24-30/27-1.jpg)
Утолщение и расщепление капиллярных петель обнаружено во всех случаях ГГН, пролиферация эндотелия сосудов — в 54,2 %, фибриноидное набухание их стенки, эластофиброз и лимфогистиоцитарная инфильтрация — соответственно в 50 %, инфильтрация капилляров полиморфноядерными лейкоцитами и гиалиноз артериол — в 45,8 %, плазматическое пропитывание сосудов — в 37,5 %, пролиферация капиллярных эндотелиоцитов и периваскулярный склероз — в 33,3 %, склероз сосудистых стенок — в 29,2 %, их фибриноидный некроз и дисмукоидоз — в 20,5 %. У пациентов 2-й группы в 2,3 раза чаще отмечали лимфогистиоцитарную инфильтрацию сосудов (χ2 = 4,44; р = 0,035). Морфологическая картина ГГН напоминала первичный мезангиопролиферативный гломерулонефрит с тубулоинтерстициальным компонентом. Частота депозитов IgA, IgG, IgM, C3 и C1q в капиллярах клубочков и артериолах представлена в табл. 1. Возраст начала болезни влияет на отложения в клубочках IgM, а в сосудах — IgA, IgG и IgM. При этом существуют прямые корреляции возраста больных в дебюте ГВ с гломерулярной депозицией IgA и сосудистой IgG.
/24-30/28-1.jpg)
Выводы
1. Независимо от возраста пациентов в дебюте ГВ почечная патология в виде ГГН встречается с одинаковой частотой у 7 из 10 взрослых больных, у которых может формироваться нефротический синдром и выше темпы прогрессирования хронической болезни почек.
2. Развитие ГГН тесно связано с общей активностью заболевания, тяжестью висцеральных экстраренальных признаков, вовлечением в процесс скелетных мышц, межфаланговых сочленений стоп и формированием лигаментоза коленных суставов.
3. При ГГН у пациентов с началом болезни во взрослом возрасте большие степени поражения почечных артериол, клубочков, канальцев и стромы, выше уровни артериального давления и периферического сосудистого сопротивления.
4. Дебютный возраст ГВ влияет на последующую частоту IV, V и VI морфологических классов ГГН, определяет дисперсионные и прямые корреляционные связи с уровнями лимфогистиоцитарной инфильтрации сосудистой стенки и депозиции в клубочках и сосудах IgA, IgG, IgM.
Конфликт интересов
При подготовке материала к публикации авторы не получали гонораров и не имели другой материальной заинтересованности.
Список литературы
1. Aggarwal R. HLA-DRB1 in Henoch-Schönlein purpura: A susceptibility study from North India / R. Aggarwal, A. Gupta, J. Naru [et al.] // Hum. Immunol. — 2016. — Vol. 77, № 7. — P. 555-558.
2. Albaramki J. Henoch-Schonlein purpura in childhood a fifteen-year experience at a tertiary hospital / J. Albaramki // J. Med. Liban. — 2016. — Vol. 64, № 1. — P. 13-17.
3. Barut K. Diagnostic approach and current treatment options in childhood vasculitis / K. Barut, S. Şahin, A. Adroviç, O. Kasapçopur // Turk. Pediatri Ars. — 2015. — Vol. 50, № 4. — P. 194-205.
4. Calvo-Río V. Relapses in patients with Henoch-Schönlein purpura: Analysis of 417 patients from a single center / V. Calvo-Río, J.L. Hernández, F. Ortiz-Sanjuán [et al.] // Medicine. — 2016. — Vol. 95, № 28. — E. 4217.
5. Carman M. Henoch-Schönlein purpura in the ED / M. Carman, J. Forsman // Am. J. Nurs. — 2016. — Vol. 116, № 5. — P. 57-60.
6. Elfving P. Estimating the incidence of connective tissue diseases and vasculitides in a defined population in Northern Savo area in 2010 / P. Elfving, O. Marjoniemi, H. Niinisalo [et al.] // Rheumatol. Int. — 2016. — Vol. 36, № 7. — P. 917-924.
7. Fidan K. Changing trends in pediatric renal biopsies: analysis of pediatric renal biopsies in national nephrology registry data / K. Fidan, I. Isik Gonul, B. Büyükkaragöz [et al.] // Ren. Fail. — 2016. — Vol. 38, № 8. — P. 1228-1233.
8. Gaskill N. Recurrent adult onset Henoch-Schonlein purpura: a case report / N. Gaskill, B. Guido, C. Mago [et al.] // Dermatol. Online J. — 2016. — Vol. 22, № 8. — P. 163-169.
9. Gur G. Preschool education impact on child development / G. Gur, N. Cakar, S. Kiremitci [et al.] // Arch. Argent. Pediatr. — 2016. — Vol. 114, № 5. — P. 366-369.
10. Hahn D. Interventions for preventing and treating kidney di–sease in Henoch-Schönlein Purpura (HSP) / D. Hahn, E.M. Hodson, N.S. Willis, J.C. Craig // Cochrane Database Syst. Rev. — 2015. — Vol. 7, № 8. — E. 005128.
11. Hu X. A lower proportion of regulatory b cells in patients with Henoch-Schoenlein purpura nephritis / X. Hu, J. Tai, Z. Qu [et al.] // PLoS One. — 2016. — Vol. 11, № 3. — E. 0152368.
12. Jarasvaraparn C. Henoch-Schönlein without purpura: a case report and review literature / C. Jarasvaraparn, C. Lertudomphonwanit, K. Pirojsakul [et al.] // J. Med. Assoc. Thai. — 2016. — Vol. 99, № 4. — P. 441-445.
13. Jelusić M. Vasculitides in childhood: a retrospective study in a period from 2002 to 2012 at the department of paediatrics, university hospital centre Zagreb / M. Jelusić, L. Kostić, M. Frković [et al.] // Reumatizam. — 2015. — Vol. 62, № 2. — P. 6-10.
14. Kaneko M. Local leukocyte proliferation as a target for cyclophosphamide in the treatment of Henoch-Schönlein purpura nephritis grade VI / M. Kaneko, Y. Ikezumi, T. Yamada [et al.] // Nephro–logy. — 2016. — Vol. 21, № 1. — P. 68-71.
15. Khanna G., Sargar K., Baszis K.W. Pediatric vasculitis: re–cognizing multisystemic manifestations at body imaging / G. Khanna, K. Sargar, K.W. Baszis // Radiographics. — 2015. — Vol. 35, № 3. — P. 849-865.
16. Lardhi A.A. Henoch-Schonlein purpura in children from the eastern province of Saudi Arabia / A.A. Lardhi // Saudi Med. J. — 2012. — Vol. 33, № 9. — P. 973-978.
17. Liu L.J. Clinical characteristics of Henoch-Schönlein purpura in children / L.J. Liu, J. Yu, Y.N. Li // Zhongguo Dang Dai Er Ke Za Zhi. — 2015. — Vol. 17, № 10. — P. 1079-1083.
18. Mao S. Clinico-pathological association of Henoch-Schoenlein purpura nephritis and IgA nephropathy in children / S. Mao, X. Xuan, Y. Sha [et al.] // Int. J. Clin. Exp. Pathol. — 2015. — Vol. 8, № 3. — P. 2334-2342.
19. Mao Y. Incidence and clinical features of paediatric vasculitis in Eastern China: 14-year retrospective study, 1999–2013 / Y. Mao, L. Yin, H. Xia [et al.] // J. Int. Med. Res. — 2016. — Vol. 44, № 3. — P. 710-717.
20. Mohey H. Validation of the absolute renal risk of dialysis/death in adults with IgA nephropathy secondary to Henoch-Schönlein purpura: a monocentric cohort study / H. Mohey, B. Laurent, C. Ma–riat // BMC Nephrol. — 2013. — Vol. 14, № 1. — P. 169-170.
21. Oh H.J. Clinical outcomes, when matched at presentation, do not vary between adult-onset Henöch-Schönlein purpura nephritis and IgA nephropathy / H.J. Oh, S.V. Ahn, D.E. Yoo // Kidney Int. — 2012. — Vol. 82, № 12. — P. 1304-1312.
22. Park C.H. The optimal cut-off value of neutrophil-to-lymphocyte ratio for predicting prognosis in adult patients with Henoch-Schönlein purpura / C.H. Park, D.S. Han, J.Y. Jeong [et al.] // PLoS One. — 2016. — Vol. 11, № 4. — E. 0153238.
23. Vogt B. Nephrology update: glomerular disease in children / B. Vogt // FP Essent. — 2016. — Vol. 444, № 5. — P. 30-40.
24. Ye Q. 24h urinary protein levels and urine protein/creatinine ratios could probably forecast the pathological classification of HSPN / Q. Ye, S.Q. Shang, A.M. Liu [et al.] // PLoS One. — 2015. — Vol. 10, № 5. — E. 0127767.
25. Yin X.L. Twenty-three-year review of disease patterns from renal biopsies: an experience from a pediatric renal center / X.L. Yin, M.S. Zou, Y. Zhang [et al.] // J. Nephrol. — 2013. — Vol. 26, № 4. — P. 699-707.
26. Zhao Y.L. Obesity increases the risk of renal involvement in children with Henoch-Schönlein purpura / Y.L. Zhao, Z.J. Liu, X.M. Bai [et al.] // Eur. J. Pediatr. — 2015. — Vol. 174, № 10. — P. 1357-1363.

/24-30/26-1.jpg)
/24-30/27-1.jpg)
/24-30/28-1.jpg)