Журнал «» 5 (49) 2016
Вернуться к номеру
Порівняння впливу фіксованої комбінації периндоприл/амлодипін на ураження органів-мішеней у пацієнтів з артеріальною гіпертензією з ішемічною хворобою серця та без неї (результати дослідження EPHES)
Авторы: Радченко Г.Д.(1), Муштенко Л.О.(1), Торбас О.О.(1), Кушнір С.М.(1), Яринкіна О.А.(1), Поташев С.В.(2), Сіренко Ю.М.(1)
(1) – ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України», м. Київ, Україна
(2) – Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
Рубрики: Кардиология
Разделы: Клинические исследования
Версия для печати
Дослідження EPHES (Evaluation of influence of fixed dose combination Рerindopril/Amlodipine on target organ damage in patients with arterial HypErtension with or without iSchemic heart disease — оцінка впливу фіксованої комбінації периндоприл/амлодипін на ураження органів-мішеней у пацієнтів з артеріальною гіпертензією (АГ) з ішемічною хворобою серця (ІХС) та без неї) мало за мету порівняти ефективність фіксованої комбінації (ФК) периндоприл/амлодипін щодо зниження артеріального тиску (АТ) та динаміки вираженості ураження органів-мішеней у хворих на АГ з ІХС та без неї. Матеріали та методи. У дослідження EPHES було включено 60 пацієнтів з АГ віком старше від 30 років: перша група — 30 пацієнтів без ІХС, друга — 30 пацієнтів, які мали ІХС. Строк спостереження становив 12 місяців. Усім пацієнтам у день рандомізації призначали ФК периндоприл/амлодипін у початковій дозі 5/5 мг один раз на добу. При необхідності (АТ > 140/90 мм рт.ст.) дози компонентів ФК збільшували поступово кожні 2 тижні до 10/10 мг, а після 6 тижнів лікування додавався індапамід 1,5 мг. 66,7 та 96,7 % пацієнтів в першій та другій групах відповідно отримували бета-адреноблокатори. Усім пацієнтам проводили: вимірювання маси тіла та зросту, офісних рівнів систолічного АТ (САТ), діастолічного АТ (ДАТ) та частоти серцевих скорочень (ЧСС), добове моніторування АТ, визначення швидкості поширення пульсової хвилі в артеріях еластичного (ШППХе) та м’язового типів, центрального САТ, стандартизованого до ЧСС 75 уд/ хв індексу аугментації (Аіх75), біохімічне дослідження крові, електрокардіографію, ехокардіографію з допплерографією, вимірювання гомілково-плечового індексу, визначення товщини комплексу інтима-медіа (ТКІМ). Результати. Встановлено, що призначена терапія на основі ФК периндоприл/амлодипін незалежно від наявності або відсутності ІХС ефективно (до цільових рівнів) та безпечно знижувала офісний, середньодобовий, денний, нічний та центральний АТ. При цьому достовірно зменшувалися початково підвищені денна та нічна варіабельність АТ, величина ранкового підйому САТ та частка пацієнтів з добовим профілем АТ типу «нон-дипер», проте ці показники залишалися достовірно більшими у пацієнтів з ІХС на всіх етапах лікування. Хворі з ІХС та без неї не відрізнялися за початковою величиною АІх75, і на фоні призначеної терапії спостерігалося достовірне зменшення цього показника в обох групах, проте у хворих з ІХС це зменшення АІх75 було достовірно меншим, ніж у групі без ІХС, що, імовірно, було пов’язано з більш частим застосуванням бета-блокаторів. Ефективне щодо зниження АТ лікування призводило в обох групах до достовірного зменшення ураження органів-мішеней — покращення пружно-еластичних властивостей аорти та діастолічної функції лівого шлуночка, зменшення рівня альбумінурії, гіпертрофії лівого шлуночка та розміру лівого передсердя. Ступінь зниження ШППХе був достовірно (Р < 0,005) меншим у пацієнтів без ІХС, ніж у групі з ІХС — 2,5 ± 0,2 м/с проти 4,4 ± 0,5 м/с. Окрім того, незважаючи на однаковий ступінь зменшення індексу маси міокарда лівого шлуночка, покращення діастолічної функції лівого шлуночка (збільшення Е/А та зменшення Е/Е’) у групі хворих з ІХС було більшим — на 64,4 та 54,1 % проти 39,8 та 23,2 % відповідно (Р < 0,05 для обох показників). Максимальна величина ТКІМ достовірно зменшилася лише в пацієнтів з ІХС. Терапія не призводила до достовірних змін біохімічних показників та добре переносилася хворими — побічні явища зареєстровані у 2 (6,5 %) в групі без ІХС та у 3 (10 %) у групі з ІХС (Р = НД між групами). Групи достовірно не відрізнялися за динамікою скарг, і серед пацієнтів з ІХС, які мали стенокардію на початку дослідження, значно зменшилася кількість приступів стенокардії за тиждень — з 2,5 ± 0,4 до 1,2 ± 0,2 (Р < 0,01). Висновки. Отже, лікування АГ на основі ФК периндоприл/амлодипін було ефективним щодо зниження АТ та регресу ураження органів-мішеней незалежно від наявності ІХС. Зміни показників, що характеризують ураження органів-мішеней, дещо відрізнялися в пацієнтів з ІХС та без неї, що необхідно враховувати при виборі тактики лікування.
Исследование EPHES (Evaluation of influence of fixed dose combination Рerindopril/Amlodipine on target organ damage in patients with arterial HypErtension with or without iSchemic heart disease) имело целью оценить эффективность фиксированной комбинации (ФК) периндоприл + амлодипин в отношении снижения артериального давления (АД) и динамики поражения органов-мишеней у больных с артериальной гипертензией (АГ) с ишемической болезнью сердца (ИБС) и без нее. Материалы и методы. В исследование были включены 60 пациентов с АГ в возрасте старше 30 лет: первая группа — 30 пациентов без ИБС, вторая — 30 пациентов с ИБС. Всем пациентам в день рандомизации назначали фиксированную комбинацию периндоприл/амлодипин в начальной дозе 5/5 мг один раз в сутки. При необходимости (АД > 140/90 мм рт. ст.) дозы компонентов фиксованной комбинации увеличивали постепенно каждые 2 недели до 10/10 мг, а после 6 недель лечения добавляли индапамид 1,5 мг. 66,7 и 96,7 % пациентов первой и второй групп принимали также бета-адреноблокаторы. Всем пациентам проводили: измерение массы тела и роста, офисных уровней систолического АД (САД), диастолического (ДАД) и частоты сердечных сокращений (ЧСС), суточное мониторирование АД, определение скорости распространения пульсовой волны по артериям эластического (СРПВэ) и мышечного типов, центрального САД, индекса аугментации, стандартизированного к ЧСС 75 уд/ мин (Аіх75), биохимическое исследование крови, электрокардиографию, эхокардиографию с допплерографией, измерение лодыжечно-плечевого индекса, определение толщины комплекса интима-медиа (ТКИМ). Результаты. Установлено, что терапия на основе ФК периндоприл/амлодипин независимо от наличия или отсутствия ИБС эффективно (до целевых уровней) и безопасно снижала офисное, среднесуточное, дневное, ночное и центральное АД. При этом достоверно уменьшались исходно повышенные дневная и ночная вариабельность АД, величина утреннего подъема САД и доля пациентов с суточным профилем «нон-диппер», однако эти показатели оставались достоверно более высокими у пациентов с ИБС на всех этапах лечения. Пациенты с ИБС и без нее исходно не отличались по величине АІх75, и на фоне назначенной терапии наблюдалось достоверное снижение этого показателя в обеих группах, однако у пациентов с ИБС уменьшение АІх75 было достоверно меньшим, чем в группе без ИБС, что, вероятно, было связано с более частым использованием бета-блокаторов в этой группе. Эффективное в отношении снижения АД лечение приводило к достоверному уменьшению поражения органов-мишеней — улучшению упруго-эластических свойств аорты и диастолической функции левого желудочка, уменьшению уровня альбуминурии, гипертрофии левого желудочка и размера левого предсердия. Степень снижения СРПВэ была достоверно (Р < 0,005) меньше у пациентов без ИБС, чем в группе с ИБС — 2,5 ± 0,2 м/с против 4,4 ± 0,5 м/с. Несмотря на одинаковое снижение индекса массы миокарда левого желудочка, улучшение диастолической функции левого желудочка (увеличение Е/А и уменьшение Е/Е’) в группе больных с ИБС было большим — на 64,4 и 54,1 % против 39,8 и 23,2 % соответственно (Р < 0,05 для обоих показателей). Максимальная величина ТКИМ достоверно уменьшилась только у пациентов с ИБС. Терапия не приводила к достоверным изменениям биохимических показателей и хорошо переносилась пациентами. Побочные явления были зарегистрированы у 2 больных (6,5 %) в группе без ИБС и у 3 (10 %) — в группе с ИБС (Р = НД). Группы достоверно не отличались по динамике жалоб, и среди пациентов с ИБС, которые имели стенокардию, достоверно уменьшилось количество приступов стенокардии за неделю — с 2,5 ± 0,4 до 1,2 ± 0,2 (Р < 0,01). Выводы. Таким образом, лечение АГ на основе ФК периндоприл/амлодипин было эффективным в отношении снижения АД и регресса поражения органов-мишеней независимо от наличия ИБС. Изменения показателей, которые характеризуют поражение органов-мишеней, несколько различались у пациентов с ИБС и без нее, что необходимо учитывать при выборе тактики лечения.
EPHES trial (Evaluation of influence of fixed dose combination Рerindopril/amlodipine on target organ damage in patients with arterial HypErtension with or without iSchemic heart disease) had aim to compare the effect of fixed-dose combination (FDC) perindopril/amlodipine on blood pressure (BP) decrease and the dynamics of target organ damage patterns in patients with arterial hypertension (AH) with and without ischemic heart disease (IHD). Materials and methods. EPHES study included 60 patients aged over 30 years with AH: the first group — 30 individuals without IHD, the second one — 30 persons with IHD. The follow-up period was 12 months. All patients in the day of randomization were administered FDC perindopril/amlodipine in baseline dose 5/5 mg once a day. If it was necessary (BP > 140/90 mmHg), the doses of FDC components were increased gradually every two weeks to 10/10 mg, and after 6 weeks of treatment, indapamide 1.5 mg was added. 66.7 and 96.7 % of patients from the first and second groups received beta-blockers. All patients underwent the measurement: of body weight and height, office levels of systolic BP (SBP), diastolic BP (DBP) and heart rate (HR), ambulatory BP, pulse wave velocity in elastic (PWVe) and muscle arteries, central SBP, augmentation index adjusted to HR 75 bpm (Aix75), biochemical blood count, echocardiography, echocardiography with Doppler, ankle-brachial index, intima-media thickness. Results. It was found that prescribed therapy based on FDC perindopril/amlodipine, regardless of the presence or absence of IHD, has reduced the office, average daily, daytime, night-time and central BP effectively (to target levels) and safely. At the same time, initially increased day and night BP variability, the value of morning rise of SBP and proportion of patients with circadian non-dipper BP profile have significantly decreased, but these figures were cinsiderably higher in patients with IHD at all stages of treatment. Patients with IHD and without it have no differences in the initial value of АІх75, and against the background of prescribed therapy, there was a significant decrease of this index in both groups, but in patients with IHD this reduction of АІх75 was significantly lower than in the group without IHD that probably was due to more frequent use of beta-blockers. Treatment, effective in terms of reducing BP, has led in both groups to a significant decrease of target organ damage — improving the elastic properties of the aorta and left ventricular diastolic function, reduction in the level of albuminuria, in left ventricular hypertrophy and left atrial size. The degree of PWVe decrease was significantly (P < 0.005) lower in patients without IHD than in the group with IHD — 2.5 ± 0.2 m/s vs 4.4 ± 0.5 m/s. In addition, despite the same degree of reduction in the left ventricular mass, an improvement of left ventricular diastolic function (increased E/A and reduced E/E’) was higher in the group of patients with IHD — by 64.4 and 54.1 % against 39.8 and 23.2 %, respectively (P < 0.05 for both indicators). The maximum value of intima-media thickness has significantly decreased only in patients with IHD. The therapy did not lead to significant changes in biochemical parameters and was well tolerated by patients — adverse events reported in 2 (6.5 %) persons in the group without IHD and in 3 (10 %) patients in the group with IHD (P = NS between groups). The groups did not differ significantly by the dynamics of complaints, and patients with IHD, who had angina at baseline, had a significant decrease in the number of angina attacks per week — from 2.5 ± 0.4 to 1.2 ± 0.2 (P < 0.01). Conclusions. Thus, treatment of AH based on FDC perindopril/amlodipine was effective in reducing BP and regression of target organ damage, regardless of the presence of IHD. Changes of the indicators characterizing the target organ damage were somewhat different in patients with and without IHD that must be considered, when choosing treatment regimen.
артеріальна гіпертензія; ішемічна хвороба серця; органи-мішені; фіксована комбінація
артериальная гипертензия; ишемическая болезнь сердца; органы-мишени; фиксированная комбинация
arterial hypertension; ischemic heart disease; target organs; fixed dose combination
Статтю опубліковано на с. 11-26
Дослідження EPHES (Evaluation of influence of fixed dose combination Рerindopril/Amlodipine on target organ damage in patients with arterial HypErtension with or without iSchemic heart disease — оцінка впливу фіксованої комбінації периндоприл/амлодипін на ураження органів-мішеней у пацієнтів з артеріальною гіпертензією (АГ) з ішемічною хворобою серця (ІХС) та без неї) мало за мету порівняти ефективність фіксованої комбінації щодо зниження артеріального тиску (АТ) та динаміки вираженості ураження органів-мішеней у хворих на АГ з ішемічною хворобою серця та без неї. Вибір даної комбінації базувався на двох основних критеріях. По-перше, для того щоб оцінити особливості регресу органів-мішеней у різних когортах хворих, необхідно, щоб пацієнти отримували порівнянну (краще однакову) антигіпертензивну терапію. По-друге, у великих дослідженнях ALLHAT, ASCOT та EUROPA було доведено високу ефективність периндоприлу, амлодипіну та їх комбінації як при АГ, так і при ІХС. Тому фіксована комбінація периндоприл + амлодипін показана як хворим на АГ, так і при поєднанні АГ з ІХС. У попередніх статтях [3, 4] ми подавали результати дослідження окремо щодо хворих на АГ з ІХС та без неї. Дана стаття є результатом порівняння отриманих даних у цих різних популяціях пацієнтів з АГ.
Матеріали та методи
Результати
Обговорення
/20_2.jpg)
Обмеження дослідження
Висновки
1. Компендіум. Лікарські засоби / Під редакцією акад. В.М. Коваленка та проф. А.П. Вікторова. — К.: Моріон, 2010. — С. Л-219.
2. Методичні рекомендації Асоціації кардіологів України. Дисліпідемії: діагностика, профілактика та лікування. — К., 2011. — 49 с.
3. Радченко Г., Муштенко Л.О., Торбас О.О. та ін. Оцінка впливу фіксованої комбінації периндоприл/амлодипін на ураження органів-мішеней у пацієнтів з артеріальною гіпертензією (первинні результати дослідження EPHES) // Артеріальна гіпертензія. — 2015. — № 4. — С. 27-41.
4. Радченко Г., Муштенко Л.О., Торбас О.О. та ін. Оцінка впливу фіксованої комбінації периндоприл/амлодипін на ураження органів-мішеней у пацієнтів з артеріальною гіпертензією та ішемічною хворобою серця (результати дослідження EPHES) // Артеріальна гіпертензія. — 2016. — № 2. — С. 77-92.
5. Шевелева О.Е. Поражение органов-мишеней у больных артериальной гипертонией в сочетании с ИБС, проживающих в среднем Приобье: Автореф. дис… канд. мед. наук. — 21 с. — Режим доступу: http://medical-diss.com/medicina/porazhenie-organov-misheney-u-bolnyh-arterialnoy-gipertoniey-v-sochetanii-s-ibs-prozhivayuschih-v-srednem-priobie#ixzz-4G9wRhoVT.
6. 2013 ESH/ESC Guidelines for the management of arterial hypertension. The Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // Journal of Hypertension. — 2013. — Vol. 31. — P. 1281-1357.
7. Ariff B., Zambanini A., Vamadeva S. et al. Candesartan- and Atenolol-Based Treatments Induce Different Patterns of Carotid Artery and Left Ventricular Remodeling in Hypertension // Stroke. — 2006. — Vol. 37. — P. 2381-2384.
8. Barron A., Hughes A., Sharp A. et al. Long-Term Antihypertensive Treatment Fails to Improve E/e′ Despite Regression of Left Ventricular Mass An Anglo-Scandinavian Cardiac Outcomes Trial Substudy // Hypertension. — 2014. — Vol. 63. — P. 252-258.
9. Boutouyrie P., Tropeano A.I., Asmar R. et al. Aortic stiffness is an independent predictor of primary coronary events in hypertensive patients: a longitudinal study // Hypertension. — 2002. — Vol. 39. — P. 10-15.
10. Boutouyrie P., Achouba A., Trunet P. et al. for the EXPLOR Trialist Group. Amlodipine-Valsartan Combination Decreases Central Systolic Blood Pressure More Effectively Than the Amlodipine-Atenolol Combination The EXPLOR Study // Hypertension. — 2010. — Vol. 55. — P. 1314-1322.
11. Cay S., Cagirci G., Demir A. et al. Ambulatory blood pressure variability is associated with restenosis after percutaneous coronary intervention in normotensive patients // Atherosclerosis. — 2011. — Vol. 219. — P. 951-957.
12. Cuffe R.L., Rothwell P.M. Medium-term variability in systolic blood pressure is an independent predictor of stroke // Cerebrovasc. Dis. — 2005. — Vol. 19 (suppl 2). — P. 51.
13. Daemen J. Diastolic dysfunction and arterial stiffness: the chicken or the egg? // Neth. Heart J. — 2013. — Vol. 21(5). — P. 219-221
14. Dahlof B., Devereux R., Kjeldsen S. еt al. for the LIFE Study Group. Cardiovascular morbidity and mortality in losartan interventional for endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol // Lancet. — 2002. — Vol. 359. — P. 995-1003.
15. Flues K., Moraes-Silva I.C., Mostarda C. et al. Cardiac and Pulmonary arterial remodeling after sinoaortic denervation in normotensive rats // Autonomic Neuroscience. — 2012. — Vol. 166. — P. 47-53.
16. Foppa M., Duncan B., Rohde L. Echocardiography-based left ventricular mass estimation. How should we define hypertrophy? // Cardiovasc. Ultrasound. — 2005. — Vol. 3. — P. 17.
17. Frattola A., Parati G., Cuspidi C., Albini F., Mancia G. Prognostic value of 24-hour blood pressure variability // J. Hypertens. — 1993. — Vol. 11. — P. 1133-1137.
18. Fukui M., Ushigome E., Tanaka E. et al. Home blood pressure Variability on one occasion is a novel factor associated with Arterial stifness in patients with type 2 diabetes // Hypertension Research — 2013. — Vol. 36. — P. 219-225.
19. Garca-Garca А., Garca-Ortiz L., Recio-Rodr guez L. et al. Relationship of 24-h blood pressure variability with vascular structure and function in hypertensive patients // Blood Pressure Monitoring. — 2013. — Vol. 18. — P. 101-106.
20. Iwata S., Jin Z., Schwartz E. et al. Relationship between ambulatory blood pressure and aortic archatherosclerosis // Atherosclerosis. — 2012. — Vol. 221. — P. 427-431.
21. Kamberi L.S., Bakalli A.B., Budima N.M. et al. Pleiotropic and Lipid-lowering Effects of Statins in Hypertension // Mater Sociomed. — 2012. — Vol. 24 (2). — Р. 84-86.
22. Kario K., Pickering T., Umeda Y. et al. Morning surge in blood pressure as a predictor of silent and clinical cerebrovascular disease in elderly hypertensives: a prospective study // Circulation. — 2003. — Vol. 18. — Vol. 107(10). — P. 1401-1416.
23. Kawai T., Ohishi M., Kamide K. et al. Diferences between daytime and nighttime blood pressure variability regarding systemic atherosclerotic change and renal function // Hypertension Research. — 2013. — Vol. 36. — P. 232-239.
24. Klause O., Stumpe К., Agabiti-Rosei Е., Zielinski Т. et al. Carotid intima-media thickness and plaque volume changes following 2-year angiotensin II-receptor blockade. The Multicentre Olmesartan atherosclerosis Regression Evaluation (MORE) study // Ther. Adv. Cardiovasc. Dis. — 2007. — Vol. 1, № 2. — P. 97-106.
25. La Rosa J.C., Grundy S.M., Waters D.D. et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease // N. Engl. J. Med. — 2005. — Vol. 352(14). — P. 1425-1435.
26. Levey A., Stevens L., Schmid C. et al. CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). A new equation to estimate glomerular filtration rate // Ann. Intern. Med. — 2009. — Vol. 150(9). — P. 604-612.
27. Mancia G., Parati G., Hennig M. et al. Relation between blood pressure variability and carotid artery damage in hypertension: baseline data from the European Lacidipine Study on Atherosclerosis(ELSA) // J. Hypertens. — 2001. — Vol. 19. — P. 1981-1989.
28. Matsui Y., Eguchi K., O’Rourke M. et al. Differential Effects Between a Calcium Channel Blocker and a Diuretic When Used in Combination With Angiotensin II Receptor Blocker on Central Aortic Pressure in Hypertensive Patients // Hypertension. — 2009. — Vol. 54. — P. 716-723.
29. McMullan C.J., Bakris G.L., Phillips R.A., Forman J.P. Association of BP variability with mortality among African Americans with CKD // Clinical Journal of the American Society of Nephrology. — 2013. — Vol. 8. — P. 731-738.
30. Miao C.Y., Su D.E. The importance of blood pressure variability in rat aortic and left ventricular hypertrophy produced by sinoaortic denervation // J. Hypertens. — 2002. — Vol. 20. — P. 1865-1872.
31. Miao C.Y., Xie H., Zhan L., Su D. Blood Pressure variability is more important than blood pressure Level in determination of end-organ damage in rat // J. Hypertens. — 2006. — Vol. 24 — P. 1125-1135.
32. Migrino R., Bowers М., Harmann L., Prost R., LaDisa J. Jr. Carotid plaque regression following 6-month statin therapy assessed by 3T cardiovascular magnetic resonance: comparison with ultrasound intima media thickness // Journal of Cardiovascular Magnetic Resonance. — 2011. — Vol. 13. — P. 37.
33. Mottram P.M., Haluska B.A., Leano R. et al. Relation of arterial stiffness to diastolic dysfunction in hypertensive heart disease // Heart. — 2005. — Vol. 91(12). — P. 1551-1556.
34. Munro E., Patel M., Chan P. et al. Inhibition of human vascular smooth muscle cell proliferation by lovastatin: the role of isoprenoid intermediates of cholesterol synthesis // Eur. J. Clin. Invest. — 1994. — Vol. 24. — P. 766-772.
35. Nissen S.E., Tuzcu E.M., Schoenhagen P. et al. Effect of intensive compared with moderate lipid-lowering therapy on progression of coronary atherosclerosis: a randomized controlled trial // JAMA. — 2004. — Vol. 291(9). — P. 1071-1080.
36. Olsen M., Wachtell K., Neland K. et al. Losartan but not atenolol reduce carotid artery hypertrophy in essential hypertension. A LIFE substudy // Blood Press. — 2005. — Vol. 14. — P. 177-183.
37. Ozawa M., Tamura K., Okano Y. et al. Identification of an increased short-term blood pressure variability on ambulatory blood pressure monitoring as a coronary risk factor in diabetic Hypertensives // Clinical and Experimental Hypertension. — 2009. — Vol. 31. — P. 259-270.
38. Palatini P., Penzo M., Racioppaetal. A. Clinical relevance of night time blood pressure and of daytime blood pressure variability // Archives of Internal Medicine. — 1992. — Vol. 152. — P. 1855-1860.
39. Parati G., Lantelme P. Blood pressure variability, target organ damage and cardiovascular event // J. Hypertens. — 2002. — Vol. 20. — P. 1725-1729.
40. Parati G., Pomidossi G., Albini F., Malaspina D., Mancia G. Relationship of 24-hour blood pressure mean and variability toseverity of target-organ damage in hypertension // J. Hypertens. — 1987. — Vol. 5. — P. 93-98.
41. Preston Mason R., Walter M.F., Day C.A., Jacob R.F. Intermolecular differences of 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitors contribute to distinct pharmacologic and pleiotropic action // Am. J. Cardiol. — 2005. — Vol. 96 (Suppl.). — P. 11F-23F.
42. Rothwell P., Howard S., Dolan E. et al. Prognostic significance of visit-to-visit variability, maximum systolic blood pressure, and episodic hypertension // Lancet. — 2010. — Vol. 375. — P. 895-905.
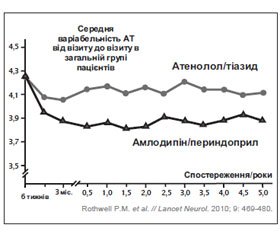
43. Rothwell P.M., Howard S.C., Dolan E. et al. Effects of beta blockers and calcium-channel blockers on within-individual variability in blood pressure and risk of stroke // Lancet Neurol. — 2010 — Vol. 9(5). — P. 469-480.
44. Rothwell Р. Limitations of the usual blood-pressure hypothesis and importance of variability, instability, and episodic hypertension // Lancet. — 2010. — Vol. 375. — P. 938-48.
45. Sakakura K., Ishikawa J., Okuno M. et al. Exaggerated ambulatory blood pressure variability is associated with cognitive dysfunction in the very elderly and quality of life in the younger elderly // Ameriсan J. Hypertens. — 2007. — Vol. 20. — P. 720-727.
46. Sander D., Kukla C., Klingelhöfer J., Winbeck K., Conrad B. Relationship between circadian blood pressure patterns and progression of early carotid atherosclerosis: a 3-year follow-up study // Circulation. — 2000. — Vol. 102. — Р. 1536-1541.
47. Schillaci G., Bilo G., Pucci G. et al. Relationship between short-term blood pressure variability and large-artery stifness in human hypertension: in dings from 2 large databases // Hypertension. — 2012. — Vol. 60. — P. 369-377.
48. Schutte A., Schutte R., Huisman H. et al. Blood pressure variability is significantly associated with ECG left ventricular mass in normotensive Africans: the SABPA Study // Hypertension Research. — 2011. — Vol. 34. — P. 1127-1134.
49. Sega R., Corrao G., Bombelli M. et al. Blood pressure variability and organ damage in a general population: results from the PAMELA study // J. Hypertens. — 2002. — Vol. 39. — P. 710-714.
50. Sever P., Dahlöf B., Poulter N. et al. Potential synergy between lipid-lowering and blood-pressure-lowering in the Anglo-Scandinavian Cardiac Outcomes Trial // Eur. Heart J. — 2006. — Vol. 27. — P. 2982-2988.
51. Sipahi I., Tuzcu E.M., Schoenhagen P. et al. Effects of normal, pre-hypertensive, and hypertensive blood pressure levels on progression of coronary atherosclerosis // J. Am. Coll. Cardiol. — 2006. — Vol. 15, № 48(4). — P. 833-838.
52. Stein J., Korcarz C., Hurst R. et al. American Society of Echocardiography Carotid Intima-Media Thickness Task Force. Use of carotid ultrasound to identify subclinical vascular disease and evaluate cardiovascular disease risk: a consensus statement from the American Society of Echocardiography carotid intima-media thickness task force endorsed by the society of vascular medicine // J. Am. Society Echoc. — 2008. — Vol. 21(2). — P. 93-111.
53. Su D.F., Miao C.Y. Blood pressure variability and organ damage // Clinical and Experimental Pharmacology and Physiology. — 2001. — Vol. 28. — P. 709-715.
54. Webb А., Fischer U., Mehta Z., Rothwell P. Effects of antihypertensive-drug class on interindividual variation in blood pressure and risk of stroke: a systematic review and meta-analysis // Lancet. — 2010. — Vol. 375. — P. 906-915.
55. White W. Blood pressure monitoring in Cardiovascular Medicine and Therapeutics. — N. Jersy: Humana Press, 2001. — P. 308.
56. Williams B., Lacy P. for the CAFE and the ASCOT (Anglo-Scandinavian Cardiac Outcomes Trial) Investigators Impact of Heart Rate on Central Aortic Pressures and Hemodynamics Analysis From the CAFE (Conduit Artery Function Evaluation) Study: CAFE-Heart Rate // J. Am. Coll. Cardiol. — 2009. — Vol. 54. — P. 705-713.
57. Zanchetti А., Gene Bond М., Hennig М. et al. Calcium Antagonist Lacidipine Slows Down Progression of Asymptomatic Carotid Atherosclerosis Principal Results of the European Lacidipine Study on Atherosclerosis (ELSA), a Randomized, Double-Blind, Long-Term Trial // Circulation. — 2002. — Vol. 106. — P. 2422-2427.
58. Zhang Y., Agnoletti D., Safar M.E., Blacher J. Effect of Antihypertensive Agents on Blood Pressure Variability The Natrilix SR Versus Candesartan and Amlodipine in the Reduction of Systolic Blood Pressure in Hypertensive Patients (X-CELLENT) Study // Hypertension. — 2011. — Vol. 58. — P. 155-160.

/13.jpg)
/16.jpg)
/18.jpg)
/17.jpg)
/19.jpg)
/20.jpg)