Статья опубликована на с. 6-8 (Мир)
Тромбоцитопении — это группа заболеваний и синдромов, объединенных общим признаком: наличием геморрагического синдрома, развивающегося в результате снижения числа кровяных пластинок в периферической крови до менее 150 • 109/л [1]. Они могут выступать в качестве самостоятельного заболевания (первичные) либо симптома других болезней (вторичные); иметь острое течение — длительностью до 6 месяцев, с внезапным началом и быстрым снижением количества тромбоцитов и хроническое — более 6 месяцев, с постепенным нарастанием проявлений и снижением уровня тромбоцитов [1, 2]. Распространенность тромбоцитопении достаточно велика, ежегодно регистрируется возникновение от 10 до 130 новых случаев на 1 млн населения [2].
Тромбоциты, тромбопоэтин и их функции
Количество тромбоцитов в норме составляет от 150 до 400 тыс/мм3. Это наиболее мелкие элементы крови, размер которых — 3,0–0,5 микрона. У тромбоцита нет ядра, но имеется большое количество гранул различного строения, называемых грануломерами; все негранулярные компоненты цитоплазмы относятся к гиаломерам. Плазмолемма тромбоцитов содержит многочисленные рецепторы, опосредующие действие веществ, активирующих и ингибирующих функции тромбоцитов, обусловливающие их адгезию к эндотелию сосудов и агрегацию друг с другом, что обеспечивает остановку кровотечений.
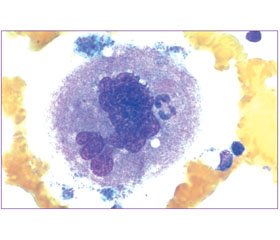
Тромбоциты образуются при фрагментации цитоплазмы мегакариоцитов — огромных полиплоидных костномозговых клеток, образующихся посредством эндомитоза (рис. 1). При этом происходит 3–5 циклов удвоения хромосом без разделения цитоплазмы. После выхода из костного мозга примерно треть тромбоцитов секвестрируется в селезенке, а оставшиеся две трети циркулируют в кровотоке 7–10 сут. При уменьшении количества тромбоцитов число, размер и плоидность мегакариоцитов возрастают, что способствует активизации образования тромбоцитов [1].
Этот процесс регулируется тромбопоэтином (ТПО), рецептор которого кодируется протоонкогеном MPL. Тромбопоэтин — главный физиологический регулятор образования тромбоцитов, экспрессируется преимущественно в печени, почках и в меньшей степени — в строме костного мозга. Действует как мощный стимулятор на всех стадиях роста и развития мегакариоцитов, а также стимулирует пролиферацию предшественников мегакариоцитов и стволовых кроветворных клеток [6, 7]. Таким образом, тромбопоэтин служит основным регуляторным фактором поддержания безопасного уровня тромбоцитов в организме.
Причины и патогенетические аспекты тромбоцитопений
Основные причины тромбоцитопений:
- перераспределение тромбоцитов, при котором их количество в общем кровотоке резко снижается;
- повышенная потребность организма в тромбоцитах;
- повышенная деструкция тромбоцитов;
- недостаточное образование тромбоцитов (сниженная продукция) [11].
Вынужденное перераспределение тромбоцитов приводит к их избытку в органе депонирования — селезенке и недостатку в крови. Развивается гиперспленизм (при спленомегалии до 90 % тромбоцитов находится в селезенке, хотя обычно депонируется только 1/3 этих клеток). Депонирование происходит вследствие цирроза печени с портальной гипертензией, злокачественных патологий кровеносной системы (лимфомы, лейкозы), инфекционных болезней (туберкулез, малярия, эндокардит), гипотермии.
При значительной потере тромбоцитов в результате процессов тромбообразования возникает повышенная потребность в них. Это происходит при массивных кровотечениях, экстракорпоральной циркуляции (например, при использовании искусственной почки или аппарата искусственного кровообращения).
Разрушение тромбоцитов — самая распространенная причина развития тромбоцитопений. Когда возникает повышенная потребность в красных кровяных пластинках, костный мозг начинает работать в усиленном режиме. Со временем развивается гиперплазия ткани и увеличивается число мегакариоцитов. Но если тромбоциты разрушаются быстрее, чем успевают поступать в кровеносное русло новые элементы, возникает тромбоцитопения.
Клинически тромбоцитопении, возникшие в результате повышенной деструкции тромбоцитов, по патогенезу разделяют на две группы: иммунологические и неиммунологические.
Врожденные неиммунные причины: преэклампсия у матери, инфекции.
Врожденные иммунные причины: идиопатическая тромбоцитопеническая пурпура (у матери), медикаменты.
Приобретенные неиммунные причины: инфекции, синдром диссеминированного внутрисосудистого свертывания крови (ДВС-синдром), медикаменты, гемолитико-уремический синдром.
Приобретенные иммунные причины: системная красная волчанка, неходжкинская лимфома, инфекции, медикаменты (хинин, гепарин), тромбоцитопеническая пурпура, ВИЧ-инфекция, посттрансфузионная пурпура, акушерские осложнения.
При тромбоцитопенической пурпуре тромбоцитопения развивается вследствие разрушения тромбоцитов посредством иммунных механизмов. Антитела к собственным тромбоцитам могут появляться спустя 1–3 нед. после перенесенных вирусных или бактериальных инфекций, профилактических прививок, приема лекарственных препаратов при индивидуальной их непереносимости, переохлаждения или инсоляции, после хирургических операций, травм. Поступившие в организм антигены оседают на тромбоцитах и индуцируют иммунный ответ. При этом продолжительность жизни тромбоцитов, нагруженных антителами, при тромбоцитопенической пурпуре снижена до нескольких часов вместо 7–10 дней в норме.
При иммунной тромбоцитопенической пурпуре развитие тромбоцитопении не приводит к сопоставимому росту тромбопоэтина в крови [8]. В отличие от эритропоэтина и гранулоцитарного колониестимулирующего фактора продукция основной фракции тромбопоэтина конституциональна [9], т. е. он продуцируется в относительно постоянном количестве печенью и утилизируется путем соединения с рецептором на макрофагах и тромбоцитах. На первом этапе заболевания продукция тромбопоэтина повышена, но повышено и его разрушение макрофагами вместе с присоединившимся ТПО. Увеличение потребления ТПО при стабильной продукции может приводить к снижению его концентрации и ослаблению стимуляции мегакариоцитов — «фабрики» тромбоцитов [10].
Тромбоцитопения при ВИЧ-инфекции по своему патогенезу и клиническому течению сходна с иммунной тромбоцитопенической пурпурой у неинфицированных пациентов. Частота тромбоцитопении при ВИЧ-инфекции возрастает по мере падения уровня CD4 Т-лимфоцитов и в стадии СПИДа достигает 30–45 % [13]. К причинам тромбоцитопении относится снижение выработки тромбоцитов, ускоренное их разрушение, депонирование при спленомегалии и сочетание этих факторов [16]. Разрушению тромбоцитов может способствовать индуцированный СD8 Т-лимфоцитами лизис [14]. Cole с соавт. первыми показали, что мегакариоциты человека, несущие рецепторы к CD4+-лимфоцитам, способны связываться с ВИЧ [15]. Ballem с соавт. обнаружили CXCR-4 — хемокиновый рецептор, известный как корецептор к ВИЧ на предшественниках мегакариоцитов, мегакариоцитах и тромбоцитах.
Также к причинам тромбоцитопении относится снижение выработки тромбоцитов, ускоренное их разрушение, депонирование при спленомегалии и сочетание этих факторов [16]. В костном мозге обнаруживается снижение числа клеток-предшественников мегакариоцитов. В мегакариоцитах выявлена РНК ВИЧ-1 со структурными нарушениями [17]. Антитромбоцитарные аутоантитела обнаруживаются у пациентов в разной клинической стадии, при этом отсутствует корреляция между наличием антител к тромбоцитам и развитием тромбоцитопении в ходе ВИЧ-инфекции [18]. ВИЧ-специфические антитела перекрестно реагируют с антигенами тромбоцитов gpIIb/IIIа. Очевидно, что молекулярная мимикрия между антигенами ВИЧ gp 160/120 и тромбоцитарными gp Iib/IIIa может обусловливать разрушение тромбоцитов по этому механизму [19].
Недостаточное образование тромбоцитов может быть следствием угнетения пролиферации клеток костного мозга при наличии [1, 11]:
- наследственных заболеваний: конституционной панцитопении (апластическая анемия Фанкони) и амегакариоцитарной тромбоцитопении с другими врожденными пороками;
- приобретенной изолированной амегакариоцитарной тромбоцитопенической пурпуры; лучевой болезни; при приеме цитостатиков (миелосупрессивных препаратов), которые оказывают непосредственное воздействие на красный костный мозг, угнетая его функции, применении некоторых лекарственных препаратов (тиазидных диуретиков, интерферона, эстрогенов); при наличии вирусов паротита, гепатитов А, В, С, ВИЧ; сепсиса.
В патогенезе тромбоцитопении при гепатите С основным механизмом развития тромбоцитопении является нарушение образования тромбоцитов. Но присутствует и их повышенное разрушение. Нарушение образования тромбоцитов связано с подавлением костномозгового кроветворения, а также со снижением активности и содержания тромбопоэтина вследствие прямого действия вирусов или в результате противовирусного лечения [20]. При этом мегакариоциты подвергаются прямой атаке вируса или токсического агента, что ведет к снижению продукции тромбоцитов [21]. Кроме того, вследствие снижения числа нормально функционирующих гепатоцитов при данной патологии возникает недостаточность тромбопоэтина и уменьшается его активность [20]. Также часто при вирусном гепатите С происходит выработка антител к вирусу. Антитела связываются с тромбоцитами, а иммунная система воспринимает их как чужеродный объект, что способствует их поглощению и разрушению клетками ретикулоэндотелиальной системы в печени и селезенке [22].
Химиотерапия, применяемая при опухолях, направленно подавляет клоны клеток, которые активно делятся. Это основной принцип, заложенный в цитостатическую терапию, поскольку опухоль неконтролируемо растет, а основная масса клеток обновляется медленно. Кроветворные клетки, в том числе тромбоциты, тоже постоянно делятся и поэтому чувствительны к химиотерапии (метотрексат, карбоплатин и др.). Последние угнетают функцию кроветворных органов, оказывают миелотоксическое воздействие на костный мозг, снижают уровень тромбопоэтина, что проявляется тромбоцитопенией [12]. Установлено, что тромбоцитопения поражает не менее 25 % всех пациентов, подвергшихся химиотерапии. Она возникает на 7-й день от момента введения препарата, достигая максимума к 10–12-му дню терапии. Развитие тромбоцитопении может происходить уже после 1 курса химиотерапии, постепенно прогрессируя с каждым последующим курсом. Согласно критериям ВОЗ по шкале СоmmonToxicityCriteriaNCIC выделяют 4 степени токсичности химиотерапии для тромбоцитов [28]:
I степень — 75–99 • 109/л.
II степень — 50–74 • 109/л.
III степень — 25–49 • 109/л.
IV степень — менее 25 • 109/л.
У пациентов с количеством тромбоцитов более 50 • 109/л тромбоцитопения нередко протекает бессимптомно; при 25–49 • 109/л любая травма может вызывать кровотечение, а концентрация менее 25 • 109/л повышает риск спонтанного кровотечения, петехий и кровоподтеков. Спонтанные кровотечения происходят у больных с количеством тромбоцитов менее 5 • 109/л и считаются угрожающим жизни состоянием [3, 4], нередко заканчивающимся летальным исходом. Тромбоцитопения ниже 25 • 109/л приводит к отсрочке и/или ограниченному применению последующих циклов химиотерапии, снижая шансы успешного лечения [29].
Методы терапии при тромбоцитопении
На сегодняшний день существует несколько методов, используемых в борьбе с тромбоцитопенией. Это трансфузия тромбоцитов, спленэктомия и применение рекомбинантного тромбопоэтина.
Заместительные трансфузии тромбоцитов или тромбоконцентрата используются в течение продолжительного периода, начиная с 50-х годов прошлого века. Согласно рекомендациям Американского общества клинической онкологии (ASCO) их назначают при падении уровня тромбоцитов крови ниже 10 • 109/л у клинически стабильного больного без признаков инфекции и геморрагии. При наличии перечисленных признаков профилактические трансфузии начинают при уровне тромбоцитов ниже 20 • 109/л. Только в США ежегодно пациентам трансфузируют около 8 миллионов единиц тромбоцитов, для того чтобы уменьшить опасность тяжелых кровотечений. Однако данный метод лечения дорогостоящий и в 30 % случаев сопровождается осложнениями, среди которых наиболее распространенными являются лихорадочные состояния, бактериемия, тромбозы, реакция «трансплантат против хозяина» или острое повреждение легких. У 50–90 % пациентов при множественных трансфузиях тромбоцитов развивается HLA-аллоиммунизация и рефрактерность к донорской плазме. Кроме того, трансфузии тромбоцитов создают опасность инфекций, передаваемых через кровь, таких как гепатит В, С, ВИЧ-инфекция и заражение Т-лимфотропным вирусом человека [30].
Другим методом борьбы с тромбоцитопенией является спленэктомия. С одной стороны, она позволяет быстро решить проблему тромбоцитопении, с другой — рецидив заболевания наблюдается в 25–40 % случаев, причем чаще в первый год после операции. По результатам ретроспективного анализа, включавшего данные опроса специалистов в 6 странах Европы и опубликованного в 2008 г., 74 % респондентов готовы отложить спленэктомию или отказаться от нее при опасениях больного или наличии противопоказаний [31]. В реальности лишь 6 % от 610 первичных больных, по данным этого анализа, перенесли спленэктомию.
Что же ограничивает более широкое применение данного эффективного и недорогого метода лечения тромбоцитопении? В первую очередь это опасность инфекции. Известно, что больные после спленэктомии более подвержены инфекции, вызываемой инкапсулированными микробами (стрептококки, нейссерия, гемофилюс, клебсиелла). Эти патогены после присоединения антител или компонентов комплемента С3b эффективно задерживаются макрофагами селезенки, но при ее отсутствии могут вызывать инфицирование внутренних органов. Развивающаяся инфекция, как правило, крайне агрессивна (менингит, сепсис), вызывает смертность в 40–70 % случаев [32]. Помимо повышения риска инфекции при спленэктомии также отмечено повышение риска легочной гипертензии [33].
Тромбопоэтин в терапии тромбоцитопений
Открытие и получение в рекомбинантной форме тромбопоэтина — фактора роста и развития мегакариоцитов — позволило значительно продвинуться в терапии тромбоцитопении. В ряде исследований было показано, что ТПО воздействует на мегакариоцитопоэз несколькими путями (рис. 2) [25]:
- вызывает увеличение размеров и повышение числа мегакариоцитов;
- повышает содержание ДНК в мегакариоцитах в форме полиплоидии;
- повышает эндомитоз мегакариоцитов;
- вызывает ускоренное созревание мегакариоцитов;
- увеличивает процентное содержание клеток-предшественников в костном мозге.
Благодаря этому индуцируется увеличение количества тромбоцитов, что позволяет решить проблему тромбоцитопений.
В настоящее время рекомбинантный тромбопоэтин человека стал доступен в Украине, что открывает новые возможности в лечении пациентов с тромбоцитопениями в нашей стране.
Эмаплаг (Emaplug) — первый в Украине1 рекомбинантный человеческий тромбопоэтин (представлен фармацевтической корпорацией «Юрия-фарм») — специфически стимулирует пролиферацию и дифференциацию мегакариоцитов, способствует образованию и высвобождению тромбоцитов периферической крови, а также восстановлению общего содержания лейкоцитов. Это возможно за счет связывания Эмаплага со специфическим рецептором ТПО-R, в результате чего запускается ряд молекулярных событий, приводящих к увеличению производства тромбоцитов.
Основными показаниями к назначению препарата Эмаплаг являются: лечение тромбоцитопении, вызванной химиотерапией, у пациентов с солидной опухолью; при уровне тромбоцитов ниже 50 • 109/л; а также в тех случаях, когда врач считает необходимым увеличить количество тромбоцитов.
Взрослым пациентам Эмаплаг вводят 1 раз в день подкожно через 6–24 часа после химиотерапии. Доза составляет 300 ЕД/кг массы тела на протяжении 14 дней. Если количество тромбоцитов в процессе лечения восстанавливается до 100 • 109/л и более либо абсолютный прирост тромбоцитов составляет более 50 • 109/л, введение препарата прекращают. При возникновении анемии или лейкопении, связанных с химиотерапией, Эмаплаг применяют в сочетании с рекомбинантным эритропоэтином или рекомбинантным человеческим гранулоцитарным колониестимулирующим фактором соответственно.
Во II фазе клинического исследования с участием 311 пациентов с тромбоцитопенией, индуцированной химиотерапией, частота благоприятного результата терапии составляла 96,14 %, побочные реакции носили легкий характер и не требовали отмены препарата.
Тромбоцитопения, индуцированная химиотерапией, вызвана апоптозом значительного количества мегакариоцитов и их предшественников. Причем химиотерапевтические препараты в большей степени цитотоксичны в отношении разных стадий мегакариопоэза, чем для клеток СD34 и полиплоидных мегакариоцитов (рис. 3) [27].
При введении тромбопоэтина уровень мегакариоцитов прогрессивно повышался, в то время как количество апоптозных клеток на протяжении всей химиотерапии оставалось практически без изменения. У пациентов без введения тромбопоэтина продукция мегакариоцитов значительно снижалась, а уровень апоптоза мегакариоцитов во время химиотерапии повышался. В исследовании было показано, что Эмаплаг способствует защите мегакариоцитов у пациентов при химиотерапии [25, 26] (рис. 4, 5).
Эффективность Эмаплага при тромбоцитопении, индуцированной химиотерапией, была изучена в открытом рандомизированном перекрестном исследовании с самоконтролем с участием 59 пациентов с солидными опухолями. У всех больных минимальный уровень тромбоцитов составлял 50 • 109/л и более во время первого курса химиотерапии. Эмаплаг вводили через 6–24 часа после химиотерапии по 300 ЕД/кг 1 раз в сутки в течение 14 дней.
Было продемонстрировано, что Эмаплаг способствует быстрому восстановлению количества тромбоцитов после химиотерапии, повышая их количество до 200 • 109/л в период с 15-го по 24-й день после ее проведения (рис. 6). Тогда как в контрольной группе этот показатель составлял 100–140 • 109/л. Также Эмаплаг повышал критично сниженный уровень тромбоцитов на 34 % и уменьшал потребность в переливании тромбоцитов после химиотерапии у 60 % пациентов.
Эффективность Эмаплага при иммунной тромбоцитопении показана в неконтролируемом открытом исследовании, проводившемся в 2004 году. В нем приняли участие 82 пациента с иммунной тромбоцитопенией, рефрактерной к кортикостероидам, иммуносупрессантам, или спленэктомией с уровнем тромбоцитов ниже 30 • 109/л. Эмаплаг назначали подкожно 1,0 мкг/кг 1 раз в сутки в течение 14 дней.
Было установлено, что эффективность Эмаплага при данной патологии составляет 85,3 %. Препарат действовал на 3-й день, и через месяц после проведения терапии уровень тромбоцитов был выше 75 • 109/л. Определение динамики выработки антител проводилось у 16 пациентов, однако нейтрализующие антитела были выявлены лишь у одного из них. При этом антитела у пациента были в крайне низком титре и не оказывали нейтрализующего эффекта [30].
Таким образом, тромбоцитопения — серьезная проблема, сопровождающая ряд заболеваний, увеличивающая частоту геморрагических осложнений и связанной с этим смертности. Она является тяжелым осложнением химиотерапии, приводящим к отмене последней, снижению ее эффективности и росту летальности как вследствие прогрессирования опухолевого процесса, так и в результате кровотечений.
Появление рекомбинантного тромбопоэтина Эмаплаг — новая возможность в борьбе с тромбоцитопенией, в том числе вызванной химиотерапевтическим лечением у пациентов с солидными опухолями. Он стимулирует пролиферацию и дифференциацию мегакариоцитов, способствует образованию, высвобождению и восстановлению тромбоцитов в периферической крови. Это, в свою очередь, позволяет соблюдать схемы химиотерапии, продолжительность курсов лечения и интервалов между циклами, увеличивая шансы на успех терапии и выживаемость пациентов.

/6_m.jpg)
/8_m.jpg)
/8_m2.jpg)