Статтю опубліковано на с. 27-32
Сьогодні загальновизнаним фактом є важлива роль синдрому системної відповіді на запалення (в англомовній літературі — Systemic Inflammatory Response Syndrome, SIRS) у формуванні критичного стану будь-якої етіології з високим ризиком розвитку синдрому поліорганної недостатності (СПОН) і смерті хворого [3, 5, 23, 27].
У критичному стані антигенна стимуляція призводить до секреції біологічно активних речовин, у тому числі цитокінів, що регулюють реакцію пацієнта на інфекцію, імунологічні вторгнення, запалення й травму. До основних груп цитокінів належать інтерлейкіни (IL), інтерферони, фактор некрозу пухлини α (TNF-α), ростові та колонієстимулюючі чинники, супресорні фактори й хемотаксини [1].
Загальні функції цитокінів: проліферація та диференціювання попередників функціонально активних імунокомпетентних клітин, хемотаксис, зміна експресії антигенів і різних маркерів, переключення синтезу імуноглобулінів, індукція цитотоксичності в макрофагів, формування вогнища запалення, гуморальна ланка взаємозв’язків інтеграційних систем організму — імунної, нервової та ендокринної.
Ефекти цитокінів тісно пов’язані з фізіологічними й патофізіологічними реакціями організму. На початковій стадії розвитку запалення реєструють підвищений рівень прозапальних цитокінів (TNF-α, IL-1, -6, -8), із гіперпродукцією яких пов’язують виникнення шоку, респіраторного дистрес-синдрому, синдрому дисемінованого внутрішньосудинного згортання крові. Метаболічною відповіддю організму на запалення є розвиток синдрому гіперметаболізму-гіперкатаболізму, що запускає СПОН [22].
Найбільш виражені метаболічні ефекти мають такі цитокіни: IL-1, IL-6, TNF-α та γ-інтерферон [6, 12, 19, 25].
IL-1 викликає депресію центральної нервової системи, розвиток анорексії. Гіперпродукція IL-1β через нейроендокринну гіпоталамо-гіпофізарно-наднирникову активацію сприяє розвитку гіперкатаболізму й м’язової атрофії [11]. IL-1 стимулює місцеве вивільнення простагландинів, що викликають розвиток гарячки (синергізм із TNF-α), збільшення швидкості метаболізму й споживання кисню (О2). IL-1 стимулює утворення гепатоцитами білків гострої фази і продукцію Т-хелперами IL-2, диференціацію й проліферацію В-клітин, звільнення факторів, пов’язаних із ростом і диференціюванням мієлоїдної та лімфоїдної клітинних ліній. IL-1 викликає нейтрофілію та обумовлює розвиток артеріальної гіпотонії.
Основним ефектом IL-6 є його участь як кофактора в диференціації В-лімфоцитів, їх дозріванні та перетворенні в плазматичні клітини, які секретують імуноглобуліни. IL-6 сприяє експресії рецептора IL-2 на активованих імуноцитах, а також індукує виробництво IL-2 Т-клітинами.
TNF-α продукується моноцитами крові, легеневими макрофагами, купферівськими клітинами печінки, перитонеальними макрофагами у відповідь на введення в організм ендотоксину (ліпополісахарид). TNF-α може вироблятися в клітинах інших органів при їх ішемії.
TNF-α відіграє важливу роль в адаптації організму до процесів тканинного пошкодження і запалення, індукує апоптоз у міокарді через утворення сфінгозину, оксиду азоту й активацію рецепторів до TNF-α I типу. Сфінгозин (метаболіти сфінголіпідів утворюються при стресі), можливо, є медіатором ранньої фази функціональної депресії міокарда. Оксид азоту — це медіатор пізньої фази пригнічення скоротливої здатності міокарда, зумовленого TNF-α. Інші механізми, через які реалізуються негативні впливи TNF-α на міокард: погіршення функції мітохондрій, окислювальний стрес, переривання збудження й індукція апоптозу міоцитів, синтезу кардіодепресивних речовин (IL-1 і IL-6).
TNF-α сприяє розвитку артеріальної гіпотонії (через зниження скоротливої здатності міокарда, загального периферичного опору судин, дилатації правого шлуночка серця), гострого легеневого пошкодження, коагулопатії, анорексії, кахексії, гіпертригліцеридемії, інсулінорезистентності, синтезу й звільненню гострофазових білків, активації глюконеогенезу, нейтропенії; викликає гіперглікемію, гіперкаліємію, петехіальні крововиливи в легенях і шлунково-кишковому тракті, гострий некроз канальців нирок.
TNF-α є відповідальним за підвищення транс–крипції печінкових білків гострої фази і призводить до виснаження тканин, а якщо це триває довго — до кахексії. Наслідки: анорексія, втрата маси тіла, зниження імунітету, сповільнене загоєння ран.
γ-інтерферон є синергістом TNF-α, тому викликає такі самі клінічні та метаболічні відповіді.
Прозапальні цитокіни беруть участь у регуляції різних функцій скелетних м’язів, безпосередньо змінюють чутливість рецепторів до дії інсуліну. Після взаємодії цитокінів із відповідними рецепторами на клітинній мембрані сигнал передається в ядро клітини, де активуються відповідні гени, відповідальні за вироблення клітиною низькомолекулярних білкових речовин.
При критичному стані, незважаючи на підвищення рівня інсуліну в крові, розвивається цитокін–індукована інсулінорезистентність. У скелетних м’язах пацієнтів посилюється катаболізм білка для забезпечення субстрату під час гострої фази запальної відповіді, глюконеогенезу, відновлення тканин і функції імунної системи. Дослідження Monk D.N. et al. (1996) було спрямоване на проведення аналізу динаміки витрат енергії і складу тіла (маса, загальний азот, жир і вода тіла, внутрішньоклітинний калій) у хворих з тупою травмою. Упродовж 21 дня спостереження у хворих у критичному стані була зареєстрована втрата 1,62 кг загального білка тіла (16 %), з яких 1,09 кг (67 %) — білок зі скелетних м’язів (р < 0,0002) [27].
Zhang Y. et al. (2000) опублікували результати дослідження, мета якого полягала в установленні наявності рецепторів на поверхні клітин скелетної мускулатури для чотирьох прозапальних цитокінів: IL-1, IL-6, TNF-α і γ-інтерферону [13]. На тканинному рівні виявлено механізм сенсибілізації рецепторів прозапальними цитокінами. Показано, що ефект впливу цитокінів на рецептори скелетних м’язів посилювався в комбінації IL-1, IL-6, TNF-α й ендотоксину.
Z.A. Puthucheary (2013) вивчав терміни розвитку атрофії скелетних м’язів при критичних захворюваннях [10]. У хворих у критичному стані проводилося ультразвукове дослідження, а саме вимірювання площі поперечного перерізу прямого м’яза стегна на 1, 3, 7 і 10-й день захворювання. На підставі гістопатологічного аналізу характеризувалася динаміка синтезу білка в м’язах, співвідношення білка й ДНК. Зроблено висновки, що у пацієнтів у критичному стані протягом першого тижня хвороби відбувається швидка втрата м’язової маси, більш виражена у хворих зі СПОН.
Отже, під впливом прозапальних цитокінів швидке виснаження пластичних і енергетичних ресурсів організму супроводжується розвитком гіперлактатемії, інсулінорезистентності, порушенням утилізації глюкози, збільшенням синтезу глюкози, депресією глюконеогенезу й непереносимістю глюкози.
Сильне запалення активує протизапальні патологічні шляхи, що проявляється продукцією протизапальних цитокінів, таких як IL-10 і трансформуючий фактор росту β (transforming growth factor-β) [31]. Функцією IL-10 є запобігання надмірному запаленню через зниження продукції гранулоцитів, колонієстимулюючого фактора й IL-1, -6, -8 і TNF-α [28]. IL-10 справляє імуностимулюючий ефект на Т-супресори, є потужним фактором проліферації й диференціації В-лімфоцитів, стимулює синтез імуноглобулінів класу М, А і G [2].
Підвищена продукція IL-10 може спровокувати стан імуносупресії, відомий як синдром протизапальної відповіді (Сompensatory Anti-inflammatory Response Syndrome, CARS) [17]. Розвиток CARS спрямований на обмеження надмірного запального процесу у хворих з інфекційним (сепсисом) або неінфекційним синдромом системної відповіді на запалення [9].
Одним з основних наслідків CARS є підвищення чутливості пацієнтів, яким проводиться інтенсивна терапія, до розвитку інфекцій, зумовлених умовно-патогенною флорою (опортуністичною). Розвиток нозокоміальної інфекції й абдомінального сепсису є причиною додаткового джерела пошкодження органів пацієнтів у відділенні анестезіології й інтенсивної терапії (ВАІТ) [18].
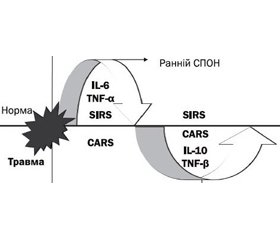
У багатьох випадках ці два синдроми (SIRS/САRS) можуть існувати разом [14, 26] (рис. 1).
Синдром змішаної антагоністичної дії (Mixed Antagonistic Response Syndrome, MARS) визначається як синдром взаємодії різноспрямованих (запальної/протизапальної) відповідей (SIRS/САRS). В умовах критичного стану MARS — стадія імунодефекту (фаза адаптивного імунітету), коли є часовий розрив між SIRS і CARS. На 5-ту добу з моменту пошкодження починається максимальний ризик розвитку септичних ускладнень, тому ступінь збалансованості цих процесів обумовлює вихід постраждалого з критичного стану [8]. Отже, SIRS, SIRS/САRS і MARS — це складові (стадії) системної відповіді організму на запалення. На сьогодні визнано, що імунний дистрес — це неспецифічний клінічний синдром порушення механізмів вродженого й адаптивного імунітету з дисфункцією клітин імунного реагування [7].
Для корекції синдрому гіперметаболізму-гіперкатаболізму та імунного дистресу в комплексі інтенсивної терапії критичних станів патогенетично обґрунтовані показання до нутритивної підтримки з використанням різних фармаконутрієнтів, у тому числі ω-3 жирних кислот (ЖК) як компонента цілеспрямованої органопротективної терапії [4].
Згідно з Guidelines on Parenteral Nutrition: Intensive Care (2009), у хворих під час перебування у ВАІТ ліпіди повинні бути невід’ємною частиною парентерального харчування (ПХ) для забезпечення енергії і незамінних ЖК [20]. До оптимального складу ПХ, імовірно, повинні входити ω-3 ЖК. Акцентується увага на тому, що використання суміші довголанцюгових і середньоланцюгових (LCT/MCT) ліпідних емульсій має клінічні переваги порівняно з LCT, але це потребує підтвердження в проспективних контрольованих дослідженнях. Суміші LCT/MCT у комплексі нутритивної підтримки є ефективним джерелом енергії, стійкі в умовах пероксидації, підвищують захисні властивості клітинної мембрани ізольованих нейтрофілів і не є субстратом для синтезу протизапальних медіаторів.
Додавання ω-3 ейкозапентаєнової (ЕПК) і доксагексаєнової (ДГК) кислот у ліпідні емульсії має очевидний протективний ефект на клітинні мембрани й запальні процеси. Застосування жирових емульсій з додаванням риб’ячого жиру (переважання ω-3) зменшує синтез менш активних ейкозаноїдів і прозапальних медіаторів, молекул адгезії, проліферацію лімфоцитів і моноцитів, хемотаксис, адгезію й міграцію лейкоцитів. Зроблено висновок, що ліпідні емульсії з умістом риб’ячого жиру, ймовірно, можуть зменшувати тривалість лікування хворих у ВАІТ.
За даними M. Jędrzejczak-Czechowicz, M.L. Ko–wal–ski (2011), сьогодні доцільно говорити про вплив ліпідних емульсій на функції імунної системи й запальні процеси, що супроводжують основне захворювання [21]. Метаболізм ω-3 ЕПК відбувається з утворенням медіаторів непарної серії — PG 3-ї серії, TX 3-ї серії та LT 5-ї серії, що забезпечують протизапальну дію (anti-inflammatory action).
У процесі метаболізму лінолевої кислоти (ω-6) утворюється арахідонова кислота. Цикл арахідонової кислоти проходить з утворенням 2-ї серії простагландинів (PG) і тромбоксанів (TX) за циклооксигеназним шляхом (COX) і лейкотрієнів 4-ї серії (LT) — за ліпоксигеназним (LOX). Синтезовані –медіатори парної серії забезпечують прозапальну дію (pro-inflammatory action). Наприклад, підвищений синтез PGE2 супроводжується розвитком гіпертермії, вазодилатації та гіперемії, набряків і гіпералгезії. TXA2 стимулює агрегацію тромбоцитів, обумовлює вазоконстрикторний та бронхоконстрикторний ефекти. LTB4 обумовлює адгезію лейкоцитів із судинним ендотелієм, сприяє їх екстравазації.
Tina Jafari et al. (2015) проведено комп’ютери–зований пошук літератури в базах даних PubMed и Cochrane, ISI WEB of Science і Iran Medex для пошуку рандомізованих контрольованих досліджень, які оцінювали ефект ПХ з фармаконутрієнтами [24]. Під час аналізу показано, що внутрішньовенне введення фармаконутрієнтів значно знижувало ризик розвитку інфекційних ускладнень (р ≤ 0,05) і летальності (р ≤ 0,001) у хворих на гострий панкреатит, вірогідно знижувалася тривалість госпіталізації (р ≤ 0,001). Зроблено висновок, що включення в комплекс ПХ фармаконутрієнтів, таких як глутамін і ω-3 ЖК, може поліпшувати прогноз у хворих на гострий панкреатит.
Ефективним донатором енергії та компонентом імунонутритивної підтримки в пацієнтів після операційних утручань великого обсягу, хворих на сепсис, пацієнтів із масивними травматичними пошкодженнями та опіками вважається використання LCT/MCT-емульсій з ω-3 ЖК (ліпоплюс у складі нутрифлекс омега). Це забезпечує можливість уведення есенціальних ЖК, зменшення глюкозного навантаження із забезпеченням високого протеїн–зберігаючого ефекту. Згідно з даними R.D. Stapleton et al. (2010), на фоні інфузії LCT/MCT-емульсій з ω-3 ЖК у хворих не знижувалася артеріальна оксигенація, не підвищувалися рівні аспартатамінотрансферази, аланінамінотрансферази (АЛТ) і білірубіну, забезпечувалася регуляція балансу про- і протизапальних медіаторів системи SIRS/CARS [16]. Використання збагачених риб’ячим жиром ліпідних емульсій у пацієнтів у критичному стані супроводжувалося зменшенням тривалості лікування в стаціонарі.
L. Pradelli et al. (2012) провели метааналіз 23 досліджень, які включали 502 планових хірургічних і реанімаційних хворих (серед них 762 пацієнти з ВАІТ). Пацієнти при гіперзапальних станах отримували за показаннями додаткове ПХ, збагачене ω-3 ЖК [30]. Автори продемонстрували, що введення ПХ, збагаченого ω-3 ЖК, дає певні переваги, пов’язані зі статистично та клінічно значущим зниженням рівня інфекційних ускладнень, зменшенням тривалості перебування у ВАІТ і стаціонарі в цілому. Реєструвалося поліпшення газообміну в легенях, зниження маркерів запалення, поліпшення функції печінки, антиоксидантного статусу, оптимізація вмісту ЖК у фосфоліпідах плазми й мембранах клітин, тенденція до зниження частоти дисфункції нирок.
За даними N.N. Li et al. (2014), призначення в післяопераційному періоді ПХ, збагаченого ω-3 ЖК, супроводжувалося значним зниженням тривалості лікування хворих у стаціонарі (95% довір–чий інтервал (ДІ) від –3,02 до –1,27), імовірності розвитку інфекції (95% ДІ від 0,35 до 0,81), зменшенням рівня АЛТ (95% ДІ від –11,75 до –0,94) і загального білірубіну крові (95% ДІ від –3,6 до 0,52) [15]. Зроблено висновок, що ω-3 ЖК у складі ПХ є безпечними і необхідними для лікування післяопераційних хворих.
Висновки
1. Розвиток у пацієнта SIRS або CARS повинен визначати вибір ліпідної емульсії в комплексі ПХ у схемі інтенсивної терапії.
2. У пацієнтів із масивними травматичними пошкодженнями, опіками і сепсисом, а також у післяопераційних хворих використання LCT/MCT-емульсій і ω-3 ЖК як донатора енергії є ефективним і безпечним компонентом імунонутритивної підтримки.
3. Використання в комплексі нутритивної підтримки ліпідних емульсій, збагачених риб’ячим жиром, сприяє зниженню тривалості лікування в стаціонарі пацієнтів із критичними станами.
Список литературы
1. Козлов В.К. Иммунопатогенез и цитокинотерапия хирургического сепсиса: Пособие для врачей / В.К. Козлов. — СПб.: Ясный свет, 2002. — 48 с.
2. Малыш И.Р. Уровень интерлейкина-10 и состояние клеточного звена иммунитета у пострадавших с синдромом полиорганной недостаточности вследствие тяжелой политравмы / И.Р. Малыш, Ю.А. Гайдаев, Л.В. Згржебловская // Український журнал екстремальної медицини імені Г.О. Можаєва. — 2003. — Т. 4, № 4. — С. 22-27.
3. Молчанова Л.В. Cистемный воспалительный ответ и молекулы адгезии // Общая реаниматология. — 2005. — Т. I, № 1. — С. 54-59.
4. Нестеренко А.Н. Заместительная иммунокоррекция при хирургическом сепсисе: осознание патогенетической целесообразности / Нестеренко А.Н. // Медицина неотложных состояний. — 2011. — № 7–8 (38–39). — С. 123-130.
5. Лукач В.Н. Прогностическое значение определения спектра провоспалительных цитокинов у больных с краниоторакальной травмой тяжелой степени / Лукач В.Н., Калиничев А.Г., Байтугаева Г.А., Мангус А.Э., Вторушина Л.И. // Анестезиология и реаниматология. — 2008. — № 1. — С. 74-77.
6. Мороз В.В. Сепсис: клинико-патофизиологические аспекты интенсивной терапии: Рук-во для врачей / В.В. Мороз, В.Н Лукач, Е.М. Шифман, В.Т. Довгих, И.И. Яковлева. — Петрозаводск: ИнтелТех, 2004. — 291 с.
7. Черний В.И. Нарушения иммунитета при критических состояниях: особенности диагностики / В.И. Черний, А.Н. Нестеренко // Внутренняя медицина. — 2007. — № 2. — С. 12-23.
8. Черний В.И. Иммунокоррекция в комплексе интенсивной терапии хирургического сепсиса: Методические рекомендации / В.И. Черний, А.Н. Нестеренко. — К., 2010. — 76 с.
9. Adib-Conquy M. Compensatory anti-inflammatory response syndrome / M. Adib-Conquy, J.M. Cavaillon // Thromb. Haemost. — 2009. — Vol. 101, № 1. — P. 36-47.
10. Acute skeletal muscle wasting in critical illness / Puthucheary Z.A., Rawal J., McPhail M., Connolly B., Ratnayake G., Chan P., Hopkinson N.S., Phadke R., Dew T., Sidhu P.S., Velloso C., Seymour J., Agley C.C., Selby A., Limb M., Edwards L.M., Smith K., Rowlerson A., Rennie M.J., Moxham J., Harridge S.D., Hart N., Montgomery H.E. // JAMA. — 2013. — Vol. 310, № 15. — Р. 1591-1600.
11. Central nervous system inflammation induces muscle atrophy via activation of the hypothalamic-pituitary-adrenal axis / Braun T.P., Zhu X., Szumowski M., Scott G.D., Grossberg A.J., Levasseur P.R., Graham K., Khan S., Damaraju S., Colmers W.F., Baracos V.E., Marks D.L. // J. Exp. Med. — 2011. — Vol. 208, № 12. — Р. 2449-2463.
12. Bédard S. Cytokines modulate glucose transport in ske–letal muscle by inducing the expression of inducible nitric oxide synthase / Bédard S., Marcotte B., Marette A. // Biochem. J. — 1997. — Vol. 325. — Р. 487-493.
13. Zhang Y. Cytokines and endotoxin induce cytokine receptors in skeletal muscle / Zhang Y., Pilon G., Marette A., Baracos V.E. // Am. J. Physiol. Endocrinol. Metab. — 2000. — Vol. 279. — P. 196-205.
14. David N. Herndon: Total burn care. — Saunders, Elsevier. — 2007. — Р. 292-308.
15. Li N.N. Does intravenous fish oil benefit patients post-surgery? A meta-analysis of randomised controlled trials / N.N. Li, Y. Zhou, X.P. Qin, Y. Chen, D. He, J.Y. Feng, X.T. Wu // Clin. Nutr. — 2014. — Vol. 33, № 2. — Р. 226-239.
16. Stapleton R.D. Fish oil in critical illness: mechanisms and clinical applications / Stapleton R.D., Martin J.M., Mayer K. // Crit. Care Clin. — 2010. — Vol. 26. — Р. 501-514.
17. Fumeaux T. Role of interleukin-10 in the intracellular sequestration of human leukocyte antigen-DR in monocytes during septic shock / T. Fumeaux, J. Pugin // Am. J. Respir. Crit. Care Med. — 2002. — Vol. 166. — Р. 1475-1482.
18. Grigoryev E.G. Therapy of compartmentalization of the proinflammatory and anti-inflammatory cytokines in sepsis / E.G. Grigoryev // Critical Care. — 2010. — Vol. 14, № 1. — P. 566.
19. Goodman M.N. Tumor necrosis factor induces ske–letal muscle protein breakdown in rats / M.N. Goodman // Am. J. Physiol. Endocrinol. Metab. — 1991. — Vol. 260. — Р. 727-730.
20. Singer P. Guidelines on Parenteral Nutrition: Intensive care / P. Singer, M.M. Berger, G. Van den Berghe, G. Biolo, P. Calder, A. Forbes, R. Griffiths, G. Kreyman, X. Leverve, C. Pichard // Clinical Nutrition. — 2009. — № 28. — Р. 387-400.
21. Jędrzejczak-Czechowicz M. Effects of parenteral lipid emulsions on immune system response / M. Jędrzejczak-Czechowicz, M.L. Kowalski // Аnaesthesiology Intensive Therapy. — 2011. — Vol. XLIII, № 4. — P. 207-213.
22. Marshall J.C. Biomarker of sepsis / J.C. Marshall, K. Rein–hart // Crit. Care Med. — 2009. — Vol. 37, № 7. — P. 2290-2298.
23. Lee J.H. Outcomes and prognostic factors for severe community-acquired pneumonia that requires mechanical ventilation / J.H. Lee, Y.J. Ryu, E.M. Chun, J.H. Chang // Korean J. Intern. Med. — 2007. — № 22. — Р. 157-163.
24. Jafari T. Parenteral immunonutrition in patients with acute pancreatitis: A systematic review and meta-analysis / T. Jafari, A. Feizi, G. Askari, A.A. Fallah // Clinical nutrition. — 2015. — Vol. 34, № 1. — P. 35-44.
25. Memon R.A. Regulation of fatty acid transport protein and fatty acid translocase mRNA levels by endotoxin and cytokines / Memon R.A., Feingold K.R., Moser A.H., Fuller J., Grunfeld C. // Am. J. Physiol. Endocrinol. Metab. — 1998. — Vol. 274. — Р. 210-217.
26. Cotran R.S. Robbins pathologic basis of disease / Cotran R.S., Kumar V., Collins T., Robbins S.L. — 6th ed. — Philadelphia: W.B. Saunders, 1999. — 75 р.
27. Monk D.N. Sequential changes in the metabolic response in critically injured patients during the first 25 days after blunt trauma / Monk D.N., Plank L.D., Franch-Arcas G., Finn P.J., Streat S.J., G.L. Hillet // Ann. Surg. — 1996. — Vol. 223. — Р. 395-405.
28. Schneider C.P. The role of interleukin-10 in the regulation of the systemic inflammatory response following trauma-hemorrhage / C.P. Schneider, M.G. Schwacha, I.H. Chaudry // Biochеm. Biophys. Acta. — 2004. — Vol. 1689. — P. 22-32.
29. Vosylius S. Sequential organ failure assessment score as the determinant of outcome for patients with severe sepsis / S. Vosylius, J. Sipylaite, J. Ivaskevicius // Croat Med. J. — 2004. — № 45. — Р. 715-720.
30. Pradelli L. ω-3 fatty acid-enriched parenteral nutrition regimens in elective surgical and ICU patients: a meta-analysis / L. Pradelli, K. Mayer, M. Muscaritoli, A.R. Helle // Critical Care. — 2012. — № 16. — R184.
31. Yeh F.L. Deficient transforming growth factor beta and interleukin-10 response contribute to the septic death of burned patients / F.L. Yeh, H.D. Shen, R.H. Fang // Burns. — 2002. — Vol. 28, № 7. — P. 631-637.

/27-32/29-1.jpg)