Статтю опубліковано на с. 124-129
Вступ
За даними ВООЗ, рівень дитячої смертності з 1990 року до сьогодні знизився на 53 %, проте у 2015 році у світі померло 5,9 млн дітей, що становить майже 16 тис. дитячих смертей кожного дня.
Ризик смерті в дітей до 5 років залишається найвищим в Африці та становить 81 випадок смерті дітей на 1000 народжених живими, тоді як аналогічний показник для Європи приблизно в 8 разів нижчий і становить 11 випадків смерті на 1000 народжених живими [13]. Протягом останніх десятиріч відбулися значні зрушення в структурі нозокоміальних інфекцій, що пов’язані не тільки зі збільшенням частоти інвазивних мікозів (ІМ) у пацієнтів із порушенням імунного статусу, але і з наявністю хірургічної патології та критично тяжкого стану. Дані локального епідеміологічного статусу у відділеннях інтенсивної терапії (ВІТ), а також прогнозування ризику виникнення ІМ можуть допомогти ідентифікувати, адекватно профілактувати та лікувати ІМ у таких пацієнтів.
Відомо, що інфекції кровотоку, асоційовані з наданням медичної допомоги та спричинені Сandida spp., посідають третє місце серед усіх інфекцій у ВІТ у США та Європі [7]. Candida spp. — це найчастіші збудники ІМ, а 70–90 % випадків інфікування трапляються в стаціонарі [9]. Частота виникнення інвазивного кандидозу (ІК) низька серед критичних дорослих пацієнтів без нейтропенії та становить 2 випадки на 1000 надходжень у ВІТ, тоді як у дітей раннього віку вона є суттєво вищою [1, 6, 7, 9]. Кандидемія подовжує час госпіталізації, витрати на лікування одного випадку становлять близько 40 тис. доларів, а рівень 30-денної летальності перевищує 50 % [9]. Рівень атрибутивної летальності серед пацієнтів з ІМ становить від 11,4 до 13,6 % [6].
Мета дослідження: вивчити дані літератури щодо поширення та причин розвитку ІМ у дітей в критичному стані; проаналізувати поширеність ІМ серед пацієнтів із тяжким сепсисом (ТС), які перебували на стаціонарному лікуванні; установити фактори ризику розвитку інвазивних мікозів у дітей із ТС; вивчити частоту поширення флюконазол-резистентних штамів Candida spp. у даних хворих.
Матеріали та методи
До дослідження увійшли 18 дітей із тяжким сепсисом, із них 12 дітей були віком від 1 міс. до 1 року та 6 дітей — від 1 до 3 років. Усі пацієнти перебували на лікуванні в комунальному закладі «Львівська обласна дитяча клінічна лікарня «ОХМАТДИТ» із 01.07.2015 р. по 01.11.2016 р.
Дизайн дослідження: відкрите обсерваційне проспективне нерандомізоване дослідження. Критеріями включення в дослідження були клінічні ознаки ТС, мікологічні критерії доведеного ІМ, вік дітей 1 міс. — 3 роки; критерієм виключення з дослідження — термінальний стан пацієнта. Усі пацієнти з метою профілактики розвитку ІМ при верифікації ТС отримували флуконазол у дозі 10–12 мг/кг/добу.
Результати та обговорення
За результатами епідеміологічного дослідження, проведеного у Великобританії у 2000–2009 роках серед дітей до 15 років, установлено, що частота кандидемії найвища в дітей до 1 року та становить 11 випадків на 100 000 осіб на рік; у віці 1–4 роки — 1,77 випадку; у віці 5–9 років — 0,53 випадку та у віці 10–14 років знижується до 0,47 випадку на 100 000 осіб на рік. Гриби роду Сandida було виявлено у 89,6 % випадків ІМ, а Сandida albicans та Candida parapsilosis були найчастішими збудниками для всіх вікових груп [2].
Разом із тим у проспективному обсерваційному мультицентровому дослідженні серед дітей і новонароджених з ІК (2007–2011 роки, включено 196 педіатричних і 25 неонатальних пацієнтів) установлено, що non-albicans виду Candida є предомінантною причиною ІК у 56 % випадків у дітей понад 1 міс. та в 52 % випадків у неонатальній групі пацієнтів, тоді як добра відповідь на лікування відмічалася в 92 % неонатальних та лише в 76 % педіатричних пацієнтів [7]. Серед пацієнтів неонатальних ВІТ найчастішими збудниками ІК є C. albicans та C. parapsilosis, а фактором, що наявний у всіх випадках ІК, є центральний венозний катетер. Поширеність ІК серед неонатальних пацієнтів становила 4,2 випадку на 1000 госпіталізованих у ВІТ дітей, а з усіх випадків він діагностований у 65,9 % дітей, народжених з екстремально низькою масою тіла [6]. Сandida parapsilosis — друга за частотою після Сandida albicans причина кандидемії. Вона найчастіше зустрічається у віці менше 2 років і асоціюється з проведенням максимальної вентиляції легень. У дітей до 2 років С. parapsilosis спостерігається в 62 % випадків, тоді як у старших дітей — у 50 % випадків [3]. Відповідно до даних проспективного мультицентрового дослідження, ініційованого European Confederation of Medical Mycology (ECMM) у 2006–2008 роках [8], проаналізовано дані 779 пацієнтів з ІМ з 14 країн Європи, із них 42 пацієнти були дітьми, 26 із них — до 1 року. У дітей С. albicans виділено в 42,3 %, С. parapsilosis — у 38,5 %, C. glabrata — у 7,7 %, С. tropicalis — у 7,7 %, C. guilliermondii — у 3,8 % випадків. У цьому дослідженні було встановлено, що якщо дорослим пацієнтам, крім протигрибкового лікування, видаляли центральний судинний доступ (у 70 % всіх пацієнтів з ІК), то це супроводжувалося підвищенням рівня виживання з 48,8 до 68,1 % (р = 0,02). Рівень атрибутивної летальності становив 15 %. Рівень 30-денної летальності в дорослих пацієнтів становив 38,8 %, у дітей 3–12 міс. — 72,4 %, у 4 дітей до 3 міс. — 67 %. Інфекції, викликані С. krusei та C. glabrata, призводили до вищого рівня летальності (57,9 та 43,6 % відповідно) порівняно з С. tropicalis (26,8 %), С. albicans (36,8 %), С. parapsilosis (36,2 %). Крім того, ризик смерті був нижчим у тих хірургічних пацієнтів, яким проводилися повторні операції. У 3,7 % із крові пацієнтів було виділено більше 1 виду Candida. Також установлено певні географічні відмінності в поширенні різних збудників: у Південній Європі С. parapsilosis перебуває на другому місці за частотою, а C. glabrata — на третьому, тоді як у Північній Європі навпаки: C. glabrata — на другому, а С. parapsilosis — на третьому місці. С. parapsilosis — це ізолят, що найчастіше виділяється в дітей до 1 року [8].
За даними дослідження, результати якого опубліковані у 2016 році в авторитетному журналі JAMA, летальність від ІМ зросла за останню декаду, що підтверджує нашу відсталість щодо менеджменту ІМ для пацієнтів із бактеріальним септичним шоком [9]. Зважаючи на це, багато керівництв фокусують свою увагу на емпіричному деескалаційному лікуванні ехінокандинами критичних пацієнтів із позитивною культурою Candida або за наявності позитивних діагностичних біомаркерів. Тому в деяких випадках застосування ехінокандинів зросло з 4,6 до 48,5 %. Крім того, доведена неефективність профілактичного застосування флуконазолу всім пацієнтам, які отримують довготривалу антибіотикотерапію, без урахування інших факторів ризику розвитку ІМ та індексу колонізації Candida spp. Проте відмічається все ще мало даних про те, як знизити летальність за допомогою профілактичної протигрибкової терапії [9].
Ризик інфікування грибами роду Candida прий–нято визначати, ураховуючи індекс колонізації та коригований індекс колонізації. Традиційно індекс колонізації розраховують як співвідношення між кількістю місць колонізації Candida spp. (не в крові!) та загальною кількістю культур, забір котрих був здійснений із різних частин організму (формула 1). Ураховують лише штами Candida.
Також підраховують коригований індекс колонізації (ССІ), що є добутком індексу колонізації та співвідношення між кількістю тих ділянок, із культури яких було отримано масивний ріст Candida spp. («+++» при напівкількісній культурі або ≤ 105 у сечі або шлунковому вмісті), та загальною кількістю ділянок, де отримано ріст Candida spp. (формула 2).
Індекс колонізації використовують для прогнозування виникнення ІК у пацієнтів високого ризику його розвитку: двічі на тиждень проводиться забір культури з таких ділянок: орофарингеальний мазок або секрет із трахеї, шлунковий сік, мазок із черевної порожнини або зразок випорожнень, зразок сечі, мазок із хірургічної рани або рідина, що виділяється по дренажах із черевної порожнини, місця встановлення катетерів [12].
Для діагностики ІК, крім рутинного мікробіологічного дослідження, використовують такі маркери: (1–3)-β-D-глюкан, що має високу точність при ранній верифікації абдомінального кандидозу з негативною гемокультурою в хірургічних пацієнтів; маннан-/антиманнан-тест та канд-тек-Candida-антиген, що мають низьку специфічність та чутливість. Проте комбінація більше одного серологічного маркера підвищує цю чутливість. Новим діагностичним напрямком є виявлення ДНК Candida в крові [11].
На сьогодні переглянуто стратегію традиційної профілактики кандидозу в критичних пацієнтів, так само як за останні 20 років було переглянуто агресивні методи лікування та моніторингу, що мали потенційний ятрогенний ризик: від високого до низького дихального обсягу для максимальної вентиляції легень; від ліберальної до консервативної стратегії рідинного менеджменту та трансфузій продуктів крові; від рутинного до більш інвазивного моніторингу гемодинаміки; від суворого до більш ліберального контролювання рівня цукру крові; від високодозованого до селективного застосування глюкокортикостероїдів; від застосування пролонгованої седації до щоденних перерв у седації. Тому результати дослідження EMPIRICUS показують, що емпірична та пролонгована протигрибкова терапія не призводить до покращання результатів лікування. Незважаючи на це, емпірична терапія мікафунгіном призводить до зниження частоти інвазивних грибкових інфекцій серед пацієнтів із ВІТ-асоційованим сепсисом, множинними джерелами колонізації Candida spp., синдромом поліорганної недостатності, при застосуванні антибіотиків широкого спектра дії, але не знижує рівень летальності. Тому нові біомаркери та клінічне оцінювання ризику за алгоритмом допоможуть ідентифікувати тих пацієнтів, які мають найвищий ризик ІК та антифунгальної терапії [9]. За даними дослідження EMPIRICUS, емпіричне застосування мікафунгіну в пацієнтів із ВІТ-асоційованим сепсисом не впливає на рівень 28-денної летальності порівняно з плацебо, але знижує з 12 до 3 % частоту нової інвазивної грибкової інфекції порівняно з групою плацебо (р = 0,008) [10].
За наявності ознак, що вказують на розвиток ІК, необхідно дотримуватися деескалаційної стратегії протигрибкової терапії — стартово застосовувати ехінокандини, при верифікації збудника та встановленні його чутливості — тріазоли [11]. Терапія полієнами показана при інфекціях органів (менінгіт, ендокардит, остеомієліт), або коли збудниками є інші гриби (Aspergillus spp., Mucor spp.). Вона повинна тривати 14 днів після останньої негативної гемокультури [11]. Кращий профіль безпеки та зниження рівня токсичності нових протигрибкових препаратів забезпечують зростання застосування цих препаратів для емпіричного лікування [9].
Відповідно до результатів дослідження, опублікованих у 2015 році, серед хірургічних пацієнтів було встановлено такі дані: 81,8 % пацієнтів мали лише кандидемію, 16,2 % — кандидемію та глибоке розміщення інфекції, у 2 % пацієнтів був ІК без кандидемії. Частота виявлення C. glabrata зростає з віком: із всіх випадків ІК, спричиненого цим збудником, 71,8 % припадає на пацієнтів віком понад 60 років [5, 8]. Необхідно зазначити, що в 16,5 % пацієнтів, які отримували протигрибкові препарати з метою профілактики, розвинувся ІК. Серед пацієнтів, які отримували для профілактики флюконазол, у 44 % випадків причиною ІК була С. albicans, у 27,6 % — С. parapsilosis, у 17,4 % — C. glabrata, у 4,1 % — С. krusei. За даними мультиваріантного аналізу встановлено, що видалення центрального судинного доступу після верифікації ІК та кандидемії внаслідок інвазії C. glabrata та С. parapsilosis не впливає на виживання на відміну від інфекції, спричиненої С. albicans [8].
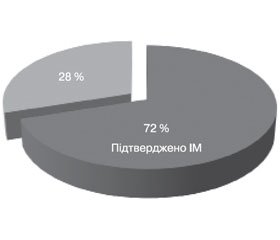
Нами встановлено, що серед 18 пацієнтів із ТС у 13 хворих (72 %) виявлено Candida spp. у зазвичай стерильних біологічних рідинах організму (рис. 1), із них у 5 пацієнтів — кандидемія (38,5 % серед всіх випадків підтвердженого ІМ), у 3 (23 %) — Candida spp. із нижніх дихальних шляхів, у 4 (30,8 %) — Candida spp. водночас із крові та з дихальних шляхів, у 1 (7,7 %) — Candida spp. одночасно з крові та з черевної порожнини (рис. 2).
За літературними даними, високий ризик розвитку ІМ мають пацієнти з такими факторами ризику: імуносупресія, велика абдомінальна операція, порушення фізіологічних бар’єрів травного тракту, застосування антибіотиків широкого спектра дії, парентеральне харчування, сечовий катетер, центральний венозний доступ, масивні трансфузії, дренажі в порожнинах тіла, тривале лікування у відділеннях інтенсивної терапії, нутритивний дефіцит [5, 8].
Ми проаналізували такі дев’ять факторів ризику ІМ: наявність центрального венозного катетера, сечового катетера, тривалий прийом антибіотиків, тривале перебування у ВІТ, проведення штучної вентиляції легенів через ендотрахеальну трубку, нутритивний дефіцит, проведення парентерального харчування, гемотрансфузій, наявність дренажів у порожнинах тіла, та встановили, що в 50 % пацієнтів із ТС були всі фактори ризику розвитку ІМ, у 22 % — вісім факторів ризику й у 28 % — п’ять (табл. 1).
У всіх пацієнтів із 8 та більше факторами ризику розвитку ІМ було підтверджено його розвиток. У 61,5 % пацієнтів із ТС та ІМ (8 пацієнтів із 13) верифіковано наявність флюконазол-резистентних штамів Candida spp., та в 1 (7,7 %) підтверджено вориконазол-резистентний штам Сandida spp. У разі виявлення флуконазол-резистентних штамів Candida spp. пацієнтам призначали вориконазол, а при виявленні вориконазол-резистентних — каспофунгін. У всіх випадках зміни протигрибкової терапії вона була ефективною.
Висновки
Емпіричне призначення флуконазолу в пацієнтів із ТС та наявністю 8 і більше факторів ризику розвитку ІМ у 72 % випадків було неефективним. У 61,5 % пацієнтів із ТС та ІМ верифіковано наявність флюконазол-резистентних штамів Candida spp., що може бути зумовлено безконтрольним масовим застосуванням флуконазолу з метою профілактики ІМ. Застосування індексу колонізації та коригованого індексу колонізації допоможе об’єктивізувати потребу в призначенні протигрибкових препаратів, а суворе дотримання правил асептики в пацієнтів із ТС допоможе зменшити витрати на лікування ІМ. Зниження відмінностей рівня економічного розвитку між країнами та використання деескалаційної стратегії протигрибкової терапії при ІМ можуть зберегти більше дитячих життів та покласти кінець причинам смерті серед дітей, яким можна запобігти.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Invasive candidiasis in pediatric intensive care in Greece: A nation wide study / L. Vogiatzi, S. Ilia, G. Sideri, E. Vagelakoudi [et al.] // Intensive Care Med. — 2013. — Vol. 39(12). — P. 2188-95. — doi: 10.1007/s00134-013-3057-y. Epub. 2013 Aug 14.
2. The epidemiology of neonatal and pediatric candidemia in England and Wales, 2000–2009 / C. Oeser, T. Lamagni, P.T. Heath [et al.] // Pediatr. Infect. Dis. J. — 2013. — Vol. 32(1). — P. 23-6. — doi: 10.1097/INF.0b013e318275612e.
3. Epidemiology, Risk Factors and Outcome of Candida parapsilosis Bloodstream Infection in Children / J. Dotis, P.A. Prasad, T. Zaoutis [et al.] // Pediatr. Infect. Dis. J. — 2012. — Vol. 31(6). — P. 557-560. — doi:10.1097/INF.0b013e31824da7fe.
4. Clinical Practice Guideline for the Management of Candidiasis: 2016 Update by the Infectious Diseases Society of America / P.G. Pappas, C.A. Kauffman, D.R. Andes [et al.] // Clin. Infect. Dis. — 2016. — Vol. 62(4). — P. e1-50. — doi: 10.1093/cid/civ933. Epub. 2015, Dec 16.
5. Risk factors for late recurrent candidaemia. A retrospective matched case-control study / P. Muñoz, A. Vena, M. Valerio [et al.] // J. Chemother. Clin. Microbiol. Infect. — 2016. — Vol. 22(3). — P. 277. — e11-20. — doi: 10.1016/j.cmi.2015.10.023. Epub. 2015, Nov 5.
6. Invasive fungal infection in neonatal intensive care units: a multicenter survey. Results from a prospective, international, epidemiologic study of invasive candidiasis in children and neonates / M.I. Baptista, J. Nona, M. Ferreira [et al.] // Journal of Chemotherapy. — 2016. — Vol. 28(1). — P. 37-43. — doi: 10.1179/1973947814Y.0000000222.
7. Results from a prospective, international, epidemiologic study of invasive candidiasis in children and neonates / W.J. Steinbach, E. Roilides, D. Berman [et al.] // Pediatr. Infect. Dis. J. — 2012. — Vol. 31(12). — P. 1252-7. — doi: 10.1097/INF.0b013e3182737427.
8. Invasive Candida infections in surgical patients in intensive care units: a prospective, multicentre survey initiated by the European Confederation of Medical Mycology (ECMM) (2006–2008) / L. Klingspor, A.M. Tortorano, J. Peman [et al.] // Clin. Microbiol. Infect. — 2015. — Vol. 21(1). — P. 87, e1-87, e10. — doi: 10.1097/INF.0b013e3182737427.
9. Siddharthan T. Empirical antifungal therapy in critically ill patients with sepsis / T. Siddharthan, P.C. Karakousis, W. Checkley // JAMA. — 2016. — Vol. 316(15). — P. 1549-1550. — doi: 10.1001/jama.2016.13801.
10. Timsit J.-F. Empirical Micafungin treatment and survival without invasive fungal infection in adults with ICU-acquired sepsis, Candida colonization and multiple organ failure. The EMPIRICUS randomized clinical trial / J.-F.Timsit, E. Azoulay, C. Schwebel // JAMA. — 2016. — Vol. 316(15). — P. 1555-1564. — doi:10.1001/jama.2016.14655.
11. Pascalea G.D. Fungal infections in the ICU: advances in treatment and diagnosis / G.D. Pascalea, M. Tumbarellob // Curr. Opin. Crit. Care. — 2015. — Vol. 21. — P. 421-429. — doi:10.1097/MCC.0000000000000230.
12. Eggimann P. Candida colonization index and subsequent infection in critically ill surgical patients: 20 years later / P. Eggimann, D. Pittet // Intensive Care Med. — 2014. — Vol. 40(10). — P. 1429-1448. — doi: 10.1007/s00134-014-3355-z.
13. Child mortality and causes of death // http://www.who.int/gho/child_health/mortality/en/

/124-129/126-0.jpg)
/124-129/126-1.jpg)
/124-129/127-1.jpg)
/124-129/127-2.jpg)