Статья опубликована на с. 94-100
Введение
В системе внутриклеточной антиоксидатной защиты в первую линию «обороны» входит тиоредоксиновая система, которая также участвует в регуляции нескольких сигнальных внутриклеточных путей, обеспечивающих жизнедеятельность клетки [27].
Система тиоредоксинов
Семейство тиоредоксинов
Тиоредоксины эволюционировали как шаперонподобные протеины, которые участвуют в поддержании структуры белков, содержащих дитиольный активный центр. Система тиоредоксина, новыми представителями которой являются тиоредоксинредуктаза (TRXR) и тиоредоксины (TRX), последовательно передающие электроны с никотинамидадениндинуклеотидфосфата (НАДФH), осуществляет инактивацию перекиси водорода (H2O2) и перекисей липидов. К системе тиоредоксина относятся и другие протеины, в частности TRX-связанный протеин 14 кДа (TRP14), который активирует PTEN; TRX-связанный протеин 32 (TRP32)/TRX-подобный протеин 1 (TXL-1), TRX-подобный протеин 2 (TXL-2), который обладает уникальной способностью ассоциироваться с микротрубочками реснитчатого эпителия. В эндоплазматической сети клетки локализуются такие представители семейства TRX, как дисульфидная изомераза (PDI), кальций-связывающий протеин 1 (CaBP1), ERp72, ERdj5/JPDI и TRX-связанный трансмембранный протеин (TMX), который участвует в поддержании молекулярной структуры белков, подобно шаперонам. В ядре клетки локализуется еще один представитель семейства TRX — нуклеоредоксин (NRX), регулирующий окислительно-восстановительное состояние факторов транскрипции NF-kB, AP-1, CREB [21]. В широком смысле система тиоредоксинов может включать в себя и пероксиредоксины — тиоредоксины восстанавливают пероксиредоксины, которые в последующем катализируют разложение H2O2 [27]. Система тиоредоксина не только выполняет антиоксидантную роль, но и участвует в процессах выживания клетки, в частности оказывая антиапоптотическое действие [17, 28]. Тиоредоксины являются важнейшим компонентом антиоксидантной защиты респираторного тракта [22].
Тиоредоксины (КФ 1.8.4.8) — убиквитарные, полифункциональные низкомолекулярные белки, обладающие устойчивой молекулярной структурой к высокой температуре. Важной характеристикой молекул TRX является наличие в их активном каталитическом центре канонического Cys-Gly-Pro-Cys (CGPC)-мотива. Цистеиновые остатки данного мотива могут образовывать обратимые дисульфидные связи, что позволяет TRX участвовать в окислительно-восстановительных реакциях дисульфидов. Цистеиновые остатки CGPC-мотива, разрывая дисульфидные связи в окисленных протеиновых субстратах TRX, окисляются и образуют дисульфидные связи между собой. Под влиянием TRXR происходит обратный процесс, в результате которого цистеиновые остатки CGPC-мотива восстанавливаются [4, 23].
Третичная структура TRX состоит из пяти β-нитей, окруженных четырьмя α-спиралями. В N-терминальном регионе располагаются β1α1β2α2β3 и в С-терминальном регионе — β4β5α4 структуры, которые связаны между собой α3-спиралью. β-нити в N-терминальном регионе расположены параллельно, а в С-терминальном регионе — антипараллельно. Каталитический CGPC-мотив находится на поверхности белка в α2-спирали N-терминального региона молекулы [7].
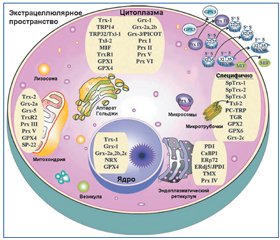
Тиоредоксины в организме человека представлены тремя изомерами: цитоплазматическим TRX1, митохондриальным TRX2 и p32TRXL (TRX спермы). Молекула TRX1 состоит из 105 аминокислотных остатков, молекулярная масса около 12 кДа. Несмотря на то, что молекула TRX1 не имеет ядерной локализации, этот белок обнаруживается в ядре некоторых нормальных и опухолевых клеток. В отличие от митохондриального протеина TRX2 молекула цитоплазматического TRX1 в дополнение к двум цистеиновым остаткам, локализованным в активном центре (CGPC мотиве), содержит еще три цистеиновых остатка [1, 27]. В молекуле TRX1 два из дополнительных цистеиновых остатка (Cys62 и Cys69) располагаются на α3-спирали, а третий (Cys73) — в непосредственной близости к мотиву CGPC активного сайта. Дополнительные цистеиновые остатки участвуют в посттрансляционной модификации, в частности в глутатионилировании и S-нитрозилировании [7]. Молекула TRX2 синтезируется в виде предшественника, молекула которого состоит из 166 аминокислотных остатков с молекулярной массой около 18 кДа. В последующем происходит отщепление 60 аминокислотных остатков N-терминального региона молекулы. Молекулярная масса зрелого протеина TRX2 составляет 12,2 кДа. Митохондриальная TRX2-система включает TRX2, TRXR2, НАДФ и пероксиредоксин-3 [7, 10, 27].
Третья форма TRX — p32TRXL состоит из 289 аминокислотных остатков и экспрессируется во всех тканях человека, но, похоже, не восстанавливается TRXR. Функции p32TRXL изучены недостаточно. Протеины TRX1 и TRX2 могут находиться и в экстрацеллюлярном пространстве. Секретируемый TRX1 действует как фактор хемотаксиса нейтрофилов, моноцитов и Т-клеток [27].
Протеин TRX1 в результате посттрансляционной модификации, что заключается в усечении последовательности С-терминального региона в 10 кДа, преобразуется в тиоредоксин 80 (TRX80), который секретируется во внеклеточное пространство и стимулирует пролиферацию моноцитов в периферической крови [14]. Экспрессия TRX1 индуцируется H2O2, TNF-α, эстрогенами, простагландином E1, циклическим аденозинмонофосфатом, ультрафиолетовым излучением и высокой температурой. Активация фактора теплового шока 2 (HSF2) сопровождается усилением транскрипции гена TRX1 [2].
Тиоредоксинредуктаза (КФ 1.8.1.9) является НАДФН-зависимым гомодимером флавопротеидной оксидоредуктазы (с одним флавинадениндинуклеотидом на субъединицу), которая восстанавливает окисленный активный центр TRX [4, 8, 23].
Молекулы TRXR содержат две аминокислотных последовательности, организующие активные каталитические центры. Одна последовательность Cys59-Val-Asn-Val-Gly-Cys64 содержится в N-терминальном регионе, а другая — Gly-Cys497-SeCys498-Gly — в С-терминальном регионе молекулы. Предполагается, что ион селена повышает эффективность работы фермента при низких значениях рН и расширяет спектр восстанавливаемых соединений. Тиоредоксинредуктаза представлена тремя изомерами — TRXR1, TRXR2, TRXR3. Гомодимер TRXR1 локализуется в цитоплазме и ядре клетки, TRXR2 — в митохондриях; TRX1 располагается в цитоплазме клетки и может транслоцироваться в ядро, TRX2 локализуется в митохондриях (рис. 1). Изомер TRXR3 или тиоредоксинглутатионредуктаза катализирует восстановление как TRX, так и окисленного глутатиона (GSSG) [1, 4, 23].
Тиоредоксинзависимые окислительно-восстановительные реакции
Протеины TRX являются донорами электронов для таких ферментов, как рибонуклеотидредуктаза, метионинсульфоксидредуктаза и пероксиредоксины. Тиоредоксины, которые характеризуются низким уровнем окислительно-восстановительного потенциала, восстанавливают дисульфиды окисленной протеиновой молекулы при помощи двух цистеиновых остатков Cys-Gly-Pro-Cys активного центра. Окисленная молекула TRX более стабильна, чем восстановленная структура TRX. Разница в стабильности между окисленным и восстановленным состояниями TRX является движущей силой редокс-реакции. Механизм каталитического цикла TRXR включает процесс восстановления TRX с участием НАДФН, сходный с аналогичным процессом для глутатионредуктазы. Вначале осуществляется перенос электрона с НАДФН через флавинадениндинуклеотид на дисульфид активного центра TRXR, который образован остатками Cys в положении 59 и 64 в N-терминальном регионе молекулы. Затем в димерном ферменте электроны переносятся от образовавшегося дитиола одной субъединицы на Cys497-SeCys498 С-терминального региона другой субъединицы молекулы фермента (рис. 2) [1, 11, 14]. Таким образом, реакция соответствует уравнениям:
/97.jpg)
Такой перенос электронов на другую субъединицу может иметь место и при восстановлении GSSG глутатионредуктазой. С-терминальный SEC участвует в восстановлении многочисленных субстратов TRXR1. Перекись водорода, перекиси, включая гидроперекиси липидов, могут непосредственно восстанавливаться TRXR1. Посредством этого механизма TRXR1 функционирует как путь ферментативной детоксикации гидроперекисей липидов [3, 18].
Другие физиологические эффекты системы тиоредоксинов
Помимо поддержания окислительно-восстановительного баланса тиоредоксины участвуют в регуляции нескольких сигнальных внутриклеточных путей, регулируя жизнедеятельность клетки (табл. 1).
/97_2.jpg)
Так, восстановленная форма протеина TRX1 может связываться с апоптотической сигнал-регулируемой киназой 1 (apoptosis signal-regulating kinase 1 — ASK1), ключевым компонентом сигнальных путей индуцированного апоптоза, и подавлять ее активность, тем самым выполняя антиапоптотическую роль. Связывание молекулы TRX1 с ASK1 обусловлено образованием цистеиновыми остатками (Cys32 и Cys35) в каталитическом центре двух дисульфидных мостиков. В результате действия избыточного количества активированных кислородсодержащих метаболитов разрушается смешанная дисульфидная связь и происходит высвобождение ASK1. В последующем ASK1 подвергается полной гомоолигомеризации, в результате которой происходит аутофосфорилирование аминокислотного остатка Thr838, расположенного в киназном домене. Данные изменения в структуре молекулы обусловливают активацию ASK1 (рис. 3) [7, 17, 20].
Киназа ASK1 относится к митогенактивируемым протеинкиназам (МАРК). Каскад МАРК включает в себя три последовательно активируемых протеинкиназы: митогенактивируемую киназу киназы протеинкиназы (MAP3K/MAPKKK), митогенактивируемую киназу протеинкиназы (MAP2K/MAPKK) и МАРК. ASK1 является MAP3K, которая активирует MAP2K (MKK4/MKK7 и MKK3/MKK6), что приводит к возбуждению JNK и p38 соответственно. У млекопитающих идентифицированы три основные подгруппы МАРК: экстрацеллюлярные регулируемые киназы (ERK1/2) и стресс-активируемые с-Jun NH2-терминальные киназы (JNK-1/2/3), p38 (p38-α/-β/-γ/-δ) и ERK5. Молекулы различных групп МАРК структурно похожи, но выполняют разные функции. Киназа ERK регулирует преимущественно рост и дифференцировку клеток, JNK и p38 — пролиферацию и дифференциацию, миграцию и апоптоз клеток [6, 16, 30].
В регуляции запрограммированной гибели клеток определенную роль играет и TRX2, который, ингибируя высвобождение цитохрома C из митохондрий, подавляет активность каспазозависимого пути апоптоза [21, 24].
TRX1 регулирует активность супрессора опухоли р53, ингибитора 1A циклинзависимой киназы p21, транскрипционных факторов APEX1, AP-1, NF-κB, HIF-1α, Sp1 и Sp3, влияя на процессы роста, дифференцировки, апоптоза, выживания клетки, на воспаление, ангиогенез, канцерогенез [5]. Внеклеточно локализованный TRX1 оказывает выраженное противовоспалительное действие [14]. TRX1 ингибирует секрецию фактора миграции макрофагов и эотаксина, что, соответственно, приводит к подавлению рекрутирования нейтрофилов и эозинофилов в регионы воспаления. Под влиянием TRX1 происходит сравнимое снижение активности Th1- и Th2-ассоциированных цитокиновых ответов [15, 25, 26, 29]. В то же время TRX80 и внутриядерно локализованный TRX1 индуцируют воспалительный процесс (рис. 4).
/98_2.jpg)
В частности, при гриппозной инфекции H1N1, которая, как правило, сопровождается развитием оксидантного стресса, TRX1 после транслокации в ядро клетки нейтрализует перекись водорода, что уменьшает ингибицию фактора транскрипции NF-kB, обусловленную процессом окисления. Внутриядерно расположенный протеин TRX1 может не только увеличивать, но и через APEX1/Ref-1 подавлять трансактивность NF-kB. Однако в целом активирующее действие TRX1 на воспалительный процесс преобладает над ингибирующим. Под влиянием внутриядерного TRX1 происходит усиление продукции провоспалительных цитокинов и общевоспалительной реакции, определяющей тяжесть заболевания [19].
Протеин TRX80 стимулирует экспрессию CD14, CD40, CD54, CD86, секрецию IL-12, IL-1, IL-6, CXCL8/IL-8 и TNF-α мононуклеарными клетками периферической крови, способствуя развитию Th1-ответа [13, 17]. Внеклеточно локализованный TRX1 ингибирует активность механизмов, участвующих в ремоделировании стенки бронхов. Известно, что активированные кислородсодержащие метаболиты индуцируют продукцию TGF-β1, под действием которого повышается экспрессия рецепторов эпидермального фактора роста (EGFR). Возбуждение EGF-ассоциированного сигнального пути обусловливает возбуждение киназы p21, которая активирует пролиферацию и репарацию эпителиальных клеток респираторного тракта. В то же время под влиянием активированных кислородсодержащих метаболитов происходит фосфорилирование ASK1 и JNK, p38, активность которых предопределяет развитие апоптоза клетки. TRX, подавляя продукцию TGF-β1 и активность p21, ASK1, JNK, снижает активность ремоделирования стенок бронхов (рис. 5) [12].
/99_2.jpg)
Системы глутатиона и тиоредоксинов, несмотря на то, что их функции во многом близки друг к другу, представляют собой независимые молекулярные формирования (табл. 2).
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Калинина Е.В. Участие тио-, перокси- и глутаредоксинов в клеточных редокс-зависимых процессах / Е.В. Калинина, Н.Н. Чернов, А.Н. Саприн // Успехи биологической химии. — 2008. — Т. 48. — С. 319-331.
2. Ago T. Thioredoxin and ventricular remodeling / T. Ago, J. Sadoshima // J. Mol. Cell. Cardiol. — 2006. — Vol. 41, № 5. — P. 762-773. — DOI: 10.1016/j.yjmcc.2006.08.006.
3. Arnér E.S. Physiological functions of thioredoxin and thioredoxin reductase / E.S. Arnér, A. Holmgren // Eur. J. Biochem. — 2000. — Vol. 267, № 20. — P. 6102-6109. — PMID: 11012661.
4. Arnér E.S. Focus on mammalian thioredoxin reductases-important selenoproteins with versatile functions // Biochim. Biophys. Acta. — 2009. — Vol. 1790, № 6. — P. 495-526. — DOI: 10.1016/j.bbagen.2009.01.014. — Epub 2009 Feb 11.
5. Biaglow J.E. The thioredoxin reductase/thioredoxin system: novel redox targets for cancer therapy / J.E. Biaglow, R.A. Miller // Cancer Biol. Ther. — 2005. — Vol. 4, № 1. — P. 6-13. — PMID: 15684606.
6. Cargnello M. Activation and function of the MAPKs and their substrates, the MAPK-activated protein kinases / M. Cargnello, P.P. Roux // Microbiol. Mol. Biol. Rev. — 2011. — Vol. 75, № 1. — P. 50-83. — DOI: 10.1128/MMBR.00031-10.
7. Collet J.F. Structure, function, and mechanism of thioredoxin proteins / J.F. Collet, J. Messens // Antioxid. Redox Signal. — 2010. — Vol. 13, № 8. — P. 1205-1216. — DOI: 10.1089/ars.2010.3114.
8. Crystal structure of the human thioredoxin reductase-thioredoxin complex/ K. Fritz-Wolf, S. Kehr, M. Stumpf et al. // Nat. Commun. — 2011. — Vol. 2. — P. 383. — DOI: 10.1038/ncomms1382.
9. Finkel T. Signal transduction by reactive oxygen species // J. Cell. Biol. — 2011. — Vol. 194, № 1. — P. 7-15. — DOI: 10.1083/jcb.201102095.
10. Hall G. Structure of human thioredoxin exhibits a large conformational change / G. Hall, J. Emsley // Protein Sci. — 2010. — Vol. 19, № 9. — P. 1807-1811. — DOI: 10.1002/pro.466.
11. Hondal R.J. Using chemical approaches to study selenoproteins-focus on thioredoxin reductases // Biochim. Biophys Acta. — 2009. — Vol. 1790, № 11. — P. 1501-1512. — DOI: 10.1016/j.bbagen.2009.04.015. — Epub 2009 May 4.
12. Huang G. Regulation of JNK and p38 MAPK in the immune system: signal integration, propagation and termination / G. Huang, L.Z. Shi, H. Chi // Cytokine. — 2009. — Vol. 48, № 3. — P. 161-169. — DOI: 10.1016/j.cyto.2009.08.002. — Epub. 2009 Sep 8.
13. Identification of human thioredoxin as a novel IFN-gamma-induced factor: mechanism of induction and its role in cytokine production / S.H. Kim, J. Oh, J.Y. Choi et al. // BMC Immunol. — 2008. — Vol. 9. — P. 64. — DOI: 10.1186/1471-2172-9-64.
14. Nakamura H. Thioredoxin and its related molecules: update 2005 // Antioxid. Redox Signal. — 2005. — Vol. 7, № 5–6. — P. 823-828. — DOI: 10.1089/ars.2005.7.823.
15. Nakamura H. Extracellular functions of thioredoxin // Novartis Found Symp. — 2008. — Vol. 291. — P. 184-192. — PMID: 18575274.
16. Pathophysiological roles of ASK1-MAP kinase signaling pathways / H. Nagai, T. Noguchi, K. Takeda, H. Ichijo // J. Biochem. Mol. Biol. — 2007. — Vol. 40, № 1. — P. 1-6. — 17244475.
17. Pekkari K. Truncated thioredoxin: physiological functions and mechanism / K. Pekkari, A. Holmgren // Antioxid. Redox Signal. — 2004. — Vol. 6, № 1. — P. 53-61. — DOI: 10.1089/152308604771978345.
18. Prast-Nielsen S. Thioredoxin glutathione reductase: its role in redox biology and potential as a target for drugs against neglected diseases / S. Prast-Nielsen, H.H. Huang, D.L. Williams // Biochim. Biophys. Acta. — 2011. — Vol. 1810, № 12. — P. 1262-1271. — DOI: 10.1016/j.bbagen.2011.06.024. — Epub. 2011 Jul 14.
19. Protein Cysteines Map to Functional Networks According to Steady-state Level of Oxidation / Y.M. Go, D.M. Duong, J. Peng, D.P. Jones // J. Proteomics Bioinform. — 2011. — Vol. 4, № 10. — P. 196-209. — DOI: 10.4172/jpb.1000190.
20. Ray P.D. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling / P.D. Ray, B.W. Huang, Y. Tsuji // Cell. Signal. — 2012. — Vol. 24, № 5. — P. 981-990. — DOI: 10.1016/j.cellsig.2012.01.008. — Epub. 2012 Jan 20.
21. Redox regulation of cell survival by the thioredoxin superfamily: an implication of redox gene therapy in the heart / M.K. Ahsan, I. Lekli, D. Ray et al. // Antioxid. Redox Signal. — 2009. — Vol. 11, № 11. — P. 2741-2758. — DOI: 10.1089/ARS.2009.2683.
22. Role of thioredoxin in lung disease / J. Xu, T. Li, H. Wu, T. Xu // Pulm. Pharmacol. Ther. — 2012. — Vol. 25, № 2. — P. 154-162. — DOI: 10.1016/j.pupt.2012.01.002. — Epub. 2012 Jan 25.
23. Small molecule inhibitors of mammalian thioredoxin reductase / W. Cai, L. Zhang, Y. Song et al. // Free Radic. Biol. Med. — 2012. — Vol. 52, № 2. — P. 257-265. — DOI: 10.1016/j.freeradbiomed.2011.10.447. — Epub. 2011, Oct 21.
24. The emerging role of the thioredoxin system in angiogenesis / L.L. Dunn, A.M. Buckle, J.P. Cooke, M.K. Ng // Arterioscler. Thromb. Vasc. Biol. — 2010. — Vol. 30, № 11. — P. 2089-2098. — DOI: 10.1161/ATVBAHA.110.209643. — Epub. 2010 Aug 26.
25. Thioredoxin suppresses airway inflammation independently of systemic Th1/Th2 immune modulation / M. Torii, L. Wang, N. Ma et al. // Eur. J. Immunol. — 2010. — Vol. 40, № 3. — P. 787-796. — DOI: 10.1002/eji.200939724.
26. Thioredoxin 1 delivery as new therapeutics/ H. Nakamura, Y. Hoshino, H. Okuyama et al. // Adv. Drug. Deliv. Rev. — 2009. — Vol. 61, № 4. — P. 303-309. — PMID: 19385090.
27. Thioredoxin and its role in toxicology / W.H. Watson, X. Yang, Y.E. Choi et al. // Toxicol. Sci. — 2004. — Vol. 78, № 1. — P. 3-14. — DOI: 10.1093/toxsci/kfh050.
28. Thioredoxins and glutaredoxins: unifying elements in redox biology / Y. Meyer, B.B. Buchanan, F. Vignols, J.P. Reichheld // Annu. Rev. Genet. — 2009. — Vol. 43. — P. 335-367. — DOI: 10.1146/annurev-genet‑102108-134201.
29. Thioredoxin in allergic inflammation / W. Ito, N. Kobayashi, M. Takeda et al. // Int. Arch. Allergy Immunol. — 2011. — Vol. 155, Suppl. 1. — P. 142-146. — DOI: 10.1159/000327501. — Epub. 2011 Jun 1.
30. Thioredoxin overexpression modulates remodeling factors in stress responses to cigarette smoke / Y.L. Huang, C.Y. Chuang, F.C. Sung, C.Y. Chen // J. Toxicol. Environ. Health A. — 2008. — Vol. 71, № 22. — P. 1490-1498. — DOI: 10.1080/15287390802350030.
/97.jpg)
/98.jpg)
/99_2.jpg)

/95.jpg)
/96.jpg)
/97_2.jpg)
/98_2.jpg)
/99.jpg)