Статтю опубліковано на с. 7-12
Герпетичний енцефаліт (ГЕ) становить 10–42 % від загальної кількості вірусних енцефалітів з частотою захворюваності до 0,8 на 100 тис. населення [1–4]. У новонароджених ГЕ виникає у 2–3 випадках на 10 000 новонароджених дітей [1]. Летальність при ГЕ без застосування противірусного лікування становить 60–70 %, при використанні ацикловіру знижується до 15–20 % [3].
Інфекція виникає в усіх вікових групах, причому одна третина всіх випадків припадає на дітей і підлітків. Близько 90 % випадків ГЕ викликає HSV 1-го типу. HSV 2-го типу викликає ураження нервової системи, частіше у новонароджених (як один із проявів генералізованої герпетичної інфекції) та в осіб з імунодефіцитними станами (ВІЛ-інфіковані, реципієнти нирок тощо) [5].
Джерелом герпетичної інфекції є людина. Інфікування відбувається переважно контактним або повітряно-крапельним шляхом. Вертикальний шлях передачі здійснюється трансплацентарно або постнатально. Найбільш сприйнятливі до інфекції діти раннього віку. Захворювання не має чітко вираженої сезонності.
Вхідними воротами інфекції є слизові оболонки або шкіра, де відбувається первинна реплікація вірусу. Надалі HSV проникає в чутливі та вегетативні нервові закінчення і транспортується по аксону до тіла нервової клітини в черепних і спинальних гангліях. Проникнення HSV у гліальні клітини й ней–рони головного мозку відбувається гематогенно (під час вірусемії) і ретроаксонально (з гангліїв черепних нервів: трійчастого, нюхового, язико-глоткового та ін.). В уражених клітинах розвиваються запальні зміни, що сприяє набряку-набуханню головного мозку, швидкому формуванню ділянок некрозу з вогнищевим випадінням функції і наростанням неврологічної симптоматики.
Після первинного інфікування HSV довічно персистує в нервових гангліях. Спонтанно або під впливом провокуючих факторів (стрес, травма, імуносупресія, інсоляція, переохолодження, радіація) можлива реактивація латентної герпетичної інфекції з розвитком енцефаліту. Цікаво, що лише у 25 % хворих на ГЕ були епізоди герпетичної інфекції шкіри в анамнезі, що співпадає з даними у популяції в цілому [5]. У дітей ГЕ розвивається переважно при первинній інфекції [6].
ГЕ — це некротичний енцефаліт. Розрізняють два типи ураження речовини мозку: осередкове і дифузне. При осередковому процесі визначають один або кілька вогнищ некрозу. При дифузному виявляють поширене ураження речовини головного мозку, що характерно для генералізованої герпетичної інфекції у новонароджених і дітей раннього віку.
При гострому розвитку енцефаліту формуються вогнища некрозу в корі головного мозку із захопленням прилеглої білої речовини, переважно в лобних, скроневих, тім’яних, рідше — потиличних ділянках. При підгострому і хронічному перебігу енцефаліту поряд зі свіжими вогнищами некрозу виявляються кісти, гліоз, а також мононуклеарні запальні інфільтрати з перифокальною і периваскулярною локалізацією.
Інкубаційний період при первинному ГЕ становить від 2 до 26 днів, у середньому 9–14 днів. Захворювання розпочинається, як правило, гостро, з гіпертермії, загальних або локальних судом, втрати свідомості. Часто проявам енцефаліту передують ГРВІ, стоматит, типові герпетичні висипання на шкірі та слизових оболонках. В 1/3 випадків відзначається більш поступовий розвиток хвороби: лихоманка до 39,0 °С і вище має постійний характер, головний біль наростаючий, дифузного характеру або з локалізацією в лобово-скроневій ділянці, повторна блювота, не пов’язана з прийомом їжі. На 2-гу — 4-ту добу з’являються симптоми набряку головного мозку: порушення свідомості у вигляді сплутаності, відсутності орієнтації в часі та просторі.
Іноді хворі стають агресивними, з’являються зорові або слухові галюцинації, делірій або порушення свідомості, розвиваються вогнищеві або генералізовані судоми. Часто виникають джексонівські напади (періодичні клонічні посмикування в одній половині тіла з подальшою генералізацією судом). Виявляються вогнищеві симптоми у вигляді спастичних моно- або геміпарезів, парестезії в кінцівках, порушення вищих кіркових функцій (афазія, апраксія, агнозія), розлади координації руху, статична атаксія.
Прогресуючий набряк і некротичні зміни в головному мозку обумовлюють розвиток стовбурової симптоматики: подальший розлад свідомості аж до коми, почастішання епілептичних нападів з переходом в епістатус, порушення вітальних функцій, виражені вогнищеві симптоми (гемі- або тетрапарез, гіперкінези), поява нейротрофічних порушень. Можливий розвиток дислокаційного синдрому, що призводить до зупинки дихання та серцевої –діяльності.
Зворотний розвиток симптомів захворювання починається з 3–4-го тижня хвороби і триває протягом 3–6 міс. Відбувається поступове відновлення вітальних функцій, знижується температура тіла, відновлюється свідомість. Дуже повільно нормалізуються гностичні функції, мова, з’являються емоційно-поведінкові реакції. У період ранньої реконвалесценції на перший план виступають порушення психічної діяльності, часто зі зміною поведінки, втратою –навичок.
Після перенесеного ГЕ до 60 % пацієнтів мають різноманітні неврологічні порушення: парези (паралічі), гіперкінези, епісиндром, епілепсія тощо [3].
При найбільш типовому перебігу ГЕ виділяють 5 періодів: загальноінфекційний, енцефалічний, енцефалітичний (коматозний), ранньої реконвалесценції, залишкових явищ.
Загальноінфекційний період енцефаліту триває від 1 до 21 дня й супроводжується катаром верхніх дихальних шляхів, підвищенням температури тіла до 38–40 °С, інтенсивним головним болем, блюванням. Можливе пухирцеве висипання на шкірі та слизових оболонках, але герпетичне висипання не є обов’язковим.
В енцефалічний період наростає головний біль, посилюється блювання, виникає психомоторне збудження. У частини дітей захворювання перебігає за типом інфекційного психозу з мареннями, галюцинаціями. У 3/4 дітей відмічаються кіркові порушення, що проявляються як сенсорна афазія, апраксія (втрата набутих навичок), агнозія (не впізнає оточуюче середовище, батьків), пірамідні розлади, гіперкінези (тремор, стереотипні рухи), підвищення тонусу м’язів. Цей період триває 1–10 днів. Наявність у 70–75 % хворих на ГЕ характерних кіркових розладів дає можливість запідозрити його до розвитку коми і максимально рано розпочати специфічну етіотропну терапію.
Протягом подальших 2–10 днів з’являються легкі розлади свідомості — від психічного збудження до легкого сопора, генералізовані клоніко-тонічні судоми, менінгеальні симптоми. У частини хворих енцефалічний період може бути відсутній, захворювання починається одразу з появи загальномозкових і вогнищевих симптомів.
Енцефалітичний (коматозний) період характеризується розладами свідомості різного ступеня. Одними з перших симптомів ГЕ можуть бути генералізовані судоми чи міоритмії (ритмічні скорочення дрібних м’язів навколо рота чи ока). Також з’являються вогнищеві симптоми: парези, переважно спастичного характеру, ураження черепних нервів, переважно VII пари, розлади дихання, бульбарні порушення. Своєрідність вогнищевої симптоматики пов’язана з переважною локалізацією патологічних вогнищ у лобній і скроневій частках. Цей період може продовжуватись від декількох днів до двох місяців.
У дітей після виходу з енцефалітичного періоду відзначають адинамію, що чергується з періодами збудження, а також ретроградну і фіксаційну амнезію, апраксію, агнозію. Спостерігається втрата набутих навичок, регрес у фізичному розвитку. Цей період ранньої реконвалесценції триває протягом 1–12 місяців.
Після перенесеного захворювання впродовж місяців або років можуть залишатися психічні розлади, гіперкінези, парези кінцівок та інші неврологічні симптоми [7].
Після перенесеного ГЕ у 5–10 % випадків можливі рецидиви, які виникають протягом трьох місяців [3, 6].
Можливий так званий псевдотуморозний варіант ГЕ, коли при нормальній чи субфебрильній температурі тіла поступово протягом декількох тижнів наростають симптоми ураження центральної нервової системи (ЦНС), ознаки внутрішньочерепної гіпертензії, з’являються зміни на очному дні.
Поряд з описаними формами ГЕ виділяють інсультоподібний, стовбуровий, енцефаломієлітичний та деякі інші варіанти.
При поєднанні ураження мозку і мозкових оболонок у клінічній картині захворювання відмічається виражений менінгеальний синдром, а в лікворі визначають запальні зміни.
Хронічний перебіг ГЕ частіше спостерігається у дорослих. Лише 38 % хворих після перенесеного ГЕ повертаються до нормального життя, 9 % хворих мають помірні порушення життєвих функцій, від 50 до 70 % хворих мають грубі порушення, що призводять до інвалідизації. Наслідки захворювання залежать від його тяжкості, терміну призначення специфічної терапії, віку пацієнта. Прогноз суттєво погіршується при сумі балів за шкалою коми Глазго 6 та менше, при ранньому віці пацієнта, при затримці з призначенням специфічної противірусної терапії [8, 9].
Згідно з рекомендаціями Association of British Neurologists and British Paediatric Allergy Immunology and Infection Group National Guidelines, усім пацієнтам із підозрою на енцефаліт після госпіталізації потрібно якомога раніше провести спинномозкову пункцію [10]. Однак за наявності вираженого набряку головного мозку, зміщення серединних структур цю процедуру проводять після зниження внутрішньочерепного тиску з метою запобігання ускладненням. У спинномозковій рідині пацієнтів із ГЕ зазвичай визначають помірний лімфоцитарний плеоцитоз, помірне підвищення концентрації білка та нормальний або дещо підвищений рівень глюкози. До 5–10 % пацієнтів із ГЕ мають нормальні показники ліквору.
Додаткові інструментальні дослідження при енцефалітах включають комп’ютерну томографію (КТ) або магнітно-резонансну томографію (МРТ) для отримання специфічної діагностичної інформації та виключення наявності внутрішньочерепної пухлини або абсцесу.
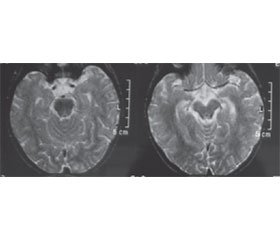
На КТ при ГЕ в типових випадках головний мозок має гіперехогенні зони в одній чи обох скроневих частках, але може мати й нормальний вигляд, особливо на початку хвороби. Чутливість і специфічність МРТ краща, ніж КТ, особливо на ранніх стадіях захворювання. МРТ з контрастом може допомогти виявити дрібні відхилення в структурі головного мозку й підтвердити ГЕ. МРТ чутлива на початкових фазах ГЕ, хоч інколи при цьому розладі теж демонструє нормальну картину. Типовими МРТ-ознаками при ГЕ є наявність ділянок локального набряку в скроневих частках, орбітальних зонах лобних часток, корі острівця й кутової закрутки з підсиленням сигналу на FLAIR і T2-зважених режимах (рис. 1).
При вираженому набряку головного мозку трапляється зміщення серединних структур останнього. Однофотонна емісійна комп’ютерна томографія у разі можливості її проведення дає додаткову інформацію при ГЕ, наприклад, наявність гіпоперфузії скроневої частки головного мозку.
Біопсію головного мозку сьогодні проводять дуже рідко, хоч інколи її застосовують при вагомих діагностичних сумнівах щодо причин захворювання.
Електроенцефалографію (ЕЕГ) слід проводити в усіх випадках енцефаліту, вона особливо корисна для диференціації між енцефалітом і дисметаболічною енцефалопатією. На ЕЕГ виявляють патологічні зміни при ГЕ, зокрема раннє неспецифічне сповільнення або періодичні латералізовані епілептиформні розряди, хоча вони і не є патогномонічними. Дані ЕЕГ корисні для контролю ефективності протисудомних препаратів у періоді реконвалесценції.
Встановлення діагнозу ГЕ набагато полегшилось з упровадженням у клінічну практику визначення ДНК вірусу методом полімеразної ланцюгової реакції (ПЛР) у лікворі. Зазвичай ПЛР на ДНК HSV є позитивною приблизно у 95 % випадків протягом першого тижня захворювання. Чутливість методу ПЛР для визначення ДНК HSV у лікворі при ГЕ становить 96 %, специфічність — 99 % [11]. Результат ПЛР на наявність ДНК HSV може бути негативним у перші 2–3 дні захворювання та після 10–14 днів хвороби [1]. Також слід пам’ятати, що результати дослідження залежать від методики визначення ПЛР і застосованих праймерів. Наприклад, заміна лише одного нуклеотиду в ділянці ДНК вірусу, комплементарній застосовуваному праймеру, призводить до псевдонегативного результату ПЛР, а застосування праймера іншого виробника, що комплементарний до іншої консервативної ділянки вірусного геному, яка не зазнала мутації в даного штаму збудника, може допомогти встановити етіологію захворювання [12]. A real-time ПЛР дозволяє точно підрахувати кількість вірусних часток, однак може давати псевдонегативні результати при низькому вірусному навантаженні, хоча мала кількість вірусної ДНК може бути виявлена при застосуванні конвенційної методики ПЛР з підрахунком результату наприкінці постановки [12]. Залежності між кількістю копій вірусу в лікворі та наслідками захворювання не виявлено [13].
Інформативним є визначення специфічних імуноглобулінів у лікворі. Молекули імуноглобуліну (Ig) М мають винятково інтратекальне походження, тому що на відміну від IgG вони не проникають через гематоенцефалічний бар’єр. Найбільш активно IgМ виробляються з 5-ої по 14-ту добу гострого інфекційного процесу. Хибнонегативні результати можуть бути зумовлені передчасним або запізнілим тестуванням і наявністю вибіркового дефіциту IgМ у пацієнта [12]. IgG у лікворі зберігаються більш тривало (період їх напіврозпаду становить 21–23 дні), що дозволяє підтвердити етіологію захворювання через 1–2 місяці після елімінації вірусу. Хибнонегативні результати можуть бути зумовлені гуморальними імунодефіцитами, зокрема ізольованими дефіцитами субкласів IgG [12].
Специфічним методом лікування ГЕ є внутрішньовенне введення ацикловіру, який специфічно діє проти клітин, інфікованих вірусом. Лікування ацикловіром покращує наслідки ГЕ і дозволяє знизити летальність з 70 до 20 % [3, 10]. За даними NIAID CASG, летальність при лікуванні ацикловіром становила 19 %, а відарабіном — 55 % [14].
При підозрі на ГЕ ацикловір слід призначати якнайшвидше в дозі 10–15 мг/кг тричі на день, при неонатальній герпетичній інфекції — 20 мг/кг/добу. Затримка терапії на 3 дні та більше призводить до несприятливих наслідків.
Якщо діагноз ГЕ підтверджено позитивною ПЛР ліквору і/або виявляють характерні зміни на МРТ, курс лікування препаратом становить 14–21 день. Наприкінці лікування повторюють ПЛР ліквору на HSV. При від’ємному результаті переходять на 90-денний курс перорального застосування ацикловіру один раз на день або валацикловіру для запобігання рецидиву хвороби. При неонатальних ГЕ продовження вживання ацикловіру до 6 місяців після одужання супроводжувалося відновленням функцій ЦНС у 60 % дітей [14].
У разі підозри на ГЕ і негативних результатах ПЛР ліквору лікування ацикловіром проводять протягом 10 днів [1]. Якщо ПЛР на ДНК вірусу простого герпесу негативна після третього дня від початку захворювання і клінічні ознаки малохарактерні для ГЕ, ацикловір можна відмінити [1].
Резистентність до ацикловіру виявляють в 0,1–0,7 % випадків герпетичної інфекції, а серед імунокомпромісних пацієнтів цей показник може зростати до 10 % [8]. В разі резистентності HSV до ацикловіру призначають фоскарнет у дозі 40 мг/кг 3 рази на добу [10]. У літературі є дані про випадок, коли, починаючи з 4-го тижня застосування ацикловіру для лікування неонатального ГЕ, кількість HSV-1 в лікворі стала збільшуватися, і додавання відарабіну в дозі 15 мг/кг/добу сприяло ерадикації збудника [15]. У цього хворого була виявлена нуклеотидна мутація G375T у HSV-1 TK гені, що призвела до розвитку резистентності до ацикловіру. При ГЕ, викликаних HSV з дефицітом тимідинкінази, ефективним може бути збільшення дози ацикловіру [10].
Ефективність застосування глюкокортикостероїдних препаратів при лікуванні ГЕ не доведена.
За останні два роки у відділенні нейроінфекцій Київської міської дитячої клінічної інфекційної лікарні (КМДКІЛ) було проліковано 7 дітей із ГЕ. Серед них було 3 (42,9 %) дітей віком від 17 днів до 1 року життя, 3 (42,9 %) дітей — від 6 до 7 років і 1 (14,3 %) дитина 12 років. В однієї 8-місячної дитини (14,3 %) захворювання було викликано герпесвірусом 2-го типу, у решти дітей — герпесвірусом 1-го типу. Серед хворих було 6 (85,7 %) дівчаток і 1 хлопчик (14,3 %). У всіх хворих захворювання розпочиналось гостро, з проявів загальноінфекційного та загальномозкового синдромів (підвищення температури від 38,4 до 40,0 °С, слабкість, млявість, відмова від їжі, сильний головний біль, порушення свідомості). У всіх дітей старше 6 років життя на початку захворювання спостерігались емоційна лабільність, апатія, загальмованість. У 3 (42,9 %) дітей за 5–8 днів до початку ГЕ були прояви гострого респіраторного захворювання: підвищення температури, кашель, нежить. При госпіталізації в усіх хворих мали місце прояви загальноінфекційного, загальномозкового синдромів і вогнищеві симптоми (табл. 1).
/7-12/10-1.jpg)
Рівень порушення свідомості коливався від сопору до коми І ступеня. Після відновлення свідомості 2 (28,6 %) дітей були дезорієнтовані, протягом 5–7 днів зберігалась амнезія. В однієї дитини у періоді ранньої реконвалесценції з’явились енурез, нецукровий діабет, відсутність короткочасної пам’яті. Менінгеальні симптоми зберігались 5–7 днів.
При дослідженні ліквору у 2 (28,6 %) дітей було виявлено незначне підвищення рівня білка (від 0,4 до 0,62 г/л), у 3 (42,9 %) дітей — лімфоцитарний плеоцитоз (від 68 до 240 кл/мкл). При проведенні МРТ головного мозку в усіх хворих виявлялись типові вогнищеві зміни в скроневих ділянках, окрім цього у 2 (28,6 %) хворих були вогнищеві зміни в тім’яних і лобних ділянках. На контрольних МРТ через 1–3 місяці в цих ділянках формувалися вогнища некрозів і атрофічних змін. Поступово неврологічні дефекти відновлювались: на момент виписки прояви енурезу та нецукрового діабету зберігались в однієї дитини, геміпарезу — в однієї дитини, церебрастенічний синдром — у 4 дітей. Летальних випадків не було.
Всі хворі на ГЕ з першого дня госпіталізації отримували ацикловір парентерально протягом 3 тижнів з подальшим переходом на пероральний прийом у разі необхідності.
Наводимо приклад ефективної терапії ГЕ. Дитина П., 6 років, захворіла 05.08.2014 р., коли раптово підвищилась температура тіла до 38,4 °С, з’явились головний біль і блювання. Оглянута педіатром, діагностовано гостру респіраторно-вірусну інфекцію, призначено симптоматичне лікування. 08.08.2014 р. на фоні високої температури з’явились клоніко-тонічні судоми, сопор. Дитина госпіталізована в КМДКІЛ. При огляді: сопор, виражені менінгеальні симптоми, девіація язика вправо. Порушення свідомості, менінгеальні симптоми, судоми зберігалися протягом 3 днів, у цей термін з’явились ознаки правобічного верхнього монопарезу за центральним типом, сенсорної афазії. Після відновлення свідомості дитина протягом 5 днів була дезорієнтована, сенсорна афазія зберігалась протягом 2 тижнів, порушення функцій правої руки — 4 тижні. При надходженні: в лікворі білок — 0,3 г/л, цитоз — 68 клітин у мкл (90 % лімфоцитів), методом ПЛР виявлено ДНК НSV 1-го типу. В крові в цей час IgM та G до HSV 1/2 відсутні. При МРТ головного мозку виявлені дрібні вогнища некрозу в скроневій та тім’яній ділянках зліва. Був встановлений діагноз: ГЕ, викликаний НSV 1-го типу, тяжкий ступінь. Дитина отримувала лікування: ацикловір у дозі 10 мг/кг маси тіла кожні 8 годин внутрішньовенно крапельно протягом 3 тижнів, біовен. Паралельно призначали комплексну патогенетичну та протисудомну терапію. На 21-й день терапії ДНК НSV 1-го типу в лікворі не виявлено, білок — 0,25 г/л, цитоз — 4 кл/мкл. Дитина виписана додому в задовільному стані, протягом 2 років перебувала під наглядом невролога. При контрольній МРТ головного мозку через 3 місяці в скронево-тім’яних ділянках зліва виявлено кистозно-гліозні зміни. При цьому патологічні зміни з боку нервової системи, окрім церебрастенії, не виявлялись. Під контролем ЕЕГ поступово через 12 місяців відмінили протисудомну терапію, прояви церебрастенічного синдрому зберігалися до 6 місяців.
Також наводимо приклад неефективної терапії ГЕ внаслідок пізнього призначення специфічної противірусної терапії. Дитина Ф., 10 міс., захворіла 6.01.2010 р. з підвищення температури до 38,5 °С, загальної в’ялості. До лікарів батьки не звертались, лікували жарознижуючими засобами. 8.01.2010 р. з’явились клоніко-тонічні судоми, через що була викликана карета швидкої допомоги, яка доставила дитину до лікарні. Була проведена діагностична люмбальна пункція для виключення менінгіту. Діагноз не підтвердився. Дитину залишили в стаціонарі для спостереження та подальшого обстеження. Але батько дитини не дозволяв проводити хворій медичні дії для подальшого обстеження та лікування. Наступного дня у дитини повторився напад судом, почала погіршуватись свідомість. Був запідозрений ГЕ, призначено внутрішньовенне введення ацикловіру, від чого батько дитини категорично відмовився. Специфічне обстеження та лікування ацикловіром змогли почати тільки 10.01.2010 р., коли дитина була вже в коматозному стані. Діагноз ГЕ був підтверджений позитивною ПЛР ліквору на HSV-1 та даними МРТ головного мозку, де були виявлені ознаки запальних змін у лобно-скронево-тім’яній ділянці зліва. Проводилось лікування ацикловіром внутрішньовенно в дозі 15 мг/кг тричі на добу протягом 21 дня, патогенетична терапія. Але вираженого позитивного ефекту від лікування добитися не вдалось. Через місяць від початку захворювання дитина не впізнавала своїх батьків, не могла тримати в руках іграшки, зберігались явища правостороннього спастичного геміпарезу, епісиндром. На контрольному МРТ головного мозку відмічено ознаки кистозної дегенерації лівої лобно-скронево-тім’яної ділянки як наслідок перенесеного ГЕ. Дитина була переведена до неврологічного відділення для реабілітаційного лікування.
Отже, ГЕ у дітей — це тяжке інфекційне захворювання центральної нервової системи з високими показниками ускладнень та смертності. Рання діагностика захворювання з використанням ацикловіру значно покращує перебіг хвороби та знижує летальність.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інте–ресів.
Список литературы
1. Волоха А.П. Вірусні енцефаліти у дітей (лекція) // Современная педиатрия. — 2013. — № 8. — С. 139-144.
2. Granerod J., Ambrose H.E., Davies N.W., Clewley J.P., Walsh A.L., Morgan D., Cunningham R., Zuckerman M., Mutton K.J., Solomon T., Ward K.N., Lunn M.P., Irani S.R., Vincent A., Brown D.W., Crowcroft N.S. Causes of encephalitis and differences in their clinical presentations in England: a multicentre, po–pulation-based prospective study // Lancet Infect. Dis. — 2010. — Vol. 10(12). — P. 835-844. [PMID: 20952256] [doi: 10.1016/S1473-3099(10)70222-X].
3. Kaeley N., Bansal S., Bhatia R., Ahmad S. Herpes Simplex Encephalitis: An Uncommon Presentation // J. Clin. Diagn Res. — 2016. — Vol. 10(5). — P. 25-26. [doi: 10.7860/JCDR/2016/19040.7801. Epub 2016 May 1]
4. Mailles A. Infectious encephalitis in France in 2007: a national prospective study // Clinical Infectious Diseases. — 2009. — Vol. 49. — P. 1838–1847. [doi: 10.1086/648419] [PMID: 19929384]
5. Kennedy P.G.E. Herpes simplex encephalitis // J. Neurol. Neurosurg. Psychiatry. — 2002. — Vol. 73. — P. 237-238. [doi: 10.1136/jnnp.73.3.237]
6. Cherry J.D. Encephalitis and meningoencephalitis // Feigin and Cherry’s Textbook of Pediatric Infectious Disea–ses. — 6th ed. / Feigin R.D., Cherry J.D., Demmler’ Harrison G.J., Kaplan S.L. (Eds). — Saunders, Philadelphia, 2009. — P. 504-518.
7. Gnann J.W., Sköldenberg B., Hart J. et al. Herpes Simplex Encephalitis: Lack of Clinical Benefit of Long-term Valacyclovir Therapy // Clin. Infect. Dis. — 2015. — Vol. 1, № 61(5). — P. 683-691. [doi: 10.1093/cid/civ369. Epub 2015 May 8] [PMID: 25956891].
8. Tunkel A.R., Glaser C.A., Bloch K.C. et al. The Management of encephalitis: clinical practice guidelines by the Infectious Di–seases Society of America // Clinical Infectious Diseases. — 2008. — Vol. 47. — P. 303-327. [PMID 18582201]
9. Whitley R., Lakeman A.D., Nahmias A. et al. DNA restriction enzyme analysis of herpes simplex virus isolates obtained from patients with encephalitis // N. Engl. J. Med. — 1982. — Vol. 307. — P. 1060-1062. [PMID: 6289100] [doi: 10.1056/NEJM198210213071706]
10. Mandell G.L., Dolin R., Bennett J.E. Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases. — 2014. — Р. 1729.
11. Shoji H. Japanese guidelines for the management of herpes simplex encephalitis; comparison with those from the International Management Herpes Forum // Rinsho Shinkeigaku. — 2006. —Vol. 46(11). — P. 955-957. [PMID: 17432231].
12. Мальцев Д.В., Євтушенко С.К. Сучасні підходи до діагностики герпесвірусних нейроінфекцій (науковий огляд) // Международный неврологический журнал. — 2016. — № 3(81). — С. 32-45.
13. Poissy J., Champenois K., Dewilde A. et al. Impact of Herpes simplex virus load and red blood cells in cerebrospinal fluid upon herpes simplex meningo-encephalitis outcome // BMC Infectious Diseases. — 2012. — Vol. 12. — P. 356. [doi: 10.1186/1471-2334-12-356].
14. Scheld W.M., Whitley R.J., Marra C.M. Infections of the Central Nervous System, 3rd edition. — Philadelphia: Lippincott Williams, 2014. — 928 р.
15. Kakiuchi S., Nonoyama S., Wakamatsu H. et al. Neonatal herpes encephalitis caused by a virologically confirmed acyclovir-resistant herpes simplex virus 1 strain // J. Clin. Microbiol. — 2013. — Vol. 51(1). — P. 356-359. [PMID: 23100343 PMCID] [doi: 10.1128/JCM.02247-12].

/7-12/9-1.jpg)
/7-12/10-1.jpg)