Продолжение. Начало в журнале «Актуальная инфектология», № 1, 2016
Всемирная организация здравоохранения и Продовольственная сельскохозяйственная организация ООН (ФАО) в 2014 году опубликовали многокритериальный рейтинг риска заражения пищевыми паразитами. Экспертная группа провела огромное исследование, в котором учитывались риск заражения тем или иным гельминтом, тяжесть клинической картины, вызванная паразитом, прогноз для жизни человека после перенесенного заболевания. На основании этого ими был подготовлен рейтинг самых опасных пищевых паразитов. Мы на страницах журнала хотим показать вам десятку лидеров этого списка.
7-е место среди самых опасных пищевых паразитов
Трихинеллез
Шифр МКБ-10: В75
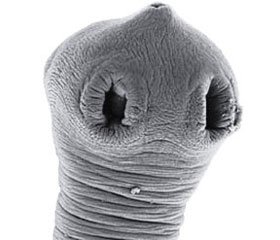
Трихинеллез (Trichinella spiralis) — биогельминтоз из группы нематодозов, характеризующийся лихорадкой, миалгиями, отеком лица, кожными сыпями, эозинофилией крови. В природе существует 4 вида трихинелл: T.spiralis, T.nativa, T.nelson, T.рseudospiralis [1].
История открытия
В 1835 году в Лондоне 21-летний студент первого курса медицинского колледжа Джеймс Педжет анатомировал труп итальянца. При вскрытии трупа будущий ученый обнаружил мелкие белые крупинки извести. Заинтересовавшись находкой, он посмотрел их под микроскопом и обнаружил в крупинках червя. Нужно отметить, что в то время в Лондоне было только два микроскопа, и получить доступ к ним студенту первого курса было не так-то просто. Вскоре Педжет доложил о своем открытии на заседании Научного общества в Лондоне, не указав, однако, систематического положения обнаруженного им организма. После чего кусочек мышц от этого же трупа был доставлен для детального исследования зоологу Ричарду Оуэну. Он и описал находку, дав название червячку Т.spiralis, поскольку в охлажденном спокойном состоянии он приобретал вид спирали из 3–4 витков.
В 1860 году немецкий патолог Zenker при вскрытии трупа женщины, умершей от брюшного тифа, обнаружил в мышцах множество инкапсулированных личинок паразита и указал тем самым связь между трихинеллами и тифоподобными заболеваниями.
Строение
Длина половозрелой самки до оплодотворения — 1,5–0,8 мм, после оплодотворения длина увеличивается до 4,4 мм. Длина самца — до 2 мм. Самка откладывает личинки длиной 0,09–0,11 мм, которые в мышцах хозяина увеличиваются до 0,8–1 мм в длину. Тело гельминта покрыто поперечно-исчерченной кутикулой. Пищеварительная система представляет собой ротовое отверстие — ротовую капсулу — стилет (с помощью которого паразит прикрепляется к слизистой оболочке кишечника хозяина) — пищевод — кишечник и заканчивается прямой кишкой [1, 2].
Половая система непарная. У самца она заканчивается на заднем конце тела двумя копулятивными придатками. У самок в задней части тела расположен яичник, который переходит в яйцевод. Большая часть тела занята длинной и широкой маткой, которая заканчивается половым отверстием в конце передней четверти тела [1, 3].
Жизненный цикл
В природных очагах источником инвазии являются дикие животные, заражение которых происходит в результате хищничества и поедания трупов павших инвазированных животных, содержащих живые инкапсулированные личинки трихинелл. В синантропных очагах источником служат домашние животные (свиньи, кошки, собаки), грызуны и другие животные, которые заражаются при поедании продуктов убоя, пищевых отходов и падали, содержащих личинки трихинелл. Человек заражается при употреблении в пищу сырого, плохо проваренного или прожаренного (в том числе шашлыки) мяса свиней, а также через свиное сало и прослойки мышечной ткани, содержащие личинки трихинелл. Соление, копчение мяса и сала не убивают трихинелл. Надежное обезвреживание трихинелл в мясе может быть достигнуто лишь путем варки в течение 2 часов (рис. 1).
Паразитирование трихинелл в организме хозяина состоит из следующих стадий: кишечной, миграционной и мышечной [2, 4].
Заглоченные с мясом личинки трихинелл под воздействием пищеварительных ферментов в желудке и тонком кишечнике человека высвобождаются от капсулы, и личинки выходят в просвет кишечника. Уже через час они внедряются в слизистую оболочку, достигая подслизистого слоя тонкого кишечника. Затем трихинеллы превращаются в самцов и самок. Половозрелые особи с помощью головного стилета прикрепляются к слизистой оболочке кишок, где затем и копулируют. Самцы после оплодотворения самок обычно погибают. Самки трихинелл живородящие, за время их жизни в кишечнике (3–6 недель) одна самка отрождает от 200 до 2000 личинок размером около 0,1 мм. Метаболиты взрослых трихинелл оказывают иммуносупрессивное действие, благодаря чему создаются условия для миграции личинок.
Через слизистую кишечника личинки проникают в лимфатическую, а затем в кровеносную систему и током крови разносятся по всему организму. Затем личинки активно проникают из капилляров в мышечные волокна поперечно-полосатой скелетной мускулатуры. В мышце сердца и гладкой мускулатуре других органов личинки не локализуются. Трихинеллы чаще всего поражают наиболее активно работающие мышцы, обильно снабжаемые кровью: ножки диафрагмы, межреберные, жевательные, глазодвигательные, шейные мышцы, мышцы гортани и языка. При интенсивной инвазии в 1 г этих мышц может находиться от 50 до 100 и более личинок трихинелл. Там они увеличиваются в размерах до 0,8–1 мм и сворачиваются спиралью. Вследствие продуктивного воспалительного процесса вокруг личинки образуется интенсивная клеточная инфильтрация, а затем формируется капсула, состоящая из сарколеммы мышечного волокна, соединительнотканного и гиалинового слоев (рис. 2). Иногда в одной капсуле могут находиться две личинки. Средняя величина капсул у человека 0,35 × 0,24 мм. Капсула выполняет защитную роль, ее стенка пронизана кровеносными сосудами, через которые личинка получает питательные вещества и кислород и отдает продукты метаболизма. Через 18–20 дней личинки становятся инвазионными. С шестого месяца после инвазирования капсулы начинают обызвествляться, при этом многие личинки погибают, однако часть из них могут сохранять жизнеспособность в течение 25 лет и более. Инкапсулированная личинка может продолжать дальнейшее развитие до половозрелой особи только в том случае, если будет съедена с сырой мышечной тканью другим хозяином. В кишечнике нового хозяина она высвобождается из капсулы и повторяет уже новый цикл развития [1, 3, 4].
/85-92/87-1.jpg)
Классификация
Трихинеллез может быть острым и хроническим.
По тяжести течения острый трихинеллез подраз–деляют на тяжелую, среднетяжелую и легкую формы. Могут быть и атипичные формы трихинеллеза, к которым относятся стертая и бессимптомная [2, 4, 5].
Клиническая картина
Инкубационный период в среднем составляет 10–25 дней, при массивных инвазиях он может удлиняться до 45 дней и укорачиваться до недели при легких формах [2–4].
Картина трихинеллеза имеет 4 признака:
1) лихорадка;
2) отеки;
3) боли в мышцах;
4) высокая эозинофилия в крови.
Начало болезни острое. Лихорадка чаще ремиттирующего или неправильного типа. При легких формах заболевания температура может и не повышаться или наблюдается субфебрилитет, который может сохраняться несколько месяцев. Воспалительные процессы, протекающие по типу реакции гиперчувствительности немедленного типа, приводят к гемокоагуляционным нарушениям, повышению проницаемости сосудов, развитию отеков. Отеки век и лица в сочетании с конъюнктивитом возникают и развиваются в течение 1–5 дней, сохраняясь при легких и средней тяжести формах болезни 1–2, реже — 3 нед. Распространение отеков на шею, туловище, конечности прогностически неблагоприятно [3, 5, 6].
Параллельно развитию отеков появляются миалгии разных групп мышц, они могут быть очень интенсивными, вплоть до болевых контрактур. Одновременно с этим может развиться абдоминальный синдром: дис–пептические расстройства, боли в животе. У больных появляются слабость, бессонница, головная боль, разнообразные высыпания на коже [3, 5].
Эозинофилия возникает с первых дней болезни и достигает высокого уровня (до 80 %).
При интенсивной инвазии и недостаточной реактивности организма трихинеллез протекает крайне тяжело, возникают органные поражения, которые нередко являются причиной летального исхода [3, 6].
Осложнения
Миокардит аллергической природы — основная причина смерти таких пациентов. С первых дней болезни отмечаются тахикардия, глухость тонов, нарушение сердечного ритма.
На втором месте среди причин летальности при трихинеллезе — пневмония с вовлечением в патологический процесс плевры. Вследствие развития сердечной недостаточности увеличиваются периферические отеки, происходит выпот в серозные полости, усиливаются застойные явления в легких. Возникает мигрирующая очаговая пневмония, появляются геморрагии, выпот в плевру, которые вместе с присоединяющимися астматическими явлениями приводят к нарушению дыхания. Поражения легких, усугубляющиеся присоединением вторичной инфекции [4, 5].
На третьем месте среди причин смерти больных трихинеллезом — поражение центральной нервной системы (ЦНС), происходит развитие отека мозговых оболочек, в результате которого возникают сначала функциональные, а затем и органические изменения различных компонентов ЦНС. Появляются симптомы полиневритов, миастении, менингита, энцефаломиелита, парезов, параличей, психозов [1, 5, 6].
Также возможно поражение печени. Развитие тромбогеморрагического синдрома.
Диагностика
— Данные эпидемиологического анамнеза. Необходимо выяснить, было ли употребление в пищу свинины.
— Обнаружение личинок трихинелл в остатках употребленного мяса.
— Обнаружение личинок в биоптатах мышц (трихинеллоскопия). Под местной анестезией с соблюдением правил асептики и антисептики вырезают кусочек икроножной или дельтовидной мышцы размером 0,5–1 × 2–3 см, из которого готовят тонкие срезы между стеклами компрессориума для микроскопии. Трихинеллоскопию применяют и для посмертной диагностики [6, 7].
— Серологическая диагностика основана на использовании реакции непрямой гемагглютинации и иммуноферментного анализа. Оба метода обладают высокой разрешающей способностью. Для ранней серологической диагностики желательна одновременная постановка обеих серологических реакций. При кишечной и ранней мышечной стадиях (3–10 дней инвазии) антитела не выявляются. Подтверждением диагноза служит нарастание титра антител в парных сыворотках, взятых с интервалом 10–14 дней [7].
— Кожно-аллергические пробы (инвазия выявляется со 2‑й недели заболевания, она может быть положительной спустя 5–10 лет после заболевания).
— Общий анализ крови: стойкая эозинофилия (96,6 %), лейкоцитоз (68,1 %).
Дифференциальная диагностика
Трихинеллез необходимо дифференцировать с острыми кишечными инфекциями, брюшным или сыпным тифом, гриппом и острым респираторным заболеванием, отеком Квинке, пневмонией, токсической дифтерией зева, лептоспирозом, геморрагической лихорадкой с почечным синдромом и др.
Лечение
Лечение больных трихинеллезом следует проводить в стационаре. Этиотропная терапия наиболее эффективна в первые две недели после заражения, пока самки гельминтов не начали отрождать личинок. После инкапсуляции трихинелл эффективность этиотропной терапии снижается. В качестве этиотропных препаратов, действующих как на самих гельминтов, так и на их личинки, используют альбендазол или мебендазол. Альбендазол назначается в дозе 400 мг 2 раза в сутки, а больным с массой тела менее 60 кг — по 15 мг/кг 2 раза в сутки. Максимальная суточная доза для взрослых составляет 800 мг. Курс лечения 7–14 дней. Мебендазол взрослым и детям старше 7 лет рекомендуется принимать по 100 мг каждые 8 ч в течение 2–3 недель [2, 4].
Для предупреждения побочных аллергических реакций в ответ на гибель паразитов специфическое лечение проводят на фоне противовоспалительной терапии ибруфеном или вольтареном и антигистаминных средств (кларитин, зодак, зиртек, цетрин, эриус и другие).
Назначение гормональных препаратов показано лишь при тяжелых формах трихинеллеза и при развитии осложнений, так как препараты этой группы вызывают нарушение процессов инкапсуляции личинок трихинелл в мышцах, что, как правило, приводит к формированию затяжного и рецидивирующего течения трихинеллеза. Преднизолон назначается в средних и высоких дозах и короткими курсами — с 40–80 мг/сут в течение 5–7 дней с последующим снижением дозы и отменой препарата через 1–1,5 недели [2].
Диспансерное наблюдение
Реконвалесценты трихинеллеза подлежат диспансеризации в течение 6 мес., а при наличии остаточных проявлений — на протяжении 1 года.
8-е место среди самых опасных пищевых паразитов
Описторхоз
Шифр МКБ-10: B66.0
Возбудителями описторхоза являются гельминты, относящиеся к типу Plathelmintes, классу Trematoda, семейству Opisthorchidae, видам Opisthorchis felineus (двуустка кошачья) и Opisthorchis viverrini [1, 4].
Основным возбудителем описторхоза человека является Opisthorchis felineus (Rivolta, 1884). Opisthorchis viverrini распространен в Юго-Восточной Азии (Таиланд, Лаос, Индия, Китай) [1, 2, 4].
История открытия
В 1884 году итальянский ученый С. Ривольта нашел у кошки гельминт, ранее неизвестный науке, но у него не получилось определить его видовую принадлежность.
Биологическое описание выявленного паразита сделал в 1885 году Р. Бланшар и назвал его кошачьей двуусткой.
Несколькими годами позднее Браун предположил, что заражение паразитом происходит через рыбу, учитывая тот факт, что локальное заражение данной патологией происходит только около пресных водоемов. В 1904 году эта версия была подтверждена ученым Асканази экспериментально.
В 1891 году профессор К.Н. Виноградов при патологоанатомическом исследовании печени человека обнаружил небольшого гельминта, описал его и назвал двуусткой сибирской. Его исследования показали, что у плоского паразита есть промежуточный хозяин — моллюск. Этот факт подтвердили и работы немецкого исследователя Г. Фогеля, а также работы российского ученого Я.И. Старобогатого [8].
Последующие исследования показали, что двуустка кошачья и двуустка сибирская — один и тот же вид гельминта. Название «двуустка (двуротка)» посчитали неправильным, так как рот у гельминта один, а выявленную трематоду отнесли к роду описторхис, то есть заднесеменковый (семенники расположены сзади), а заболевание назвали описторхозом [8, 9].
Строение
Описторхисы имеют листовидную или ланцетовидную форму с заостренным передним концом, ротовой и брюшной присосками (рис. 3). Opisthorchis felineus несколько отличается размерами (длина 4–13 мм и ширина 1–3,5 мм) от Opisthorchis viverrini (длина 5,4–10,2 мм и ширина 0,8–1,9 мм). От ротовой присоски описторхисов идут глотка, пищевод, двуветвистый кишечник. Экскреторный канал находится в заднем конце тела [2, 4, 9]. Половая система гермафродитная. Мужские органы представлены двумя лопастными семенниками, семяприемником — в задней трети тела; женские — маткой и желточниками, отодвинутыми вперед и занимающими среднюю часть тела. Половое отверстие открывается впереди брюшной присоски (рис. 4). Размножение описторхиса происходит выделением яиц. Одна особь червя в организме своего окончательного хозяина способна ежедневно производить 900–1000 яиц.
/85-92/89-1.jpg)
Яйца описторхисов бледно-желтого цвета, имеют нежную двухконтурную оболочку и крышечку на одном полюсе и утолщение скорлупы на противоположном полюсе (по форме напоминают огуречное семя). Их размеры 26–30 × 10–15 мкм [4, 8, 9].
Жизненный цикл
Яйца описторхисов с уже сформированными личинками выделяются с фекалиями во внешнюю среду (рис. 5). Последующее развитие происходит в пресноводных водоемах, где обитает промежуточный хозяин описторхисов — пресноводные моллюски Codiella inflata и Codiella troscheli. Моллюск с пищей заглатывает яйцо, из которого выходят мирацидии, превращающиеся в спороцисту, редию и хвостатую личинку — церкария. Покидая тело моллюска, церкарий выходит в водоем. В последующем в силу хемо- и фототаксиса прикрепляется к телу своего дополнительного хозяина — рыбы семейства карповых (язь, лещ, карп, чебак, елец, линь, красноперка, сазан, пескарь и др.). Попадая в мышечную и соединительную ткани рыбы, церкарии инцистируются и превращаются в метацеркарий. Метацеркарии достигают инвазионной стадии через 6 недель. В организм окончательного хозяина — человека и животных — метацеркарии попадают при употреблении в пищу инвазированной необезвреженной рыбы. Насчитывается 34 вида рыбоядных млекопитающих (кошка, собака, свинья, лисица, волк, корсак, песец, бурый медведь, росомаха, хорь, бобр и др.). В желудке окончательного хозяина происходит переваривание наружной капсулы, а под действием дуоденального сока метацеркарии высвобождаются из своей внутренней оболочки и через ампулу дуоденального сосочка мигрируют в общий желчный проток и внутрипеченочные желчные протоки. У 20–40 % зараженных лиц описторхисы также обнаруживаются и в протоках поджелудочной железы, куда они проникают по вирсунгову протоку. Проникая в гепатобилиарную систему и поджелудочную железу, метацеркарии через 3–4 нед. достигают половой зрелости и начинают продуцировать яйца. Количество паразитов у одного человека может быть от единиц до десятков тысяч. Весь цикл развития описторхиса от яйца до половозрелой стадии длится 4–4,5 мес. [1, 4, 10].
/85-92/90-1.jpg)
Клиническая картина
Клинические варианты описторхоза разнообразны — от латентных до генерализованных аллергических реакций с множественными поражениями.
Инкубационный период описторхоза составляет от 2 до 4 недель (максимальный — до 6 недель) [1, 2].
В острой фазе описторхоза ведущим звеном в патогенезе является развитие аллергических реакций и органных поражений в ответ на воздействие продуктов метаболизма паразита. В связи с этим в клинической картине преобладают гепатохолангитический синдром (боли в правом подреберье, увеличение печени, желтуха, повышение активности аминотрансфераз — аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы). Системная аллергическая реакция обусловливает вовлечение в патологический процесс легких (летучие эозинофильные инфильтраты, эозинофильная пневмония, бронхиальная астма, экссудативный плеврит), желудочно-кишечного тракта (гастродуоденит, энтероколит), опорно-двигательного аппарата (полиартралгии, реактивные артриты, миалгии), кожи (крапивница, атопический дерматит), реже — сердечно-сосудистой системы (боли в области сердца, сердцебиение, приглушенность тонов, систолический шум на верхушке, аритмии, нарушение метаболических процессов в миокарде). У подавляющего числа больных наблюдается лихорадка, сопровождающаяся ознобами и проливными потами. Могут развиваться и очень тяжелые токсико-аллергические проявления, такие как острый эпидермальный некролиз (синдром Лайелла), синдром Стивена — Джонсона, острый миокардит, отек Квинке, крапивница. Длительность острой фазы 1–3 месяца (реже — 6–9 месяцев).
В патогенезе хронической стадии описторхоза большую роль играют повторные заражения с обострением воспалительного процесса, фиброзом билиарных путей, поджелудочной железы, дистрофией паренхимы печени, дискинезией желчевыводящих путей, холестазом [11]. Хроническая фаза описторхоза может протекать латентно или с клиническими проявлениями. При латентном течении, как правило, описторхоз выявляется случайно при профосмотре или обследовании по поводу других заболеваний. При клинически выраженном течении описторхоза выявляются синдромы холангита, холангиохолецистита, холецистопанкреатита, холангиогепатита. Им часто сопутствуют дискинезия желчевыводящих путей (чаще по гипотоническому типу), хронический гастродуоденит, рефлюкс-гастрит, энтероколит, дисбактериоз кишечника [12]. Хронический описторхоз продолжается многие годы и протекает длительно с периодами ремиссий и обострений. Провоцирующими факторами могут быть: погрешность в диете, интеркуррентные инфекции, стрессорные факторы, физическая нагрузка. Нередко описторхоз проявляется аллергическими реакциями (крапивница, отек Квинке, атопический дерматит), что связано с выраженной сенсибилизацией организма больного. Возможно поражение опорно-двигательного аппарата и сердечно-сосудистой системы [9–11].
Возможные осложнения описторхоза: гнойный холангит, разрыв кистозно-расширенных желчных протоков с развитием желчного перитонита, эрозивно-язвенные поражения верхнего отдела пищеварительного тракта, панкреатит, хронический гепатит, цирроз печени, холангиокарцинома [13, 14].
Диагностика
1. Данные эпидемиологического анамнеза (употребление в пищу недостаточно термически обработанной рыбы).
2. Копрологическое исследование (выявление яиц гельминта Opistorchis felineus в фекалиях) [7].
3. Серологическое исследование (обнаружение антител классов IgG и IgM к возбудителю описторхоза в крови) [7, 15].
4. ПЦР кала (выявление ДНК гельминта Opistorchis felineus в фекалиях больного) [7, 9].
5. Гематологический метод (выявление лейкоцитоза, повышение скорости оседания эритроцитов, эозинофилии, снижение уровня гемоглобина и эритроцитов в крови) [7].
6. Биохимический метод (выявление повышения АЛТ, АСТ, щелочной фосфатазы, прямого билирубина в крови) [7, 8].
7. Микроскопическое исследование дуоденального секрета (обнаружение яиц гельминта Opistorchis felineus) [1, 7].
Лечение описторхоза должно быть комплексным с соблюдением принципа сочетания патогенетической и этиотропной терапии [2, 8]. Этапность в схеме лечения предусматривает подготовку, назначение антигельминтного препарата на фоне патогенетической терапии, реабилитацию, диспансеризацию, контроль эффективности лечения.
I этап — подготовительная патогенетическая терапия (2–3 недели). В соответствии с клинической картиной и тяжестью течения заболевания назначается комплекс лечебных мероприятий: диета № 5, гепатопротекторы, спазмолитики, желчегонные и ферментные препараты, антигистаминные средства, тюбажи с минеральной водой через день, по показаниям проводится дезинтоксикационная терапия.
II этап лечения описторхоза предусматривает проведение специфической химиотерапии (проводится только в период клинико-лабораторной ремиссии) — празиквантел (Praziguantel, син.: Biltricide, Azinox, Cesol, Cisticid, Pyguiton, Droncit). Фармакокинетика празиквантела и его аналогов связана с повышением проницаемости клеточных мембран паразитов для ионов кальция, сокращением мускулатуры паразитов, переходящим в спастический паралич. Препарат назначают в курсовой дозе 40–75 мг/кг массы тела больного в 3 приема с интервалом 4 часа, после еды. Этиотропное лечение описторхоза назначается и проводится только в медицинских учреждениях под наблюдением врача.
III этап — не менее 1–2 недель. Продолжается реабилитационная патогенетическая терапия, направленная на максимальное выведение продуктов жизнедеятельности и распада паразитов: желчегонная терапия, адекватная типу дискинезии желчевыводящих путей, беззондовое дуоденальное зондирование (тюбажи с ксилитом, сорбитом, сернокислым магнием, минеральной водой) 2–3 раза в течение 1-й недели, далее 1–2 раза в неделю (до 3 мес.), сорбенты (лактофильтрум, энтеросгель, полифепан и др.), пре- и пробиотики — для восстановления биоценоза кишечника. При усилении аллергических реакций, интоксикационного синдрома, связанных с дополнительным антигенным воздействием при гибели гельминтов, требуется назначение десенсибилизирующей (антигистаминные препараты, при необходимости — глюкокортикоиды) и дезинтоксикационной (инфузии растворов, сорбенты) терапии. Комплекс реабилитационных мероприятий включает также прием гепатопротекторов, отваров желчегонных трав в течение 3–4 месяцев, по показаниям применяют спазмолитики, антихолестатические препараты, антигистаминные средства и другие патогенетические средства [1, 8, 9].
Диспансерное наблюдение подразумевает этапное наблюдение больного описторхозом в течение 1 года (контрольное обследование через 1, 3, 6, 9 и 12 мес. после лечения) и предусматривает оценку гельминтоцидной и клинической эффективности химиотерапии. Учитывая возможность повторного заражения (супер–инвазии, реинвазии), важное значение имеет просветительная и санитарно-воспитательная работа среди больных и его родственников.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.

/85-92/86-1.jpg)
/85-92/87-1.jpg)
/85-92/89-1.jpg)
/85-92/90-1.jpg)