Резюме
Актуальність. Молекулярні механізми спеціалізації серотонінергічних нейронів зі стовбурових і прогеніторних нервових клітин вивчені далеко не повністю. Мета дослідження — визначення найбільш ефективних нейроіндукторів, що підтримують життєздатність та функціональну активність серотонінергічних нейронів та їх детермінованих попередників. Як критерії оцінки були обрані: експресія відповідних генів, загальний вміст серотоніну та чисельність серотонінергічних нейронів, візуалізованих за допомогою гістохімічної реакції. Матеріали та методи. Робота була виконана на суспензійній культурі клітин зони n.raphe з використанням гістохімічних методів, імуноферментного аналізу та полімеразної ланцюгової реакції. Результати. Установлено, що BDNF та NGF стимулюють збільшення чисельності серотонінергічних нейронів у дисоційованій культурі в 1,6 та 2 рази порівняно з контрольними зразками. Додавання в культуральне середовище BDNF та ретиноєвої кислоти призводить до зростання вмісту серотоніну в культуральному матеріалі. Експресія гена Nkx 2.2, що є маркером мітотично-активних попередників серотонінергічних нейронів, підтримується за наявності BDNF і збільшується під впливом EGF та FGFb. Експресія гена Pet1, що свідчить про наявність детермінованих прогеніторів серотонінергічних нейронів, підтримується всіма досліджуваними факторами, за виключенням екзогенного серотоніну. Експресія гена Tph1, маркера початку синтезу серотоніну, спостерігається під впливом FGFb, EGF та NGF. Висновки. Таким чином, наші дані показали, що вищевказані нейроіндуктори впливають на різні фази серотонінгенезу і можуть бути використані для його регуляції.
Актуальность. Молекулярные механизмы специализации серотонинергических нейронов из стволовых и прогениторных нервных клеток изучены далеко не полностью. Цель исследования — определение наиболее эффективных нейроиндукторов, поддерживающих жизнеспособность и функциональную активность серотонинергических нейронов и их детерминированных предшественников. В качестве критериев оценки были выбраны: экспрессия соответствующих генов, общее содержание серотонина и количество серотонинергических нейронов, визуализированных с помощью гистохимической реакции. Материалы и методы. Работа была проведена на суспензионной культуре клеток зоны n.raphe с использованием гистохимических методов, иммуноферментного анализа и полимеразной цепной реакции. Результаты. Установлено, что BDNF и NGF стимулируют увеличение количества серотонинергических нейронов в диссоциированной культуре в 1,6 и 2 раза по сравнению с контрольными образцами. Добавление в культуральную среду BDNF и ретиноевой кислоты приводит к возрастанию содержания серотонина в культуральном материале. Экспрессия гена Nkx 2.2, который является маркером митотически-активных предшественников серотонинергических нейронов, поддерживается при наличии BDNF и увеличивается под влиянием EGF и FGFb. Экспрессия гена Pet1, свидетельствующая о наличии детерминированных прогениторов серотонинергических нейронов, поддерживается всеми исследуемыми факторами, за исключением экзогенного серотонина. Экспрессия гена Tph1, маркера начала синтеза серотонина, наблюдается под воздействием FGFb, EGF и NGF. Выводы. Таким образом, наши данные показали, что перечисленные нейроиндукторы влияют на различные фазы серотонингенеза и могут быть использованы для его регуляции.
Background. Serotonergic neurons of n.raphe play a key role in the modulation of behavior, and their dysfunction is associated with severe neurological and psychiatric disorders. However, the molecular mechanisms underlying the differentiation of the nerve stem and progenitor cells and the specification of the serotonergic phenotype are not fully understood. The aim of our study was to determine the most effective neuroinductors to support the survivability and functional activity of serotonergic neurons and their determined precursors. Materials and methods. The research was carried out on the suspension culture of nerve cells, obtained from the n.raphe zone of fetal rat brain E16 gestation. Neuroinductors epidermal growth factor (EGF), fibroblast growth factor (FGFb), nerve growth factor (NGF), brain derived neurotrophic factor (BDNF), retinoic acid and exogenic serotonin were tested in our study to determine their role in the serotonergic neurons differentiation. Such criteria were taking into account: the relevant genes expression (Nkx 2.2, Lmx 1b, Pet 1, Tph 1, Tph 2 and Sert), total serotonin content, and serotonergic neurons amount. Methods of reverse transcription polymerase chain reaction, enzyme-linked immunosorbent assay and hystochemical Falсk-Hillarp reaction were used in our work. Results. Our data demonstrated that cell population, received from the n.raphe zone of fetal rat brain E16 gestation, consists of all types of cells, taking part in the serotoninogenesis: from early mitotically-active progenitors to mature serotonergic neurons. So, it can be used as an experimental model of the neuroinductor activity testing in vitro. It is confirmed that standard culture condition supported already formed serotonergic neurons, but their generation from determined progenitors doesn’t take place. We have observed that in phase of cell expansion the presence of EGF and FGFb in n.raphe suspension culture stimulated the pool of early progenitors of serotoninogenesis. Another neuroinductors realized their effects in different ways. It has been established, that BDNF and NGF stimulated the serotonergic neurons amount increasing in the dissociated culture by 1.6 and 2 times compared with the control slices. Adding BDNF and retinoic acid leads to increased total serotonin content in the culture material. The Nkx2.2 genes expression, which is the marker of the mitosis-active serotonergic progenitors, is supported by BDNF and increased in the presence of EGF and FGFb. The gene Pet1 expression indicating the presence of serotonergic determined precursors is supported by all using factors, except exogenous serotonin. The gene Tph1 expression, marker of serotonin synthesis start, was observed in the presence of FGFb, EGF and NGF. Adding exogenic serotonin stimulated the earliest progenitors of serotogenesis, marked by the gene Nkx 2.2 expression. At the same time, it suppressed determined progenitors marked by Pet 1 and can be accumulated in the nerve cells of culture population by the reuptake way. Conclusions. So, our data show that neuroinductors, listed here, influence different phases of serotoninogenesis from the progenitor cell expansion to the serotonin synthesis in mature neurons and can be used for its regulation.
Статтю опубліковано на с. 94-101
Вступ
В останнє десятиріччя в нейробіології велика увага приділяється порушенню генезу серотонінергічної системи у зв’язку з розширенням уявлення про її значну роль у розвитку неврологічних та психіатричних хвороб, а також поширенням застосування фармакологічних препаратів, що впливають на активність зворотного захвату серотоніну. Не викликає сумніву, що в основі багатьох неврологічних розладів лежать молекулярно-генетичні порушення метаболізму серотонінергічних нейронів, що не діагностуються морфологічно, але мають складні наслідки для організму з огляду на інтегративні функції серотоніну як нейромедіатора та його рецепторів [1]. Отже, створення принципово нових підходів до лікування неврологічних хвороб неможливо без досконалого розуміння процесів серотонінгенезу та пошуків засобів його корекції на молекулярно-генетичному рівні, одним з яких є клітинна терапія.
На сьогодні встановлені основні каскади генів, що регулюють генерацію серотонінергічних нейронів від прогеніторів до термінальних стадій диференціювання [2–4]. Відомі деякі з трофічних факторів, що активують експресію вказаних вище генів [5–7]. Ці дані створюють можливості для здійснення направленого впливу на популяцію серотонінергічних нейронів як in vitro, так і in vivo.
Отже, в сучасній науковій практиці існує необхідність дослідити можливості застосування нейроіндукторів для отримання in vitro популяції фетальних клітин, збагаченої серотонінергічними нейронами та їх детермінованими попередниками, здійснюючи моніторинг ступеня зрілості на генетичному та молекулярному рівнях.
Мета дослідження — визначення найбільш ефективних нейроіндукторів, що здатні здійснювати направлене диференціювання прогеніторних клітин нервової системи по серотонінергічному типу, а також підтримувати життєздатність і функціональну активність серотонінергічних нейронів.
Матеріали та методи
Для культивування використовували суспензію нервових клітин зони ядер шва фетального мозку щурів стадії Е16. Під час експериментального утримання лабораторних тварин маніпуляції, що з ними проводились, відповідали протоколу комітету з медичної етики ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова» (№ 1 від 19.04.2013 р.), розробленому відповідно до чинного законодавства.
Протягом першого тижня зразки культивували на середовищі Ігла (РАА, Австрія) із додаванням 10% термоінактивованої фетальної телячої сироватки (РАА, Австрія), збагаченому факторами EGF (epidermal growth factor) та FGFb (fibroblast growth factor) у концентрації 40 нг/мл (Sigma, США). З 8-ї по 14-ту добу культивування проводилося на середовищі Ігла (РАА, Австрія) та 10% фетальної телячої сироватки (РАА, Австрія) із додаванням у різних серіях експерименту ретиноєвої кислоти (Sigma, США) у концентрації 1 мкМ, NGF (nerve growth factor) (Sigma, США) — 80 нг/мл, BDNF (brain derived neurotrophic factor) (Sigma, США) — 50 нг/мл та серотоніну креатинін сульфату (Janssen Chemica, Бельгія) — 75 мкМ. На 14-ту добу культуральні зразки фіксували для подальших досліджень.
Візуалізація серотоніну в клітинах здійснювалася за допомогою гістохімічної реакції Фалька — Хілларпа. Препарати досліджували за допомогою флуоресцентного мікроскопа в системі IBAS 2000, здійснюючи підрахунок клітин у 10 полях зору кожного препарату. Статистичну обробку даних проводили з використанням критерію Стьюдента.
Дослідження рівня серотоніну проводили методом конкурентного твердофазового імуноферментного аналізу з використанням діагностичного набору RE 59121 (IBL, Німеччина). Попереднє ацилювання зразків здійснювали згідно з інструкцією до набору.
Дослідження експресії генів — регуляторів серотонінгенезу — Nkx 2.2, Lmx1b, Pet1, Tph1, Tph2, Sert у культуральному матеріалі проводилося методом зворотно-транскриптазної полімеразної ланцюгової реакції. Геномну ДНК (дезоксирибонуклеїнову кислоту) виділяли з використанням наборів «ДНК-сорб В» (Amplisens, Росія), РНК (рибонуклеїнову кислоту) — «РИБО-сорб» (Amplisens, Росія). Реакцію зворотної транскрипції здійснювали з використанням набору RevertAidTM First strand cDNA synthesis kit (Fermentas, Литва). Для визначення експресії генів Nkx 2.2, Lmx1b, Pet1, Tph1, Tph2, Sert були використані специфічні пари праймерів [2–4]. Отримані продукти ампліфікації складалися з 374, 492, 109, 184, 117, 127 пар нуклеотидів (п.н.) відповідно. Візуалізація продуктів ампліфікації проводилася за допомогою електрофорезу в 2% агарозному гелі.
Результати
Метою першого етапу культивування було досягнення максимальної клітинної експансії за допомогою факторів-мітогенів EGF та FGFb із запобіганням при цьому диференціюванню клітин [7].
Спостереження за нативною культурою показали, що на цій стадії клітини зберігають невеликі розміри та округлу форму без відростків. Вони характеризуються зниженим рівнем серотоніну (табл. 1) та зникненням експресії генів Tph2 та Sert (рис. 1). До того ж значно підсилюється експресія гена Pet1 (рис. 1). Також у зразках культурального матеріалу зберігається експресія Nkx 2.2 (рис. 1).
На другому етапі для стимуляції нейронального диференціювання використовувалися нейроіндуктори: ретиноєва кислота, BDNF, NGF, а також екзогенний серотонін. Темпи росту клітинної популяції при цьому різко зменшувалися. Під впливом нейроіндукторів клітини змінювали форму та починали встановлювати контакти за допомогою аксонів та дендритної мережі (рис. 3).
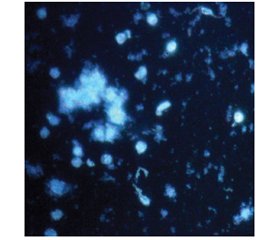
На гістологічних препаратах, забарвлених за методикою Фалька — Хілларпа, спостерігалися окремі клітини з флуоресцентними гранулами в цитоплазмі, найчастіше в її периферийних зонах (рис. 3). Ми не відмічали флуоресценції в аксонах та встановлення міжклітинних зв’язків.
Аналіз експресії генів показав, що порівняно з фазою клітинної експансії в контрольних культурах дещо знижується рівень експресії Nkx 2.2 та зникає експресія Tph1 (рис. 2).
Чисельність клітин із флуоресценцією серотонінергічних гранул та вміст самого нейромедіатора в культуральному матеріалі знаходяться на рівні, досягнутому за період клітинної експансії (табл. 1).
Додавання BDNF в культуральне середовище призводило до вірогідного збільшення вмісту серотонінергічних нейронів в 1,6 раза (табл. 1). Збільшення процентного вмісту серотонінергічних нейронів в цих серіях дослідів супроводжувались формуванням клітинних агрегатів чисельністю (5–10) клітин (рис. 3). На препаратах, забарвлених за методикою Фалька — Хілларпа, флуоресцентні гранули заповнюють периферичні та центральні зони цитоплазми, іноді спостерігаючись в аксонах та дендритах, які в більшості нейронів, залишаються вільними (рис. 3). Внесення BDNF призвело до вірогідного підвищення вмісту серотоніну в 1,7 раза в культуральному матеріалі (табл. 1). Дослідження експресії генів продемонструвало, що присутність BDNF в культуральному середовищі збільшує експресію генів Pet 1 та Nkx 2.2 (рис. 2).
На відміну від впливу BDNF дія NGF на серотонінергічні нейрони в культурі є недостатньо вивченою, але згідно з нашими результатами, безперечно, заслуговує на увагу. Додавання NGF до живильного середовища викликає в культуральній популяції зміни зовсім іншого характеру порівняно з BDNF та контрольною групою. При значному вірогідному збільшенні вдвічі вмісту нейроклітин, що містять гранули серотоніну в цитоплазмі (табл. 1, рис. 3), його загальний вміст залишається на рівні контрольних значень (табл. 1).
Генетичний аналіз культурального матеріалу під впливом NGF продемонстрував повне зникнення експресії гена Nkx 2.2 і значне зниження експресії гена Pet1 (рис. 2). Проте з’являється експресія гена Tph1.
За наявності ретиноєвої кислоти в первинній культурі ядер шва порівняно з контрольними зразками нами було відмічено зникнення експресії гена Nkx 2.2, тоді як експресія гена Pet1 зберігалася на тому ж рівні (рис. 1). Загальний вміст серотоніну та чисельність клітин із флуоресцентними гранулами в цитоплазмі в культуральному матеріалі зростають під впливом ретиноєвої кислоти в 1,7 та 1,5 раза відповідно (табл. 1).
Застосування екзогенного серотоніну як агента диференціювання в культурі також сприяє збільшенню чисельності відповідних нейронів в 1,5 раза (табл. 1). На препаратах, забарвлених за методикою Фалька — Хілларпа, нейрони з відповідними флуоресцентними гранулами розташовані поодинці, але відбувається інтенсивне формування аксонів і дендритної мережі, що часто формують розгалужені і навіть замкнені структури. Спостерігається переміщення флуоресценції з цитоплазми в зону відростків (рис. 3), що свідчить про формування відповідних синапсів і активний транспорт нейромедіатора.
За даними імуноферментного аналізу, додавання серотоніну стимулювало його захоплення та накопичення в клітинах суспензійної культури, внаслідок чого його вміст у культуральному матеріалі зростає майже до рівня висхідного контролю (табл. 1). На електрофореграмах майже зникає експресія гена Pet1 і повністю відсутня експресія гена Tph1, але наявна експресія гена Nkx 2.2 (рис. 1).
Обговорення
Згідно з нашими даними, при переході в умови суспензійної культури популяція нейроклітин ядер шва втрачає високодиференційовані зрілі серотонінергічні нейрони, про що свідчать зниження рівня серотоніну та зникнення експресії генів Tph та Sert. Проте активується пул детермінованих попередників, що характеризуються експресією Pet1 та Nkx 2.2, внаслідок чого загальний вміст серотонінергічних нейронів у популяції залишається на тому ж рівні в процентному відношенні до інших клітин (табл. 1). Цей процес є відображенням регенеративної пластичності, що властива нервовій системі на ранніх етапах розвитку.
Порівняння показників висхідного контролю з контрольною групою після двотижневого культивування показало, що в культуральних умовах в основному підтримується життєдіяльність уже сформованих серотонінергічних нейронів, у тому числі і тих, генерація яких відбулася на попередній фазі клітинної експансії, внаслідок чого їх процентний вміст лишається незмінним в умовах зростання загальної чисельності клітинної популяції. Відбувається гальмування поділу мітотично-активних прогеніторів та генерації нових серотонінергічних нейронів. Отже, стандартних культуральних умов достатньо для реалізації генетичної програми диференціювання серотонінергічних нейронів з їх детермінованими попередниками.
Генетичний аналіз показав, що попередня активація прогеніторних клітин у фазі стимуляції розмноження in vitro створює сприятливі умови для стимуляції серотонінгенезу, оскільки зростає пул клітин, чутливих до їх впливу.
Стимулюючий вплив BDNF на формування серотонінергічних нейронів в умовах in vitro був установлений раніше і описаний у роботах багатьох дослідників [5–7]. Наші дані дозволили деталізувати цей ефект із точки зору генетичної регуляції. Отримані нами дані імуноферментного та генетичного аналізу свідчать на користь того, що стимулюючий вплив BDNF здійснюється за рахунок підтримки направленої активації прогеніторних клітин серотонінгенезу.
Також отримані нами дані дозволяють висловити припущення, що під впливом NGF гальмується процес збільшення пулу прогеніторів серотонінгенезу і вони переходять у наступний етап активного синтезу ней-ромедіатора, про що свідчить поява експресії гена Tph.
Схожим способом виявляється в даних умовах ней-роіндуктивна дія ретиноєвої кислоти. Відбуваються гальмування ранніх мітотично-активних попередників серотоніногенезу та підтримка пулу більш диференційованих прогеніторів серотонінгенезу.
Аналіз даних з експресії генів показав, що наявність екзогенного серотоніну сприймається як гальмівний сигнал детермінованими попередниками, що перебувають на кінцевих етапах диференціювання. Разом із тим екзогенний серотонін здійснює трофічну підтримку ранніх прогеніторів, про що свідчить експресія гена Nkx 2.2.
З літературних джерел відомо, що 5-гідрокситриптофан на ранніх етапах розвитку серотонінергічних нейронів може функціонувати як регуляційний сигнал, його автокринна секреція стимулює серотонінергічне диференціювння [8]. Агоніст серотоніну 8-гідроксі-2-[ді-(н-пропіл)аміно]тетралін, так само як і сам серотонін, зв’язуючись із рецепторами, ініціює та підсилює власний синтез [6].
Наші дані підтверджують, що серотонін може здійснювати несинаптичний вплив на клітини на ранніх стадіях розвитку нервової системи, виконуючи не лише нейромедіаторні, але й нейротрофічні функції. Ці ефекти опосередковані через паракринну, дифузну дію на відміну від більш направленого швидкого впливу в синапсах. Власне це є еволюційно ранній тип нейромедіаторної передачі, що повторюється на початкових етапах онтогенезу, який відомий і для інших нейротрансміттерів. Разом із тим детальний аналіз наших результатів показав, що дія серотоніну, внесеного екзогенно, залежить від фази розвитку клітин — попередників серотонінергічного типу — від стимуляції найбільш ранніх мітотично-активних прогеніторів до гальмування більш детермінованих.
Таким чином, досліджені нами нейроіндуктори впливають на різні фази серотонінгенезу, що може бути використано для стимуляції направленої регенерації серотонінергічної системи.
Висновки
1. Активна стимуляція регенеративних процесів серотонінергічної системи, підтверджена молекулярно-генетичними методами, спостерігалася нами за наявності BDNF, NGF, EGF, FGFb, ретиноєвої кислоти та екзогенного серотоніну. При цьому підтримка життєдіяльності та функціональної активності серотонінергічних нейронів відбувалася різними шляхами.
2. Популяція нервових клітин, отримана у вигляді суспензійної культури із зони ядер шва фетального головного мозку щурів, відповідає на стимулюючий вплив BDNF та NGF збільшенням процентного вмісту серотонінергічних нейронів порівняно з контролем в 1,6 та 2 рази відповідно.
3. Загальний вміст серотоніну в цьому культуральному матеріалі за даними імуноферментного аналізу зростає в 1,7 раза під впливом BDNF та ретиноєвої кислоти.
4. Експресія гена Nkx 2.2, що є маркером мітотично-активних попередників серотонінергічних нейронів, підтримується за наявності BDNF та зростає під впливом факторів-мітогенів EGF та FGFb. Експресія гена Pet1, що свідчить про наявність детермінованих попередників серотонінергічних нейронів, за нашими даними, підтримується всіма дослідженими трофічними факторами, за виключенням екзогенного серотоніну. Експресія гена Tph1, що свідчить про формування молодих серотонінергічних нейронів і є початковим етапом синтезу нейромедіатора, спостерігається під впливом FGFb, EGF та NGF.
5. Результати роботи дозволять у перспективі створити протокол отримання популяції серотонінергічних клітин потрібного ступеня сформованості — від прогеніторів до зрілих нейронів — для застосування як дослідницької моделі, а також вдосконалення методів клітинної терапії для регенерації неврологічних пошкоджень.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/95.jpg)
/96.jpg)
/98.jpg)
/97.jpg)