В последние годы на изучение подагры обращено пристальное внимание. Во многом это объясняется ростом заболеваемости, ассоциированным не с улучшением диагностики или приемом мочегонных препаратов, а с наличием других метаболических нарушений — ожирения, сахарного диабета, артериальной гипертензии, инсулинорезистентности, нарушений липидного обмена [2]. Рост заболеваемости также связан с изменениями образа жизни и питания пациентов (повышение уровня жизни, изменение характера питания, злоупотребление алкоголем, снижение физической активности). Частое сочетание подагры с различными метаболическими заболеваниями увеличивает риск развития у таких больных серьезных кардио–васкулярных заболеваний и значительно осложняет выбор адекватной терапии.
Несмотря на успехи в диагностике, понимании патогенеза заболевания и разработке эффективных лекарственных средств для лечения подагры, ведение этой категории пациентов может представлять для интернистов определенные трудности. По данным исследователей, диагноз «подагра» устанавливается в первый год заболевания только в 1/4 случаев, в среднем же проходит 7–8 лет до постановки правильного диагноза [1]. Только в одном из 4–5 случаев подагру правильно верифицируют на ранних стадиях. Cчитается, что при первом приступе артрита подагра правильно диагностируется лишь у 10–15 % больных, у 30–40 % больных диагноз устанавливается через 5–7 лет [4].
Причиной поздней диагностики может быть естественное течение заболевания — чередование редких, к тому же кратковременных приступов моноартрита, с более длительными «светлыми промежутками» болезни вследствие присущего подагрическому артриту интермиттирующего течения [2]. Другим объяснением поздней диагностики подагры может служить и то, что врачом первого контакта при этом заболевании нередко становится хирург или травматолог, который, видя перед собой пациента с острым, крайне болезненным артритом, направляет его на рентгенологическое исследование пораженного сустава, с помощью которого диагностировать дебют подагры зачастую не представляется возможным, поскольку крупные кисты в субхондральной зоне кости (так называемый симптом «пробойника», или рентгенонегативные внутрикостные тофусы) появляются значительно позже — в среднем через 7–8 лет от момента первого приступа подагры [7]. Отсутствие изменений на рентгенограмме приводит к исключению диагноза подагры из круга подозреваемых заболеваний. Еще одной причиной диагностической ошибки является определение уровня мочевой кислоты в сыворотке крови во время острого приступа. Необходимо помнить, что во время атаки подагры уровень мочевой кислоты в сыворотке крови может снижаться вплоть до нормальных значений [12], поэтому исследование концентрации мочевой кислоты должно проводиться через некоторое время после разрешения артрита.
Несвоевременная диагностика подагры приводит к череде дальнейших диагностических и тактических ошибок. Прежде всего это касается назначения нестероидных противовоспалительных препаратов –(НПВП) без верификации диагноза. В дальнейшем каждый последующий приступ артрита пациент будет стараться купировать самостоятельно, принимая «понравившийся с первого раза» НПВП, до тех пор, пока либо не проявится неблагоприятная реакция на препарат, либо НПВП перестанут оказывать ожидаемый эффект. Следующим шагом в условиях неэффективности –НПВП может быть необоснованное назначение глюкокортикоидов (ГК). В связи с их высокой эффективностью пациенты применяют ГК в виде частых внутримышечных (в/м) инъекций или длительными курсами, даже при отсутствии явлений артрита. Применение ГК при подагре возможно только короткими курсами, так как длительный их прием при этом заболевании недопустим в связи с высоким риском развития побочных эффектов у данного контингента больных, часто имеющих сопутствующие заболевания. При этом такие заболевания, как ожирение, артериальная гипертензия, метаболический синдром, дислипидемия, сахарный диабет, могут не только обостряться, но и возникать на фоне применения ГК [6].
Пациентов с подагрой также характеризует низкая приверженность к лечению, в частности, к необходимости длительного приема уратснижающих препаратов [3, 4]. Однако анализ причин отказа больных по–дагрой от терапии продемонстрировал, что основным фактором являются некорректные рекомендации врача, а уже затем — прием многочисленных лекарственных препаратов, обострение артрита в первые недели после начала терапии аллопуринолом, низкая комплайентность и др. [8]. Иными словами, даже незначительная на первый взгляд врачебная оплошность при ведении больного подагрой может предопределить прогрессирование заболевания на долгие годы [1]. Недопущение подобных ошибок — вполне решаемая задача.
Низкая эффективность аллопуринола связана в первую очередь с его субоптимальными назначаемыми дозами и отсутствием долгосрочных подходов к гипоурикемической терапии. Назначение аллопуринола пациентам с подагрой не сопровождается предписанием профилактической противовоспалительной терапии на начальном этапе лечения, что может выступать в качестве причины учащения острых атак артрита в первые месяцы его приема [5].
Иллюстрацией позднего установления диагноза по–дагры и неправильного лечения, что привело к серьезным осложнениям, является представленный клинический случай. Несвоевременный диагноз подагры привел к череде ошибок со стороны врача и пациента.
Больной Н., 42 года, частный предприниматель, обратился на консультативный прием в коммунальное учреждение охраны здоровья «Областная клиническая больница — центр экстренной медицинской помощи и медицины катастроф» г. Харькова, поликлиническое отделение, с жалобами на боли в суставах кистей, стоп, коленных, голеностопных, локтевых суставах, деформацию суставов, значительные функциональные ограничения, утреннюю скованность до 1 часа, повышение артериального давления (АД) до 200/100 мм рт.ст., увеличение массы за последние несколько лет на 12 кг.
Анамнез. В 2007 году появились приступообразные боли и отечность в суставах нижних конечностей, которые сначала купировал НПВП (диклофенак, ибупрофен) с положительным эффектом в течение нескольких дней. В течение двух лет частота и длительность приступов стала нарастать, и больной по рекомендациям из Интернета стал принимать ГК. Начинал с однократного в/м введения бетаметазона с отличным клиническим эффектом, что обусловило дальнейшее применение неадекватных доз ГК для снятия острых приступов артрита, а затем — переход на пероральный длительный прием ГК. Так, через некоторое время пациент начал системный прием преднизолона в дозе 10–20 мг в сутки. На фоне длительного бесконтрольного приема ГК присоединилось стойкое повышение артериального давления и избыточная масса тела. В этот период АД колебалось от 150/100 до 180/110 мм рт.ст. В 2010 году по рекомендации кардиолога начал прием комбинированного гипотензивного препарата, содержащего тиазидный диуретик. Артериальное давление снизилось, хотя и не достигло целевых уровней. Одновременно возросла частота и интенсивность приступов подагры, «светлые» межприступные промежутки сократились до нескольких дней, стала беспокоить постоянная боль в суставах, появились деформации, что привело к дальнейшему повышению дозы преднизолона. В 2014 году в связи с выраженным суставным синдромом и очередным обострением пациент обратился к семейному врачу, была диагностирована по–дагра, и в момент острого приступа рекомендован аллопуринол в дозе 300 мг/сут. На фоне приема аллопуринола отмечено ухудшение течения артрита, в результате чего больной прием этого препарата прекратил, а самостоятельно продолжил прием ГК.
В настоящее время обратился на прием к ревматологу в связи с предстоящим решением экспертных вопросов трудоспособности и определения группы инвалидности. На момент приема пациент принимал 20 мг преднизолона и 1 табл. каптопреса в сутки. Диеты не придерживался. О диагнозе «подагра» пациент осведомлен, однако полагает, что лечение аллопуринолом неэффективно, а использование ГК для лечения артрита считает правильным, поскольку препарат облегчает его состояние. О возможных побочных эффектах длительной терапии ГК пациент ничего не знал.
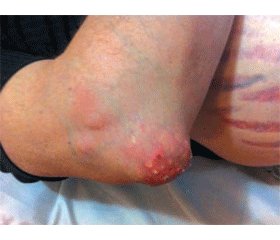
Объективно. Состояние пациента средней тяжести, что обусловлено тяжелым течением тофусной подагры, артериальной гипертензией, значительными функциональными ограничениями. Передвигается прихрамывая, с помощью трости из-за болей в коленных и голеностопных суставах. Резко повышенного питания. Рост — 174 см, масса тела — 128 кг. Окружность талии — 134 см, окружность бедер — 109 см. Индекс массы тела— 42,27 кг/м2. Ожирение IV ст. Симптом Кушинга: кожа лица гиперемирована, на коже боковых поверхностей живота множественные стрии малинового цвета до 2 см в ширину и от 1 до 10 см и больше в длину. Лицо крупное, лунообразное, наблюдается избыточное отложение жира в области груди, живота, спины, матронизм. На коже спины множественные акне. Множественные тофусы в области ушных раковин, локтевых суставов (рис. 1, 2). Тофус в области правого локтевого сустава воспален, кожа натянута, с покраснениями, пальпация болезненная, видны множественные дефекты кожи, через которые выделяется творогоподобная масса. Пастозность голеней и стоп. Припухлость, дефигурация и деформация суставов кистей, стоп, пальпация их болезненна, объем движений ограничен. Припухлость, дефигурация коленных, голеностопных суставов, пальпация их болезненна, объем движений значительно ограничен, локальное повышение температуры над указанными суставами. В легких аускультативно — везикулярное дыхание. Частота дыхания — 20/мин. Тоны сердца пониженной звучности, деятельность ритмичная, акцент II тона на аорте и точке Боткина-Эрба. Частота сердечных сокращений — 84 в 1 минуту, АД — 190/110 мм рт.ст. Живот мягкий, значительно увеличен в объеме за счет подкожной жировой клетчатки. Пальпируется грыжа белой линии живота. Пальпация печени затруднена, перкуторно +2 см ниже реберной дуги. Симптом Пастернацкого отрицателен с обеих сторон.
/39-1.gif)
/39-2.gif)
Общий анализ крови: Нb — 125 г/л, эритроциты — 4,7 × 1012/л, лейкоциты — 7,9 × 109/л, тромбоциты — 311 × 109/л, палочкоядерные — 4 %, сегментоядерные — 68 %, эозинофилы — 2 %, лимфоциты — 17 %, моноциты — 9 %, скорость оседания эритроцитов —24 мм/час.
Биохимический анализ крови выявил стойкое повышение уровня мочевой кислоты до 464,8 мкмоль/л (7,8 мг/дл), а также повышение концентрации глюкозы до 8,6 ммоль/л. Креатинин — 100 мкмоль/л, мочевина — 7,6 ммоль/л, ревматоидный фактор — отрицательный, С-реактивный белок — 24 мг/дл, функциональные пробы печени без изменений.
На рентгенограмме стоп выявлены грубые нарушения структуры мелких суставов с множественными суставно-перисуставными тофусами (рис. 3).
На рентгенограмме стоп в прямой проекции определяются проявления локального остеопороза; в костях плюсны, головках плюсневых костей, особенно I пальцев визуализируются множественные участки про–светления — симптом «пробойника»(внутрикостные тофусы) различного диаметра, наиболее крупные — 5 мм, подвывихи во всех пястно-фаланговых суставах. Головки плюсневых костей стоп деформированы, деструктивно изменены, с разрушением эпифизов смежных костей, множественными участками просветления (тофусами). На уровне I плюснефаланговых суставов с обеих сторон выявляются уплотнения периартикулярных мягких тканей (периартикулярные тофусы). Подобные изменения также отмечаются в меньшей степени на уровне проксимальных и дистальных межфаланговых суставов.
Заключение: рентгенологические признаки соответствуют подагрическому полиартриту стоп, стадия III, с множественными эрозиями суставных поверхностей, суставно-перисуставными тофусами, с развитием подвывихов в плюснефаланговых суставах.
Пациенту был установлен диагноз: подагра, смешанный тип, тяжелое течение. Хронический тофусный артрит в стадии обострения. Хронический подагрический артрит II. Множественные тофусы (подкожные, в области ушных раковин, суставов, внутрикостные). Сахарный диабет 2-го типа, индуцированный ГК, средней тяжести, субкомпенсированный. Медикаментозный синдром Кушинга. Симптоматическая артериальная гипертензия, II стадия, III ст., высокий дополнительный риск. Сердечная недостаточность IIА.
Учитывая тяжелое течение подагры, наличие множественных тофусов, длительную глюкокортикоидную терапию, приведшую к формированию ятрогенного синдрома Кушинга и сахарного диабета, высокие показатели АД, а также определенный негативизм пациента к установленному диагнозу, необходимости модификации способа жизни и проведению постоянного лечения, назначение адекватной терапии представляло определенные трудности. Пациенту было предложено применение фебуксостата в дозе 80 мг в сутки с контролем уровня мочевой кислоты через 2 нед. и возможным повышением дозы фебуксостата до 120 мг/сут. Пациенту указано на необходимость достижения целевого уровня мочевой кислоты для контроля течения подагры. С пациентом также была проведена беседа о необходимости снижения дозы преднизолона с полным прекращением его приема. Была произведена замена преднизолона 20 мг на метилпреднизолон в дозе 16 мг с постепенным снижением на 1–2 мг в 10–14-й день до полной отмены. Для коррекции сахарного диабета стартово назначен метформин в дозе 850 мг 2 раза в день под контролем глюкозы крови. Для коррекции артериальной гипертензии предложены лозартан в дозе 100 мг/сут и лерканидипин 10 мг/сут. Учитывая необходимость применения противовоспалительной терапии, был назначен нимесулид 200 мг/сут. Были также даны четкие рекомендации по модификации образа жизни и гастрономическим предпочтениям.
Данное наблюдение, по нашему мнению, наглядно демонстрирует недостатки в лечении подагры, существующие в клинической практике.
1. Пациент не обратился за медицинской помощью при первом остром приступе подагры, что привело к отсутствию определения нозологической принадлежности суставного синдрома и патогенетической терапии.
Несмотря на то, что диагностика подагры может быть сопряжена с существенными трудностями, она базируется прежде всего на знании особенностей клинических проявлений заболевания [1]. Так, отличительной чертой острого подагрического артрита являются внезапное, острое начало с выраженной болью и воспалением, достигающими максимума в течение нескольких часов, сопровождающимися яркой эритемой, а затем быстрая регрессия артрита (в пределах 2 нед.). Эти признаки в сочетании с поражением I плюснефалангового сустава и гиперурикемией, в соответствии с современными рекомендациями [10], позволяют установить предварительный диагноз по–дагры. Возможно, что обращение пациента к терапевту/семейному врачу/ревматологу при первом остром приступе способствовало бы ранней постановке диагноза подагры.
2. Длительное бесконтрольное и необоснованное применение глюкокортикоидов, которое привело к развитию ятрогенных осложнений: метаболических нарушений, артериальной гипертензии и сахарного диабета. Следует отметить, что ГК назначаются при подагрическом артрите только для купирования острого приступа и при отсутствии эффекта от нестероидных противовоспалительных препаратов [6, 10].
3. Применение комбинированных гипотензивных препаратов, содержащих тиазидные диуретики, для лечения неосложненной гипертонии и вызывающих усугубление гиперурикемии. Кардиологом была назначена комбинированная антигипертензивная терапия с диуретиком без учета сопутствующих заболеваний, что привело к усугублению течения подагры. В данном случае относительно позитивным моментом является факт нерегулярного приема диуретика пациентом и отсутствие приверженности к назначенному лечению. При этом ассоциация между приемом диуретиков и развитием подагры в клинической медицине известна с 1958 г. из работ В. Oren и соавторов [11]. Впервые этот эффект был отмечен для тиазидных диуретикив, позже — и для петлевых [9]. Механизмы задержки мочевой кислоты почками при применении диуретиков хорошо изучены. Уменьшение объема циркулирующей плазмы крови путем применения мочегонных препаратов приводит к усилению канальцевой реабсорбции мочевой кислоты, а также к снижению ее фильтрации. При гиперурикемии, связанной с приемом диуретиков, имеет значение и снижение секреции мочевой кислоты. Косвенные зависимости между натрием и уратами чрезвычайно важны с клинических позиций, поскольку гиповолемия (частично из-за повышения продукции ангиотензина II) ассоциируется с соответствующим ростом реабсорбции натрия в проксимальных канальцах [3].
4. Применение высокой дозы аллопуринола в момент острого приступа подагрического артрита. Несмотря на то, что участковый терапевт разобралась в ситуации и впервые установила диагноз подагры, назначение аллопуринола в стартовой дозе 300 мг/сут в момент острого приступа подагры без обеспечения адекватной противовоспалительной терапии, безусловно, привело к обострению артрита и самостоятельной отмене пациентом этого важного препарата. Обычно гипоурикемическую терапию начинают не ранее 1–2 недель после того, как острый приступ был полностью купирован. При первичном назначении уратснижающих препаратов или в случае увеличения дозы вследствие снижения уровня уратов в организме наблюдается учащение острых приступов подагры, так называемая мобилизация острых приступов подагры. Триггерным фактором для развития острого подагрического артрита являются колебания концентрации уратов в крови. Поэтому начинать уратснижающую терапию необходимо с малых доз препаратов (с 50 или 100 мг для аллопуринола и 40 мг для фебуксостата) и медленно их наращивать до максимально эффективных (start low, go slow). Знание рекомендаций при назначении аллопуринола и четкое следование им, мониторирование побочных эффектов, параметров активности подагры, уровня мочевой кислоты в крови, подбор наиболее оптимальной дозы методом титрования при долгосрочной гипоурикемической терапии позволило бы добиться снижения активности подагры [5].
5. Отсутствие длительной и непрерывной уратснижающей терапии как базовой терапии подагрического артрита. Аллопуринол — это препарат, предназначенный для длительной уратснижающей терапии; его следует стартово назначать в низкой дозе (например, 100 мг ежедневно, при почечной недостаточности — 50 мг ежедневно) и повышать на 100 мг каждые 2–4 недели до 800 мг в сутки при необходимости до достижения целевых уровней мочевой кислоты [10]. Инициировать уратснижающую терапию следует как можно раньше: согласно современным рекомендациям ее целесообразно начинать уже после двух приступов острого артрита в течение одного года. Аллопуринол является наиболее назначаемым препаратом, учитывая его высокую эффективность независимо от причин гиперурикемии, относительную безопасность, невысокую стоимость и доступность. Однако побочные эффекты и часто невозможность достичь максимальной суточной дозы (800 мг/сут) для достижения целевых уровней мочевой кислоты несколько ограничивают его применение в клинической практике. Фебуксостат — новый урикостатический препарат, селективный ингибитор ксантиноксидазы. В отличие от аллопуринола фебуксостат имеет структуру пуринов, но является непуриновым аналогом, смешанным ингибитором ксантиноксидазы. Полагают, что именно это делает возможным его применение у пациентов с гиперчувствительностью к аллопуринолу. Фебуксостат сегодня рассматривают как удачную альтернативу аллопуринолу. Его преимущества заключаются в возможности назначения пациентам с почечной недостаточностью, при непереносимости аллопуринола или рефрактерности к нему, невозможности достичь целевого уровня мочевой кислоты, а также одноразовый прием (80 или 120 мг). Учитывая негативный опыт применения аллопуринола нашим пациентом, необходимость быстрого достижения целевого уровня мочевой кислоты и более жесткого контроля данного показателя, пациенту был назначен фебуксостат. Одноразовый прием, надеемся, также повысит приверженность к терапии.
Таким образом, в современных условиях подагра остается важной проблемой клинической медицины и требует широких образовательных мероприятий как среди пациентов, так и среди врачей первичного звена. Образование больного в отношении необходимости отказа от систематического приема алкоголя и соблюдения диеты, позволяющей контролировать или снижать избыточную массу тела. Необходимо также помнить, что НПВП являются препаратами первой линии в лечении острого или обострении хронического подагрического артрита. Подбор собственно уратснижающей терапии должен начинаться с небольших доз в режиме титрования до достижения целевых цифр мочевой кислоты, которыми в случае тяжелой тофусной подагры (как у данного представленного пациента) являются 5 мг/дл. Это позволит как избежать побочных эффектов, так и минимизировать дозу, при которой удастся достичь нормоурикемии. В то же время только своевременная диагностика и адекватная терапия могут существенно улучшить состояние и прогноз этой категории больных.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.

/39-1.gif)
/39-2.gif)
/40-1.gif)