Хотя в фундаментальной науке иммуноглобулины описаны прежде всего как противомикробные факторы, а в клинической медицине препарат иммуноглобулина впервые был использован для лечения гуморального иммунодефицита, на сегодняшний день иммуноглобулинотерапия наиболее часто применяется именно при аутоиммунных заболеваниях человека, причем поражения периферической нервной системы лидируют в перечне причин назначения этого вида иммунотерапии в мировой практике. Действительно, такие заболевания, как синдром Гийена — Барре, хроническая воспалительная демиелинизирующая полинейропатия и мультифокальная моторная невропатия, являются высокочувствительными к препаратам в/в иммуноглобулина (ВИГ), а обоснованность назначения иммунотерапии в таких случаях соответствует наивысшему уровню доказательности А благодаря результатам специально спланированных рандомизированных клинических исследований. Это означает, что в/в иммуноглобулин является препаратом первой линии терапии аутоиммунных заболеваний периферической нервной системы человека и должен быть компонентом рутинной клинической практики в таких случаях. Аутоиммунные нейропатии являются исключениями из общих правил ведения аутоиммунитета, так как в/в иммуноглобулин превышает по эффективности стероиды и цитостатики, традиционно назначаемые при аутоиммунных болезнях человека. Помимо этого, иммуноглобулинотерапия — сравнительно безопасная стратегия, которая имеет безоговорочно лучший профиль переносимости, чем конкурентные иммуносупрессивные препараты и эфферентные методы лечения. В/в иммуноглобулин может быть назначен маленьким детям, включая новорожденных [3], беременным на любом сроке гестации и пожилым пациентам с признаками почечной недостаточности. В довершение следует отметить, что иммунотерапия может иметь дополнительные преимущества при аутоиммунных заболеваниях человека, например подавляет оппортунистические инфекции, которые выступают триггерами аутоагрессии, или компенсирует гуморальные иммунодефициты, нередко являющиеся причиной развития аутоиммунной реакции.
В данной статье приведены доказательства эффективности и безопасности в/в иммуноглобулина при аутоиммунных поражениях периферической нервной системы как на основании рекомендаций экспертов EFNS, регламентирующих применение иммуноглобулинотерапии в неврологии в странах Европейского cоюза [16], так и результатов новых клинических исследований, проведенных после 2008 года, когда были опубликованы указанные рекомендации.
Механизм развития аутоиммунных заболеваний периферической нервной системы
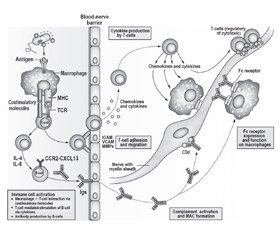
Установлено, что аутоиммунные невропатии обусловлены ошибочной продукцией аутоантител и аутореактивных лимфоцитов против антигенов периферических нервных волокон, преимущественно — ганглиозидов [31] и галактоцереброзидов [50]. Можно выделить экстра- и интрацеребральные этапы механизма развития болезни. Первый этап, реализующийся в периферических иммунных органах, включает в себя сенсибилизацию и собственно формирование аутоиммунной реакции. При этом происходит фагоцитоз антигена триггера, обладающего свойством молекулярной мимикрии с аутоантигенами нервной ткани, переработка этого антигена в фагоците и презентация иммуногенного пептида специфическому Т-хелперу, а затем подбор при помощи примированного Т-хелпера специфических В-лимфоцитов и цитотоксических Т-клеток. Обычно аномальная сенсибилизация к аутоантигенам происходит в иммуноскомпрометированном организме — у пациентов с первичными и вторичными иммунодефицитами, включая общий вариабельный иммунодефицит, изолированный дефицит субклассов IgG и метамизол-индуцированный агранулоцитоз [9]. Второй этап происходит в периферических нервах, куда устремляются, форсируя гематоэнцефалический барьер, сформированные в иммунных органах аутореактивные лимфоциты и аутоантитела. Нервные волокна повреждаются при помощи трех основных механизмов: активации комплемента по классическому пути с формированием мембранатакующих комплексов, антителозависимой клеточно-опосредованной цитотоксичности, при которой эффекторными клетками выступают макрофаги, нейтрофилы и естественные киллеры, и иммунной клеточной цитотоксичности, опосредованной специфическими СD8+ Т-лимфоцитами. Расположение антигена-мишени определяет тип невропатии. Так, при атаке на ганглиозиды перехватов Ранвье формируется преимущественно аксональный тип поражения, характеризующийся большей тяжестью моторного дефицита и менее благоприятным прогнозом. Напротив, при сенсибилизации к основному белку миелина периферических нервов развивается преимущественно демиелинизирующий тип поражения с большим удельным весом сенсорных нарушений и лучшим прогнозом патологического процесса [59] (рис. 1).
/36-1.jpg)
Механизм терапевтического эффекта внутривенного иммуноглобулина при аутоиммунных поражениях периферической нервной системы
Эффективность ВИГ связывают со способностью к подавлению аутоиммунной реакции, лежащей в основе поражения нервных волокон при периферических невропатиях (рис. 2). Хотя могут быть и более глубокие терапевтические эффекты, такие как нейтрализация триггера аутоиммунитета и компенсация причинного гуморального иммунодефицита, ответственного за срыв иммунной толерантности к аутоантигенам и утрату контроля над триггером.
Известно, что ВИГ способен подавлять аутоиммунную реакцию как на экстра-, так и на интрацеребральном этапе патологического процесса, однако эти эффекты реализуются при различных дозах препарата. Если экстрацеребральную аутоиммунную реакцию можно подавить при помощи средних доз препарата (600–1000 мг/кг/мес), то для угнетения иммунного воспаления в нервных волокнах необходимо использование высокой дозы иммуноглобулина (2 г/кг/мес), что связано прежде всего с ограничением биодоступности в связи с наличием гематоэнцефалического барьера.
ВИГ нейтрализует аутоантитела, циркулирующие в сыворотке крови и лимфе, при помощи антиидиотипических иммуноглобулинов, находящихся в препарате. Помимо этого, при посредстве влияния на Fc-рецепторы осуществляется снижение активности аутореактивных В-лимфоцитов и связанное с этим ослабление продукции аутоантител. Параллельно подавляется функциональная активность аутореактивных Т-лимфоцитов путем нейтрализации поверхностной молекулы LFA-1 [35]. Кроме этого, M.S. Maddur с соавт. показали, что ВИГ обеспечивает реципрокную регуляцию активности Th1/Th17 и регуляторных СD4+CD25+ Т-лимфоцитов, способствуя подавлению аутоиммунной реакции при синдроме Гийена — Барре [41].
В нервной ткани ВИГ угнетает все три основных механизма аутоповреждения нервных волокон: ингибирует каскад комплемента, уменьшая выработку мембран-атакующих комплексов, вызывает сатурацию Fc-рецепторов макрофагов, нейтрофилов и естественных киллеров, задействованных в реакциях антителозависимой цитотоксичности, и снижает цитотоксический потенциал эффекторных СD8+ Т-лимфоцитов путем вмешательства в систему индукции апоптоза Fas:FasL [27].
Все эти особенности определяют фазность иммунотерапии при аутоиммунных заболеваниях периферической нервной системы. Поначалу, в фазу насыщения, которая в среднем продолжается от 1 до 3 мес., назначают высокую дозу ВИГ не только для подавления аутоиммунной реакции в экстрацеребральном компартменте, но и для устранения иммунного воспаления в нервной ткани. Затем, в фазу поддерживающей терапии, когда воспаление в нервной ткани почти отсутствует, дозу препарата постепенно снижают до среднего, а иногда и низкого уровня (200–400 мг/кг/мес), поскольку сохраняется необходимость подавления лишь экстрацеребрального патологического процесса в иммунных органах.
Синдром Гийена — Барре
Предложенная аутоиммунная этиология синдрома Гийена — Барре привела к внедрению иммунотерапии. До еe введения 10 % пациентов умирали, а у 20 % развивались серьезные физические недостатки [67]. Обмен плазмы, или плазмаферез, был представлен как эффективный метод лечения в 1978 году. Существенные преимущества такой терапии продемонстрированы в рандомизированном исследовании, результаты которого опубликованы в 1985 году [52]. Этот терапевтический подход стал золотым стандартом по сравнению с другими методами лечения [12]. Внутривенный иммуноглобулин был предложен для лечения синдрома Гийена — Барре в 1988 году [33]. А уже в 1992-м первое рандомизированное клиническое исследование, сравнивающее ВИГ и плазмаферез, показало сходные эффекты терапии [58]. В пяти последующих контролируемых исследованиях, включающих 582 участника, улучшение по шкале степени инвалидности при применении ВИГ было аналогично таковому при плазмаферезе (WMD 20,02; 95% ДИ 20,25–0,20) [13, 46, 47, 58]. Эффективность ВИГ показали у пациентов с синдромом Гийена — Барре, которые были не в состоянии ходить без посторонней помощи (оценка инвалидности GBS > 3), при назначении ВИГ в течение 2 недель после появления первых симптомов мышечной слабости. Результаты клинических исследований показывают, что плазмаферез эффективен при применении у пациентов с менее тяжелым течением [48] и у пациентов, которые начинают лечение в течение первых 4 недель от начала болезни [52]. Эффективность при отсроченном назначении не была исследована в работах по лечению иммуноглобулином. Хотя плазмаферез чаще прекращался из-за побочных эффектов, по другим результатам значительной разницы между ВИГ и обменом плазмы не было отмечено [46]. В одном клиническом исследовании, сравнивающем только плазмаферез с комбинированным лечением с применением плазмафереза и ВИГ, у 128 пациентов, проходивших комбинированную терапию, не отмечалось достоверного дополнительного преимущества после 4 недель лечения по сравнению со 121 пациентом, которым проводили только обмен плазмы [47]. У детей, которые, возможно, имеют лучший прогноз синдрома Гийена — Барре, чем взрослые, ограниченные данные трех открытых клинических исследований показывают, что ВИГ ускоряет восстановление по сравнению только с одной поддерживающей терапией [21, 34, 66]. Это заключение поддерживается результатами наблюдательного клинического исследования хорошего качества [32]. В недавнем исследовании сообщалось о возможном незначительном кратковременном преимуществе комбинированного введения внутривенного метилпреднизолона в высокой дозе и ВИГ у детей с синдромом Гийена — Барре [3, 61]. Значение этих результатов широко обсуждалось [25]. Сравнение ВИГ и плазмафереза не показало разницы в долгосрочных результатах. Ни ВИГ, ни обмен плазмы, ни любое другое лечение достоверно не снижают летальности, которая варьирует от 5 до 15 % по результатам популяционных исследований [28].
По дозировке ВИГ доступна ограниченная информация. Обычно препарат вводится в режиме 0,4 г/кг/сутки в течение 5 последовательных дней. Во французском исследовании введение препарата на протяжении 3 дней по 0,4 г/кг в сутки было недостоверно менее эффективным, чем 6 дней по 0,4 г/кг в день [48]. В ретроспективных исследованиях пациенты с антителами к ганглиозидам Gm1 или Gm1b, получавшие ВИГ, восстанавливались быстрее, чем пациенты, которым проводился плазмаферез [31, 37, 69]. Не существует доказательств преимущества назначения ВИГ в дозе 2 г/кг за 2 или 5 дней. Имеется несколько признаков того, что введение препарата за 2 дня может привести к рецидиву болезни у большей доли пациентов [34]. Также недостает информации о том, как лечить пациентов, которые не реагируют на ВИГ или обмен плазмы. Обычной практикой для пациентов с рецидивом, поначалу ответивших стабилизацией или регрессом клинических симптомов, является повторное назначение ВИГ в дозе 2 г/кг на протяжении 2–5 дней или плазмафереза. Есть некоторые данные, указывающие на то, что при рецидиве через 9 недель у пациента, скорее всего, был острый дебют хронической воспалительной демиелинизирующей полинейропатии, а не синдром Гийена — Барре [49]. В некоторых центрах пациентов лечат повторно, если не удается добиться улучшения через 2 или 3 недели, но доказательств легитимности этой практики недостаточно [28]. Необходимо ли пациентам с легкой формой синдрома Гийена — Барре (способным передвигаться без посторонней помощи) или синдромом Миллера — Фишера назначать ВИГ — пока точно не известно. Нет также доказательств того, что второй курс ВИГ приводит к восстановлению неврологических функций у больных, проявивших устойчивость к первому курсу терапии. Тем не менее A. Chaudhary с соавт. описали синдром Миллера — Фишера у 45-летней женщины, который имитировал острый сфеноидит и полностью разрешился на фоне применения ВИГ [8]. I.V. Yepishin с соавт. также указали на полное устранение проявлений синдрома Миллера — Фишера, диагноз которого был подтвержден при помощи выявления антиганглиозидных анти-GQ1b-антител, после введения ВИГ в дозе 2 г/кг [68]. K. Shinoda с соавт. привели данные истории болезни 26-летней пациентки с одномоментным развитием синдрома Фишера и фарингоцервикобрахиальной формы синдрома Гийена — Барре, у которой отмечались антитела к ганглиозидам GT1a и GQ1b, а также к галактоцереброзидам. ВИГ был эффективен в устранении офтальмоплегии и атаксии, но не влиял на двусторонний парез лицевых нервов и слабость брахиальной мускулатуры, поэтому был добавлен в/в метилпреднизолон, который помог разрешить оставшиеся симптомы [50]. Тем не менее P. Kumar с соавт. доложили о полном устранении двусторонней плегии лицевой мускулатуры как проявления синдрома Гийена — Барре после одного курса ВИГ [36].
В сравнительном клиническом исследовании B. Charra с соавт. показано преимущество ВИГ перед плазмаферезом в эффективности лечения острой демиелинизирующей полирадикулоневропатии [7], хотя также проведены другие исследования, демонстрирующие превосходство плазмафереза или одинаковую эффективность обеих терапевтических стратегий, поэтому за последнее время не изменились классические представления о клинической равнозначности ВИГ и плазмафереза при синдроме Гийена — Барре у людей.
Несколько исследований были посвящены поиску биомаркеров, при помощи которых можно прогнозировать чувствительность к иммунотерапии у пациентов с синдромом Гийена — Барре. Установлено, что гипоальбуминемия после введения ВИГ является неблагоприятным фактором, указывающим на потенциальную резистентность к препарату и связанным с плохим восстановлением мышечной силы и смертностью [19]. В другом контролируемом клиническом исследовании показано, что степень повышения сывороточной концентрации молекул IgG после инфузии ВИГ прямо коррелирует с положительной клинической динамикой у пациентов с синдромом Гийена — Барре, и те пациенты, у которых отмечается незначительная гипериммуноглобулинемия, хуже отвечают на ВИГ, чем лица с выраженным повышением содержания IgG в сыворотке крови [60]. Также показано, что профиль N-гликозилирования Fс-фрагментов эндогенных молекул IgG у пациентов с синдромом Гийена — Барре связан с чувствительностью к ВИГ [18]. По-видимому, эти три биомаркера можно использовать для прогнозирования ответа на ВИГ у пациентов с синдромом Гийена — Барре с целью рационального планирования терапевтических вмешательств, хотя по всем трем пунктам необходимы дополнительные исследования для валидации.
Хроническая воспалительная демиелинизирующая полирадикулонейропатия
До 2008 года было выполнено семь рандомизированных контролируемых клинических исследований по типу «случай — контроль» по применению ВИГ при хронической воспалительной демиелинизирующей полинейропатии, включающих 284 пациента, на основании чего был создан кокрановский систематический обзор [15, 22, 30, 42, 53, 63, 64]. Четыре клинических исследования сравнили дозу 2 г/кг ВИГ [22, 30, 42, 53, 64] на протяжении 2 или 5 дней с плацебо, одно — ВИГ с 6-недельным курсом перорального преднизолона в дозе от 60 до 10 мг ежедневно [29] и еще одно — ВИГ в дозе 1,8 г/кг курсом 6 недель с плазмаферезом, выполняемым дважды в неделю в течение 3 недель, а затем один раз в 7 дней в течение еще 3 недель [15]. Исследования показали различные результаты, что затрудняет выработку обобщенных рекомендаций. Метаанализ пяти плацебо-контролируемых рандомизированных клинических исследований, включающих 232 пациента, показал, что ВИГ приводит к достоверному устранению признаков инвалидности на срок 2–6 недель с относительной выгодой на уровне 2,0 (95% ДИ 1,48–2,71; признак класса I) [63]. Два перекрестных клинических исследования, сравнивающие плазмаферез с ВИГ и преднизолон с ВИГ, не показали достоверных различий в кратковременной перспективе, но выборки были слишком малыми для установления эквивалентности [63]. В обоих исследованиях были также другие методологические проблемы. Однако существует много наблюдательных исследований, сообщающих о благоприятном воздействии кортикостероидов, кроме случаев чисто моторной полинейропатии, при которой эти препараты оказывают неблагоприятное воздействие (достоверность III и IV уровня) [14, 26]. Нет доказательств, касающихся преимуществ различных лечебных подходов при хронической воспалительной демиелинизирующей полинейропатии, кроме тяжелых двигательных форм [26]. Долгосрочные эффекты иммунотерапии оценивались в самом большом исследовании, в котором участвовало 117 пациентов [30]. Начальная доза ВИГ составляла 2 г/кг, затем переходили на поддерживающую дозу 1 г/кг каждые 3 недели. После 24 недель лечения основное изменение начальной инвалидности составило 1,1 (SD 1,8) в группе лечения ВИГ и всего 0,3 (SD 1,3) в группе плацебо (разница взвешенной средней величины 0,8; 95% ДИ 1,37–0,23). Во второй части исследования, после того как пациенты были повторно рандомизированы по ВИГ и плацебо, также был установлен подобный эффект. Длительное открытое проспективное исследование, включающее 84 пациента с хронической воспалительной демиелинизирующей полинейропатией, получавших ВИГ, продемонстрировало достижение ремиссии в большинстве случаев. Семьдесят три пациента (87 %) нуждались по крайней мере в двух курсах терапии. Средняя длительность ремиссии составила 2,1 года, однако 10 % пациентов нуждались в получении ВИГ на протяжении более 8,7 года [60].
На основании этих данных эксперты EFNS рекомендуют ВИГ как средство первой линии терапии при хронической воспалительной демиелинизирующей полинейропатии у людей. Хотя у ВИГ доказательная база лучше (А), чем у глюкокортикостероидов (В), однако преимущество при легких формах болезни отдается именно стероидам, исходя из финансовых соображений, за исключением чисто моторных форм полинейропатии [16].
Результаты исследований последних лет укрепили позиции ВИГ как высокоэффективного средства терапии хронической воспалительной демиелинизирующей полинейропатии у людей.
Совсем недавно E. Nobile-Orazio с соавт. провели сравнительное контролируемое клиническое исследование терапии при помощи ВИГ и метилпреднизолона при хронической воспалительной демиелинизирующей полинейропатии. 24 пациента получали ВИГ в дозе 0,5 г/кг на протяжении 5 дней, а 21 — внутривенный метилпреднизолон в дозе 0,5 г/сутки 4 дня. Курсы терапии повторялись ежемесячно на протяжении полугода. Убедительно продемонстрировано преимущество ВИГ перед стероидом. Препарат оказался гораздо эффективнее и безопаснее, чем метилпреднизолон. Единственным преимуществом стероида являлась более низкая стоимость лечения [45]. В другом сравнительном контролируемом клиническом исследовании показаны сходные клинические эффекты 6-месячных курсов ВИГ и метилпреднизолона в отношении отдаленных рецидивов хронической воспалительной демиелинизирующей полинейропатии. Хотя подобные обострения встречались несколько позже после резкого прекращения 6-месячной пульс-терапии метилпреднизолоном (5 последовательных дней в месяц по 1000 мг/сутки), чем после аналогичной по длительности в/в иммуноглобулинотерапии (5 последовательных дней в месяц по 400 мг/кг/сутки), переносимость лечения была однозначно лучше в группе иммунотерапии [44].
Результаты исследования F. Gallia с соавт. не показали различий в клинических исходах после применения ВИГ различных мировых брендов при хронической воспалительной демиелинизирующей полинейропатии, равно как и при мультифокальной моторной нейропатии, хотя ранее имелись опасения насчет неодинаковой эффективности ВИГ разных производителей при аутоиммунных поражениях периферической нервной системы у людей [20].
В плацебо-контролируемом рандомизированном клиническом исследовании N. Latov с соавт. изучали сроки наступления терапевтического эффекта после назначения ВИГ у пациентов с хронической воспалительной демиелинизирующей полинейропатией. Показано, что достаточный инициальный эффект наступает только после 2 курсов высокодозовой иммунотерапии, разделенных промежутком в 3 недели, однако для достижения полноценного клинического результата необходимо дальнейшее проведение поддерживающей терапии в дозе 1 г/кг/мес на протяжении нескольких месяцев [38].
Многоочаговая моторная нейропатия
Существует мало эффективных методов лечения многоочаговой моторной нейропатии. Эта болезнь обычно не отвечает на стероиды или плазмаферез, и у пациентов может отмечаться ухудшение состояния при прохождении такого лечения [6, 11, 43, 56]. Эффективность ВИГ была продемонстрирована многими открытыми неконтролируемыми исследованиями; в 94 сообщениях о клинических случаях (487 пациентов с мультифокальной моторной нейропатией), опубликованных в промежутке между 1990 и 2004 годом, уменьшение симптомов мышечной слабости было отмечено в 81 % случаев, а купирование признаков инвалидности — в 74 % (доказательный уровень IV) [57, 62]. Были выполнены четыре рандомизированных контролируемых клинических исследования, посвященные ВИГ при мультифокальной моторной нейропатии [4, 17, 19, 55]. Эти исследования охватывают лишь 45 пациентов, так как указанная патология встречается редко. Тридцати четырем пациентам рандомизированно назначили ВИГ или плацебо, на основании чего был получен кокрановский систематический обзор [63]. Показана тенденция к выздоровлению под влиянием ВИГ, которая, однако, не была выраженной (P = 0,08). ВИГ превосходил плацебо в стимулировании нарастания мышечной силы, и этот эффект был значительным (р = 0,0005; NNT 1,4; 95% ДИ = 1,1–1,8) (уровень доказательности I). Поскольку слабость — единственный определяющий фактор инвалидности при мультифокальной моторной нейропатии, следует ожидать, что у тех пациентов, чья мышечная сила нарастает под воздействием ВИГ, инвалидность будет устранена. Повышенная концентрация антител против Gm1 и выявленные при электронейромиографии (ЭНМГ) блоки проведения коррелируют с положительной реакцией на ВИГ (уровень доказательности IV) [57]. Приблизительно у трети пациентов на фоне ВИГ достигается длительная ремиссия (> 12 месяцев); половина пациентов нуждается в повторных курсах ВИГ, а половина из них — в дополнительном иммунодепрессивном лечении [39]. Эффект ВИГ снижается во время длительного лечения, даже при увеличении дозы, вероятно из-за продолжающейся аксональной дегенерации [51, 54]. Однако в одном ретроспективном исследовании при лечении препаратами ВИГ в высокой дозе (1,6–2,0 г/кг на протяжении 4–5 дней) вызванная иммунотерапией реиннервация сокращала число блоков проведения и предотвращала аксональную дегенерацию у 10 пациентов с мультифокальной моторной нейропатией при получении ВИГ в течение 12 лет [65].
На основании этих данных эксперты EFNS позиционируют иммуноглобулинотерапию как единственный метод лечения мультифокальной моторной нейропатии с доказанной эффективностью и уровнем доказательности А [16].
Результаты новых клинических исследований укрепляют позиции ВИГ как высокоэффективного средства терапии этой редкой болезни нервной системы.
A.F. Hahn с соавт. провели двойное слепое плацебо-контролируемое клиническое исследование эффективности в/в иммуноглобулинотерапии при многоочаговой моторной нейропатии с участием 44 пациентов. ВИГ использовали в высокой дозе на протяжении 12 недель. Показано, что в группе плацебо сила мышц в конечностях снизилась на 31,38 %, а среди пациентов, получавших ВИГ, — увеличилась на 3,75 % (p = 0,005). В 35,7 % случаев в группе плацебо отмечалось снижение силы в руках по шкале Guy’s Neurological Disability, однако такая ситуация не наблюдалась на фоне приема ВИГ (p = 0,021). В 69 % случаев в связи с резким ухудшением состояния приходилось досрочно переводить пациентов из группы плацебо в открытую группу приема ВИГ, в то время как «расслепление» среди пациентов, получавших иммунотерапию, вынужденно произвели лишь в 2,4 % случаев (p < 0,001). Авторы засвидетельствовали, что ВИГ эффективно сохраняет и наращивает мышечную силу и замедляет темп утраты дееспособности у пациентов с мультифокальной моторной нейропатией, являясь безопасной терапевтической стратегией [23].
A. Baumann с соавт. провели проспективное кли–ническое исследование, посвященное изучению эффекта повышения дозы ВИГ при мультифокальной моторной нейропатии у людей. Дозу препарата постепенно увеличивали с 0,5 до 1–2 г/кг/мес на протяжении полугода наблюдения. Отчетливо показано улучшение клинического эффекта, состоящее в возрастании мышечной силы по мере увеличения дозы ВИГ. Клинический прогресс зависел не столько от уровня исходной дозы препарата, сколько от прироста дозы ВИГ за последний месяц, причем лучший эффект получен у пациентов с меньшей длительностью болезни [5].
T. Harbo с соавт. провели двойное слепое плацебо-контролируемое рандомизированное перекрестное клиническое исследование, посвященное сравнению эффективности и переносимости препаратов в/в и подкожного нормального иммуноглобулина человека при многоочаговой моторной нейропатии у людей. Препараты показали одинаковую клиническую эффективность при хорошей переносимости. Сила мышц возросла на 3,6 % при применении подкожного иммуноглобулина (95% ДИ от –3,6 до 10,9 %) и на 4,3 % после введения в/в аналога (от –1,3 до 10,0 %; р = 0,86). Одинаковой была и динамика балльной оценки по шкалам качества жизни [24].
Почему внутривенный иммуноглобулин более эффективен при аутоиммунных поражениях периферической нервной системы, чем стероиды и цитостатики?
Принципиально важным является концептуальный вопрос о причинах преимущества ВИГ по клинической эффективности перед традиционно используемыми в лечении аутоиммунных заболеваний глюкокортикостероидами и цитостатиками при аутоиммунных поражениях периферической нервной системы. Биодоступность препарата при ревматических заболеваниях однозначно выше, чем при неврологической патологии, однако клинический эффект ВИГ парадоксально сильнее именно при вовлечении нервной ткани. Различия в эффективности ВИГ при рассеянном склерозе и синдроме Гийена — Барре действительно можно в определенной мере объяснить неодинаковой проницаемостью гематоэнцефалического барьера в центральной и периферической нервной системе. Природа антигенов-мишеней также может иметь значение для неоднородности клинической эффективности. Антиганглиозидный иммунный ответ, по-видимому, более чувствителен к иммунотерапии, нежели иммунная реакция, к центральному основному белку миелина или миелин-ассоциированному гликопротеину. Недавно G. Zhang с соавт. показали, что специализированные молекулы IgG ВИГ очень эффективно подавляют антителозависимое иммунное воспаление, опосредованное именно антиганглиозидными иммуноглобулинами [70]. Помимо этого, могут иметь значение различия в патогенезе болезней. ВИГ более эффективен при аутоиммунитете, опосредованном гуморальной иммунной реакцией и связанной с этим комплементзависимой аутоагрессией, чем при клеточном аутоиммунном процессе. При аутоиммунных поражениях периферической нервной системы удельный вес гуморального аутоиммунитета в патогенезе болезни гораздо больше, чем при вовлечении ЦНС и при многих ревматических заболеваниях. В структуре самого гуморального аутоиммунитета можно выделить IgМ- и IgG-опосредованные реакции. Мировой опыт иммуноглобулинотерапии показывает, что ВИГ лучше помогает именно при IgМ-индуцированной аутоагрессии. По-видимому, это связано с более сильным вовлечением системы комплемента в таких случаях. Аутоиммунные болезни периферической нервной системы характеризуются активным участием IgМ-опосредованных иммунных реакций в патогенезе, что может предоставить дополнительное объяснение преимущества ВИГ в таких случаях. Кроме этого, B. Ciric с соавт. продемонстрировали прямое стимулирующее воздействие ВИГ на шванновские клетки периферических нервов, независимое от иммуномодуляции, чем объяснили непосредственный ремиелинизирующий эффект препарата [10]. Действительно, синергические эффекты иммуномодуляции и ремиелинизации могут обеспечить преимущество ВИГ перед стероидами и цитостатиками, применение которых, напротив, сопряжено с некоторой дистрофией миелина. Объяснение различий можно получить и при изучении иммунного статуса у таких пациентов. Из учения о первичных иммунодефицитах известно, что аутоиммунные нейропатии чаще формируются именно при гуморальных иммунодефицитах, а рассеянный склероз — при клеточных иммунных дисфункциях [2]. В сравнительном клиническом исследовании проанализировано состояние иммунитета у пациентов с синдромом Гийена — Барре и хронической воспалительной полинейропатией, которые хорошо отвечают на ВИГ, и у лиц, страдающих системной красной волчанкой и васкулитом, ассоциированным с антинейтрофильными антителами, у которых ответ на ВИГ обычно менее выражен. Показаны существенные различия в нарушениях иммунного статуса в обеих группах наблюдения. У пациентов с аутоиммунными поражениями периферической нервной системы преобладали гуморальные иммунодефициты, включая дефицит тотального IgG, субклассов IgG, классов IgА и IgЕ, тогда как при ревматических болезнях был большим удельный вес клеточных нарушений. Учитывая эти данные, причину усиленного воздействия ВИГ при нейропатиях можно усмотреть в потенциации иммунозаместительного эффекта препарата по отношению к причинному гуморальному иммунодефициту и иммуномодулирующего эффекта, связанного с подавлением имеющейся аутоиммунной реакции [1]. Однако вполне возможно, что истинная причина преимущества ВИГ при аутоиммунных нейропатиях будет установлена лишь в будущих исследованиях.
Стратегия иммуноглобулинотерапии при аутоиммунных болезнях периферической нервной системы
ВИГ является высокоэффективным средством терапии аутоиммунных заболеваний периферической нервной системы у людей, таких как синдром Гийена — Барре, хроническая воспалительная демиелинизирующая полинейропатия и многоочаговая моторная нейропатия.
Плазмаферез и ВИГ имеют одинаковую клиническую эффективность при синдроме Гийена — Барре, однако ВИГ лучше переносится и является технически более простой терапевтической стратегией. Хотя прямые финансовые затраты на лечение больше у ВИГ, общие затраты, связанные с закупкой и амортизацией оборудования, обеспечением функционирования отделения и лечением осложнений, выше у плазмафереза. Комбинирование ВИГ и плазмафереза не приводит к усилению клинического эффекта, так как это во многом конкурирующие методы терапии. Плазмаферез устраняет антиидиотипическую иммуноглобулиновую сеть, на потенциации которой основывается иммуномодулирующее воздействие ВИГ, а ВИГ, насыщая белковый пул крови, увеличивает необходимый объем замены плазмы при плазмаферезе. Стартовая монотерапия глюкокортикостероидами — грубая терапевтическая ошибка при ведении пациентов с синдромом Гийена — Барре.
У ВИГ больше доказательная база эффективности и лучше профиль переносимости, чем у глюкокортикостероидов, при хронической воспалительной демиелинизирующей полинейропатии, поэтому представления о преимуществе преднизолона у пациентов с легким и умеренным неврологическим дефицитом основываются на финансовых соображениях. Глюкокортикостероиды ухудшают состояние пациента при тяжелых чисто моторных формах болезни. Комбинация ВИГ и стероидов, по-видимому, может приводить к усилению терапевтического эффекта и коррекции некоторых побочных явлений гормональных препаратов, однако в этом направлении проведено слишком мало клинических исследований для окончательных выводов. Плазмаферез не является первой линией терапии этого заболевания и не должен заменять собой ВИГ в рутинной практике.
ВИГ на сегодняшний день является единственным методом лечения многоочаговой моторной нейропатии у людей с доказанной эффективностью. Ни глюкокортикостероиды, ни плазмаферез не являются средствами выбора терапии этой редкой болезни периферической нервной системы.
Проводят кратко-, средне- и долгосрочную иммуноглобулинотерапию. Краткосрочная терапия при помощи ВИГ на протяжении 1–2 месяцев осуществляется у пациентов с синдромом Гийена — Барре с учетом кратковременности аутоиммунной реакции при этой патологии. Долгосрочная терапия показана при хронической воспалительной демиелинизирующей полинейропатии по крайней мере в 10 % случаев, а также почти во всех случаях при многоочаговой моторной нейропатии, имеющей более неблагоприятный прогноз. К среднесрочной иммуноглобулинотерапии, охватывающей обычно период 3–6 месяцев, можно прибегнуть при усугублении симптомов ранее легко протекающей или хорошо поддающейся лечению стероидами хронической воспалительной демиелинизирующей полинейропатии для стабилизации клинического состояния, наращивания мышечной силы и возврата к прежней терапии при переходе к более благоприятному течению болезни.
Различают фазы насыщения и поддерживающей терапии при помощи ВИГ при аутоиммунных нейропатиях. В фазу насыщения используют высокую дозу препарата (около 2 г/кг/мес) на протяжении 1–3 смежных месяцев. Добившись достаточного возрастания мышечной силы, постепенно снижают дозу препарата, переходя в фазу поддерживающего лечения, в среднем на 100–300 мг/кг/мес. Целевой является минимально эффективная доза препарата, уровень которой может колебаться между 1000 и 200 мг/кг/мес. Можно также уменьшить кратность применения препарата — от обычного введения 1 раз в 3–4 недели до 1 раза в 6–8 недель, причем попытки снижения дозы должны предшествовать увеличению кратности применения. При обострении болезни доза препарата временно может быть увеличена вплоть до стартового 2 г/кг/мес, причем величина прироста дозы должна соответствовать тяжести обострения.
Предложено три режима введения ВИГ при аутоиммунных периферических нейропатиях у людей: болюсный, при котором вся доза препарата вводится за 1 сутки, полуболюсный, когда рассчитанная доза делится пополам на 2 последовательных суток, и классический, или пролонгированный, при котором препарат вводится на протяжении 5 смежных дней в равной или почти равной дозе с 25-дневными промежутками между последующими курсами, хотя допустимы различные режимы иммуноглобулинотерапии на протяжении 1–5 последовательных суток в месяц без разрывов в курсе терапии. Нет достаточных данных, чтобы считать какой-либо режим введения более эффективным, хотя имеются результаты некоторых исследований, свидетельствующие о большей эффективности и безопасности пролонгированных 5-дневных инфузий по сравнению с 2-дневным введением ВИГ.
Клинический эффект после применения ВИГ может развиться уже на протяжении первых суток, однако он может быть отсрочен на 6–8 суток от начала терапии. При хронической воспалительной демиелинизирующей полинейропатии чаще всего полнота инициального эффекта раскрывается только после 2 курсов иммуноглобулинотерапии. Драматизм ответа на ВИГ связан с дозой препарата, субтипом нейропатии и длительностью заболевания. Необходимо максимально раннее назначение ВИГ тяжелым пациентам. Так, при синдроме Гийена — Барре терапевтическое окно оптимального применения ВИГ составляет первые 2 недели от момента дебюта симптомов.
Целесообразно шире применять ВИГ в Украине для лечения аутоиммунных заболеваний периферической нервной системы, что позволит оптимизировать клинические исходы при этой тяжелой, инвалидизирующей патологии.
Конфликт интересов: не заявлен.
Список литературы
1. Мальцев Д.В. Ассоциация аутоиммунных демиелинизирующих болезней нервной системы с гуморальными иммунодефицитами: новый ключ к пониманию эффективности иммуноглобулинотерапии // Международный неврологический журнал. — 2014. — № 2 (64). — С. 27-32.
2. Мальцев Д.В. Малі імунодефіцитні хвороби. — К.: Центр учбової літератури, 2015. — 460 с.
3. Неврология раннего детского возраста / Под ред. проф. С.К. Евтушенко. — К.: Издатель Заславский А.Ю., 2016. — 287 с.
4. Azulay J.-P., Blin O., Pouget J. et al. Intravenous immunoglobulin treatment in patientswith motor neuron syndromes associated with anti-GM1 antibodies: a double-blind, placebo-controlled study // Neurology. — 1994. — Vol. 44. — P. 429-432.
5. Baumann A., Hess C.W., Sturzenegger M. IVIg dose increase in multifocal motor neuropathy: a prospective six month follow-up // J. Neurol. — 2009. — Vol. 256 (4). — P. 608-614.
6. Carpo M., Cappellari A., Mora G. et al. Deterioration of multifocal motor neuropathyafter plasma exchange // Neurology. — 1998. — Vol. 50. — P. 1480-1482.
7. Charra B., Hachimi A., Benslama A., Motaouakkil S. Intravenous immunoglobulin vs plasma exchange in treatment of mechanically ventilated adults with Guillain-Barré syndrome // Pan. Afr. Med J. — 2014. — Vol. 18. — P. 35.
8. Chaudhary A., Ramchand T., Frohman L.P. Miller Fisher variant of Guillain-Barré syndrome masquerading as acute sphenoid sinusitis with orbital apex syndrome // Laryngoscope. — 2012. — Vol. 122 (5). — P. 970-972.
9. Cho Y.Y., Joung J.Y., Jeong H. et al. Postinfectious Guillain-Barre syndrome in a patient with methimazole-induced agranulocytosis // Korean. J. Intern. Med. — 2013. — Vol. 28 (6). — P. 724-727.
10. Ciric B., Van Keulen V., Paz Soldan M., Rodriguez M., Pease L.R. Antibody-mediated remyelinationoperates through mechanism independent of immunomodulation // Journal of Neuroimmunology. — 2004. — Vol. 146. — P. 153-161.
11. Claus D., Specht S., Zieschang M. Plasmapheresis in multifocal motor neuropathy: a casereport // Journal of Neurology, Neurosurgery and Psychiatry. — 2000. — Vol. 68. — P. 533-535.
12. Consensus Conference. The utility of therapeutic plasmaphe-resis for neurological disorders. NIH Consensus Development // The Journal of the American Medical Association. — 1986. — Vol. 256. — P. 1333-1337.
13. Diener H.C., Haupt W.F., Kloss T.M. et al. A preliminary, randomized, multicenter study comparing intravenous immunoglobulin, plasma exchange, and immune adsorption in Guillain-Barré syndrome // European Neurology. — 2001. — Vol. 46. — P. 107-109.
14. Donaghy M., Mills K.R., Boniface S.J. et al. Pure motor demyelinating neuropathy: deteriorationafter steroid treatment and improvement with intravenous immuno-globulin // Journal of Neurology, Neurosurgery and Psychiatry. — 1994. — Vol. 57. — P. 778-783.
15. Dyck P.J., Litchy W.J., Kratz K.M. et al. A plasma exchange versus immune globulin infusiontrial in chronic inflammatory demyelinating polyradiculoneuropathy // Annals of Neurology. — 1994. — Vol. 36. — P. 838-845.
16. Elovaara I., Apostolski S., van Doorn P. et al. EFNS guidelines for the use of intravenous immunoglobulin in treatment of neurological diseases: EFNS task force on the use of intravenous immunoglobulin in treatment of neurological diseases // Eur. J. Neurol. — 2008. — Vol. 15 (9). — P. 893-908.
17. Fergusson D., Hutton B., Sharma M. et al. Use of intravenous immunoglobulin for treatmentof neurological conditions: a systematic review // Transfusion. — 2005. — Vol. 45. — P. 1640-1657.
18. Fokkink W.J., Selman M.H., Dortland J.R. IgG Fc N-glycosylation in Guillain-Barré syndrome treated with immunoglobulins // J. Proteome Res. — 2014. — Vol. 13 (3). — P. 1722-1730.
19. Fokkink W.R., Walgaard C., Kuitwaard K. et al. Association of Albumin Levels With Outcome in Intravenous Immunoglobulin-Treated Guillain-Barré Syndrome // JAMA Neurol. — 2016. Dec 27. [Epub ahead of print].
20. Gallia F., Balducci C., Nobile-Orazio E. Efficacy and tolerability of different brands of intravenous immunoglobulin in the maintenance treatment of chronic immune-mediated neuropathies // J. Peripher. Nerv. Syst. — 2016. — Vol. 21 (2). — P. 82-84.
21. Gurses N., Uysal S., Cetinkaya F., Icslek I., Kalayci A.G. Intravenous immunoglobulintreatment in children with Guillain-Barré syndrome // Scandinavian Journal of Infectious Diseases. — 1995. — Vol. 27. — P. 241-243.
22. Hahn A.F., Bolton C.F., Zochodne D.W., Feasby T.E. Intravenous immunoglobulin treatmentin chronic inflammatory demyelinating polyneuropathy. A double-blind, placebocontrolled, cross-over study // Brain. — 1996. — Vol. 119. — P. 1067-1077.
23. Hahn A.F., Beydoun S.R., Lawson V. et al. A controlled trial of intravenous immunoglobulin in multifocal motor neuropathy // J. Peripher. Nerv. Syst. — 2013. — Vol. 18 (4). — P. 321-330.
24. Harbo T., Andersen H., Hess A. et al. Subcutaneous versus intravenous immunoglobulin in multifocal motor neuropathy: a randomized, single-blinded cross-over trial // Eur. J. Neurol. — 2009. — Vol. 16 (5). — P. 631-638.
25. Hughes R.A.C. Treatment of Guillain-Barré syndrome with corticosteroids: lack of benefit? // Lancet. — 2004. — Vol. 363. — P. 181.
26. Hughes R.A.C., Bouche P., Cornblath D.R. et al. EFNS/PNS guideline on management ofchronic inflammatory demyelinating polyradiculoneuropathy. Report of a joint task forceof the European Fede-ration of Neurological Societies and the Peripheral Nerve Society // European Journal of Neurology. — 2006. — Vol. 13. — P. 326-332.
27. Hughes R.A.C., Cornblath D.R. Guillain-Barré syndrome // Lancet. — 2005. — Vol. 366. — P. 1653-1666.
28. Hughes R.A.C., Swan A.V., Raphael J.C. et al. Immunotherapy for Guillain-Barré syndrome: a systematic review // Brain. — 2007. — Vol. 130. — P. 2245-2257.
29. Hughes R.A., Bensa S., Willison H.J. et al. Randomized controlled trial of intravenous immunoglobulin versus oral prednisolone in chronic inflammatory demyelinating polyradiculoneuropathy // Annals of Neurology. — 2001. — Vol. 50. — P. 195-201.
30. Hughes R.A., Donofrio P., Bril V. et al. Intravenous immune globulin (10 % caprylate chromatography purified) for the treatment of chronic inflammatory demyelinatingpolyradiculoneuropathy (ICE study): a randomised placebo-controlled trial // Lancet Neurology. — 2008. — Vol. 7. — P. 136-144.
31. Jacobs B.C., Van Doorn P.A., Schmitz P.I. et al. Campylobacter jejuni infections and anti-GM1 antibodies in Guillain-Barré syndrome // Annals of Neurology. — 1996. — Vol. 40. — P. 181-187.
32. Kanra G., Ozon A., Vajsar J., Castagna L., Secmeer G., Topaloglu H. Intravenous immunoglobulintreatment in children with Guillain-Barré syndrome // European Journal of Paediatric Neurology. — 1997. — Vol. 1. — P. 7-12.
33. Kleyweg R.P., Van der Meche F.G.A., Meulstee J. Treat-ment of Guillain-Barré syndromewith high-dose gammaglobulin // Neurology. — 1988. — Vol. 38. — P. 1639-1641.
34. Korinthenberg R., Schessl J., Kirschner J., Montning J.S. Intravenous immunoglobulin inthe treatment of child-hood Guillain-Barré syndrome // Pediatrics. — 2005. — Vol. 116. — P. 8-14.
35. Kuitwaard K., van den Berg L.H., Vermeulen M. et al. Randomised controlled trial comparing two different intravenous immunoglobulins in chronic inflammatory demyelinating polyradiculoneuropathy // J. Neurol. Neurosurg. Psychiatry. — 2010. — Vol. 81 (12). — P. 1374-1379.
36. Kumar P., Charaniya R., Bahl A. et al. Facial Diplegia with Paresthesia: An Uncommon Variant of Guillain-Barre Syndrome // J. Clin. Diagn. Res. — 2016. — Vol. 10 (7). — OD01-2.
37. Kuwabara S., Mori M., Ogawara K., Hattori T., Yuki N. Indicators of rapid clinical recoveryin Guillain-Barré syndrome // Journal of Neurology, Neurosurgery and Psychiatry. — 2001. — Vol. 70. — P. 560-562.
38. Latov N., Deng C., Dalakas M.C. et al. Timing and course of clinical response to intravenous immunoglobulin in chronic inflammatory demyelinating polyradiculoneuropathy // Arch. Neurol. — 2010. — Vol. 67 (7). — P. 802-807.
39. Leger J.M., Chassande B., Musset L. et al. Intravenous immunoglobulin therapy in multifocal motor neuropathy: a double-blind, placebo-controlledstudy // Brain. — 2001. — Vol. 124. — P. 145-153.
40. Leger J.M., Viala K., Cancalon F. et al. Intravenous immunoglobulin as short- and longterm therapy of multifocal motor neuropathy: a retrospective study of response to IVIGand of its predictive criteria in 40 patients // Journal of Neurology, Neurosurgery and Psychiatry. — 2008. — Vol. 79. — P. 93-96.
41. Maddur M.S., Rabin M., Hegde P. et al. Intravenous immunoglobulin exerts reciprocal regulation of Th1/Th17 cells and regulatory T cells in Guillain-Barré syndrome patients // Immunol. Res. — 2014. — Vol. 60 (2-3). — P. 320-329.
42. Mendell J.R., Barohn R.J., Freimer M.L. et al. Rando-mized controlled trial of IVIG inuntreated chronic inflammatory demyelinating polyradiculoneuropathy // Neurology. — 2001. — Vol. 56. — P. 445-449.
43. Nobile-Orazio E. Multifocal motor neuropathy // Journal of Neuroimmunology. — 2001. — Vol. 115. — P. 4-18.
44. Nobile-Orazio E., Cocito D., Jann S. et al. Frequency and time to relapse after discontinuing 6-month therapy with IVIg or pulsed methylprednisolone in CIDP // J. Neurol. Neurosurg. Psychiatry. — 2015. — Vol. 86 (7). — P. 729-734.
45. Nobile-Orazio E., Cocito D., Jann S. et al. Intravenous immunoglobulin versus intravenous methylprednisolone for chronic inflammatory demyelinating polyradiculoneuropathy: a randomised controlled trial // Lancet Neurol. — 2012. — Vol. 11 (6). — P. 493-502.
46. Nomura K., Hamaguchi K., Hattori T. et al. A randomized controlled trial comparing intravenousimmunoglobulin and plasmapheresis in Guillain-Barré syndrome // Neurological Therapeutics. — 2001. — Vol. 18. — P. 69-81.
47. Plasma Exchange/Sandoglobulin Guillain-Barré Syndrome Trial Group. Randomised trialof plasma exchange, intravenous immunoglobulin, and combined treatments in Guillain-Barré syndrome // Lancet. — 1997. — Vol. 349. — P. 225-230.
48. Raphael J.C., Chevret S., Harboun M., Jars-Guince-stre M.C. French Guillain-Barré Syndrome Cooperative Group. Intravenous immune globulins in patients with Guillain-Barré syndrome and contraindications to plasma exchange: 3 days versus 6 days // Journal of Neurology, Neurosurgery and Psychiatry. — 2001. — Vol. 71. — P. 235-238.
49. Ruts L., van Koningsveld R., Van Doorn P.A. Distin-guishing acute-onset CIDP from Guillain-Barré syndrome with treatment related fluctuations // Neurology. — 2005. — Vol. 65. — P. 138-140.
50. Shinoda K., Murai H., Shibata K. et al. Overlap case of Fisher syndrome and pharyngeal-cervical-brachial variant of Guillain-Barré syndrome // Rinsho Shinkeigaku. — 2012. — Vol. 52 (1). — P. 30-33.
51. Terenghi F., Cappellari A., Bersano A., Carpo M., Bar–bieri S., Nobile-Orazio E. How long is IVIG effective in multifocal motor neuropathy? // Neurology. — 2004. — Vol. 62. — P. 666-668.
52. The Guillain-Barré Syndrome Study Group. Plasma-pheresis and acute Guillain-Barré syndrome // Neurology. — 1985. — Vol. 35. — P. 1096-1104.
53. Thompson N., Choudhary P.P., Hughes R.A.C., Quinlivan R.M. A novel trial design tostudy the effect of intra-venous immunoglobulin in chronic inflammatory demy-elinatingpolyradiculoneuropathy // Journal of Neurology. — 1996. — Vol. 243. — P. 280-285.
54. Van den Berg L.H., Franssen H., Wokke J.H.J. The long-term effect of intravenous immunoglobulintreatment in multifocal motor neuropathy // Brain. — 1998. — Vol. 121. — P. 421-428.
55. Van den Berg L.H., Kerkhoff H., Oey P.L. et al. Treatment of multifocal motor neuropathywith high dose intravenous immunoglobulins: a double blind, placebo controlled study // Journal of Neurology, Neurosurgery and Psychiatry. — 1995. — Vol. 59. — P. 248-252.
56. Van den Berg L.H., Lokhorst H., Wokke J.H. Pulsed high-dose dexamethasone isnot effective in patients with multifocal motor neuropathy [comment] // Neurology. — 1997. — Vol. 48. — P. 1135.
57. Van den Berg-Vos R.M., Franssen H., Wokke J.H.J., Van Es.H.W., Van den Berg L.H. Multifocal motor neuropathy: diagnostic criteria that predict the response to immunoglobulin treatment // Annals of Neurology. — 2000. — Vol. 48. — P. 919-926.
58. Van der Meche F.G.A., Schmitz P.I.M. The Dutch Guillain-Barré Study Group. A randomizedtrial comparing intravenous immune globulin and plasma exchange in Guillain-Barrésyndrome // New England Journal of Medicine. — 1992. — Vol. 326. — P. 1123-1129.
59. Van Doorn P.A., Dippel D.W.J., Vermeulen M. Longterm iv immunoglobulin treatment inchronic inflammatory demyelinating polyneuropathy // Journal of the Peripheral Nervous System. — 2007. — Vol. 12. — P. 89.
60. Van Doorn P.A., Kuitwaard K., Jacobs B.C. et al. Serum IgG levels as biomarkers for optimizing IVIg therapy in CIDP // J. Peripher. Nerv. Syst. — 2011. — Vol. 1. — P. 38-40.
61. Van Koningsveld R., Schmitz P.I.M., Van der Meche F.G.A. et al. Effect of methylprednisolone when added to standard treatment with intravenous immunoglobulin for Guillain-Barré syndrome: randomised trial // Lancet. — 2004. — Vol. 363. — P. 192-196.
62. Van Schaik I.N., van den Berg L.H., de Haan R., Vermeulen M. Intravenous immunoglobulinefor multifocal motor neuropathy // Cochrane Database of Systematic Reviews. — 2005. — Vol. 2. — CD004429.
63. Van Schaik I.N., Winer J.B., de Haan R., Vermeulen M. Intravenous immunoglobulinefor chronic inflammatory demyelinating polyradiculoneuropathy // Cochrane Database of Systematic Reviews. — 2004. — Vol. 2. — P. CD001797.
64. Vermeulen M., Van Doorn P.A., Brand A., Strengers P.F.W., Jennekens F.G.I., Busch H.F.M. Intravenous immunoglobulin treatment in patients with chronic inflammatory demyelinatingpolyneuropathy // Journal of Neurology, Neurosurgery and Psychiatry. — 1993. — Vol. 56. — P. 36-39.
65. Vucic S., Black K.R., Chong P.S.T., Cros D. Multifocal motor neuropathy. Decrease in conductionblocks and reinnervation with long-term IVIG // Neurology. — 2004. — Vol. 63. — P. 1264-1269.
66. Wang R., Feng A., Sun W., Wen Z. Intravenous immunoglobulin in children with Guillain-Barré syndrome // Journal of Applied Clinical Pediatrics. — 2001. — Vol. 16. — P. 223-224.
67. Winer J.B., Hughes R.A.C., Osmond C. A prospective study of acute idiopathic neuropathy.I. Clinical features and their prognostic value // Journal of Neurology, Neurosurgeryand Psychiatry. — 1988. — Vol. 51. — P. 605-612.
68. Yepishin I.V., Allison R.Z., Kaminskas D.A. et al. Miller Fisher Syndrome: A Case Report Highlighting Heterogeneity of Clinical Features and Focused Differential Diagnosis // Hawaii J. Med. Public. Health. — 2016. — Vol. 75 (7). — P. 196-199.
69. Yuki N., Ang C.W., Koga M. et al. Clinical features and response to treatment in Guillain-Barré syndrome associated with antibodies to GM1b ganglioside // Annals of Neurology. — 2000. — Vol. 47. — P. 314-321.
70. Zhang G., Massaad C.A., Gao T. et al. Sialylated intravenous immunoglobulin suppress anti-ganglioside antibody mediated nerve injury // Exp. Neurol. — 2016. — Vol. 282. — P. 49-55.

/36-1.jpg)
/37-1.jpg)