Международный неврологический журнал 1 (87) 2017
Эффективность, безопасность и переносимость комбинации электролитов и цитиколина (Нейроцитин®) у пациентов с острым ишемическим инсультом: первые результаты исследования
Резюме
Актуальність. Гострий ішемічний інсульт є глобальною медичною проблемою, оскільки велика частина хворих помирає або стає інвалідами. У зв’язку з цим залишається актуальним пошук нових ефективних методів лікування даної патології. Ми ініціювали власне дослідження для оцінки одного з найбільш відомих церебропротекторів (цитиколін) у комбінації з електролітами (Нейроцитин®) при цьому виді гострих мозкових катастроф. Матеріали та методи. У відкрите рандомізоване контрольоване дослідження планується включити 55 пацієнтів обох статей віком від 25 до 75 років із діагнозом «гострий ішемічний інсульт». Контрольну групу складуть 25 пацієнтів зі стандартною терапією гострого ішемічного інсульту за наказом № 602 Міністерства охорони здоров’я України (без церебропротекторів). До основної групи буде включено 30 хворих із тією ж стандартною терапією + Нейроцитин® 100 мл 2 рази на добу протягом 14 днів. До головних критеріїв ефективності були віднесені: кількість балів за шкалою NIHSS, індексом Бартел і шкалою Ранкіна станом на 14-й день лікування; уміст нейронспецифічної єнолази (маркер ушкодження нейронів), величина біспектрального індексу (маркер електричної активності кори) станом на 14-й день лікування, показник церебральної оксиметрії (маркер оксигенації головного мозку) станом на 5-й день лікування; стан мозкової гемодинаміки за даними ультразвукової доплерографії судин головного мозку станом на момент виписки. Результати. На момент підготовки цієї статті в основну і контрольну групи дослідження було включено по 20 пацієнтів. Станом на 14-й день лікування зниження вмісту нейронспецифічної єнолази було в 2,73 рази більше в основній групі (зі включенням препарату Нейроцитин® (комбінація електролітів натрію, калію, кальцію, хлору, а також лактату та цитиколіну)) у порівнянні з контрольною і був близький до норми. Станом на 14-й день лікування зростання біспектрального індексу було на 64,9 % більше в основній групі порівняно з контрольною і його величина була близькою до норми. Станом на 5-й день лікування зростання показника церебральної оксиметрії було на 49,6 % більше в основній групі порівняно з контрольною і його величина досягала нормальних значень. У багатьох випадках покращання в групі з застосуванням препарату Нейроцитин® розвивалося в більш ранні терміни порівняно з терапією без церебропротектора. Висновки. Попередні результати проведеного нами дослідження свідчать про те, що включення препарату Нейроцитин® (комбінація електролітів натрію, калію, кальцію, хлору, а також лактату та цитиколіну) у схему лікування гострого ішемічного інсульту призводить до вірогідно більш швидкого зменшення пошкодження нейронів, відновлення електричної активності кори і оксигенації головного мозку порівняно з терапією без нейропротекції. У багатьох випадках ці ефекти спостерігаються в більш ранні терміни. Попередні результати дослідження вказують на доцільність включення Нейроцитину® в сучасні протоколи лікування гострого ішемічного інсульту.
Актуальность. Острый ишемический инсульт представляет собой глобальную медицинскую проблему, поскольку большая часть больных умирает или становится инвалидами. В связи с этим остается актуальным поиск новых эффективных методов лечения данной патологии. Мы инициировали собственное исследование для оценки одного из наиболее известных церебропротекторов (цитиколин) в комбинации с электролитами (Нейроцитин®) при этом виде острых мозговых катастроф. Материалы и методы. В открытое рандомизированное контролируемое исследование планируется включить 55 пациентов обоих полов в возрасте от 25 до 75 лет с диагнозом «острый ишемический инсульт». Контрольную группу составят 25 пациентов со стандартной терапией острого ишемического инсульта согласно приказу № 602 Министерства здравоохранения Украины (без церебропротекторов). В основную группу будет включено 30 больных с той же стандартной терапией + Нейроцитин® 100 мл 2 раза в сутки в течение 14 дней. К главным критериям эффективности были отнесены: количество баллов по шкале NIHSS, индексу Бартел и шкале Ранкина к 14-му дню лечения; содержание нейронспецифической енолазы (маркер повреждения нейронов), величина биспектрального индекса (маркер электрической активности коры) к 14-му дню лечения, показатель церебральной оксиметрии (маркер оксигенации головного мозга) к 5-му дню лечения; состояние мозговой гемодинамики по данным ультразвуковой допплерографии сосудов головного мозга к моменту выписки. Результаты. К моменту подготовки настоящей статьи в основную и контрольную группы исследования было включено по 20 пациентов. К 14-му дню лечения снижение содержания нейронспецифической енолазы было в 2,73 раза больше в основной группе (с включением препарата Нейроцитин® (комбинация электролитов натрия, калия, кальция и хлора, а также лактата и цитиколина)) по сравнению с контрольной и было близким к достижению нормы. К 14-му дню лечения рост биспектрального индекса был на 64,9 % больше в основной группе, чем в контрольной, и его величина была близка к норме. К 5-му дню лечения рост показателя церебральной оксиметрии был на 49,6 % больше в основной группе по сравнению с контрольной, и его величина достигала нормальных значений. Во многих случаях улучшение в группе с применением препарата Нейроцитин® развивалось в более ранние сроки по сравнению с терапией без комплексной нейропротекции. Выводы. Предварительные результаты предпринятого нами исследования свидетельствуют о том, что включение препарата Нейроцитин® (комбинация электролитов натрия, калия, кальция и хлора, лактата и цитиколина) в схему лечения острого ишемического инсульта приводит к достоверно более быстрому уменьшению повреждения нейронов, восстановлению электрической активности коры и оксигенации головного мозга по сравнению с терапией без комплексной нейропротекции. Во многих случаях эти эффекты наблюдаются в более ранние сроки. Предварительные результаты исследования указывают на целесообразность включения Нейроцитина® в современные протоколы лечения острого ишемического инсульта.
Background. Acute ischemic stroke is a global health problem, since most of the patients die or become disabled. In this regard, it continues to be relevant to search for new effective treatments for this disease. We have initiated our own study to assess one of the most famous cerebroprotectors (citicoline) in combination with electrolyte (Neurocitin®) in such acute cerebral accidents. Materials and methods. In an open, randomized, controlled trial, it is planned to include 55 patients of both sexes aged 25 to 75 years with a diagnosis of acute ischemic stroke. The control group would consist of 25 patients with standard therapy of acute ischemic stroke by Order of the Ministry of Health of Ukraine N 602 (without cerebroprotectors). Study group will include 30 patients with the same standard therapy + Neurocitin® 100 ml 2 times a day for 14 days. The primary efficacy outcomes included: the score on the NIHSS scale, Barthel index and Rankin scale by day 14 of treatment; content of neuron specific enolase (the marker of neuronal damage), the value of bispectral index (the marker of electrical activity of the cortex) by day 14 of treatment, the measure of cerebral oximetry (the marker of brain oxygenation) by day 5 of treatment; the state of cerebral hemodynamics according to Doppler ultrasound of brain vessels by discharge. Results. By the time of preparation of this article, both the study and control groups of the research included 20 patients each. By day 14 of treatment, the decrease of neuron specific enolase content was 2.73 times greater in the study group (with Neurocitin® (electrolyte combination of sodium, potassium, calcium and chlorine, as well as lactate and citicoline)) compared with the controls, and was close to reach normal. By day 14 of treatment, the increase of bispectral index was 64.9 % higher in the study group than in the control one, and its value practically reached normal. By day 5 of treatment, the increase of measure of cerebral oximetry was 49.6 % higher in the study group compared to the controls, and its value reached the norm. In many cases, an improvement in the group of Neurocitin® developed earlier compared to the treatment without cerebroprotector. Conclusions. Preliminary results of our study suggest that the inclusion of Neurocitin® (electrolyte combination of sodium, potassium, calcium and chlorine, as well as lactate and citicoline) into the scheme of treatment of acute ischemic stroke leads to a significantly more rapid reduction of neuronal damage, restore the electrical activity of the cortex and brain oxygenation compared to the therapy without cerebroprotector. In many cases, these effects are observed at an earlier date. Preliminary results of the study indicate the desirability of Neurocitin® inclusion into the current protocols of treatment for acute ischemic stroke.
Ключевые слова
цитиколін; Нейроцитин®; гострий ішемічний інсульт; нейронспецифічна єнолаза; біспектральний індекс; церебральна оксиметрія
Нейроцитин®; цитиколин; острый ишемический инсульт; нейронспецифическая енолаза; биспектральный индекс; церебральная оксиметрия; комплексная нейропротекция
Neurocitin®; citicoline; acute ischemic stroke; neuron specific enolase; bispectral index; cerebral oximetry; comprehensive neuroprotection
Введение
Ежегодно в Украине регистрируют 100–120 тыс. новых случаев мозгового инсульта, большая часть из которых носит ишемический характер. Около 50 % больных умирает в течение 1 года после перенесенного инсульта, в то время как большая часть выживших становятся инвалидами. Следовательно, поиск путей оптимизации интенсивной терапии в остром периоде инсульта и последующей реабилитации является важной медицинской задачей [1–4].
К настоящему времени переосмыслены многие лечебные аспекты при остром ишемическом инсульте. В частности, была обоснована необходимость проводить достаточную инфузионную терапию для поддержания нормоволемии в организме больного. Тактику ограничения введения жидкости и проведения дегидратации сегодня считают недопустимой. Важно поддерживать состояние нормоосмолярности в плазме крови и нормальный уровень гематокрита. Недопустимо применение растворов, содержащих глюкозу, поскольку гипергликемия усиливает ацидоз в ишемизированных участках мозга. Кроме того, растворы глюкозы являются источником свободной жидкости, что может способствовать развитию отека мозга [5, 6].
Особое место среди мероприятий по оказанию помощи больным с ишемическим инсультом занимает назначение средств, увеличивающих сохранность нервной ткани. По мнению P. Sahota и соавт., наиболее многообещающими интервенциями, обеспечивающими нейропротекцию в остром периоде инсульта и протестированными в больших клинических исследованиях, являются гипотермия, магния сульфат, цитиколин и альбумин. Наиболее же многообещающими интервенциями, усиливающими нейровосстановление в подостром периоде инсульта, являются гранулоцитарный колониестимулирующий фактор (G-CSF), цитиколин и клеточная терапия [7]. Видно, что только цитиколин проявляет выраженную эффективность как в острой, так и в подострой фазе инсульта и при этом не вызывает значимых побочных эффектов [8].
Цитиколин (цитидин-5’-дифосфохолин, ЦДФ-холин) является важным посредником в биосинтезе фосфатидилхолина — основного компонента биологических мембран. В экспериментальных исследованиях острого ишемического инсульта была подтверждена способность цитиколина уменьшать объем инсульта, отек мозга, неврологический дефицит, улучшать обучаемость, память и выполнение поведенческих задач [9]. Механизмы, лежащие в основе перечисленных лечебных эффектов, представлены на рис. 1.
/65-1.jpg)
В отличие от экспериментальных исследований острого ишемического инсульта, в которых в основном были получены позитивные результаты, данные клинических исследований, а также их обзоров, систематических обзоров и метаанализов весьма противоречивы. Например, в обзоре E. Warburton и соавт. (2011) упоминается систематический обзор (4 рандомизированных контролируемых исследования), в котором цитиколин назначали в течение первых 24 ч после развития умеренного или тяжелого инсульта. Было обнаружено, что цитиколин достоверно увеличивает долю пациентов, полностью выздоравливающих спустя 3 месяца, по сравнению с плацебо. Однако не было обнаружено достоверных различий во влиянии на смертность [10]. В обзоре K. Overgaard (клинические исследования фазы II и III, 2014 г.) авторы пришли к заключению, что цитиколин безопасен и может оказывать положительное влияние при остром ишемическом инсульте. Его эффекты сильнее заметны при менее тяжелом инсульте у пожилых пациентов, не получавших рекомбинантный тканевый активатор плазминогена. Ни одно другое нейропротективное средство не оказывает какого-либо положительного влияния в подтверждающих клинических исследованиях и при проведении подгрупповых анализов. Цитиколин является единственным лекарственным средством, которое в большом количестве различных клинических исследований инсульта с постоянством демонстрирует определенное нейропротективное преимущество [11]. В систематическом обзоре и формальном метаанализе J.J. Secades и соавт. (10 рандомизированных контролируемых исследований, 2016 г.) сообщается о том, что систематический обзор подтверждает некоторые преимущества цитиколина при лечении острого ишемического инсульта. Однако при совместном назначении с наиболее сильной доступной терапией (рекомбинантным тканевым активатором плазминогена) преимущества цитиколина становятся стертыми [12]. В метаанализе P.Y. Shi и соавт. (7 рандомизированных контролируемых исследований, 2016 г.) был сделан вывод о том, что цитиколин не уменьшает смертность в долгосрочном периоде и функциональную зависимость от ухаживающих лиц; эффективность цитиколина может быть не больше, чем в контроле, хотя для цитиколина характерен надежный уровень безопасности [13].
С целью дальнейшего изучения свойств цитиколина у пациентов с инсультом мы инициировали собственное «Исследование эффективности, безопасности и переносимости комбинации электролитов с цитиколином (Нейроцитин®) у пациентов с острым ишемическим инсультом». Подробное описание его дизайна и первые полученные результаты представлены ниже. В работе был использован Нейроцитин®, раствор для инфузий, производства ООО «Юрия-Фарм». Код АТХ В05В В04. Растворы для внутривенного применения. Электролиты в комбинации с другими средствами. Его особенностью является то, что в состав входят электролиты — натрий, калий, кальций и хлор, а также лактат и цитиколин.
Материалы и методы
В настоящее открытое рандомизированное контролируемое исследование планируется включить 55 пациентов обоих полов в возрасте от 25 до 75 лет с диагнозом «острый ишемический инсульт». Тяжесть инсульта должна соответствовать легкой и средней степени по данным шкалы тяжести инсульта национальных институтов здоровья США (NIHSS ≤ 13 баллов). Кроме того, диагноз должен быть подтвержден с помощью методов нейровизуализации — компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ).
В соответствии с протоколом исследования все больные будут разделены на две группы. Контрольную группу составят 25 пациентов, которым будет назначена стандартная терапия острого ишемического инсульта согласно приказу № 602 Министерства здравоохранения Украины (без церебропротекторов). Основную группу составят 30 пациентов, которым в дополнение к той же стандартной терапии будет назначен Нейроцитин® 100 мл 2 раза в сутки в течение 14 дней.
Исследователями был выбран ряд критериев, позволяющих судить об эффективности стандартной терапии + Нейроцитин® по сравнению со стандартной терапией.
К основным критериям были отнесены:
— количество баллов по шкале NIHSS (оценка тяжести инсульта), индексу Бартел (оценка повседневной активности) и шкале Ранкина (оценка степени инвалидизации и функциональной независимости) к 14-му дню лечения;
— содержание нейронспецифической енолазы (NSE; маркер повреждения нейронов), величина биспектрального индекса (BIS-индекс; маркер электрической активности коры) к 14-му дню лечения; показатель церебральной оксиметрии (rSO2; маркер оксигенации головного мозга) к 5-му дню лечения;
— состояние мозговой гемодинамики по данным ультразвуковой допплерографии (УЗДГ) сосудов головного мозга к моменту выписки.
К дополнительным критериям были отнесены:
— величина систолического (САД) и диастолического артериального давления (ДАД) к 14-му дню лечения;
— результаты визуализационных исследований (КТ, МРТ) к моменту выписки.
Помимо этого, пациентам выполняли лабораторные исследования (общий анализ крови, общий анализ мочи, биохимический анализ крови, включая определение уровня глюкозы), некоторые другие инструментальные исследования (электрокардиография (ЭКГ)) и др.
При выполнении статистического анализа достоверность различий оценивали с помощью t-критерия Стьюдента. Различия считали достоверными при уровне значимости p < 0,05. Было использовано следующее программное обеспечение: Microsoft Excel, http://medstatistic.ru.
Предварительные результаты исследования
К моменту подготовки настоящей статьи в основную и контрольную группы исследования было включено по 20 пациентов. Среди критериев оценки эффективности стандартной терапии + Нейроцитин® по сравнению со стандартной терапией были обсчитаны три: содержание нейронспецифической енолазы, величина BIS-индекса и показатель церебральной оксиметрии. В исходных условиях (1-й день развития инсульта) группа стандартной терапии + Нейроцитин® и группа стандартной терапии по этим трем показателям достоверно не различались.
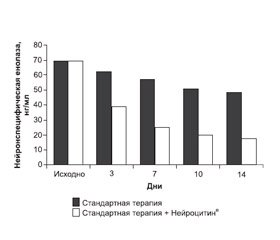
Динамика нейронспецифической енолазы в течение 14 дней после госпитализации по поводу острого ишемического инсульта представлена на рис. 2. Исходно содержание нейронспецифической енолазы было повышено в среднем в 6,33 раза в обеих группах по сравнению с нормой. Стандартная терапия достоверно снижала данный показатель начиная с 3-х суток лечения (на 2-е сутки оценивание не производилось). К 14-м суткам стандартная терапия достоверно снижала данный показатель в 1,43 раза по сравнению с исходным уровнем (1-й день), однако норма достигнута не была.
В группе стандартной терапии + Нейроцитин® достоверное снижение нейронспецифической енолазы также наблюдалось с 3-го дня. К 14-му дню было отмечено достоверное снижение данного показателя в 3,9 раза по сравнению с исходным уровнем и тенденция к достижению нормы.
Таким образом, эффективность лечения в группе стандартной терапии + Нейроцитин® была достоверно большей по сравнению с группой стандартной терапии: включение в схему лечения Нейроцитина® дополнительно снижало содержание нейронспецифической енолазы к 14-му дню лечения в 2,73 раза по сравнению с лечением без нейропротектора.
Динамика BIS-индекса в течение 14 дней после госпитализации по поводу острого ишемического инсульта представлена на рис. 3. Исходно величина BIS-индекса была снижена в среднем в 2,07 раза в обеих группах по сравнению с нормой. Стандартная терапия достоверно повышала данный показатель начиная с 7-х суток лечения (на 2-е, 3-и и 5-е сутки различия не были достоверными). К 14-м суткам стандартная терапия достоверно повышала данный показатель на 19,6 % по сравнению с исходным уровнем (1-й день), однако норма достигнута не была.
В группе стандартной терапии + Нейроцитин® достоверное повышение BIS-индекса наблюдалось со 2-го дня. К 14-му дню было отмечено достоверное повышение данного показателя на 84,5 % по сравнению с исходным уровнем, что указывало на восстановление показателей в сторону нормы.
Следовательно, эффективность лечения в группе стандартной терапии + Нейроцитин® была достоверно выше по сравнению с группой стандартной терапии: включение в схему лечения Нейроцитина® дополнительно повышало величину BIS-индекса к 14-му дню лечения на 64,9 % по сравнению с лечением без нейропротектора.
Динамика церебральной оксиметрии в течение 5 дней после госпитализации по поводу острого ишемического инсульта представлена на рис. 4. Исходно показатель церебральной оксиметрии был снижен в среднем в 1,54 раза в обеих группах по сравнению с нормой. Стандартная терапия достоверно повышала данный показатель начиная со 2-х суток лечения (в 1-е сутки различия не были достоверными). К 5-м суткам стандартная терапия достоверно повышала данный показатель на 18,9 % по сравнению с исходным уровнем (1-й день), однако норма достигнута не была.
В группе стандартной терапии + Нейроцитин® достоверное повышение показателя церебральной оксиметрии наблюдалось с 1-го дня. К 5-му дню было отмечено достоверное повышение данного показателя на 68,5 % по сравнению с исходным уровнем, достигшего нормальных значений.
Таким образом, эффективность лечения в группе стандартной терапии + Нейроцитин® была достоверно выше по сравнению с группой стандартной терапии: включение в схему лечения Нейроцитина® дополнительно повышало величину показателя церебральной оксиметрии к 5-му дню лечения на 49,6 % по сравнению с лечением без церебропротектора.
Обсуждение
При остром ишемическом инсульте нейронспецифическую енолазу определяют в слюне, плазме крови и цереброспинальной жидкости в качестве маркера повреждения нейронов. О связи с повреждением нейронов свидетельствует, в частности, наличие положительной корреляции между уровнем нейронспецифической енолазы и объемом инсульта [14–17]. Интересно, что гипергликемия приводила к большему увеличению нейронспецифической енолазы у пациентов с инсультом по сравнению с нормогликемией, что свидетельствует о большей гибели нейронов в условиях гипергликемии [18, 19].
В выполненных исследованиях была продемонстрирована диагностическая значимость нейронспецифической енолазы. Данный маркер достоверно повышался у пациентов с острым ишемическим инсультом по сравнению со здоровыми из группы контроля, хотя и не позволял провести дифференциальную диагностику острого инсульта с транзиторной ишемической атакой, состояниями, имитирующими инсульт (метастазы в мозг, злокачественная гипертензия), и с группой пациентов с высоким риском развития инсульта (гипертензия и/или сахарный диабет) [14, 20, 21]. Кроме того, изучение содержания нейронспецифической енолазы имело важную прогностическую ценность для определения тяжести инсульта, ранних и отсроченных нейроповеденческих исходов. При этом более высокие значения маркера были связаны с более плохим прогнозом [21–28]. Наличие второго пика повышения нейронспецифической енолазы свидетельствовало о геморрагической трансформации острого ишемического инсульта [29]. Вместе с тем в отдельных работах была поставлена под сомнение прогностическая значимость нейронспецифической енолазы [30, 31] и ее корреляция с объемом инсульта [31].
В нашем исследовании развитие острого ишемического инсульта было связано с повышением содержания нейронспецифической енолазы в 6,33 раза по сравнению с нормой, что свидетельствует о чувствительности данного маркера к развитию острой мозговой катастрофы. Стандартная терапия и стандартная терапия + Нейроцитин® достоверно снижали данный показатель в каждой из точек исследования, начиная с самых ранних сроков (с 3-го дня лечения; на 2-й день замеры не проводились). Однако в группе с церебропротектором в каждый момент времени это снижение происходило достоверно быстрее. К 14-му дню лечения снижение содержания нейронспецифической енолазы было в 2,73 раза больше в группе с Нейроцитином® и лишь немного не достигало нормы. Полученные данные свидетельствуют о том, что включение Нейроцитина® в схему терапии острого ишемического инсульта вносит значительный дополнительный вклад в уменьшение повреждения нейронов.
Следующим показателем, изученным в настоящей работе, был BIS-индекс. Его получают путем сложной математической обработки данных электроэнцефалографии [32]. BIS-индекс отражает электрическую активность коры [33] и широко применяется в анестезиологии, для того чтобы обеспечить адекватный уровень наркоза: чтобы он не был слишком глубоким или слишком поверхностным [34]. Исследованию BIS-индекса при ишемических нарушениях головного мозга было посвящено несколько пилотных работ. В частности, у больных с острым ишемическим инсультом, которым выполняли реканализацию, BIS-индекс хорошо коррелировал с клиническими и радиологическими данными. Повышение BIS-индекса было мощным независимым предиктором клинического улучшения после реканализации [35]. В другой работе был описан пациент, у которого развилась транзиторная ишемическая атака ствола головного мозга непосредственно перед предстоящей кардиохирургической операцией. Значение BIS-индекса уменьшилось до 60, а когда сознание спонтанно восстановилось, оно увеличилось до 85. Авторы считают, что недостаток входящих влияний от ствола мозга к фронтальной коре привел к уменьшению кортикальной электрической активности, что отразилось на значении BIS-индекса [20]. В двух исследованиях было сообщено о чувствительности BIS-индекса к развитию инсульта у пациента с аппаратом искусственного кровообращения [36] и еще у одного пациента с периоперационным инсультом [37].
В нашем исследовании развитие острого ишемического инсульта было связано со снижением величины BIS-индекса в 2,07 раза по сравнению с нормой, что свидетельствует о чувствительности данного маркера к развитию острой мозговой катастрофы. Стандартная терапия + Нейроцитин® повышала данный показатель в более ранние сроки (со 2-го дня) по сравнению со стандартной терапией (с 7-го дня) и во все сроки делала это достоверно быстрее. К 14-му дню лечения рост BIS-индекса был на 64,9 % больше в группе с Нейроцитином® и его величина лишь немного не достигала нормы. Полученные данные свидетельствуют о том, что включение Нейроцитина® в схему терапии острого ишемического инсульта вносит дополнительный весомый вклад в восстановление электрической активности коры.
Показатель церебральной оксиметрии (rSO2) характеризует регионарное насыщение кислородом тканей головного мозга. Методика проводится неинвазивно, оцениваемая кровь является артериовенозной (смешанной) [38, 39]. Церебральная оксиметрия может быть использована для оценки церебральной оксигенации во время различных фаз ишемического инсульта. Она позволяет выявить снижение церебральной оксигенации, судить об эффективности проводимого лечения и осуществлять последующий мониторинг пациентов [40, 41]. Ее применяют также при инсультах в детском возрасте [42]. Церебральная оксиметрия помогала управлять нейроанестезией и прогнозировать исход после эндоваскулярной терапии по поводу острого ишемического инсульта [43]. Данная методика позволяла снизить риск развития инсультов во время кардиохирургических операций, поскольку позволяла своевременно корректировать доставку кислорода к мозгу [44, 45], хотя в одной публикации подобная роль церебральной оксиметрии при кардиохирургических операциях была подвергнута сомнению [46]. Церебральная оксиметрия помогала предотвратить развитие инсульта и при других оперативных вмешательствах, таких как каротидная эндартерэктомия [47–49] и трансплантация печени [50], а также у пациентов на гемодиализе вследствие хронической болезни почек [51].
В нашем исследовании развитие острого ишемического инсульта было связано со снижением показателя церебральной оксиметрии в 1,54 раза по сравнению с нормой, что свидетельствует о чувствительности данного маркера к развитию острой мозговой катастрофы. Стандартная терапия + Нейроцитин® повышала данный показатель в более ранние сроки (с 1-го дня) по сравнению со стандартной терапией (со 2-го дня) и во все сроки делала это достоверно быстрее. К 5-му дню лечения рост показателя церебральной оксиметрии был на 49,6 % больше в группе с Нейроцитином® и его величина достигала нормальных значений. Полученные данные свидетельствуют о том, что включение Нейроцитина® в схему терапии острого ишемического инсульта вносит значительный дополнительный вклад в восстановление оксигенации головного мозга.
Выводы
Острый ишемический инсульт является одной из наиболее актуальных проблем современной медицины, поскольку его развитие связано со значительной смертностью и инвалидизацией пациентов. В связи с этим продолжает стоять задача оптимизации существующей терапии и поиска новых подходов к повышению ее эффективности. Предварительные результаты предпринятого нами исследования свидетельствуют о том, что включение Нейроцитина® в схему лечения острого ишемического инсульта приводит к достоверно более быстрому уменьшению повреждения нейронов, восстановлению электрической активности коры и оксигенации головного мозга по сравнению с терапией без нейропротектора. При этом во многих случаях Нейроцитин® инициирует эти улучшения в более ранние сроки после развития острого ишемического инсульта по сравнению с терапией без нейропротектора.
В связи с тем что Нейроцитин® ускоряет восстановление пациентов после острого ишемического инсульта за счет более быстрой нормализации показателей и более раннего эффекта, представляется целесообразным включение данного лекарственного средства в протоколы лечения этого вида острых мозговых катастроф. Однако описанные здесь предварительные результаты должны быть еще раз переоценены после полного завершения исследования.
Конфликт интересов. Не заявлен.
Список литературы
1. Мищенко Т.С. Лечение больных ишемическим инсультом // Здоров’я України. — 2015. — http://health-ua.com
2. Главный специалист МЗ Украины о профилактике и лечении мозговых инсультов // http://medinfo.ua
3. Академия инсульта — 2015: время действовать! // Здоров’я України. — 2015 (тематичний номер). — С. 14-16.
4. Тромболизис при ишемическом инсульте — реканализация, нейропротекция и последующая каротидная эндартерэктомия / Евтушенко С.К., Шепотинник Е.В., Родин Ю.В., Дюба Д.Ш. // Журнал неврології ім. Б.М. Маньковського. — 2013. — Т. 1, № 2. — С. 69-72.
5. Тітов І.І. Ключові питання інтенсивної терапії хворих з гострими мозковими катастрофами // III Міжнародний конгрес з інфузійної терапії — 2016. — https://www.youtube.com/watch?v = ex274I1TXJU
6. Наказ МОЗ України від 03.08.2012 № 602 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при ішемічному інсульті» // http://www.moz.gov.ua
7. Sahota P., Savitz S.I. Investigational Therapies for Ischemic Stroke: Neuroprotection and Neurorecovery // Neurotherapeutics. — 2011. — V. 8, № 3. — P. 434-451.
8. Secades J.J., Lorenzo J.L. Citicoline: pharmacological and clinical review, 2006 update // Methods Find. Exp. Clin. Pharmacol. — 2006. — V. 28 (Suppl. B). — P. 1-56.
9. Álvarez-Sabín J., Román G.C. The Role of Citicoline in Neuroprotection and Neurorepair in Ischemic Stroke // Brain Sciences. — 2013. — V. 3, № 3. — P. 1395-1414.
10. Stroke management / Warburton E., Alawneh J.A., Clatworthy P.L., Morris R.S. // BMJ Clin. Evid. — 2011. — V. 2011, pii: 0201.
11. Overgaard K. The effects of citicoline on acute ischemic stroke: a review // J. Stroke Cerebrovasc. Dis. — 2014. — V. 23, № 7. — P. 1764-1769.
12. Citicoline for Acute Ischemic Stroke: A Systematic Review and Formal Meta-analysis of Randomized, Double-Blind, and Placebo-Controlled Trials / Secades J.J., Alvarez-Sabín J., Castillo J. et al. // J. Stroke Cerebrovasc. Dis. — 2016. — V. 25, № 8. — P. 1984-1996.
13. Early application of citicoline in the treatment of acute stroke: A meta-analysis of randomized controlled trials / Shi P.Y., Zhou X.C., Yin X.X. et al. // J. Huazhong Univ. Sci. Technolog. Med. Sci. — 2016. — V. 36, № 2. — P. 270-277.
14. Al-Rawi N.H., Atiyah K.M. Salivary neuron specific enolase: an indicator for neuronal damage in patients with ischemic stroke and stroke-prone patients // Clin. Chem. Lab. Med. — 2009. — V. 47, № 12. — P. 1519-1524.
15. Neuron-specific enolase and tau protein as neurobiochemical markers of neuronal damage are related to early clinical course and long-term outcome in acute ischemic stroke / Wunderlich M.T., Lins H., Skalej M. et al. // Clin. Neurol. Neurosurg. — 2006. — V. 108, № 6. — P. 558-563.
16. S-100 protein and neuron-specific enolase concentrations in blood as indicators of infarction volume and prognosis in acute ischemic stroke / Missler U., Wiesmann M., Friedrich C., Kaps M. // Stroke. — 1997. — V. 28, № 10. — P. 1956-1960.
17. Li Y., Wang X., Yang Z. Neuron-specific enolase in patients with acute ischemic stroke and related dementia // Chin. Med. J. (Engl). — 1995. — V. 108, № 3. — P. 221-223.
18. Sulter G., Elting J.W., De Keyser J. Increased serum neuron specific enolase concentrations in patients with hyperglycemic cortical ischemic stroke // Neurosci. Lett. — 1998. — V. 253, № 1. — P. 71-73.
19. Correlative study between neuron-specific enolase and blood sugar level in ischemic stroke patients / Pandey A., Saxena K., Verma M., Bharosay A. // J. Neurosci. Rural. Pract. — 2011. — V. 2, № 1. — P. 50-54.
20. Serum neuron-specific enolase and S100 calcium binding protein B biomarker levels do not improve diagnosis of acute stroke / González-García S., González-Quevedo A., Peña-Sánchez M. et al. // J. R. Coll. Physicians Edinb. — 2012. — V. 42, № 3. — P. 199-204.
21. Serum neuron-specific enolase, carnosinase, and their ratio in acute stroke. An enzymatic test for predicting outcome? / Butterworth R.J., Wassif W.S., Sherwood R.A. et al. // Stroke. — 1996. — V. 27, № 11. — P. 2064-2068.
22. Pandey A., Shrivastava A.K., Saxena K. Neuron specific enolase and c-reactive protein levels in stroke and its subtypes: correlation with degree of disability // Neurochem. Res. — 2014. — V. 39, № 8. — P. 1426-1432.
23. Prognostic value of neuron specific enolase and IL-10 in ischemic stroke and its correlation with degree of neurological deficit / Singh H.V., Pandey A., Shrivastava A.K. et al. // Clin. Chim. Acta. — 2013. — V. 419. — P. 136-138.
24. Short-term prognostic value of serum neuron specific enolase and S100B in acute stroke patients / González-García S., González-Quevedo A., Fernández-Concepción O. et al. // Clin. Biochem. — 2012. — V. 45, № 16–17. — P. 1302-1307.
25. Islam N., Ullah E., Akhtar N. Correlation between serum neuron specific enolase and functional neurological outcome in patients of acute ischemic stroke / Zaheer S., Beg M., Rizvi I. et al. // Annals of Indian Academy of Neurology. — 2013. — V. 16, № 4. — P. 504-508.
26. Correlation of Brain Biomarker Neuron Specific Enolase (NSE) with Degree of Disability and Neurological Worsening in Cerebrovascular Stroke / Bharosay A., Bharosay V.V., Varma M. et al. // Indian J. Clin. Biochem. — 2012. — V. 27, № 2. — P. 186-190.
27. Prognostic value of somatosensory evoked potentials, neuron-specific enolase, and S100 for short-term outcome in ischemic stroke / Haupt W.F., Chopan G., Sobesky J. et al. // J. Neurophysiol. — 2016. — V. 115, № 3. — P. 1273-1278.
28. Temporal profile and clinical significance of serum neuron-specific enolase and S100 in ischemic and hemorrhagic stroke / Brea D., Sobrino T., Blanco M. et al. // Clin. Chem. Lab. Med. — 2009. — V. 47, № 12. — P. 1513-1518.
29. The second elevation of neuron-specific enolase peak after ischemic stroke is associated with hemorrhagic transformation / Kim B.J., Kim Y.J., Ahn S.H. et al. // J. Stroke Cerebrovasc. Dis. — 2014. — V. 23, № 9. — P. 2437-2443.
30. Anand N. Stead L.G. Neuron-specific enolase as a marker for acute ischemic stroke: a systematic review // Cerebrovasc. Dis. — 2005. — V. 20, № 4. — P. 213-219.
31. Kaca-Oryńska M., Tomasiuk R., Friedman A. Neuron-specific enolase and S 100B protein as predictors of outcome in ischaemic stroke // Neurol. Neurochir. Pol. — 2010. — V. 44, № 5. — P. 459-463.
32. Myles P.S. Bispectral index monitoring in ischemic-hypoxic brain injury // J. Extra. Corpor. Technol. — 2009. — V. 41, № 1. — P. 15-19.
33. Bispectral Index Changes during Acute Brainstem TIA/Ischemia / Bleeker C.P., Smits B., Vos P.E., Mourisse J.M. // Case Rep. Med. — 2010. — V. 2010, Article ID 697185.
34. Bigham C., Bigham S., Jones C. Does the bispectral index monitor have a role in intensive care? // J. Intensive Care Soc. — 2012. — 13. — 314-9.
35. Monitoring of cortical activity postreperfusion. A powerful tool for predicting clinical response immediately after recanalization / Flores A., Ribó M., Rubiera M. et al. // J. Neuroimaging. — 2015. — V. 25, № 2. — P. 257-262.
36. Leggat C.S., Fischer G.W. Early detection of an acute cerebral event during cardiopulmonary bypass using a bispectral index monitor // Semin. Cardiothorac. Vasc. Anesth. — 2008. — V. 12, № 1. — P. 80-82.
37. The bispectral index in the diagnosis of perioperative stroke: a case report and discussion / Welsby I.J., Ryan J.M., Booth J.V. et al. // Anesth. Analg. — 2003. — V. 96, № 2. — P. 435-437.
38. Murkin J.M., Arango M. Near-infrared spectroscopy as an index of brain and tissue oxygenation // Br. J. Anaesth. — 2009. — V. 103 (Suppl. 1). — P. i3-i13.
39. Validation of frontal near-infrared spectroscopy as noninvasive bedside monitoring for regional cerebral blood flow in brain-injured patients / Taussky P., O’Neal B., Daugherty W.P. et al. // Neurosurg. Focus. — 2012. — V. 32, № 2. — P. E2.
40. The evaluation of cerebral oxygenation by oximetry in patients with ischaemic stroke / Demet G., Talip A., Nevzat U. et al. // J. Postgrad. Med. — 2000. — V. 46, № 2. — P. 70-74.
41. Brain oxygen supply in the residual period of ischemic stroke / Kamenskaia O.V., Levicheva E.N., Loginova I.Iu., Karpenko A.A. // Zh. Nevrol. Psikhiatr. Im. S.S. Korsakova. — 2012. — V. 112, № 8 (Pt. 2). — P. 20-24.
42. Cerebral oximetry with cerebral blood volume index in detecting pediatric stroke in a pediatric ED / Abramo T.J., Harris Z.L., Meredith M. et al. // Am. J. Emerg. Med. — 2015. — V. 33, № 11. — P. 1622-1629.
43. Noninvasive cerebral oximetry during endovascular therapy for acute ischemic stroke: an observational study / Hametner C., Stanarcevic P., Stampfl S. et al. // J. Cereb. Blood Flow Metab. — 2015. — V. 35, № 11. — P. 1722-1728.
44. Outcome improvement and cost reduction in an increasingly morbid cardiac surgery population / Goldman S.M., Sutter F.P., Wertan M.A. et al. // Semin. Cardiothorac. Vasc. Anesth. — 2006. — V. 10, № 2. — P. 171-175.
45. Murkin J.M. Is it better to shine a light, or rather to curse the darkness? Cerebral near-infrared spectroscopy and cardiac surgery // Eur. J. Cardiothorac. Surg. — 2013. — V. 43, № 6. — P. 1081-1083.
46. Cerebral near-infrared spectroscopy monitoring and neurologic outcomes in adult cardiac surgery patients: a systematic review / Zheng F., Sheinberg R., Yee M.S. et al. // Anesth. Analg. — 2013. — V. 116, № 3. — P. 663-676.
47. Cerebral monitoring in patients undergoing carotid endarterectomy using a triple assessment technique / Ali A.M., Green D., Zayed H. et al. // Interact. Cardiovasc. Thorac. Surg. — 2011. — V. 12, № 3. — P. 454-457.
48. The value of near-infrared spectroscopy measured cerebral oximetry during carotid endarterectomy in perioperative stroke prevention. A review / Pennekamp C.W., Bots M.L., Kappelle L.J. et al. // Eur. J. Vasc. Endovasc. Surg. — 2009. — V. 38, № 5. — P. 539-545.
49. Cerebral oximetry monitoring during carotid endarterectomy: effect of carotid clamping and shunting / Cuadra S.A., Zwerling J.S., Feuerman M. et al. // Vasc. Endovascular. Surg. — 2003. — V. 37, № 6. — P. 407-413.
50. Continuous cerebral blood flow autoregulation monitoring in patients undergoing liver transplantation / Zheng Y., Villamayor A.J., Merritt W. et al. // Neurocrit. Care. — 2012. — V. 17, № 1. — P. 77-84.
51. Cerebrovascular effects of hemodialysis in chronic kidney disease / Prohovnik I., Post J., Uribarri J. et al. // J. Cereb. Blood Flow Metab. — 2007. — V. 27, № 11. — V. 1861-1869.

/65-1.jpg)
/67-1.jpg)
/68-1.jpg)