Одним из признаков современной эпохи является резкое «постарение» населения, особенно в развитых странах. В возрастной структуре населения происходят глубокие изменения — стремительно увеличивается процент людей старших возрастных групп. По данным ООН, в 1950 году в мире проживало около 214 млн лиц старше 60 лет, в 1975 году их число увеличилось до 350 млн, а в 2000 году — до 590 млн. По прогнозам ООН, в 2025 году их численность превысит 1 млрд 121 млн человек, то есть увеличится в 6 раз по сравнению с 1950 годом (за это время общая численность населения планеты возрастет в 3 раза). До 2050 года численность людей преклонного возраста достигнет 2 млрд [1, 3].
В развитых странах и в Украине процесс демографического перехода уже практически закончился. Люди старше 60 лет часто не обращают внимания на нарушения памяти, настроения и поведения, рассматривая их как неминуемый результат старения. К сожалению, такая неправильная точка зрения характерна и для их родственников, которые объясняют указанные проявления пожилым возрастом и не думают о том, что существуют возможности медицинской помощи [2, 3].
Таким образом, для повышения качества лечения когнитивных нарушений и профилактики тяжелой деменции представляется важным выявление когнитивных нарушений уже на первичном уровне оказания медицинской помощи.
Определение понятий и классификация когнитивных расстройств
Когнитивные нарушения делятся на легкие, умеренные и тяжелые.
Под легкими когнитивными нарушениями подра–зумевают невыраженные затруднения в повседневной деятельности, связанные в основном с нарушением запоминания нового материала. Легкие когнитивные нарушения могут быть проявлением как патологических изменений, так и физиологического, нормального старения.
Умеренные когнитивные нарушения характеризуются значительными затруднениями в повседневной деятельности с сохранением памяти лишь на хорошо заученную или личную информацию.
Тяжелые когнитивные нарушения проявляются неспособностью запоминать новую информацию, а также воспроизводить уже имеющуюся.
Легкие и умеренные когнитивные нарушения объединяют в категорию недементных [4, 5].
Недементные когнитивные нарушения. Когнитивные нарушения, выходящие за пределы возрастной нормы, но не достигающие степени деменции, отмечаются у 11–17 % лиц преклонного возраста.
В неврологической практике для обозначения когнитивных нарушений, не достигающих степени выраженности, соответствующей деменции, получил распространение термин «умеренные когнитивные расстройства» (англ. mild cognitive impairment, MCI). При этом когнитивные нарушения рассматриваются как синдром в клинической картине различных неврологических заболеваний (как правило, на ранних стадиях энцефалопатии различного генеза или нейродегенеративных заболеваний).
В психиатрической практике указанные когнитивные нарушения, которые не достигают степени выраженности, соответствующей деменции, могут классифицироваться как «органическое легкое когнитивное расстройство» (код F06.7) в рубрике МКБ-10 «Другие психические расстройства вследствие повреждения или дисфункции головного мозга либо вследствие физической болезни» раздела F00-F09 «Органические, включая симптоматические, психические расстройства» [6].
Деменция — приобретенное снижение интеллекта, возникающее в результате органических поражений головного мозга и нарушающее социальную адаптацию больного, т.е. делающее его неспособным к профессиональной деятельности и бытовой независимости.
Деменция выявляется у 5–8 % пожилых людей, и с увеличением возраста ее распространенность возрастает (происходит увеличение в 2 раза каждые 10 лет). В связи с ростом доли пожилых людей в обществе проблема деменции приобретает все более актуальное звучание, становясь одной из основных проблем текущего столетия — «болезнью века» или даже «эпидемией века». Между тем современные возможности лечения деменции способны (по крайней мере у части больных) существенно отсрочить момент наступления беспомощности, облегчить жизнь пациентам и их родственникам, снизить социально-экономическое бремя общества в целом [7].
20–25 лет назад было выявлено, что частой причиной атрофии головного мозга является церебральный амилоидоз, то есть появление и увеличение амилоидных бляшек в паренхиме мозга и в меньшей степени в сосудах мозга с последующим появлением внутриклеточных нейрофибриллярных сплетений тау-протеина и как следствие этих процессов — гибель нейронов. Такая первичная атрофия эквивалентна той, которую описал Альцгеймер.
Такой подход к пониманию причин деменции позволил четко разграничить первично-дегенеративную деменцию — болезнь Альцгеймера (БА) и сосудистую деменцию, то есть деменцию, связанную с нарушением мозгового кровообращения, которое обусловлено разрушением участков ткани головного мозга, отвечающих за формирование памяти и обеспечение интеллектуального уровня.
Термин «деменция» в широком смысле определяет нарушение когнитивных функций, которое не соответствует возрастным особенностям взрослого индивидуума.
Общие симптомы деменции:
— снижение памяти, влияющее на работоспособность и повседневную активность;
— сложности в выполнении повседневных действий;
— проблемы с языком (речью);
— дезориентация;
— изменение суждений (взглядов);
— проблемы с абстрактным мышлением;
— изменения настроения и поведения;
— изменения личности;
— снижение инициативы.
Психические и поведенческие расстройства при деменции. Кроме когнитивных нарушений, у лиц с болезнью Альцгеймера отмечаются различные психопатологические и поведенческие нарушения. Возникновение у больного нарушений поведения создает членам семьи гораздо больше трудностей, чем недостаточность когнитивных функций, и является наиболее частой причиной его госпитализации. Агрессия и другие поведенческие симптомы (бесцельная активность, попытки ухода из дома, перебирание вещей) заметно ухудшают качество жизни как самих пациентов, так и ухаживающих за ними лиц. Наиболее частым коморбидным психическим расстройством, сопровождающим деменцию, является депрессия [8–10].
Дифференциальная диагностика деменций. Болезнь Альцгеймера является наиболее частой причиной деменции. Мультиинфарктная деменция в настоящее время рассматривается в рамках сосудистой деменции, куда относят и болезнь Бинсвангера, церебральную аутосомно-доминантную артериопатию с подкорковыми инфарктами и лейкоэнцефалопатией (CADASIL). Распространенность сосудистой деменции составляет около 20 % среди других ее видов. В начале 1990-х гг. были открыты другие виды деменции. Второй по частоте является деменция с тельцами Леви (ДТЛ), распространенность которой составляет 15–25 %. Прослежена взаимосвязь между деменцией с тельцами Леви и болезнью Паркинсона, еще одним заболеванием с тельцами Леви. Фронтотемпоральная деменция (ФТД) — клинический синдром, манифестация которого связана с поведенческими расстройствами, исполнительной дисфункцией и/или прогрессирующей афазией. Наиболее частые нейропатологические субстраты ФТД включают болезнь Пика, кортикобазальную дегенерацию, фронтотемпоральную долевую дегенерацию с убиквитин-положительными включениями. Менее часто отмечаются нейропатологические субстраты — БА, прогрессирующий надъядерный паралич. Эта категория насчитывает 10–15 % случаев деменции [11, 12].
Цели лечения. До сих пор нет как средства излечения от необратимой деменции, так и эффективного метода ее предотвращения. На сегодня глобальная цель терапии — сделать жизнь пациента и его родственников или ухаживающих за пациентом людей настолько полной (качественной) и переносимой, насколько это возможно. Цели терапии варьируют в зависимости от того, насколько далеко зашла болезнь в том или ином конкретном случае.
В настоящее время могут быть достигнуты следующие цели в лечении БА и других необратимых деменций:
— легкая и умеренная степень тяжести деменции: улучшить или стабилизировать когнитивные функции и отсрочить их последующее снижение; поддерживать способность ежедневной деятельности и поведения; поддерживать или восстановить независимость;
— среднетяжелая и тяжелая степень деменции: улучшить или стабилизировать когнитивные функции даже на низком уровне и отсрочить их последующее снижение; стараться отсрочить потребность в госпитализации; при необходимости облегчать помощь и обеспечивать поддержку людям, обеспечивающим уход за больными.
Эффективность лечения деменции с точки зрения доказательной медицины. В 1997 г. в ЕС были приняты руководства по клиническим исследованиям препаратов для лечения деменции, в соответствии с которыми эффективность определялась изменениями по крайней мере двух из следующих уровней: когнитивные способности; ежедневная (рутинная) деятельность (функции); общее клиническое впечатление.
В настоящее время у больных с деменцией, в соответствии с принципами доказательной медицины, показана эффективность лишь двух классов лекарственных средств: ингибиторов холинэстеразы и антиглутаматергических средств. Именно они рекомендованы экспертами Европейской федерации неврологических обществ (EFNS) для лечения основных нозологических форм деменции: болезни Альцгеймера, сосудистой деменции, деменции с тельцами Леви и болезни Паркинсона с деменцией [13, 14].
Основой применения препаратов первого класса — ингибиторов холинэстеразы (ИХЭ) является так называемая холинергическая гипотеза, согласно которой когнитивные, поведенческие и функциональные расстройства при БА, деменции с тельцами Леви, болезни Паркинсона и некоторых других формах деменции объясняются (по крайней мере частично) гибелью холинергических нейронов базального ядра Мейнерта и снижением активности холинергических систем в мозге. В настоящее время применяются три ИХЭ: ривастигмин, галантамин и донепезил.
Ко второму классу препаратов, эффективность которых четко продемонстрирована при деменции, относится мемантин — селективный блокатор NMDA-глутаматных рецепторов. Механизм его действия связан с модулированием глутаматергической передачи, которая опосредует кортико-кортикальные и кортико-субкортикальные взаимосвязи в головном мозге. В серии контролируемых исследований доказана способность мемантина улучшать и стабилизировать когнитивные функции, повседневную активность, уменьшать поведенческие нарушения у пациентов с БА (как на ранней стадии, так и особенно на стадии умеренной и тяжелой деменции). Положительное влияние мемантина на когнитивные функции отмечено и при сосудистой деменции.
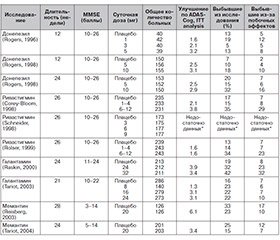
Мемантин — препарат первого выбора при умеренной и тяжелой деменции в качестве монотерапии или в комбинации с ИХЭ. В эксперименте показано, что мемантин способен защищать клетки от токсического эффекта возбуждающих аминокислот и тормозить образование нейрофибриллярных клубочков, влияя на метаболизм тау-протеина, что является одним из ключевых звеньев патогенеза БА. Доказано, что мемантин снижает эффект гиперактивированности глутаминергической системы, что обеспечивает прохождение нормальных сигналов между нейронами, и в то же время предотвращает эксайтотоксичные эффекты чрезмерного выделения глутамата. В ходе разнообразных клинических испытаний была доказана эффективность и переносимость мемантина в результате применения у пациентов со среднетяжелыми и тяжелыми формами болезни Альцгеймера. В сравнении с плацебо лечение мемантином обеспечивало улучшение, стабилизацию или же менее выраженное ухудшение по основным направлениям оценки состояния: когнитивных способностей, функционирования в повседневной жизни, поведения и общего реагирования [15–18].
Мемантин характеризуется хорошей переносимостью при сравнимой с плацебо выраженности побочных эффектов, причем как у пожилых, так и у более молодых пациентов. Тем самым определяются возможности препарата как средства эффективной и мягкой терапии для больных с деменцией.
Лечебный эффект как ИХЭ, так и мемантина даже у пациентов с одним и тем же диагнозом весьма вариабелен. Так, у больных с БА после начала приема ИХЭ любой положительный эффект (улучшение, временная стабилизация или снижение скорости прогрессирования) отмечался примерно в 60–70 % случаев, при этом лишь у 1/3 пациентов после начала приема ИХЭ отмечалось клинически значимое улучшение (оценка по MMSE повышалась на 1–2 пункта), и лишь у 10–20 % пациентов отмечалось значительное («драматическое») улучшение с повышением оценки по MMSE на 3 пункта и более. Поскольку надежные предикторы эффективности антидементных средств до настоящего времени неизвестны, первоначальная оценка их эффективности у всех пациентов, которым они показаны, должна проводиться в процессе пробной терапии в течение 6 мес. Заранее прогнозировать эффективность того или иного антидементного средства у данного конкретного пациента сложно. Если симптомы улучшаются или по крайней мере не ухудшаются столь быстро, как ранее, можно говорить об эффективности лечения. В тех случаях, когда зарегистрирован положительный эффект препарата хотя бы на одну сферу (когнитивную, функциональную, поведенческую), необходим длительный, часто многолетний прием данного средства (при условии его удовлетворительной переносимости). Контроль эффективности долгосрочной базисной терапии должен проводиться каждые 6 месяцев [20, 21].
Если ИХЭ противопоказаны, плохо переносятся или неэффективны, вместо них может применяться мемантин в качестве монотерапии. Но если ИХЭ продемонстрировал некоторую эффективность (хотя бы на ранней стадии лечения), то целесообразнее продолжать его применение, добавляя мемантин и переходя, таким образом, на комбинированную базисную терапию. За счет разных механизмов действия и точек приложения при комбинации ИХЭ с мемантином достигается не только повышение эффективности терапии, особенно в долгосрочном плане (оно может заключаться в улучшении когнитивного статуса, повседневной активности, поведения), но и улучшение переносимости лечения [22].
Только длительный прием антидементных средств позволяет пациентам и их близким извлечь максимальную пользу из лечения: при этом условии достигается задача длительного поддержания относительной бытовой независимости, предупреждения развития поведенческих нарушений [23, 24]. Показано, что у части пациентов эффективность антидементных средств может сохраняться в течение долгого времени.
Рекомендации по применению мемантина и ИХЭ отражены в унифицированном клиническом протоколе первичной, вторичной, третичной (высокоспециализированной) и паллиативной медицинской помощи при деменции (Приказ МЗ Украины № 736 от 19.07.2016).
Учитывая то, что лечение деменции требует значительных материальных затрат, а большинство пациентов с этой патологией в Украине относятся к малообеспеченным, недостаточно социально защищенным слоям населения, очень важным фактором приверженности к лечению является снижение затрат на препараты. Одним из возможных путей снижения стоимости лечения является применение генерических препаратов. При этом следует отметить, что генерические средства должны быть соответствующего качества. Особая важность последнего определяется тем, что эти препараты назначаются пожилым людям, обычно имеющим коморбидную соматическую патологию, и для крайне длительного лечения.
Эта политика положена в основу формирования различного рода списков — перечней основных лекарственных средств, формулярных перечней и т.д., в которые ЛС следует вносить под международным непатентованным наименованием (МНН). Однако для ЛС с узким индексом терапевтического действия (противосудорожных средств, сердечных гликозидов, антиаритмиков, антикоагулянтов непрямого действия и т.д.) делается исключение — при их внесении в перечни рекомендуется указывать не только МНН, но и конкретные торговые наименования. Эффективность политики генерических замен зависит от качества генериков и их терапевтической эквивалентности оригинальному препарату. В последние годы в литературе все чаще поднимается вопрос о «скрытой» стоимости генериков. В 2000 г. в рубрике официальных материалов ВОЗ была опубликована статья, в которой подчеркивалась необходимость доказывать качество генериков при их регистрации, представляя документы, подтверждающие, что препарат был произведен с соблюдением принципов надлежащей производственной практики (Good Manufacturing Practice — GMP), что он соответствует критериям качества, снабжен адекватной инструкцией по медицинскому применению и является терапевтически эквивалентным (и, следовательно, взаимозаменяемым) аналогичным продуктам, уже находящимся на фармацевтическом рынке.
Отсутствие терапевтической эквивалентности генериков оригинальному препарату наиболее опасно для некоторых групп ЛС, таких как психотропные, сердечно-сосудистые, гормональные и влияющие на обмен веществ, а также для определенных категорий пациентов — лиц пожилого возраста, детей, инвалидов, больных с психическими расстройствами.
Выводы
Деменция является одной из наиболее актуальных проблем современной неврологии и психиатрии, современные взгляды на которую позволяют назначать более адекватную терапию.
1. Терапия должна начинаться на максимально ранних этапах болезни.
2. Терапия должна быть непрерывной, длительной и адекватной.
3. Обязательным является установление генеза деменции и по возможности — последующее лечение этиологического фактора.
4. Эффективность терапии необратимых форм деменции в многоцентровых исследованиях была доказана только для ингибиторов антихолинэстеразы и препаратов, восстанавливающих глутаматную нейротрансмиссию и ограничивающих эксайтотоксичность (мемантин).
5. В отношении ряда новых лекарственных средств исследования продолжаются.
6. Нет доказательных данных в отношении эффективности каких-либо препаратов при умеренных когнитивных нарушениях, и поэтому решение о назначении лечения принимается путем соглашения между врачом и пациентом.
Конфликт интересов. Не заявлен.
MEMO-PUB-022017-017
Список литературы
1. Дубенко А.Е., Коростий В.И., Литовченко Т.А. Диагностика и лечение когнитивных нарушений. Реалии и перспективы // Здоровье Украины (ч. 1), тематический номер «Неврология. Психиатрия». — 2011. — № 3 (18). — С. 16-18.
2. Дубенко А.Е., Коростий В.И., Литовченко Т.А. Диагностика и лечение когнитивных нарушений. Реалии и перспективы // Здоровье Украины (ч. 2), тематический номер «Неврология. Психиатрия». — 2011. — № 4 (19). — С. 24-26.
3. Захаров В.В., Яхно Н.Н. Когнитивные расстройства в пожилом и старческом возрасте: Методическое пособие для врачей. — М., 2005. — 71 с.
4. Wolk D.A., Mancuso L., Kliot D., Arnold S.E. Dicker–son B.C. Familiarity-based memory as an early cognitive marker of preclinical and prodromal AD // Neuropsychologia. — 2013. — 51. — P. 1094-1102.
5. Gautheir S., Wirth Y., Mobius H.J. Effects of memantine in behavioural symptoms in Alzheimer’s disease patients: an analysis of the neuropsychiatric inventory (NPI) data of two randomized, controlled studies // Int. J. Geriatr. Psychiatry. — 2005. — Vol. 20. — P. 1-6.
6. Когнітивні та емоційні порушення внаслідок соматичних захворювань у осіб працездатного віку / І.М. Кожина, І.А. Григорова, В.І. Коростій та ін. — Харків: Раритети України. — 2011. — 80 с.
7. Scottish Intercollegiate Guideline Network (SIGN). Interventions in the management of behavioural and psychological aspects of dementia. — Edinburgh: SIGN; 2006 (SIGN publicationno. 86).
8. Дубенко А.Е., Коростий В.И. Депрессия и деменция: коморбидность, дифференциальная диагностика и тактика ведения пациентов // НейроNEWS. — 2014. — № 2/1 «Болезни пожилого и старческого возраста». — С. 22-28.
9. Пономарева Е.В. Депрессия при болезни Альцгеймера // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2008. — Т. 108, № 2. — С. 4-11.
10. Яхно Н.Н. Когнитивные расстройства в неврологической клинике // Неврол. журн. — 2006. — Т. 11 (приложение № 1). — С. 4-13.
11. The clinical guideline has been amended to incorporate Donepezil, galantamine, rivastigmine and memantine for the treatment of Alzheimer’s disease (NICE technology appraisal guidance 217) 2011.
12. Руководство по гериатрической психиатрии / Под ред. проф. С.И. Гавриловой. — М.: Пульс, 2011. — 398 с.
13. Yesavage J.A. Development and validation of ageriatric depression screening scale: A preliminary report // Journal of Psychiatric Research. — 1983. — 17. — 37-49.
14. Гаврилова С.И. Фармакотерапия болезни Альцгеймера. — М.: Пульс, 2007. — 359 с.
15. Колыхалов И.В. Поведенческие и антипсихотические эффекты мемантина у пациентов с деменцией // Психиатрия. — 2008. — № 4–6. — С. 65-69.
16. Neal M., Briggs M. Validation therapy for dementia (Cochrane Review) // The Cochrane Library. — 2003. — Issue 3.
17. Callaway E. Alzheimer’s drugs take a new tack // Nature. — 2012. — 489. — 13-14. — http://dx.doi.org/10.1038/489013a.
18. Areosa Sastre A., Sherriff F., McShane R. Memantine for dementia (Cochrane Review) // The Cochrane Library. — Chichester, UK: John Wiley & Sons, Ltd. 2005. — Issue 3.
19. Grеen R.G. Diagnosis and Treatment of Alzheimer’s Disease and other Dementias, 2005.
20. Reisberg B., Doody R., Stoffler A., Schmitt F., Ferris S., Mobius H.J. et al. Memantine in moderate-to-severe Alzheimer’s disease // N. Engl. J. Med. Overseas. Ed. — 2003. — 348(14). — 1333-41.
21. Tariot P.N., Farlow M.R., Grossberg G.T., Graham S.M., McDonald S. and Gergel I. Memantine Treatment in Patients with Moderate to Severe Alzheimer Disease Already Receiving Donepezil: A Randomized Controlled Trial // JAMA. — 2004. — 291(3). — 317-24.
22. Winblad B., Poritis N. Memantine in severe dementia: results of the 9M-Best Study (Benefit and efficacy in severely demented patients during treatment with memantine) // Int. J. Geriatr. Psychiatry. — 1999. —14(2). —135-46.
23. Orgogozo J.M., Rigaud A.S., Stoffler A., Mobius H.J., Forette F. Efficacy and safety of memantine in patients with mild to moderate vascular dementia: a randomized, placebo-controlled trial (MMM 300) // Stroke. — 2002. — 33(7). — 1834-9.
24. Wilcock G., Moebius H.J., Stoeffler A. A double-blind, placebo-controlled multicentre study of memantine in mild to moderate vascular dementia (MMM500) // Int. Clin. Psychopharmacol. — 2002. — 17(6). — 297-305.

/112-1.jpg)