Одной из основных экономических и социально-медицинских проблем в мире является постарение населения, которое приводит к значительному увеличению в структуре общей заболеваемости возрастзависимой патологии — сосудистых заболеваний мозга, артериальной гипертензии (АГ), болезней сердца, сахарного диабета, гиперхолестеринемии и др. Важным аспектом является и тот факт, что данные заболевания имеют общие механизмы формирования, могут потенцировать развитие и усугублять течение друг друга.
В структуре неврологической патологии одной из острейших и глобальных медико-социальных проблем, наносящих огромный экономический ущерб обществу, являются сосудистые заболевания головного мозга. Большой удельный вес среди цереброваскулярных заболеваний (ЦВЗ) имеют хронические нарушения мозгового кровообращения, рост частоты встречаемости которых в основном и предопределяет увеличение распространенности цереброваскулярных заболеваний [1, 2]. В Украине и странах СНГ для обозначения хронических нарушений мозгового крово–обращения уже многие десятилетия используется термин «дисциркуляторная энцефалопатия» (ДЭ). Согласно традиционным представлениям, дисциркуляторная энцефалопатия — это хроническое прогрессирующее многоочаговое или диффузное поражение головного мозга различной этиологии, обусловленное хронической сосудистой мозговой недостаточностью и/или повторными эпизодами острых нарушений мозгового кровообращения и характеризующееся постепенным нарастанием неврологических, нейропсихологических и психических нарушений [1, 3, 4].
Облигатными клиническими проявлениями ДЭ на всех стадиях ее прогрессирования являются когнитивные и тревожно-депрессивные нарушения, выраженность которых прямо пропорционально коррелирует с тяжестью ДЭ, а также существенно ухудшает качество жизни пациентов, ограничивая все виды их активности [5–8]. Такая клиническая представленность ДЭ обу–словлена наиболее частым поражением в условиях хронической ишемии мозга церебральных структур, которые в большей степени ответственны за осуществление эмоциональных реакций и мнестических процессов, — гиппокампа, таламуса, чечевицеобразного ядра, участков теменных и височных отделов коры [3, 4, 7]. Основными нейрон-повреждающими процессами, которые запускаются в условиях ишемии мозга, являются усиленное высвобождение возбуждающих аминокислот, избыточное накопление ионов кальция внутри нейронов, накопление свободных радикалов и провоспалительных факторов, развитие нейромедиаторного дисбаланса, мембранной патологии, снижение уровня макроэргических соединений [2, 4, 8–11]. Четкое и углубленное понимание основных звеньев данного патологического ишемического каскада позволило значительно оптимизировать терапевтические стратегии ДЭ и обусловило целесообразность использования группы нейропротекторов — препаратов, непосредственно влияющих на патогенетические механизмы гибели нейронов в условиях хронической ишемии мозга [9, 12–14].
Одним из таких препаратов является Цитиколин (холинцитидиндифосфат), который состоит из двух биологически активных веществ — природных метаболитов цитидина и холина. В организме цитидин и холин проникают через гематоэнцефалический барьер в мозг, после чего из них ресинтезируется цитиколин-5-дифосфохолин, основными биологическими эффектами которого являются синтез фосфолипидов нейрональных мембран; ослабление активности фосфолипазы А2; синтез ацетилхолина; стимуляция синтеза глутатиона и ослабление процессов пероксидации липидов; окисление бетаина — ведущего донатора метильных групп в энергетических реакциях в ЦНС [15, 16].
Известно, что фосфолипиды в головном мозге играют важнейшую роль, так как формируют структурно-функциональную основу нейрональных мембран, обеспечивающих деятельность нервных клеток и мозга в целом (поддержание ионного баланса и активности мембраносвязанных ферментов, обеспечение проведения нервного импульса и др.). В условиях ишемии отмечается снижение содержания фосфолипидов в мозге, обусловленное как ослаблением биосинтеза, так и в основном усилением деградации фосфатидилхолина за счет активации ведущего фермента катаболизма фосфолипидов — фосфолипазы А2 [3, 7, 17]. Следовательно, активация биосинтеза мембранных фосфолипидов нейронов мозга, в первую очередь фосфатидилхолина, и ослабление активности фосфолипазы А2 являются важнейшими механизмами действия цитиколина, обу–словливающими его нейропротекторную эффективность [15, 17, 18].
Недавно проведенные исследования позволили также доказать способность цитиколина уменьшать выраженность эксайтотоксичности в условиях ишемии путем блокады активации выброса глутамата, играющего ведущую роль в деструкции нейрональных мембран [19, 20].
Помимо нейропротекторных свойств значимыми представляются и нейромедиаторные механизмы действия цитиколина. С учетом того, что холин является предшественником ацетилхолина в процессе его биосинтеза, было сделано предположение о возможности стимуляции холинергических процессов в мозге под влиянием цитиколина, особенно в условиях ослабления холинергической нейромедиации, которая развивается при цереброваскулярной патологии [16, 18, 21]. В экспериментах на животных было выявлено стимулирующее влияние цитиколина на процессы памяти и обучения, сочетающееся с повышением включения CDP-холина в корковые холинергические нейроны [22].
Не менее важной является способность цитиколина активировать дофаминергические процессы в мозге путем стимуляции ключевого фермента биосинтеза дофамина — тирозингидроксилазы [15, 18].
В других исследованиях была доказана способность цитиколина стимулировать образование новых межнейронных контактов за счет роста дендритов пирамидальных нейронов коры в зоне ишемии [23], что было расценено исследователями как уникальный нейропротекторный механизм цитиколина, играющий важнейшую роль в восстановлении функций мозга при ишемическом повреждении.
Еще одним существенным аспектом действия цитиколина является наличие у него антиагрегантных свойств, т.е. способности уменьшать агрегацию тромбоцитов — важнейшего компонента развития ишемического поражения головного мозга [22].
В клинической практике цитиколин продемонстрировал высокую эффективность как инструмент коррекции когнитивных нарушений при деменциях различного генеза (прежде всего болезни Альцгеймера (БА) и смешанных форм), тесно связанных с возрастными изменениями мозга [24]. В Кокрейновском обзоре, включающем 14 исследований с участием 884 пожилых пациентов с разнообразными мнестическими нарушениями, проведен клинико-нейропсихологический анализ действия цитиколина. Полученные результаты продемонстрировали высокую эффективность цитиколина в улучшении памяти, поведения и эмоционального фона [24].
В ряде исследований продемонстрировано нейропротекторное действие цитиколина при острых и хронических нарушениях мозгового кровообращения. Показана эффективность препарата, связанная с его антиоксидантными, мембраностабилизирующими свойствами, способностью влиять на нормализацию энергетического потенциала нейронов и восстановление функционирования Na+-К+-АТФазы [25, 26].
Таким образом, экспериментально доказанные мультимодальные эффекты цитиколина и его клиническая эффективность позволили рассматривать препарат как нейропротектор широкого спектра действия, что определило его клинические возможности и перспективы использования при хронических нарушениях мозгового кровообращения.
Целью нашего исследования было изучение эффективности препарата Цитимакс-Дарница в лечении больных с дисциркуляторной энцефалопатией гипертонического и/или атеросклеротического генеза.
Материалы и методы
В комплексном клинико-неврологическом исследовании приняли участие 40 больных с дисциркуляторной энцефалопатией 2-й степени гипертонического генеза (31 пациент) или на фоне сочетания артериальной гипертензии и атеросклероза (9 пациентов), которые находились на стационарном лечении в неврологическом отделении научно-учебного медицинского комплекса «Университетская клиника» ХНМУ. Диагноз ДЭ выставлялся на основании жалоб больных, анамнестических данных, данных неврологического обследования, а также данных ультразвуковой допплерографии (УЗДГ), спиральной компьютерной томографии (СКТ) или магнитно-резонансной томографии (МРТ) головного мозга.
Все больные были разделены на 2 группы. Первая группа (основная) — 20 пациентов (средний возраст — 56,9 ± 1,7 года; женщин — 11, мужчин — 9), которым кроме базисного (стандартного) лечения был назначен препарат Цитимакс-Дарница (фирмы «Дарница») в дозе 1000 мг внутривенно капельно на 150 мл физиологического раствора хлорида натрия 1 раз в сутки в течение 10 дней. Вторая группа (сравнения) — 20 больных (средний возраст — 55,6 ± 1,8 года; женщин — 13, мужчин — 7), которым проводилось только базисное лечение. Базисная терапия включала дезагреганты (препараты ацетилсалициловой кислоты), гипотензивную (ингибиторы АПФ, блокаторы Са-каналов, диуретики, β-блокаторы), гиполипидемическую терапию.
Критериями исключения служили: инсульт, сердечная недостаточность III–IV функционального класса по NYHA, инфаркт миокарда, приобретенные пороки сердца. Также на основании УЗДГ-обследования были исключены пациенты с асимптомными стенозами (при стенозировании > 30 % диаметра сосуда) и симптомными стенозами магистральных артерий головы.
Результаты нейровизуализационного исследования (МРТ и СКТ) головного мозга позволили выявить расширение субарахноидальных пространств (у 33 пациентов), расширение желудочкового комплекса (у 21 пациента), наличие единичных лакун в перивентрикулярной области (у 12 пациентов), признаки лейкоареозиса (у 11 пациентов).
До и после лечения пациентам обеих групп проводили:
— комплексное клинико-неврологическое обследование. Для оценки основных субъективных клинических проявлений заболевания использовали балльную рейтинговую шкалу со стандартизированными критериями оценки выраженности каждого симптома: 0 — симптом отсутствует, 1 — легкие проявления, 2 — умеренная выраженность, 3 — выраженные проявления;
— оценку кратковременной слухоречевой памяти (тест Лурия «Запоминание 10 слов»);
— определение устойчивости внимания (таблицы Шульте);
— определение состояния когнитивных функций (шкала ММSE (Mini Mental State Examination); M.F. Folstein, S.E. Folstein, P.R. McHugh, 1975);
— оценку астенического состояния пациентов (шкала астенического состояния (ШАС); Л.Д. Малкова, Т.Г. Черткова);
— оценку состояния биоэлектрической активности мозга (электроэнцефалография (ЭЭГ) (показатели интенсивности основных ритмов ЭЭГ и частоты альфа-ритма) на аппарате DX-NT32, Украина).
Оценка нежелательных явлений проводилась на каждом визите, фиксировались все нежелательные явления, которые происходили с пациентами после приема первой дозы до окончания исследования. Оценка переносимости препарата Цитимакс-Дарница (инфузии в дозе 1000 мг № 10, фирмы «Дарница») проводилась на основании субъективных ощущений пациентов и результатов объективных клинических данных.
Полученные результаты были занесены в электронную базу данных и обработаны с помощью программы Statistica 6.0 с использованием параметрических и непараметрических методов вариационной статистики, разница была достоверной при р < 0,05.
Результаты и их обсуждение
При клиническом обследовании больных, которое включало подробный сбор жалоб, данных анамнеза, неврологического статуса и психодиагностического исследования, у всех обследованных нами пациентов были выявлены признаки ДЭ 2-й степени атеросклеротического и/или гипертонического генеза.
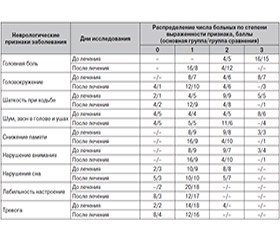
Динамика выраженности неврологической симптоматики до начала исследования и после инфузионного периода лечения представлена в табл. 1.
Как видно из табл. 1, добавление к базисной терапии препарата Цитимакс-Дарница (инфузии в дозе 1000 мг № 10, фирмы «Дарница») способствовало существенному количественному снижению выраженности неврологической симптоматики ДЭ и улучшению распределения больных внутри группы в зависимости от степени выраженности симптомов заболевания. Так, у пациентов основной группы степень выраженности субъективной неврологической симптоматики к концу инфузионной терапии снижалась более выраженно, чем в группе сравнения, с 3 до 1–2 баллов, а по некоторым показателям была отмечена полная редукция симптомов.
Аналогичная динамика была отмечена по данным объективного неврологического статуса. К окончанию лечения (10 дней) у пациентов основной группы, которая получала инфузии Цитимакса-Дарница в дозе 1000 мг/ сутки, отмечалось большее снижение частоты встречаемости и выраженности цефалгического синдрома, чем в группе сравнения (до лечения основная группа/группа сравнения — 100/100 % больных, к окончанию инфузионного периода — 30/60 % пациентов), вестибулоатактического синдрома (до лечения — 80/80 %, после инфузионного периода — 60/65 %), пирамидной недостаточности (до лечения — 65/60 %, после инфузионного периода — 55/55 %), астенического синдрома (до лечения — 100/100 %, после инфузионного периода — 55/60 %).
При использовании препарата Цитимакс-Дарница (инфузии в дозе 1000 мг № 10, фирмы «Дарница») дополнительно к базовой терапии в основной группе пациентов с ДЭ 2-й степени наблюдалось улучшение показателя общей когнитивной продуктивности (p < 0,05), отчетливые позитивные изменения функций вербальной памяти. Достоверно улучшались объемы непосредственного запоминания, а объемы отсроченного воспроизведения имели тенденцию к улучшению (табл. 2). Представленные данные свидетельствуют, что к окончанию инфузионного периода у обследованных пациентов с ДЭ 2-й степени значительно улучшились количественные показатели теста, характеризующие состояние памяти и внимания. Это выразилось в запоминании большинства слов уже со второго или третьего предъявления (повторений) стимульного материала, истощаемость к концу исследования существенно уменьшилась.
/120-2.jpg)
К окончанию периода лечения препаратом Цитимакс-Дарница результаты тестирования по таблице Шульте показали достоверное уменьшение времени отыскивания чисел на 22 %, в группе сравнения динамика эффективности работы по таблицам Шульте составила 3,8 %.
Результаты оценки выраженности астенического состояния больных с ДЭ 2-й степени по данным ШАС до и после терапии препаратом Цитимакс-Дарница (инфузии в дозе 1000 мг № 10, фирмы «Дарница») представлены в табл. 3.
Как видно из табл. 3, у обследованных больных обеих групп было выявлено снижение среднего балла астенического состояния по данным ШАС в сравнении с аналогичным показателем до лечения, более выраженное в группе пациентов с ДЭ 2-й степени, которые получали в дополнение к базисной терапии препарат Цитимакс-Дарница (инфузии в дозе 1000 мг № 10, фирмы «Дарница»).
Изучение состояния биоэлектрической активности головного мозга по данным ЭЭГ у пациентов основной группы, которые получали инфузионную терапию Цитимаксом-Дарница, выявило статистически достоверное снижение мощности в отдельных областях мозга в диапазоне медленных ритмов на фоне увеличения мощности альфа-1- и альфа-2-ритмов. Так, Цитимакс-Дарница (инфузии в дозе 1000 мг № 10, фирмы «Дарница») статистически достоверно уменьшал мощность в диапазоне дельта-ритма в лобной, затылочной и височной областях и снижал мощность в тета-диапазоне в лобной и центральной областях. Также было выявлено увеличение у больных этой группы мощности в диапазоне альфа-1- и альфа-2-ритма в лобной, центральной и височной областях. В то же время достоверного изменения мощности в диапазоне бета-1-, бета-2-ритмов у обследованных больных выявлено не было. В группе сравнения базовая терапия также способствовала снижению мощности медленных ритмов в лобной и центральной областях, но менее выраженному в сравнении с основной группой.
Изменения мощности основных ритмов ЭЭГ у больных ДЭ 2-й степени под влиянием препарата Цитимакс-Дарница (инфузии в дозе 1000 мг № 10, фирмы «Дарница») отражали способность препарата улучшать функциональное состояние подкорковых структур мозга, генерирующих медленный спектр ЭЭГ, и активизировать таламокортикальные связи, о чем свидетельствовало увеличение мощности альфа-ритма.
В ходе анализа основных показателей общеклинического состояния (артериальное давление, частота сердечных сокращений, ЭКГ) было отмечено, что использование препарата Цитимакс-Дарница не вызывало каких-либо побочных реакций кардиального характера. В общем и биохимическом анализах крови на фоне лечения не было выявлено негативного влияния препарата на параметры гомеостаза. В целом на основании результатов объективных клинических наблюдений и данных лабораторных исследований можно сделать вывод, что по результатам проведенного клинического исследования препарат Цитимакс-Дарница (инфузии в дозе 1000 мг № 10, фирмы «Дарница») показал хорошую переносимость и безопасность.
Выводы
1. Препарат Цитимакс-Дарница производства компании Дарница (Украина) в комплексном лечении больных с ДЭ 2-й стадии атеросклеротического и/или гипертонического генеза при внутривенном инфузионном введении в дозе 1000 мг в сутки в течение 10 дней способствует улучшению и регрессу субъективных и объективных симптомов данной патологии, оказывает положительное влияние на когнитивные функции, астеническую симптоматику пациентов, улучшает функциональное состояние подкорковых структур мозга и активизирует таламокортикальные связи.
2. Эффективность и безопасность препарата Цитимакс-Дарница позволяет рекомендовать его внутривенное капельное введение в дозе 1000 мг в сутки на физиологическом растворе хлорида натрия 1 раз в день на протяжении 10 дней в качестве нейропротектора при лечении больных ДЭ 2-й стадии гипертонического генеза или на фоне сочетания артериальной гипертензии и атеросклероза.
Список литературы
1. Дамулин И.В., Парфенов В.А., Скоромец А.А., Яхно Н.Н. Дисциркуляторная энцефалопатия. Болезни нервной системы: Рук-во для врачей / Под ред. Н.Н. Яхно, Д.Р. Штульмана. — М.: Медицина, 2005. — 275 с.
2. Мищенко Т.С. Достижения в области сосудистых заболеваний головного мозга за последние 2 года // Здоров’я України. — 2010. — № 5. — 12-13.
3. Кадыков А.С., Манвелов Л.С., Шахпаронова Н.В. Хронические сосудистые заболевания головного мозга: дисциркуляторная энцефалопатия: Руководство для врачей. — 2-е изд. — М.: ГЭОТАР-Медиа, 2013. — С. 232 с.
4. Камчатнов Л.Р. Дисциркуляторная энцефалопатия // Здоров’я України. — 2006. — № 19 (152). — С. 26-27.
5. Вознесенская Т.Г. Некогнитивные нервно-психические расстройства при когнитивных нарушениях в пожилом возрасте // Неврологический журнал. — 2010. — № 2. — С. 4-18.
6. Преображенская И.С., Яхно Н.Н. Возрастная когнитивная дисфункция: диагностика и лечение // Журн. невропатологии и психиатрии. — 2006. — Т. 106, № 11. — С. 33-38.
7. Левин О.С. Когнитивные расстройства. Гетерогенность умеренного когнитивного расстройства: диагностика и терапевтические аспекты / О.С. Левин, Л.В. Голубева // Consilium Medicum. — 2006. — Т. 8, № 2. — С. 106-112.
8. Яхно Н.Н., Преображенская И.С., Захаров В.В., Степкина Д.А., Локшина А.Б., Мхитарян Э.А., Коберская Н.Н., Савушкина И.Ю. Распространенность когнитивных нарушений при неврологических заболеваниях (анализ работы специализированного амбулаторного приема) // Неврология, нейропсихиатрия, психосоматика. — 2012. — № 2. — С. 30-35.
9. Кузнецова С.М., Егорова М.С. Нейрометаболическая коррекция кардиоцеребральных нарушений при дисциркуляторной энцефалопатии // Международный неврологический журнал. — 2016. — № 6 (84). — С. 41-48.
10. O’Brien J.T., Erkinjuntti T., Reisberg B., Roman G., Sawada T., Pantoni L., Bowler J.V., Ballard C., De Carli C., Gorelick P.B., Rockwood K., Burns A., Gauthier S., De Kosky S.T. Vascular cognitive impairment // Lancet Neurol.— 2003. — 2. — 89-98.
11. Savva G.M., Stephan B.C. Alzheimer’s Society Vascular Dementia Systematic Review Group. Epidemiological studies of the effect of stroke on incident dementia: a systematic review // Stroke. — 2010. — 41. — e41-e46.
12. Камчатнов П.Р., Зайцев К.А., Денисов Д.Б. Хронические расстройства мозгового кровообращения: возможности нейротрофической терапии // Consilium medicum. — 2011. — № 6.
13. Erkinjuntti T., Roman G., Gauthier S. et al. Emerging therapies for vascular dementia and vascular cognitive impairment // Stroke. — 2004. — Vol. 35. — Р. 1010-1017.
14. Бурчинский С.Г. Новые возможности нейропротекции // Междунар. неврол. журн. — 2006. — № 4. — С. 153-158.
15. Adibhatla R.M., Hatcher J.F., Dempsey R.J. Citicoline: neuroprotective mechanisms in cerebral ischemia // J. Neurochem. — 2002. — V. 80. — P. 12-23.
16. Secades J., Lorenzo J. Citicoline: Pharmacological and Clinical Review, 2006 Update Methods Find // Exp. Clin. Pharmacol. — 2006. — 27 (Suppl. B). — P. 1-56.
17. Rodgers A.P. Biochemistry of aging brain // Aging Brain. — N.Y.: N.Y. Univ. Press, 2004. — P. 44-61.
18. Secades J.J. CDP-choline: update and review of its pharmacology and clinical use // Methods & Find. Exp. Clin. Pharmacol. — 2002. — V. 24, suppl. B. — P. 1-53.
19. Hurtado O., Moro M.A., Cardenas A. et al. Neuroprotection afforded by prior citicoline administration in experimental brain ischemia: effects on glutamate transport // Neurobiol. Dis. — 2005. — V. 18. — P. 336-345.
20. Mir C., Clotet J., Aledo R. CDP-choline prevents glutamate-mediated cell death in cerebellar granule neurons // J. Mol. Neurosci. — 2003. — V. 20. — P. 53-60.
21. Hock C. Biochemical aspects of dementia // Dial. Clin. Neurosci. — 2003. — V. 5. — P. 27-34.
22. Lee H.J., Kang J.S., Kim Y.I. Citicoline protects against cognitive impairment in a rat model of chronic cerebral hypoperfusion // J. Clin. Neurol. — 2009. — 5. — 33-38.
23. Hurtado O., Cardenas A., Pradillo J.M., Morales J.R., Ortego F., Sobrino T., Castillo J., Moro M.A., Lizasoain I. A chronic treatment with CDP-choline improves functional recovery and increases neuronal plasticity after experimental stroke // Neurobiol. Dis. — 2007. — 26. — 105-111.
24. Roman G. Perspectives in the treatment of vascular dementia // Drugs Today. — 2000. — Vol. 36. — Р. 641-653.
25. Leys D., Henon H., Mackowiak-Cordoliani M.A., Pasquier F. Poststroke dementia // Lancet Neurol. — 2005. — 4. — 752-759.
26. Rasquin S.M., Verhey F.R., Lousberg R., Winkens I., Lodder J. Vascular cognitive disorders: memory, mental speed and cognitive flexibility after stroke // J. Neurol. Sci. — 2002. — 203-204. — 115-119.

/120-1.jpg)
/120-2.jpg)
/121-1.jpg)