Резюме
Актуальність. Інвазія Toxoplasma gondii у ВІЛ-інфікованих осіб може призвести до поглибленої імунопатології, що сприяє реактивації брадизоїтів та розвитку тяжких опортуністичних захворювань. Мета дослідження: вивчити особливості імунологічного статусу ВІЛ-інфікованих пацієнтів, які інвазовані токсоплазмами, та визначити предиктори розвитку токсоплазмозу мозку. Матеріали та методи. Обстежено 61 ВІЛ-інфіковану особу (33 особи серопозитивні на токсоплазмоз і 28 — серонегативні). Застосовували імуноферментний метод для визначення титрів специфічних протитоксоплазмозних IgG та IgМ; загальних IgM, IgA, IgG, а також IL-2, -4, -10, INF-γ, TNF-2α. Статистичну обробку здійснювали в статистичному пакеті програми Exсel з використанням t-критерію Стьюдента, а також z-критерію Фішера. Методом Байєса та послідовного статистичного аналізу А. Вальда визначали діагностичну цінність окремих лабораторних показників. Результати. У ВІЛ-інфікованих осіб виявлено дисбаланс цитокінів порівняно зі здоровими особами. У серонегативних на токсоплазмоз пацієнтів були підвищені рівні IL-4 (1,57 ± 0,30 пг/мл проти 0,81 ± 0,09 пг/мл, р < 0,001), IL-10 (9,81 ± 0,17 пг/мл проти 6,70 ± 0,13 пг/мл, р < 0,001), ТNF-2α (2,89 ± 0,08 пг/мл проти 1,90 ± 0,04 пг/мл, р < 0,001), INF-γ (9,30 ± 0,47 пг/мл проти 4,13 ± 0,12 пг/мл, р < 0,001), а також загальний IgG (20,63 ± 0,65 г/л проти 16,30 ± 0,94 г/л, р < 0,001). На відміну від серонегативних осіб у серопозитивних були вищими показники IL-10 (11,88 ± 0,50 пг/мл проти 9,81 ± 0,17 пг/мл, р < 0,05) та INF-γ (10,75 ± 0,44 пг/мл проти 9,30 ± 0,47 пг/мл, р < 0,05). Поєднання 2 ознак — INF-γ < 8,8 пг/мл та IL-4 < 0,77 пг/мл чи INF-γ < 8,8 пг/мл та IL-10 > 11,8 пг/мл або 3 ознак — IL-4 < 0,77 пг/мл, IL-10 > 11,8 пг/мл та IL-2 < 1,5 пг/мл є предиктором розвитку токсоплазмозного енцефаліту. Висновки. Установлено, що у ВІЛ-інфікованих осіб відмічаються підвищені рівні деяких прозапальних (TNF-α, INF-γ) та протизапальних (IL-4, -10) цитокінів, але порівняно із серонегативними в серопозитивних на токсоплазмоз осіб переважають показники INF-γ і IL-10. Проявом поглибленої імунопатології та предиктором розвитку токсоплазмозного енцефаліту є зниження рівня INF-γ, IL-4, -2 із підвищенням рівня IL-10 у контингенті серопозитивних на токсоплазмоз осіб.
Актуальность. Инвазия Toxoplasma gondii у ВИЧ-инфицированных лиц может привести к углубленной иммунопатологии, которая способствует реактивации брадизоитов и развитию тяжелых оппортунистических заболеваний. Цель исследования: изучить особенности иммунологического статуса ВИЧ-инфицированных пациентов, инвазированных токсоплазмами, и определить предикторы развития токсоплазмоза мозга. Материалы и методы. Обследован 61 ВИЧ-инфицированный человек (33 человека серопозитивные на токсоплазмоз и 28 — серонегативные). Применяли иммуноферментный метод для определения титров специфических противотоксоплазмозных IgG и IgМ; общих IgM, IgA, IgG, а также IL-2, -4, -10, INF-γ, TNF-2α. Статистическую обработку осуществляли в статистическом пакете программы Exсel с использованием t-критерия Стюдента, а также z-критерия Фишера. Методом Байеса и последовательного статистического анализа А. Вальда определяли диагностическую ценность отдельных лабораторных показателей. Результаты. У ВИЧ-инфицированных лиц выявлен дисбаланс цитокинов по сравнению со здоровыми людьми. У серонегативных на токсоплазмоз пациентов были повышены уровни IL-4 (1,57 ± 0,30 пг/мл против 0,81 ± 0,09 пг/мл, р < 0,001), IL-10 (9,81 ± 0,17 пг/мл против 6,70 ± 0,13 пг/мл, р < 0,001), ТNF-2α (2,89 ± 0,08 пг/мл против 1,90 ± 0,04 пг/мл, р < 0,001), INF-γ (9,30 ± 0,47 пг/мл против 4,13 ± 0,12 пг/мл, р < 0,001), а также общий IgG (20,63 ± 0,65 против 16,30 ± 0,94, р < 0,001). В отличие от серонегативных лиц у серопозитивных были выше показатели IL-10 (11,88 ± 0,50 пг/мл против 9,81 ± 0,17 пг/мл, р < 0,05) и INF-γ (10,75 ± 0,44 пг/мл против 9,30 ± 0,47 пг/мл, р < 0,05). Сочетание 2 признаков — INF-γ < 8,8 пг/мл и IL-4 < 0,77 пг/мл или INF-γ < 8,8 пг/мл и IL-10 > 11,8 пг/мл или 3 признаков — IL-4 < 0,77 пг/мл, IL-10 > 11,8 пг/мл и IL-2 < 1,5 пг/мл является предиктором развития токсоплазмозного энцефалита. Выводы. Установлено, что у ВИЧ-инфицированных лиц отмечаются повышенные уровни некоторых провоспалительных (TNF-α, INF-γ) и противовоспалительных (IL-4, -10) цитокинов, но по сравнению с серонегативными у серопозитивных по токсоплазмозу лиц преобладают показатели INF-γ и IL-10. Проявлением углубленной иммунопатологии и предиктором развития токсоплазмозного энцефалита является снижение уровня INF-γ, IL-4, -2 с повышением уровня IL-10 в контингенте серопозитивных на токсоплазмоз пациентов.
Background. Invasion of Toxoplasma gondii in human immunodeficiency virus (HIV) infected persons may cause more profound immunodeficiency, which may contribute to the reactivation of bradyzoites and development of severe opportunistic infections. The aim of our work was to study the features of the immune status of HIV-infected patients, who infested with Toxoplasma and to define the predictors of brain toxoplasmosis. Materials and methods. The study involved 61 HIV-positive people (33 individuals seropositive for toxoplasmosis and 28 — seronegative). Enzyme-linked immunosorbent assay was used for determining the titers of specific anti-Toxoplasma gondii immunoglobulin G (IgG) and IgM; total IgM, IgA, IgG, and interleukin-2 (IL-2), IL-4, IL-10, interferon-γ (INF-γ), tumor necrosis factor-2α (TNF-2α). Statistical analysis was performed in statistical software packages Excel using Student’s t-test and Fisher’s z-test, statistical analysis was conducted by Bayes and consistent A. Wald method. Results. In HIV-infected persons, we have identified an imbalance of cytokines compared with healthy individuals. The seronegative for toxoplasmosis patients had elevated levels of IL-4 (1.57 ± 0.30 pg/ml vs. 0.81 ± 0.09 pg/ml, р < 0.001), IL-10 (9.81 ± 0.17 pg/ml vs. 6.70 ± 0.13 pg/ml, р < 0.001), TNF-2α (2.89 ± 0.08 pg/ml vs. 1.90 ± 0.04 pg/ml, р < 0.001), INF-γ (9.30 ± 0.47 pg/ml vs. 4.13 ± 0.12 pg/ml, р < 0.001), and total IgG (20.63 ± 0.65 g/l vs. 16.30 ± 0.94 g/l, р < 0.001). In seropositive individuals, the rates of IL-10 were higher then in seronegative ones (11.88 ± 0.50 pg/ml vs. 9.81 ± 0.17 pg/ml, р < 0.05), as well as INF-γ (10.75 ± 0.44 pg/ml vs. 9.30 ± 0.47 pg/ml, р < 0.05). Combination of 2 features: INF-γ < 8.8 pg/ml and IL-4 < 0.77 pg/ml; or INF-γ < 8.8 pg/ml and IL-10 > 11.8 pg/ml; or 3 signs — IL-4 < 0.77 pg/ml, IL-10 > 11.8 pg/ml and IL-2 < 1.5 pg/ml — is predictive in terms of the development of toxoplasmosis encephalitis. Conclusions. It was found that HIV-positive people have elevated levels of certain pro-inflammatory (TNF-α, INF-γ) and anti-inflammatory (IL-4, IL-10) cytokines, but in people seropositive for toxoplasmosis compared to seronegative ones, the indicators of INF-γ and IL-10 dominated. A manifestation of profound immunopathology and a predictor of toxoplasmosis encephalitis is the reduction of INF-γ, IL-4, IL-2 with increased IL-10 level in seropositive persons.
Вступ
Імунопатологія у ВІЛ-інфікованих осіб є складною і різнобічною і пов’язана не тільки з дефіцитом CD4+-Т-лімфоцитів, але й з порушенням функції макрофагів, природних кілерів та CD8+-Т-лімфоцитів. Серйозних змін зазнає система цитокінів: знижується синтез інтерлейкіну (IL) -2, але посилюється секреція фактора некрозу пухлини (TNF) α, IL-6, IL-1β, інтерферону (INF) γ. Проліферація стовбурових клітин у кістковом мозку і тимусі пригнічується шляхом негативної регуляції інтерферонами та фактором некрозу пухлини, що пришвидшує розвиток дефіциту ключових імунокомпетентних клітин [1–3]. В організмі ВІЛ-інфікованих осіб, які додатково інвазовані токсоплазмами, виникають ще інші імунологічні проблеми. Внутрішньоклітинний паразит Toxoplasma gondii здатний до тривалої персистенції й уникнення імунного контролю, насамперед через пригнічення ефектів IFN-γ. Біологічний ефект останнього реалізується з рецепторів поверхні клітини до ядра і ДНК-транскрипції через механізм JAK-STAT сигнального шляху (Janus kinase and Signal Transducer and Activator of Transcription) [4]. В експе–рименті показано, що в людських фібробластах, що інвазовані Toxoplasma gondii, 127 IFN-γ-залежних генів не змогли активуватися під впливом стимуляції IFN-γ [5]. У мишачих моноцитах/макрофагах Toxoplasma gondii блокує IFN-γ-індуковану експресію мРНК і протеїну головного комплексу гістосумісності класу II [6], що є наслідком інтерференції внутрішньоклітинного паразита і STAT-1α [7]. Крім того, припускають, що токсоплазмостатичний ефект у клітинах різного типу може реалізовуватися через індукцію синтезу оксиду нітрогенію (NO) [8–10], яка залежить від стимулювання IFN-γ [10–12]. Проте для знищення збудника недостатньо впливу тільки одного IFN-γ, для цього повинні співдіяти інші сигнальні фактори, такі як TNF-α чи CD40L [13, 14]. З іншого боку, відомо, що існує фактор імунної системи, який справляє потужний пригнічувальний вплив на продукцію й ефекти INF-γ та інші компоненти протипаразитарного захисту, — це IL-10 [15]. Вченими виявлено посилену продукцію IL-10 спленоцитами в мишей під впливом інвазії Toxoplasma gondii, що може відігравати ключову роль в опосередкуванні імуносупресії в ураженому організмі [16]. Таким чином, різноманітні механізми уникнення імунного контролю, що властиві Toxoplasma gondii, сприяють не тільки персистуванню збудника, але, імовірно, ускладнюванню імунопатології у ВІЛ-інфікованих осіб.
Мета роботи: вивчити особливості імунологічного статусу ВІЛ-інфікованих пацієнтів, які інвазовані токсоплазмами, та визначити предиктори розвитку токсоплазмозу мозку.
Матеріали та методи
Обстежено 61 ВІЛ-інфіковану особу — 33 серопозитивних на токсоплазмоз пацієнти та 28 — серонегативних, яких відібрано випадковим способом, а саме в міру надходження в стаціонар. Застосовували імуноферментний метод для визначення титрів специфічних протитоксоплазмозних IgG та IgМ для діагностики серопозитивності щодо токсоплазмозної інвазії; також визначали IL-2, -4, -10, INF-γ, TNF-2α, загальні IgM, IgA, IgG у тест-системах для ІФА-діагностики (виробник «Вектор-Бест», Росія). Зазначене комплексне імунологічне обстеження проводили за письмовою поінформованою згодою пацієнтів. Статистичну обробку здійснювали в програмах Exсel, для порівняння середніх значень вибірки використано t-критерій Стьюдента і двобічний z-критерій Фішера. Для визначення діагностичної цінності окремих лабораторних показників і прогнозу розвитку токсоплазмозного енцефаліту був використаний байєсівський метод діагностки і прогнозування та послідовний статистичний аналіз А. Вальда [17]. Визначали порогові діагностичні значення: поріг А = 10 lg • ((1 – α)/β) і поріг В = 10 lg • (α/(1 – β)), де α = 0,05 — ймовірність помилки 1-го типу і β = 0,1 — ймовірність помилки 2-го типу. Таким чином, поріг А = 9,8, поріг В = –12,6. Діагностичний коефіцієнт кожного критерію (ДКх) = 10 lg • ((Px/A)/(Px/B)). Для визначення діагностичної цінності показників була використана формула: 10 lg • (α/(1 – β)) < 10 lg × × (P(A)/P(B)) + ДКx1 + ДКx2 + … + ДКxi < 10 lg • ((1 – α)/β), де 10 lg • (P(A)/P(B)) — діагностичний коефіцієнт апріорної захворюваності. Якщо поріг А перевищено, то важалося, що набір діагностичних ознак вірогідно відображав прогноз захворювання.
Результати
ВІЛ-інфіковані особи із серонегативним статусом на токсоплазмоз мали різні стадії ВІЛ-інфекції: 1-ша була в 5 пацієнтів (18,5 %); 2-га — у 7 (25,9 %); 3-тя — у 4 (14,8 %) та 4-та — у 12 (40,7 %). У хворих середній рівень СD4+-Т-лімфоцитів становив 303,87 ± 40,08 (min = 22, max = 666 кл/мкл). Серед пацієнтів цієї групи, як бачимо з даних, поданих у табл. 1, спостерігалася опортуністична патологія: залишкові зміни туберкульозу (ЗЗТБ) легень — у 5 хворих (17,9 %), вперше діагностований туберкульоз (ВДТБ) — у 1 (3,6 %), Епштейна — Барр-вірусний (ЕБВ) енцефаліт — у 1 (3,6 %), саркома Капоші — у 1 (3,6 %), неходжкінська лімфома — у 1 (3,6 %), криптококовий менінгіт — у 1 (3,6 %). Також поширеними були супутні хронічні вірусні гепатити (13 пацієнтів — 46,4 %): гепатит В — у 5 (17,8 %), гепатит С — у 2 (7,1 %), гепатит В та С — у 6 (21,4 %).
/31-1.gif)
Серопозитивні на токсоплазмоз особи також мали різні стадії ВІЛ-інфекції: 1-ша спостерігалась у 4 пацієнтів (12,1 %), 2-га — у 6 (21,4 %), 3-тя — у 4 (12,1%) та 4-та — у 19 (57,6 %). Рівень СD4+-Т-лімфоцитів у середньому становив 328,83 ± 30,26 кл/мкл крові (min = 17, max = 677 кл/мкл). У цій групі хворих спостерігали таку патологію: токсоплазмозний енцефаліт — у 6 осіб (18,8 %), (двічі та в поєднанні із токоплазмозним ретинітом — по 1); ЗЗТБ — у 6, ВДТБ легень — у 3, туберкульозний менінгоенцефаліт — у 1, цитомегаловірусний енцефаліт — у 2, цитомегаловірусний ретиніт — у 2, криптококовий менінгіт — в 1. Часто відмічалися супутні хронічні вірусні гепатити (12 осіб — 36,36 %): гепатит В — у 2 (6,0 %), С — у 2 (6,0 %), поєднання гепатиту В та С — у 8 (24,2 %); також спостерігалися токсичний гепатит — у 2 (6,0 %), криптогенний — у 2 (6,0 %), цироз печінки — у 3 (9,1 %).
Досліджено зміни показників прозапальних і протизапальних цитокінів у ВІЛ-інфікованих осіб в обох групах. Причому в групі серонегативних на токсоплазмоз осіб відмічено зміни, спричинені вірусом імунодефіциту людини, а в групі серопозитивних на токсоплазмоз — зміни, додатково спричинені токсоплазмами. Так, у групі серонегативних на токсоплазмоз пацієнтів, як видно з даних, наведених у табл. 2, особливих кількісних змін зазнали рівні протизапальних цитокінів IL-4 та -10. Так, IL-4 перевищував норму майже удвічі (в 1,9 раза) — 1,57 ± 0,30 пг/мл порівняно з 0,81 ± 0,09 пг/мл у здорових осіб, р < 0,001, а IL-10 у півтора раза перевищував показник у здорових осіб (9,81 ± 0,17 пг/мл проти 6,70 ± 0,13 пг/мл, р < 0,001). Підвищеним у півтора раза виявився прозапальний цитокін TNF-α — 2,89 ± 0,08 пг/мл порівняно зі здоровими пацієнтами — 1,90 ± 0,04 пг/мл, р < 0,001, також і рівень IНФ-γ у серонегативних осіб більше ніж утричі (в 2,3 раза) був вищим, ніж у здорових (9,30 ± 0,47 пг/мл проти 4,13 ± 0,12 пг/мл, р < 0,001). Рівні основних імуноглобулінів — IgM та IgA не мали суттєвих відхилень від норми, однак рівень IgG перевищував показник у здорових осіб, становивши 20,63 ± 0,65 г/л проти 16,30 ± 0,94 г/л, р < 0,001.
/32-1.gif)
Подібна динаміка змін була властива і групі серопозитивних на токсоплазмоз ВІЛ-інфікованих осіб (табл. 2). Проте різниця стосується двох показників — IL-10 та INF-γ. Так, IL-10 перевищував значення у серонегативних в 1,2 раза (11,88 ± 0,50 пг/мл проти 9,81 ± 0,17 пг/мл, р < 0,05), та приблизно на стільки ж вищим (в 1,16 раза) був показник IНФ-γ (10,75 ± 0,44 пг/мл проти 9,30 ± 0,47 пг/мл, р < 0,05).
/33-1.gif)
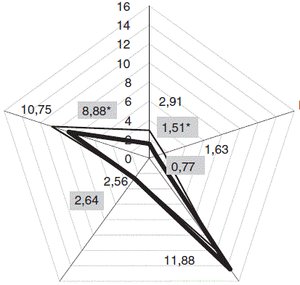
У групі серопозитивних на токсоплазмоз осіб відзначено 6 випадків захворювання на токсоплазмозний енцефаліт (в одної пацієнтки двічі з рецидивом через 2 місяці, а в іншої енцефаліт поєднувався з хоріоретинітом лівого ока). Цитокіновий профіль у цій групі хворих був суттєво відмінним від такого профілю усіх пацієнтів серопозитивної групи. Як показано на рис. 1, рівень IL-2 виявився меншим у групі хворих із токсоплазмозом мозку (1,51 ± 0,16 пг/мл), ніж у всій групі серопозитивних осіб (2,89 ± 0,20 пг/мл, p < 0,001, z = 1,7); зниженим був і рівень IL-4 (0,77 ± 0,16 пг/мл проти 1,63 ± 0,41 пг/мл, p > 0,05, z = 0,99). Натомість переважав рівень IL-10 (14,45 ± 0,58 пг/мл проти 10,39 ± 0,16 пг/мл у всій групі серопозитиних, p < 0,05, z = 0,97). Зазначені зміни цитокінового профілю у хворих із токсоплазмозним ураженням головного мозку спостерігалися на тлі низьких середніх показників СD4+-Т-лімфоцитів (81,33 ± 30,73 кл/мкл крові), однак критично низькими вони були тільки в 4 хворих — 16, 30, 38, і 48 кл/мкл крові, але в інших 2 осіб показники були значно вищими — 230 і 126 кл/мкл.
Скориставшись методом Байєса та послідовним статистичним аналізом Вальда, ми встановили діагностичну цінність показників різних цитокінів для прогнозування токсоплазмозного енцефаліту. Як видно з даних, наведених у табл. 3, установлено, що показники INF-γ < 8,8 пг/мл, IL-4 < 0,77 пг/мл, IL-10 > 11,8 пг/мл, IL-2 < 1,5 пг/мл мають певне діагностичне значення. Однак порогову величину перевищує сума діагностичних коефіцієнтів 2 ознак: INF-γ < 8,8 пг/мл та IL-4 < 0,77 пг/мл (–6 + 9 + 8 = 11 > 9,8) чи INF-γ < 8,8 пг/мл та IL-10 > 11,8 пг/мл (–6 + 9 + 7 = 10 > 9,8), або 3 ознак: ІЛ-4 < 0,77 пг/мл, IL-10 > 11,8 пг/мл та IL-2 < 1,5 пг/мл (–6 + 8 + 7 + 6 = 15 > 9,8). У цих випадках ми можемо діагностувати або прогнозувати розвиток токсоплазмозного енцефаліту з вірогідністю більше ніж 95 %.
Обговорення
Таким чином, у ВІЛ-інфікованих осіб, які мали серонегативний статус щодо токсоплазмозної інвазії, виявлено значні відхилення показників цитокінів, як протизапальних, так і прозапальних, що відображало імунопатологічні зміни, спричинені ВІЛ-інфекцією. Насамперед було виявлено підвищені рівні IL-4, -10, що свідчило про переважну активацію Т-хелперів 2-го типу. Зазначені фактори чинять пригнічувальну дію на клітинну ланку імунітету, але стимулюють гуморальну, що підтверджується підвищеним рівнем загального ІgG. Проте гуморальний імунітет є менш ефективним у контролі над опортуністичними патологіями, у тому числі токсоплазмами, ніж клітинний. Незважаючи на те, що високою активністю характеризувалися протизапальні цитокіни, клітинна ланка, що регулюється Т-хелперами 1-го типу, також перебувала в стані активності, що відображено в підвищеному рівні INF-γ. Крім того, виявилася висока активність ще одного потужного прозапального фактора — TNF-2α — важливого кофактора в протитоксоплазмозному захисті [13]. Таким чином, одночасна активація протизапальних і прозапальних цитокінів відображає загальну активацію різного роду імуноцитів у ВІЛ-інфікованих осіб, що вже висвітлювалося в науковій літературі [1–3]. Порівняно із серонегативними на токсоплазмоз пацієнтами в серопозитивних осіб знайдено деякі відмінності — вищі показники INF-γ та IL-10, що характеризувало ще вищий рівень активації Т-хелперів 1-го і 2-го типів, яка, ймовірно, додатково зумовлена хронічною інвазією Toxoplasma gondii. Стає зрозумілим те, що згодом така ситуація призводить до виснаження імуноцитів, їх апоптозу з подальшим прогресуванням імунодефіциту. Тривалий час INF-γ і TNF-2α, що чинять токсоплазмостатичну дію, забезпечують захист від реактивації токсоплазмозної інвазії. Однак Toxoplasma gondii здатна виробляти фактори інтерференції із STAT-1α і перешкоджати експресії INF-γ-залежних генів [5], що є причиною складних імунопатологічних прооцесів в інвазованому організмі. У хворих із токсоплазмозним енцефалітом порівняно з усією вибіркою серопозитивних на токсоплазмоз осіб виявлено ознаки наростаючого імунодефіциту — зменшення кількості СD4+-Т-лімфоцитів, зниження рівнів IL-2, -4, ІNF-γ одночасно із збільшенням рівня IL-10, що й створило сприятливі умови для швидкої реактивації токсоплазмозних брадизоїтів. Зниження рівнів IL-2, -4, ІNF-γ пояснюється прогресуванням дефіциту Т-хелперів 1-го і 2-го типів, а підвищення рівня IL-10 сталося, ймовірно, тому, що його здатні виробляти інфіковані токсоплазмами макрофаги [16]. Завдяки послідовному статистичному аналізу А. Вальда, виявлено, що деякі поєднання лабораторних імунопатологічних ознак, таких як ІNF-γ < 8,8 пг/мл та IL-4 < 0,77 пг/мл; INF-γ < 8,8 пг/мл та IL-10 > 11,8 пг/мл; IL-4 < 0,77 пг/мл, IL-2 < 1,5 пг/мл та IL-10 > 11,8 пг/мл, є достатньо надійним предиктором розвитку токсоплазмозного енцефаліту.
У спеціальній літературі зазначається, що токсоплазмозний енцефаліт здебільшого розвивається як реактивація латентної інвазії в осіб із низьким рівнем СD4+-Т-клітин, меншим за 100 кл/мкл крові [1, 2, 18, 19]. Проте в досліджуваній групі у 2 із 6 хворих на токсоплазмозний енцефаліт виявлено показники СD4+-Т-клітин, що були вищими від цього критичного показника. Отже, установлені нами предиктори глибокого цитокінового дисбалансу у хворих краще показали функціональну недостатність Т-хелперів, ніж абсолютна їх кількість, і повною мірою причетні до формування базисних умов для розвитку токсоплазмозного енцефаліту.
Висновки
1. У ВІЛ-інфікованих пацієнтів відмічається складна імунопатологія, що полягає в активації як прозапальної (підвищення рівнів TNF-2α, INF-γ), так і протизапальної системи цитокінів (підвищення рівнів IL-4 та -10) із певним їх балансом на більш високому, ніж у нормі, рівні.
2. У серопозитивних на токсоплазмоз ВІЛ-інфіко–ваних осіб виявлене посилене функціональне напруження Т-хелперів 1-го і 2-го типів на основі подальшого підвищення рівнів INF-γ і IL-10 порівняно із серонегативними на токсоплазмоз пацієнтами.
3. Знижені показники INF-γ, IL-4 та -2 одночасно з підвищеними рівнями IL-10 у хворих із токсоплазмозним енцефалітом відображають поглиблення імунодефіциту та є предикторами розвитку токсоплазмозу мозку у ВІЛ-інфікованих осіб, серопозитивних на токсоплазмоз.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Hoffmann C, Rockstroh JK, editors. HIV 2015/16. Available from: https://hivbook.com. Accessed: February 11, 2017.
2. Miedema F, Hazenberg MD, Tesselaar K, van Baarle D, de Boer RJ, Borghans JA. Immune Activation and Collateral Damage in AIDS Pathogenesis. Front Immunol. 2013;4:298. doi: https://doi.org/10.3389/fimmu.2013.00298.
3. Zaporozhan VM, Aryayev ML, compilers. VIL-infektsiya i SNID [HIV-infection and AIDS]. 2nd ed., rev. and suppl. Kiev: Zdorov’ya; 2004. 636 p. (in Ukrainian).
4. Aaronson DS, Horvath CM. A road map for those who don’t know JAK-STAT. Science. 2002 May;296(5573):1653-5. doi:10.1126/science.1071545. PMID: 12040185.
5. Kim SK, Fouts AE, Boothroyd JC. Toxoplasma gondii dysre–gulates IFN-gamma-inducible gene expression in human fibroblasts: insights from a genome-wide transcriptional profiling. J Immunol. 2007;178(8):5154-65. PMID: 17404298.
6. Lang C, Algner M, Beinert N, Gross U, Luder CG. Diverse mechanisms employed by Toxoplasma gondii to inhibit IFN-gamma-induced major histocompatibility complex class II gene expression. Microbes Infect. 2006;8(8):1994-2005. PMID: 16824778. doi: http://dx.doi.org/10.1016/j.micinf.2006.02.031.
7. Luder CG, Walter W, Beuerle B, Maeurer MJ, Gross U. Toxoplasma gondii down-regulates MHC class II gene expression and antigen presentation by murine macrophages via interference with nuclear translocation of STAT1alpha. Eur J Immunol. 2001;31(5):1475-84. PMID: 11465104.
8. Adams LB, Hibbs JBJr, Taintor RR, Krahenbuhl JL. Microbiostatic effect of murine-activated macrophages for Toxoplasma gondii. Role for synthesis of inorganic nitrogen oxides from L-arginine. Journal of immunology. 1990;144(7):2725-2729.
9. Jun CD, Kim SH, Soh CT, Kang SS, Chung HT. Nitric oxide mediates the toxoplasmastatic activity of murine microglial cells in vitro. Immunol Invest. 1993;22(8):487-501. doi: http://dx.doi.org/10.3109/08820139309084178.
10. Chao CC, Anderson WR, Hu S, Gekker G, Martella A, Peterson PK. Activated microglia inhibit multiplication of Toxoplasma gondii via a nitric oxide mechanism. Clin Immunol Immunopathol. 1993;67(2):178-183. doi: http://dx.doi.org/10.1006/clin.1993.1062.
11. Koide M, Kawahara Y, Tsuda T, Yokoyama M. Cytokine-induced expression of an inducible type of nitric oxide synthase gene in cultured vascular smooth muscle cells. FEBS Lett. 1993;318(3):213-217. doi: 10.1016/0014-5793(93)80514-U.
12. Zhao Y, Ferguson DJ, Wilson DC, Howard JC, Sibley LD, Yap GS. Virulent Toxoplasma gondii evade immunity-related GTPase-mediated parasite vacuole disruption within primed macrophages. Journal of immunology. 2009;182(6):3775-3781. doi: 10.4049/jimmunol.0804190.
13. Langermans JA, Hulst Vander ME, Nibbering PH, Hiemstra PS, Fransen L, Van Furth R. IFN-gamma-induced L-arginine-dependent toxoplasmastatic activity in murine peritoneal macrophaes is mediated by endogenous tumor necrosis factor-alpha. Journal of immunology. 1992;148(2):568-574. PMID: 1729374.
14. Jana M, Liu X, Koka S, Ghosh S, Petro TM, Pahan K. Ligation of CD40 stimulates the induction of nitric-oxide synthase in microglialcells. J Biol Chem. 2001;276(48):44527-44533. doi: 10.1074/jbc.M106771200.
15. Drannyk HN, editor. Klinichna imunolohiia i alerholohiia [Clinical immonology and allergology]. Kiev: Polyhraf plius; 2006. 482 p. (in Ukrainian).
16. Khan IA, Matsuura T, Kasper LH. IL-10 mediates immunosuppression following primary infection with Toxoplasma gondii in mice. Parasite immunology. 1995;17(4):185-195. doi: 10.1111/j.1365-3024.1995.tb00888.x.
17. Glantz S, compilar. Mediko-biologicheskaya statistika [Biomedical statistics]. 4th ed. Moscow: Praktika; 1999. 459p. (in Russian).
18. Toxoplasmosis (Toxoplasma Infection). Center for Disease Control and Prevention (US): Resources for Health Professionals. Available from: http://www.cdc.gov/parasites/toxoplasmosis/health_professionals/index.html#tx. Accessed: February 11, 2017.
19. Clinical protocol for diagnosis and treatment of opportunistic infections and general symptoms in HIV-infected adults and adolescents. Available from: http://ucdc.gov.ua/uploads/documents/5416f7/5e383386d320c87999c2801c80fcdcd8.pdf.

/31-1.gif)
/32-1.gif)
/33-1.gif)
/33-2.gif)