Хвороби органів дихання залишаються одними з найбільш поширених у дітей, становлячи понад 60 % від усієї дитячої захворюваності. Інфекційно-запальні захворювання респіраторної системи в дітей практично завжди супроводжуються кашлем із виділенням мокротиння у великій кількості, скудного або в’язкого, що вимагає застосування муколітичної терапії [2, 5].
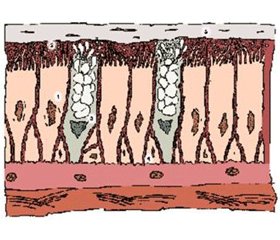
Природний захист дихальних шляхів здійснюється за допомогою багатокомпонентного механізму мукоциліарного кліренсу й факторів неспецифічного й специфічного протиінфекційного захисту. За допомогою цих механізмів забезпечуються очищення й стерильність дихальних шляхів, відновлення порушених структур і функцій респіраторної системи. Мукоциліарний транспорт — один з основних механізмів системи місцевого захисту, що забезпечує виведення ринобронхіального секрету за рахунок коливальних рухів війок одношарового багаторядного миготливого епітелію слизової оболонки. Завдяки постійному руху війок істотно скорочується тривалість контакту мікроорганізмів із клітинами слизових оболонок дихальних шляхів і, отже, значно утруднюється проникнення збудників у трахеобронхіальний епітелій [1].
В утворенні секрету беруть участь клітини слизової респіраторного тракту — бронхіальні залози, келихоподібні клітини, секреторні клітини Клара, епітелій бронхіол та альвеол. Утворення бронхіального секрету та його просування в проксимальному напрямку від альвеол до великих бронхів є одним із важливих фізіологічних процесів в організмі людини [1].
Порушення мукоциліарного транспорту виникають при запальних захворюваннях респіраторного тракту, у результаті чого відбувається пригнічення місцевих захисних механізмів, що створює умови для бактеріальної інфекції, гіперсекреції, розвитку бронхіальної обструкції, погіршення дренажу дихальних шляхів. Вплив на слизову оболонку респіраторного тракту різних факторів призводить до десквамації епітелію з різким повнокров’ям судин мікроциркуляторного русла, підвищення їх проникності; набряку слизового й підслизового шару; зміни координації та ефективності діяльності війок. Одночасно з циліарною дискінезією відбувається перебудова секреторного апарату — часткове заміщення війчастих клітин слизотвірними келихоподібними клітинами й гіперплазія бронхіальних залоз, зміна режимів продукування (гіперсекреція слизу). Одночасно з гіперпродукцією слизу змінюється й склад трахеобронхіального секрету — в ньому зменшується питома вага води й підвищується концентрація муцинів (нейтральних і кислих глікопротеїнів). Це призводить до збільшення в’язкості мокротиння [2, 3, 6, 19].
Гіперсекреція також супроводжується зниженням антибактеріальної й противірусної активності за рахунок зменшення в секреті концентрації секреторного імуноглобуліну (Ig) A, інтерферону, лактоферину, лізоциму. Секрет стає більш в’язким, що сприяє підвищенню адгезії патогенних мікроорганізмів до слизової оболонки дихальних шляхів і створює сприятливі умови для мікробної колонізації [4, 5]. Застій в’язкого секрету призводить до порушення вентиляційно-дифузійної функції легенів [6].
При порушенні фізіологічних механізмів захисту й очищення дихальних шляхів виникає кашель. У дітей раннього віку в силу анатомо-фізіологічних особливостей кашльовий рефлекс недосконалий, тому може бути відсутнім при запальних захворюваннях респіраторного тракту в новонароджених і дітей перших місяців життя. Недостатній кашльовий рефлекс, значна в’язкість мокротиння, недостатньо глибоке дихання, порушення бронхіальної прохідності можуть знижувати ефективність кашлю. У цьому випадку підвищити продуктивність кашлю можна за допомогою муколітичної терапії. Основними її завданнями є вплив на реологічні властивості слизу (в’язкість і еластичність), зменшення утворення слизу (мукорегуляторна дія), регідратація й стимуляція виведення (мукокінетична дія) [7].
Мукоактивна терапія тим більше значима, чим менший вік дітей, тому що відповідні анатомо-фізіологічні особливості істотно впливають на перебіг захворювання (відсутність кашльового рефлексу в дітей перших днів і тижнів життя, схильність до ексу–дації й набряку слизової оболонки бронхів, виражена гіперпродукція й підвищення в’язкості слизу, вузькість дихальних шляхів тощо) [8, 9].
Разом із тим при всій різноманітності відхаркувальних і муколітичних препаратів і їх лікарських форм при виборі конкретного препарату необхідно враховувати його ефективність, можливі небажані явища й безпеку, що надзвичайно важливо в педіатричній практиці. Велике значення має також можливість поєднаного впливу одного лікарського засобу відразу на декілька симптомів хвороби. Однак лікарські засоби даної групи мають різну хімічну структуру й механізми фармакодинамічної дії. Тому вибір конкретного препарату часом видається для практичного лікаря непростим завданням, від правильного вирішення якого залежить не тільки ефективність проведеної терапії, а й одужання хворого [9].
У педіатричній практиці добре відома ефективність препарату амброксолу гідрохлориду, що має швидкий і виражений муколітичний ефект за рахунок стимуляції серозних клітин залоз слизової оболонки бронхів, нормалізації співвідношення слизового й серозного компонентів мокротиння, стимуляції вироблення ферментів, що розщеплюють зв’язки між мукополісахаридами мокротиння, і сурфактанту з підвищенням його синтезу, секреції в альвеолярних пневмоцитах 2-го типу й гальмуванням його розпаду [9]. Здатність амброксолу активувати фагоцити безпосередньо й через сурф–актант відіграє важливу роль при захворюваннях, що перебігають з обструкцією [10]. Сурфактант виявляє протинабрякову дію на мембрани альвеол, посилює активність війок миготливого епітелію, що в поєднанні з покращанням в’язкоеластичних властивостей бронхіального секрету призводить до ефективного очищення дихальних шляхів, допомагаючи відкашлюванню, до зменшення застою бронхіального вмісту й збільшення швидкості мукоциліарного транспорту. Також зменшуються прояви обструктивного синдрому внаслідок таких компонентів, як обтурація в’язким слизом. При вірусній інфекції препарат посилює утворення сурфактанту в 1,5–1,7 раза [11]. Протеїн А сурфактанту безпосередньо взаємодіє з гемаглютиніном вірусу й нейтралізує його. Репродукція вірусів грипу посилюється епітеліальними протеазами, що взаємодіють із глікопротеїнами вірусу [12].
Крім того, амброксол активізує гідролізуючі ферменти, посилює вивільнення лізосом із слизо–твірних клітин, підсилює рух війок миготливого епітелію, збільшуючи мукоциліарний кліренс, заспокоює кашель [10].
Наявність в амброксолу імуномодулюючого ефекту сприяє посиленню місцевого імунітету: препарат сприяє збільшенню виділення IgA в 10 разів і IgM — в 1,2 раза порівняно з початковим рівнем, потенціює активність тканинних макрофагів, здатний пригнічувати продукцію медіаторів запалення — інтерлейкіну (ІЛ)-1, фактора некрозу пухлини. Дані ефекти демонструють його протизапальну й антиоксидантну дії [10, 13].
Однією із суттєвих переваг амброксолу є підвищення ефективності антибактеріальної терапії. Так, у рандомізованому плацебо-контрольованому клінічному дослідженні було встановлено, що амброксол потенціює клінічну ефективність антибіотиків у дітей з інфекціями нижніх дихальних шляхів, збільшуючи концентрацію антибіотиків у легеневій тканині. Крім того, підвищення ефективності антибактеріальної терапії при прийомі амброксолу пояснюють його здатністю руйнувати біоплівки патогенної флори й запобігати їх появі [14–16]. Сьогодні відомо, що біоплівка — це не просте скупчення бактерій на будь-якій поверхні (слизовій, тканинах тощо), а складна структурна композиція клітинного (асоціація або монокультура мікроорганізмів) і позаклітинного (біохімічна суміш нуклеїнових кислот, полісахаридів, глікопротеїнів і ліпідів) компонентів. Біоплівка — інструмент захисту мікроорганізмів від впливу різних чинників (фізичних, хімічних, гуморальних), а також від антибактеріальних препаратів.
Є експериментальні дані про вплив амброксолу на біоплівки, утворені патогенними мікроорганізмами. Наприклад, одним із чинників високої патогенності Pseudomonas aeruginosa й високої стійкості до більшості антибіотиків є здатність утворювати біоплівки. Їх утворення викликане мукоїдним переродженням P. aeruginosa через мутації гена Muca, що індукується поліморфноядерними лейкоцитами й активними формами кисню. У недавньому дослідженні W. Wang еt al. були отримані результати, які доводять, що амброксол інгібує H2O2-індуковане перетворення P. aeruginosa в мукоїдний фенотип. Тобто амброксол має антиоксидантну властивість щодо H2O2. Крім того, в дослідженні показане збільшення бактерицидної активності ципрофлоксацину проти мукоїдної форми P. aeruginosa, що утворює біоплівки, у пробірці при його використанні в комбінації з амброксолом [17].
Отже, при запальних інфекційних захворюваннях дихальних шляхів амброксол виявляє цілий ряд позитивних ефектів:
— запобігає формуванню біоплівки;
— покращує мукоциліарний кліренс;
— має протизапальний і антиоксидантний ефект;
— підвищує концентрацію антимікробних препаратів у вогнищі запалення.
До переваг амброксолу при захворюваннях, що супроводжуються гіперчутливістю дихальних шляхів, слід віднести імуномодулюючу дію. Для визначення ролі впливу амброксолу в експериментальній моделі бронхіальної астми мишей сенсибілізували овальбуміном. Було встановлено, що введення амброксолу до сенсибілізації пригнічувало розвиток гіперчутливості дихальних шляхів, еозинофілії, метаплазії келихоподібних клітин, а також реєструвалося зниження запалення в субепітеліальних тканинах. Відзначені знижені рівні ІЛ-5 і ІЛ-13 у бронхоальвеолярному лаважі. Введення амброксолу після сенсибілізації, але до впливу тригера показало зниження гіперчутливості дихальних шляхів, але без впливу на еозинофілію, при цьому були виявлені підвищені рівні ІЛ-10 і ІЛ-12. Отже, амброксол був ефективним у запобіганні гіперчутливості дихальних шляхів мишей [18].
Поряд з відомими доведеними ефектами амброксолу як активного мукорегуляторного препарату все частіше з’являються експериментальні дослідження, у яких вивчаються ефекти амброксолу при захворюваннях легенів незапального генезу.
Для визначення впливу амброксолу гідрохлориду на концентрацію хіміотерапевтичних препаратів паклітакселу й карбоплатину в тканині легені 470 хворих на недрібноклітинний рак легені були розділені на різні групи. Групи формувалися за часом уведення амброксолу щодо хіміотерапії. Також була сформована контрольна група, пацієнти якої не отримували амброксол (171 пацієнт). Результати показали, що концентрація паклітакселу й карбоплатину в мокротинні пацієнтів, які отримували амброксол, була значно вищою, ніж у хворих конт–рольної групи. Крім того, внутрішньовенне введення амброксолу більше ніж за 48 годин до початку хіміотерапії показало значно більшу ефективність у підвищенні концентрацій лікарських хіміотерапевтичних препаратів, ніж у контрольній групі. Також було вивчено вплив введення амброксолу на темпи розвитку мієлосупресії: не було отримано статистично значущих відмінностей за гематологічними порушеннями між основною й контрольною групою. Отримані результати показують, що амброксол, який вводиться внутрішньовенно більше ніж за 48 годин до хіміотерапії, збільшує концентрацію паклітакселу й карбоплатину в легеневій тканині без істотного збільшення гематологічної токсичності [20].
Відомо, що пацієнти з ненейронопатичною формою хвороби Гоше мають схожу з пацієнтами з хворобою Паркінсона гетерозиготну мутацію гена GBA. Як терапевтична мішень майбутнього при лікуванні хвороби Паркінсона розглядається глікоцереброзидаза (GBA), ензим, що знаходиться в лізосомах і в нормі розщеплює ліпіди. При певних мутаціях в GBA-гені відбувається зниження активності GBA з подальшою акумуляцією патологічного α-синуклеїну. Препарат для лікування хвороби Гоше, що підвищує активність GBA, може розглядатися як потенційний препарат для лікування хвороби Паркінсона. Біохімічні дослідження підтверджують, що блокування дозрівання GBA створює умови для накопичення α-синуклеїну в нейронах при хворобі Паркінсона. При цьому амброксол, що тестується сьогодні як препарат для лікування хвороби Гоше, може виявитися дивовижною нейропротекторною знахідкою для лікування даного підтипу хвороби Паркінсона. Амброксол здатний виконувати роль шаперонів для GBA, сприяючи формуванню його зрілих форм, і це дає надію на його здатність перешкоджати відкладенню в мозку токсичного α-синуклеїну й на ефективне використання його при хворобі Паркінсона. Ефективність такої комбінованої терапії, виявлена в результаті досліджень у природних умовах і в пробірці, повинна бути оцінена додатково в клінічних випробуваннях [21].
Отже, для амброксолу характерний комплексний лікувальний ефект: висока муколітична ефективність із вираженою відхаркувальною дією, протизапальна й антиоксидантна дії, а також стимуляція синтезу сурфактанту й місцевого імунітету слизових оболонок респіраторного тракту. Однак вивчення його властивостей триває, а наявні результати свідчать про можливість його застосування в комбінованій терапії онкологічних захворювань легенів і при лікуванні деяких форм хвороби Паркінсона.
Підготувала Т. Тлустова
Список литературы
1. Малахов А.Б., Колосова Н.Г., Шахназарова М.Д. и др. Терапевтические эффекты амброксола: новые свойства знакомого препарата // Consilium Medicum. Педиатрия (Прил.). — 2016. — 2. — С. 33-36.
2. Зайцева О.В. Рациональный выбор муколитической терапии в лечении болезней органов дыхания у детей // РМЖ. — 2009. — 19. — С. 1217-22.
3. Мизерницкий Ю.Л., Мельникова И.М. Муколитическая и отхаркивающая фармакотерапия при заболеваниях легких у детей. — М.: Медпрактика-М, 2013.
4. Волков И.К., Давыдова И.В., Куличихин В.Г., Лукина О.Ф. Новые возможности муколитической терапии при хронических и рецидивирующих заболеваниях легких у детей // Consilium Medicum. Пульмонология. — 2006. — 8(1). — http://www.consilium-medicum.com/pylmo/article/9559/
5. Зайцева О.В., Барденикова С.И., Зайцева С.В. и др. Современные аспекты патогенетической терапии кашля у детей // Лечащий врач. — 2010. — № 2. — http://www.lvrach.ru/2010/02/12158998/
6. Комплексный подход к лечению и профилактике острых респираторных инфекций у детей: Практическое руководство для врачей / Под ред. Н.А. Геппе, А.Б. Малахова. — М., 2012.
7. Новиков Ю.К. Мукоцилиарный транспорт как основной механизм защиты легких // РМЖ. — 2007. — 5. — 357 с.
8. Косенко И.М. О рациональном выборе фармакотерапии при заболеваниях, сопровождающихся кашлем // Consilium Medicum. Педиатрия. — 2010. — № 3. — С. 33-40.
9. Симонова О.И. Клинические эффекты амброксола гидро–хлорида (Лазолвана): от чего зависит эффективность препарата? // Педиатрия. — 2011. — Т. 90, № 5. — С. 128-133.
10. Malerba М., Ragnoli В. Ambroxol in the 21st century: pharmacological and clinical update // Exp. Opin. Drug Metab. Toxicol. — 2008. — 4(8). — Р. 1119-29.
11. Wirtz H.R. Effect of ambroxol on surfactant secretion and synthesis in isolated type II alveolar cells // Pneumologie. — 2000. — 54. — Р. 278-83.
12. Yamaya M. Ambroxol inhibits rhinovirus infection in primary cultures of human tracheal epithelial cells // Arch. Pharm. Res. — 2013. — 37 (4).
13. Beeh K.M., Beier J., Esperester A., Paul L.D. Antiinflammatory properties of ambroxol // Eur. J. Med. Res. — 2008. — 13(12). — Р. 557-62.
14. Cataldi M. et al. Biofilm-dependent airway infections: A role for ambroxol? // Pulmonary Pharmacol. Ther. — 2013. — http://dx.doi.org/10.1016/j.pupt.2013.11.002
15. Li F., Yu J., Yang H. et al. Effects of ambroxol on alginate of mature Pseudomonas aeruginosa biofilms // Curr. Microbiol. — 2008. — 57. — Р. 1-7.
16. Xia D.H., Xi L., Xv C. et al. The protective effects of ambroxol on radiation lung injury and influence on production of transforming growth factor beta1 and tumor necrosis factor alpha // Med. Oncol. — 2010. — 27. — 697e701.
17. Wang W., Yu J., He Y., Wang Z., Li F. Ambroxol inhibits mucoid conversion of Pseudomonas aeruginosa and contributes to the bactericidal activity of ciprofloxacin against mucoid P.aeruginosa biofilms // APMIS. — 2016 Jul. — 124(7). — 611-8. doi: 10.1111/apm.12542.
18. Gibbs B.F., Wolff H.H., Grabbe J. Ambroxol inhibits IgE-dependent mediator secretion from human skin mast cells // Inflamm. Res. — 2000. — 49 (Suppl. 1). — S17-8.
19. Волков А.В. Противокашлевые, муколитические и отхаркивающие средства. Что выбрать? [Текст] / А.В. Волков // Здоров’я України. — 2009, тематичний номер, жовтень. — С. 37.
20. Li J., Yi W., Jiang P., Sun R., Li T. Effects of ambroxol hydrochloride on concentrations of paclitaxel and carboplatin in lung cancer patients at different administration times // Cell Mol. Biol. (Noisy-le-grand). — 2016 Nov 30. — 62(13). — Р. 85-89. doi: 0.14715/cmb/2016.62.13.15.
21. Ishay Y., Zimran A., Szer J., Dinur T, Ilan Y., Arkadir D. Combined beta-glucosylceramide and ambroxol hydrochloride in patients with Gaucher related Parkinson disease: From clinical observations to drug development // Blood Cells Mol. Dis. — 2016 Nov 12. pii: S1079-9796(16)30229-7. doi: 10.1016/j.bcmd.2016.10.028.