Журнал «Медицина неотложных состояний» 2 (81) 2017
Вернуться к номеру
Лабораторные предикторы прогноза у больных с острым инфарктом миокарда, сочетанным с неалкогольной жировой болезнью печени
Авторы: Белая И.Е., Коломиец В.И., Мусаева Э.К.
Государственное учреждение «Луганский государственный медицинский университет», Украина
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
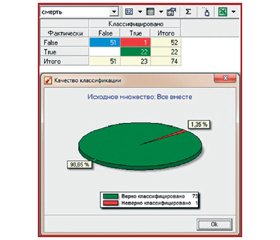
Мета: апробувати математичну модель прогнозування перебігу гострого періоду інфаркту міокарда (ІМ) із зубцем Q у поєднанні зі стеатозом печінки (СП) або неалкогольним стеатогепатитом (НАСГ). Матеріали та методи. Обстежено 74 хворих на гострий Q-позитивний ІМ лівого шлуночка різної локалізації, сполучений із СП (67 хворих) і НАСГ (7 пацієнтів), віком від 36 до 88 років (середній вік — 64 ± 1 рік). Серед них 35 жінок і 39 чоловіків. Для прогнозування наслідків гострого періоду ІМ, сполученого із СП або НАСГ, був використаний підхід, який ґрунтується на інтелектуальному аналізі даних (Data Mining) із застосуванням математичних засобів методу «дерево рішень». Результати. За допомогою алгоритму дерева рішень виділені лабораторні показники (атрибути), що в подальшому використані як вхідні дані. Адекватність класифікації цих атрибутів визначена побудовою таблиці сполученості. Оцінка точності отриманих результатів розрахунків дала в підсумку 98,65 %. Дерево рішень виділило три найбільш значущих лабораторних показники: аспартатамінотрансферазу (АСАТ), вік і вміст еритроцитів. Значущість АСАТ становить 60,9 %, показника «вік» — 25,8 %, еритроцитів — 13,3 %. На візуалізаторі «Правила» з достатньою довірою можна ставитися тільки до першого правила, в якому вірогідність досягає 100 %, а вплив на факт смерті (підтримка) — 52,9 %. Висновки. За допомогою алгоритму дерева рішень виявлені прогностично значущі маркери перебігу гострого ІМ та неалкогольної жирової хвороби печінки: АСАТ і вік. Установлено, що коли у хворих АСАТ менше 0,546 ммоль/л, а вік менше 81 року, то прогнозується сприятливий результат із точністю 98,65 %.
Цель: апробировать математическую модель прогнозирования течения острого периода инфаркта миокарда (ИМ) с зубцом Q в сочетании со стеатозом печени (СП) или неалкогольным стеатогепатитом (НАСГ). Материалы и методы. Обследовано 74 больных с острым Q-позитивным ИМ левого желудочка различной локализации, сочетанным со СП (67 больных) и НАСГ (7 пациентов), в возрасте от 36 до 88 лет (средний возраст — 64 ± 1 год). Среди них 35 женщин и 39 мужчин. Для прогнозирования исходов острого периода ИМ, сочетанного со СП или НАСГ, был использован подход, основанный на интеллектуальном анализе данных (Data Mining) с применением математических средств метода «дерево решений». Результаты. С помощью алгоритма дерева решений выделены лабораторные показатели (атрибуты), которые в дальнейшем использованы в качестве входных данных. Адекватность классификации этих атрибутов определена построением таблицы сопряженности. Оценка точности полученных результатов расчетов дала в итоге 98,65 %. Дерево решений выделило три наиболее значимых лабораторных показателя: аспартатаминотрансферазу (АСАТ), возраст и содержание эритроцитов. Значимость АСАТ составила 60,9 %, показателя «возраст» — 25,8 %, эритроцитов — 13,3 %. На визуализаторе «Правила» с достаточным доверием можно относиться только к первому правилу, в котором достоверность достигает 100 %, а влияние на факт смерти (поддержка) — 52,9 %. Выводы. С помощью алгоритма дерева решений выявлены прогностически значимые маркеры течения острого ИМ и неалкогольной жировой болезни печени: АСАТ и возраст. Установлено, что если у больных АСАТ менее 0,546 ммоль/л, а возраст менее 81 года, то прогнозируется благоприятный исход с точностью 98,65 %.
The aim of the study was to test a mathematical model for predicting the course of acute myocardial infarction period (MI) with Q wave, combined with hepatic steatosis (HS) or non-alcoholic steatohepatitis (NASH). Materials and methods. The study involved 74 patients with acute Q-positive left ventricular MI of different location, combined with HS (67 patients) and NASH (7 patients), aged 36 to 88 years (average age 64 ± 1 years). Among them there were 35 women and 39 men. To predict the outcome of acute MI period, combined with HS or NASH, we used an approach based on data mining (Data Mining) with mathematical tools of the decision tree method. Results. The decision tree algorithms allowed determine the laboratory parameters (attributes) and then use them as input data. Construction of contingency tables determined the adequacy of classification of these attributes. The accuracy of the calculation results is 98.65 %. Decision tree highlighted three most important laboratory parameters: aspartate aminotransferase (ASAT), age and red blood cells concentration. The significance of ASAT was 60.9 %, age — 25.8 %, and red blood cells — 13.3 %. With regard to Rules of visual analyzer, only the first rule earns confidence, in which the accuracy reaches 100 %, and the influence on the death (support) — 52.9 %. Conclusions. The decision tree algorithm identified important prognostic markers of acute MI and non-alcoholic fatty liver disease: ASAT and age. It determined that if patient’s ASAT level is less than 0.546 mmol/l, and age is less than 81, then a favorable outcome can be predicted with 98.65% accuracy.
гострий період інфаркту міокарда; стеатоз печінки; неалкогольний стеатогепатит; лабораторні показники; прогноз
острый период инфаркта миокарда; стеатоз печени; неалкогольный стеатогепатит; лабораторные показатели; прогноз
acute period of myocardial infarction; hepatic steatosis; non-alcoholic fatty liver disease; laboratory parameters; prediction
Введение
Материалы и методы
Результаты и обсуждение
/137.jpg)
Выводы
1. Тыць С.Н., Гуков А.Г., Пархомчук Д.С., Перцова Ю.Г. Региональная система организации и оказания экстренной медицинской помощи больным с острым коронарным синдромом в Луганской области // Український кардіологічний журнал. — 2014. — № 6. — С. 78-82.
2. Вялов С.С. Неалкогольная жировая болезнь печени как компонент метаболического синдрома: жировая печень и атеросклероз // Consilium Medicum. — 2012. — Т. 14, № 5. — С. 41-45.
3. Gu L.F., Wang Y.Q., Fan J.G. Research advances in the impact of nonalcoholic fatty liver disease on cardiac structure and function // Zhonghua Gan Zang Bing Za Zhi. — 2016 Jun. — Т. 24, № 6. — С. 461-464. — doi: 10.3760/cma.j.issn.1007-3418.2016.06.015.
4. Sîrbu O., Floria M., Dăscălița P., Şorodoc V., Şorodoc L. Non-alcoholic fatty liver disease-From the cardiologist perspective // Anatol. J. Cardiol. — 2016 Jul. — Vol. 16, № 7. — Р. 534-41. — doi: 10.14744.
5. Колесникова Е.В. Современный пациент с заболеванием печени и патологией сердечно-сосудистой системы: какой выбор сделать? // Сучасна гастроентерологія. — 2014. — Т. 76, № 2. — С. 85-94.
6. Мехтиев С.Н., Гриневич В.Б., Кравчук Ю.А., Бращенкова А.В. Неалкогольная жировая болезнь печени: клиника, диагностика и лечение // Лечащий врач. — 2008. — № 2. — С. 29-32.
7. Шульпекова Ю.О. Алгоритм обследования и лечения пациентов с гепатитами и гепатозами // Сучасна гастроентерологія. — 2009. — Т. 46, № 2. — С. 101-107.
8. Vecchione G., Grasselli E., Voci A. et al. Silybin counteracts lipid excess and oxidative stress in cultured steatotic hepatic cells // World J. Gastroenterol. — 2016 Jul. — Vol. 22, № 26. — Р. 6016-6026. — doi: 10.3748/wjg.v22.i26.6016.
9. Ткач С.М. Распространенность, течение, диагностика и стратегия лечения неалкогольной жировой болезни печени // Здоров’я України. — 2009. — № 1–2. — С. 63-65.
10. Golabi P., Locklear C.T., Austin P. et al. Effectiveness of exercise in hepatic fat mobilization in non-alcoholic fatty liver disease: Systematic review // World J. Gastroenterol. — 2016 Jul. — Vol. 22, № 27. — Р. 6318-6327. — doi: 10.3748/wjg.v22.i27.6318.
11. Calderon R.M., Cubeddu L.X., Goldberg R.B., Schiff E.R. Statins in the Treatment of Dyslipidemia in the Presence of Elevated Liver Aminotransferase Levels: A Therapeutic Dilemma // Mayo Clin. Proc. — 2010. — Vol. 85, № 4. — Р. 349-356.
12. Argo C.K., Loria P., Caldwell S.H., Lonardo A. Statins in liver disease: A molehill, an iceberg, or neither? // Hepatology. — 2008. — Vol. 48, № 2. — Р. 662-669.
13. Барсегян А.А., Куприянов М.С., Степаненко В.В., Холод И.И. Методы и модели анализа данных: OLAP и Data Mining. — СПб.: БХВ-Петербург, 2004. — 336 с.
14. Ph. Gabriel Steg, Stefan K. James, Dan Atar et al. The Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology // Eur. Heart J. — 2012. — № 33. — P. 2569-2619. — doi:10.1093/eurheartj/ehs215.

/137_2.jpg)
/138.jpg)