Международный неврологический журнал 2 (88) 2017
Вернуться к номеру
Внутривенная иммуноглобулинотерапия при рассеянном склерозе
Авторы: Мальцев Д.В.(1), Евтушенко С.К.(2)
(1) — Институт экспериментальной и клинической медицины Национального медицинского университета имени А.А. Богомольца, г. Киев, Украина
(2) — Харьковская медицинская академия последипломного образования, г. Харьков, Украина
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
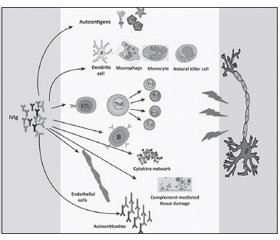
Незважаючи на багатообіцяючі дані фундаментальних досліджень, доказова база клінічного застосування в/в імуноглобуліну (ВІГ) при розсіяному склерозі (РС) все ще залишається досить хиткою і невизначеною. Ґрунтуючись на результатах досліджень, проведених до 2008 року, в/в імуноглобулін рекомендувався експертами EFNS як лікування другої або навіть третьої лінії при рецидивуючо-ремітуючому РС, якщо інші рекомендовані препарати не переносилися або не давали необхідного клінічного ефекту. Проте останнім часом розширилися і утвердилися уявлення щодо ефективності і безпеки в/в імуноглобуліну при РС. Результати недавнього метааналізу рандомізованих контрольованих клінічних досліджень (n = 537), проведеного A. Olyaeemanesh з співавт., показали, що в/в імуноглобулін вірогідно збільшує кількість пацієнтів без рецидивів і кількість випадків поліпшення, а також зменшує число випадків погіршення клінічного стану пацієнта при РС порівняно з плацебо. Ці дані повинні зміцнити позиції в/в імуноглобуліну як засобу терапії другого ряду рецидивуючо-ремітуючого РС. Крім того, при виборі імунотерапії слід враховувати додаткові дані, що можуть вказати на потенційні вигоди від застосування імуноглобуліну, включаючи імунний статус, зокрема — наявність гуморального імунодефіциту, втягнення в патологічний процес периферичної нервової системи, наявність опортуністичних інфекцій або аутоімунних реакцій як ускладнень імуносупресивного лікування хвороби і стан вагітності. Хоча ВІГ — не перша і не основна терапевтична стратегія при РС, цей безпечний і ефективний імуномодулюючий агент може бути незамінним у деяких пацієнтів з РС, що не відповідають належним чином на рекомендовані лікувальні втручання першої лінії.
Несмотря на многообещающие данные фундаментальных исследований, доказательная база клинического применения в/в иммуноглобулина (ВИГ) при рассеянном склерозе (РС) все еще остается достаточно зыбкой и неопределенной. Основываясь на результатах исследований, проведенных до 2008 года, в/в иммуноглобулин рекомендовался экспертами EFNS как лечение второй или даже третьей линии при рецидивирующе-ремиттирующем РС, если другие рекомендованные препараты не переносились или не давали необходимого клинического эффекта. Однако в последнее время расширились и утвердились представления об эффективности и безопасности в/в иммуноглобулина при РС. Результаты недавнего метаанализа рандомизированных контролируемых клинических исследований (n = 537), проведенного A. Olyaeemanesh с соавт., показали, что в/в иммуноглобулин достоверно увеличивает количество пациентов без рецидивов и количество случаев улучшения, а также уменьшает число случаев ухудшения клинического состояния пациента при РС по сравнению с плацебо. Эти данные должны укрепить позиции в/в иммуноглобулина как средства терапии второго ряда при рецидивирующе-ремиттирующем РС. Кроме того, при выборе иммунотерапии следует учитывать дополнительные данные, которые могут указать на потенциальные выгоды от применения иммуноглобулина, включая иммунный статус, в частности — наличие гуморального иммунодефицита, вовлечение в патологический процесс периферической нервной системы, наличие оппортунистических инфекций или аутоиммунных реакций как осложнений иммуносупрессивного лечения болезни и состояние беременности. Хотя ВИГ — не первая и не основная терапевтическая стратегия при РС, этот безопасный и эффективный иммуномодулирующий агент может быть незаменим у некоторых пациентов с РС, не отвечающих надлежащим образом на рекомендуемые лечебные вмешательства первой линии.
Despite the promising findings of fundamental researches, evidence base of clinical application of i/v immunoglobulin (IVIG) in multiple sclerosis (MS) is still quite shaky and uncertain. Based on the results of studies conducted before 2008, EFNS experts recommended IVIG as the treatment of the second or even third line in patients with relapsing-remitting MS, if the other recommended drugs are not tolerated or did not give the desired clinical effect. However, concept of effectiveness and safety of i/v immunoglobulin in MS recently expanded and entrenched. A recent meta-analysis of randomized controlled trials (n = 537), provided by Olyaeemanesh A. et al., have shown that IVIG use significantly increases the number of patients without relapses and number of improvements, and reduces the incidence of deterioration of the clinical status in MS patients compared to placebo. These findings should confirm the IVIG position as a second line strategy in relapsing-remitting MS. When selecting immunotherapy, you should take into account the additional information, which may indicate potential benefits of an immunoglobulin, including immune status, in particular, the presence of humoral immunodeficiency, peripheral nervous system involvement in the pathological process, the presence of opportunistic infections or autoimmune reactions as a complication of immunosuppressive treatment and pregnancy status. Although IVIG is not the first and not the main therapeutic strategy in MS, this safe and effective immunomodulatory agent can be indispensable in some patients with MS, who do not meet in a proper way the recommended first line therapeutic interventions.
розсіяний склероз; імунотерапія; в/в імуноглобулін
рассеянный склероз; иммунотерапия; в/в иммуноглобулин
multiple sclerosis; immunotherapy; i/v immunoglobulin
/78.jpg)
/79.jpg)
/80.jpg)
1. Евтушенко С.К. Рассеянный склероз у детей: 25-летний опыт диагностики и лечения // Международный неврологический журнал. — 2006. — № 3(7). — С. 29-37.
2. Мальцев Д.В. Нерешенные проблемы и перспективы исследований рассеянного склероза: вирусологические, иммунологические и терапевтические аспекты // Врачебное дело. — 2014. — № 5–6. — С. 3-19.
3. Евтушенко С.К., Москаленко М.А. Рассеянный склероз у детей (клиника, диагностика, лечение): Руководство для врачей. — К., 2009. — 254 с.
4. Achiron A., Kishner I., Sarova-Pinhas I. et al. Intravenous immunoglobulin treatment following the first demyelinating event suggestive of multiple sclerosis: a randomized, double-blind, placebo-controlled trial // Archives of Neurology. — 2004. — Vol. 61. — P. 1515-1420.
5. Achiron A., Rotstein Z., Noy S. et al. Intravenous immunoglobulin treatment in the prevention of childbirth-associated acute exacerbations in multiple sclerosis: a pilot study // Journal of Neurology. — 1996. — Vol. 243. — P. 25-28.
6. Alvarenga-Filho H., Salles M., Hygino J. et al. Fatigue favors in vitro Th1 and Th17-like cell expansion and reduces corticoid sensitivity in MS patients // J. Neuroimmunol. — 2016. — pii:S0165-5728(16)30393-9.
7. Antel J., Bar-Or A. Roles of immunoglobulins and B cells in multiple sclerosis: from pathogenesis to treatment // J. Neuroimmunol. — 2006. — Vol. 180(1–2). — P. 3-8.
8. Bayry J., Hartung H.P., Kaveri S.V. IVIg for relapsing-remitting multiple sclerosis: promises and uncertainties // Trends Pharmacol Sci. — 2015. — Vol. 36(7). — P. 419-421.
9. Berger T., Jacobi C., Haas J. et al. Predicting therapeutic efficacy of intravenous immunoglobulin (IVIG) in individual patients with relapsing remitting multiple sclerosis (RRMS) by functional genomics // J. Neuroimmunol. — 2014. — Vol. 277(1–2). — P. 145-152.
10. Brandt-Wouters E., Gerlach O.H., Hupperts R.M. The effect of postpartum intravenous immunoglobulins on the relapse rate among patients with multiple sclerosis // Int. J. Gynaecol. Obstet. — 2016. — Vol. 134(2). — P. 194-196.
11. Calic Z., Cappelen-Smith C., Hodgkinson S.J. et al. Treatment of progressive multifocal leukoencephalopathy-immune reconstitution inflammatory syndrome with intravenous immunoglobulin in a patient with multiple sclerosis treated with fingolimod after discontinuation of natalizumab // J. Clin. Neurosci. — 2015. — Vol. 22(3). — P. 598-600.
12. Cirone M., Cuomo L., Zompetta C., Ruggieri S., Frati L., Faggioni A., Ragona G. Human herpesvirus 6 and multiple sclerosis: a study of T cell cross-reactivity to viral and myelin basic protein antigens // J. Med. Virol. — 2002. — Vol. 68(2). — P. 268-272.
13. Cortese A., Franciotta D., Alfonsi E. et al. Combined central and peripheral demyelination: Clinical features, diagnostic findings, and treatment // J. Neurol. Sci. — 2016. — Vol. 363. — P. 182-187.
14. Elovaara I., Apostolski S., van Doorn P. et al. EFNS guidelines for the use of intravenous immunoglobulin in treatment of neurological diseases: EFNS task force on the use of intravenous immunoglobulin in treatment of neurological diseases // Eur. J. Neurol. — 2008. — Vol. 15(9). — P. 893-908.
15. Elovaara I., Kuusisto H., Wu X. et al. Intravenous immunoglobulins are a therapeutic option in the treatment of multiple sclerosis relapse // Clin. Neuropharmacol. — 2011. — Vol. 34(2). — P. 84-89.
16. Fazekas F., Deisenhammer F., Strasser Fuchs S. et al. Randomised placebocontrolled trial of monthly intravenous immunoglobulin therapy in relapsing-remitting multiple sclerosis. Austrian Immunoglobulin in Multiple Sclerosis Study Group // Lancet. — 1997. — Vol. 349. — P. 589-593.
17. Fazekas F., Strasser-Fuchs S., Hommes O.R. Intravenous immunoglobulin in MS: promise or failure? // Journal of the Neurological Sciences. — 2007. — Vol. 259. — P. 61-66.
18. Fragoso Y.D., Adoni T., Alves-Leon S.V. et al. Postpartum Treatment With Immunoglobulin Does Not Prevent Relapses of Multiple Sclerosis in the Mother // Health Care Women Int. — 2015. — Vol. 36(10). — P. 1072-1080.
19. Haas J. High dose IVIG in the post partum period for prevention of exacerbations in MS // Multiple Sclerosis. — 2000. — Vol. 6(2). — P. 18-20.
20. Haas J., Hommes O.R. A dose comparison study of IVIG in postpartum relapsing-remitting multiple sclerosis // Multiple Sclerosis. — 2007. — Vol. 13. — P. 900-908.
21. Hellwig K., Beste C., Schimrigk S., Chan A. Immunomodulation and postpartum relapses in patients with multiple sclerosis // Ther. Adv. Neurol. Disord. — 2009. — Vol. 2(1). — P. 7-11.
22. Hommes O.R., Haas J., Soelberg-Sorenson P., Friedrichs M. IVIG trials in MS. Is albumin a placebo? // J. Neurol. — 2009. — Vol. 256(2). — P. 268-270.
23. Hommes O.R., Sorensen P.S., Fazekas F. et al. Intravenous immunoglobulin in secondary progressive multiple sclerosis: randomised placebo-controlled trial // Lancet. — 2004. — Vol. 364. — P. 1149-1156.
24. Hong J., Zang Y.C., Li S., et al. Ex vivo detection of myelin basic protein-reactive T cells in multiple sclerosis and controls using specific TCR oligonucleotide probes // Eur. J. Immunol. — 2004. — Vol. 34(3). — P. 870-881.
25. Iwasaki Y., Kinoshita M., Uchida A. A case of multiple sclerosis demonstrating ossification of anterior, posterior longitudinal ligament, thickening of the skull, and selective IgA deficiency // Rinsho Shinkeigaku. — 1987. — Vol. 27(9). — P. 1122-1126.
26. Janke A.D., Giuliani F., Yong V.W. IV Ig attenuates T cell-mediated killing of human neurons // J Neuroimmunol. — 2006. — Vol. 177(1–2). — P. 181-188.
27. Jorgensen S.H., Storm N., Jensen P.E. et al. IVIG enters the central nervous system during treatment of experimental autoimmune encephalomyelitis and is localised to inflammatory lesions // Exp. Brain. Res. — 2007. — Vol. 178(4). — P. 462-469.
28. Katz U., Kishner I., Magalashvili D. et al. Long term safety of IVIg therapy in multiple sclerosis: 10 years experience // Autoimmunity. — 2006. — Vol. 39(6). — P. 513-517.
29. Kraus D., Konen O., Straussberg R. Schilder’s disease: non-invasive diagnosis and successful treatment with human immunoglobulins // Eur. J. Paediatr. Neurol. — 2012. — Vol. 16(2). — P. 206-208.
30. Lewanska M., Zajdal M. S., Selmaj K. No difference in efficacy of two different doses of intarvenous immunoglobulins in MS: Clinical and MRI assessment // European Journal of Neurological. — 2002. — Vol. 9. — P. 565-572.
31. Noseworthy J.H., O’Brien P.C., Petterson T.M. et al. A randomized trial of intravenous immunoglobulin in inflammatory demyelinating optic neuritis // Neurology. — 2001. — Vol. 56. — P. 1514-1522.
32. Noseworthy J.H., O’Brien P.C., Weinshenker B.G. et al. IV immunoglobulin does not reverse established weakness in MS // Neurology. — 2000. — Vol. 55. — P. 1135-1143.
33. Nozaki K., Abou-Fayssal N. High dose cyclophosphamide treatment in Marburg variant multiple sclerosis. A case report // J. Neurol. Sci. — 2010. — Vol. 296(1–2). — P. 121-123.
34. Obermann M., Ruck T., Pfeuffer S. et al. Simultaneous early-onset immune thrombocytopenia and autoimmune thyroid disease following alemtuzumab treatment in relapsing-remitting multiple sclerosis //Mult. Scler. — 2016. — Vol. 22(9). — P. 1235-1241.
35. Olyaeemanesh A., Rahmani M., Goudarzi R., Rahimdel A. Safety and effectiveness assessment of intravenous immunoglobulin in the treatment of relapsing-remitting multiple sclerosis: A meta-analysis //Med. J. Islam. Repub. Iran. — 2016. — Vol. 30. — P. 336.
36. Pohlau D., Przuntek H., Sailer M. et al. Intravenous immunoglobulin in primary and secondary chronic progressive multiple sclerosis: a randomized placebo controlled multicentre study // Multiple Sclerosis. — 2007. — Vol. 13. — P. 1107-1117.
37. Resnick E.S., Moshier E.L., Godbold J.H., Cunningham-Rundles C. Morbidity and mortality in common variable immune deficiency over 4 decades // Blood. — 2012. — Vol. 119(7). — P. 1650-1657.
38. Sharma K.R., Saadia D., Facca A.G. et al. Chronic inflammatory demyelinating polyradiculoneuropathy associated with multiple sclerosis // J. Clin. Neuromuscul Dis. — 2008. — Vol. 9(4). — P. 385-396.
39. Sorensen P.S., Fazekas F., Lee M. Intravenous immunoglobulin G for the treatment of relapsing-remitting multiple sclerosis: a meta-analysis // European Journal of Neurology. — 2002. — Vol. 9. — P. 557-563.
40. Sorensen P.S., Haas J., Sellebjerg F. IV immunoglobulins as add-on treatment to methylprednisolone for acute relapses in MS // Neurology. — 2004. — Vol. 63. — P. 2028-2033.
41. Sorensen P.S., Wanscher B., Jensen C.V. et al. Intravenous immunoglobulin G reduces MRI activity in relapsing multiple sclerosis //Neurology. — 1998. — Vol. 50. — P. 1273-1281.
42. Stangel M., Baumann U., Borte M. et al. Treatment of neurological autoimmune diseases with immunoglobulins: first insights from the prospective SIGNS registry // J. Clin. Immunol. — 2013. — Vol. 33(1). — S67-71.
43. Stangel M., Boegner F., Klatt C.H. et al. Placebo controlled pilot trial to study the remyelinating potential of intravenous immunoglobulins in multiple sclerosis // Journal of Neurology, Neurosurgery and Psychiatry. — 2000. — Vol. 68. — P. 89-92.
44. Tedeholm H., Skoog B., Hillert J. et al. Early immunotherapy in MS reduces the risk of later disability. The secondary progressive course is delayed, according to a study with virtual placebo // Lakartidningen. — 2007. — Vol. 104(22). — P. 1684-1688.
45. Tselis A., Perumal J., Caon C. et al. Treatment of corticosteroid refractory optic neuritis in multiple sclerosis patients with intravenous immunoglobulin // Eur. J. Neurol. — 2008. — Vol. 15(11). — P. 1163-1167.
46. Visser L.H., Beekman R., Tijssen C.C. et al. A randomized, double-blind, placebo-controlled pilot study of i.v. immune globulins in combination with i.v. methylprednisolone in the treatment of relapses in patients with MS // Multiple Sclerosis. — 2004. — Vol. 10. — P. 89-91.
47. Zare-Shahabadi A., Rashidian A., Sahraian M.A., Rezaei N. Potential role of immunoglobulin replacement therapy on MRI measures in multiple sclerosis: a systematic review // Expert. Rev. Clin. Immunol. — 2015. — Vol. 11(12). — P. 1291-1285.