Зофеноприл — сучасний інгібітор ангіотензинперетворюючого ферменту (ІАПФ), що знижує смертність і захворюваність у хворих на гострий інфаркт міокарда (ГІМ) більшою мірою, ніж інші ІАПФ [2]. Від решти препаратів цього класу він відрізняється наявністю двох сульфгідрильних груп. Зофеноприл є унікальним ІАПФ, оскільки збільшує біодоступність двох дуже важливих сигнальних молекул — сірководню (H2S) та оксиду азоту (NO) через брадикінін-залежну систему.
Якщо роль NO в патогенезі захворювань серцево-судинної системи добре відома широкому колу лікарів, то далеко не всі поки що мають чітке уявлення про патофізіологічне значення іншої субстанції — H2S, яка так само, як і молекула NO, належить до класу так званих газотрансмітерів, або ендогенних газів.
Традиційно до газотрансмітерів відносять оксид азоту, оксид вуглецю й сірководень, патофізіологічне значення якого серед трьох вищезгаданих молекул було розкрито останнім. Ці газоподібні речовини утворюються ендогенно (причому ферментативним шляхом), а не надходять ззовні, їх ефекти не залежить від впливу на мембранні рецептори.
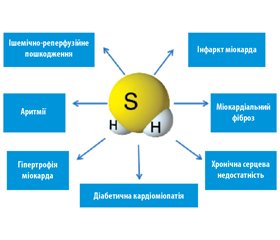
Ендогенний сірководень сьогодні вважається одним із важливих факторів, що захищають організм від серцево-судинних захворювань [8]. Недавні дослідження показали, що H2S може захищати міокард при інфарктах, аритміях, гіпертрофії, фіброзі, ішемічно-реперфузійних ушкодженнях та серцевій недостатності. Деякі механізми (рис. 1), такі як антиоксидантна дія, збереження функції мітохондрій, захист від апоптозу, антизапальні властивості, позитивний вплив на процеси ангіогенезу, здатність регулювати функцію іонних каналів, а також взаємодія з NO, можуть бути відповідальні за кардіопротективну дію H2S [13]. Цікаво, що відомі кардіопротективні властивості часнику, як виявилося, пов’язані з розпадом полісульфідних груп саме до сірководню.
Серед величезного розмаїття біологічних функцій цієї молекули особливе місце приділяють її ролі в регуляції роботи серцево-судинної системи, зокрема забезпеченні нормального рівня артеріального тиску (АТ). Виявлення такої властивості молекули H2S поклало початок новому напрямку в фармакології, пов’язаному з пошуком і створенням принципово нової групи антигіпертензивних препаратів, дія яких ґрунтувалася б на вивільненні молекул H2S.
H2S, так само як і NO, бере участь в регуляції артеріального тонусу, викликаючи розслаблення гладеньких м’язів судин. У той же час молекулярні механізми дії H2S ще донедавна залишалися нерозкритими. Якщо NO викликає розслаблення судин, активуючи фермент гладеньких м’язів гуанілатциклазу, то H2S викликає той же ефект зовсім іншим шляхом. Під дією H2S, що синтезується ферментативним шляхом, підвищується проникність так званих АТФ-залежних калієвих каналів білкових комплексів, вбудованих у мембрану клітин (зокрема, гладеньких м’язів судин), які пропускають іони калію. У результаті вихід калію з клітини посилюється, її заряд змінюється. Це призводить до зниження проникності інших — кальцієвих — каналів. Як наслідок, вхід кальцію в клітину знижується, а це призводить до розслаблення гладеньких м’язів і розширення судин. В експериментах на мишах, у яких було підвищення АТ, обумовлене віковими змінами судин, при введенні їм сірководню тиск знижувався. Це дозволило зробити висновок про важливу роль H2S у регуляції рівня АТ. Не так давно був виявлений фермент цистатіонін-гамма-ліаза, що відповідає за утворення сірководню в клітинах гладеньких м’язів, але в подальшому він був знайдений і в ендотеліальних клітинах як експериментальних тварин, так і людини, причому навіть у більшій кількості, ніж у гладеньких м’язах.
Сірководень не тільки сприяє вазорелаксації, але має ще й протизапальну дію [11]. Механізм протизапальної дії пов’язують зі здатністю H2S нейтралізувати прояви запалення, індуковані інтерлейкіном-1 [12].
Цікаво звернути увагу на ряд недавніх досліджень, що забезпечили розуміння захисної дії H2S у розвитку ішемічно-реперфузійних ушкоджень міокарда [7]. Було продемонстровано, що H2S покращує відповідь інтими на гіперплазію в кровоносних судинах після балонно-опосередкованого пошкодження судин [9]. Крім того, встановлено, що фізіологічно відповідні дози H2S сприяють посиленню ангіогенезу [4]. Отже, H2S, може виявитися корисним для гальмування рестенозу коронарних артерій та індукції ангіогенезу.
Профілактичне введення речовин, що є донорами H2S, зменшує частоту виникнення реперфузійних аритмій і покращує виживання міоцитів. Декілька років тому в експериментах на тваринах було продемонстровано, що болюсна ін’єкція речовини, що є донором H2S, як до початку ішемії, так і під час реперфузії чинить помітний позитивний вплив на розвиток ішемічно-реперфузійних ушкоджень [5].
Обидві молекули — H2S і NO — мають потужну цитопротекторну та антиоксидантну дію, що в клінічній практиці трансформується в антиангінальний та антиішемічний ефекти.
Так, в одному з клінічних досліджень порівнювалися ефекти двох інгібіторів АПФ — зофеноприлу й периндоприлу — у хворих зі стабільною стенокардією та артеріальною гіпертензією [14]. Було виявлено, що лише прийом зофеноприлу забезпечував підвищення стійкості ліпопротеїдів низької щільності до їх переокислення, що свідчило про зменшення інтенсивності процесу перекисного окислення ліпідів (ПОЛ). У свою чергу, зменшення накопичення високотоксичних продуктів ПОЛ у судинній стінці найсприятливішим чином позначалося на вазодилатуючих властивостях ендотелію, що супроводжувалося покращанням показника ендотелійзалежної вазодилатації артерій. Так, показник потікзалежної дилатації плечової артерії (ПЗВД) у хворих, які приймали зофеноприл, вірогідно збільшився майже на третину, при цьому прийом периндоприлу не впливав на ПВЗД. Відсутність здатності несірковмісних інгібіторів АПФ впливати на даний показник була продемонстрована й на фоні лікування раміприлом [10]. Більше того, тільки зофеноприл (але не раміприл) зменшував експресію так званих молекул адгезії, які відіграють ключову роль у запаленні судин, що пов’язане з АГ та атеросклерозом.
Цікаво, що кардіопротективна та вазопротективна дія зофеноприлу не залежить від його антигіпертензивних ефектів, зумовлених блокадою ренін-ангіотензин-альдостеронової системи (РААС) [3]. У реалізації судинних ефектів зофеноприлу певне значення може мати і його високий рівень ліпофільності, що в декілька разів вищий, ніж у раміприлу та периндоприлу [6]. Дана властивість дозволяє препарату проникати в клітини й ефективно пригнічувати активність тканинних ренін-ангіотензинових систем. Крім того, як уже зазначалось вище, зофеноприл стимулює здатність до ангіогенезу ендотелію судин. На рис. 2 відображені найбільш актуальні з клінічної точки зору механізми дії зофеноприлу.
/6_u.jpg)
Для вивчення питання зниження загального ішемічного ризику при застосуванні ІАПФ, що містять SH-групу, було проведено спеціально сплановане дослідження SMILE-3 (або SMILE-ішемія), присвячене саме антиішемічним ефектам нової на той час молекули — зофеноприлу [1]. У цьому рандомізованому подвійному сліпому плацебо-контрольованому дослідженні брали участь 349 хворих з ішемічною хворобою серця (ІХС) через 6 тижнів після перенесеного гострого інфаркту міокарда з фракцією викиду лівого шлуночка понад 40 %, тобто хворі, які не мали ознак хронічної серцевої недостатності. Усі пацієнти були розподілені на дві групи: стандартна терапія + зофеноприл (30–60 мг на добу) та стандартна терапія + плацебо. Спостереження тривало 6 місяців. Первинною кінцевою точкою були різні клініко-інструментальні прояви ішемії міокарда, а саме: нові ішемічні зміни на стандартній електрокардіограмі (ЕКГ) (12 відведень), нові зміни сегмента ST-T при 48-годинному моніторуванні ЕКГ, ЕКГ-ознаки й симптоми стенокардії при пробі з навантаженням, повторний інфаркт міокарда, потреба в процедурах реваскуляризації міокарда через стенокардію або інші клінічні ознаки ішемії міокарда.
У дослідженні SMILE-3 були переконливо продемонстровані потужні антиішемічні ефекти зофеноприлу у хворих із хронічними формами ІХС, що перенесли раніше ГІМ. Через 6 місяців терапії в групі пацієнтів, які отримували зофеноприл, відбулося вірогідне зменшення первинної кінцевої точки на 48 %, а також багатьох її складових. Депресія сегмента ST при амбулаторному записі ЕКГ спостерігалась у 10,7 % хворих у групі зофеноприлу проти 22,2 % у групі плацебо (р = 0,027). У групі зофеноприлу відмічалось суттєве зменшення тривалості ЕКГ-проявів ішемії. Вірогідно менше хворих у групі зофеноприлу мали випадки ангінозного болю в грудній клітці (4,7 % проти 14,3 %; р = 0,024). Частота шлуночкових аритмій також була значно нижчою в групі пацієнтів, які отримували зофеноприл (3,8 % проти 10,5 % у групі плацебо, р = 0,048).
Зниження ризику виникнення основних серцево-судинних подій у групі зофеноприлу становило 64,6 % (4,5 % мали ускладнення в групі зофеноприлу проти 12,7 % в групі плацебо; р = 0,041). Ще раз треба звернути особливу увагу на той факт, що в даному дослідженні зофеноприл призначався за показанням — ІХС, а не у зв’язку з наявністю зниження фракції викиду лівого шлуночка.
Розглядаючи можливості та переваги зофеноприлу в лікуванні хворих на ішемічну хворобу серця, не можна не зупинитися ще на одній дуже важливій і досить поширеній у повсякденній клінічній практиці проблемі. Це проблема розвитку толерантності до нітратів — поступового зниження їх антиангінальних та гемодинамічних ефектів при тривалому застосуванні. Не секрет, що, незважаючи на широке впровадження в клінічну практику сучасних препаратів, які довели свій вплив на клінічні прояви й прогноз ІХС, поширеність призначення нітратів як симптоматичних засобів залишається високою. Багато хворих зберігають прихильність до застосування цього класу антиангінальних засобів. Однак, як згадувалося раніше, довгостроковий їх прийом часто призводить до розвитку толерантності, частота якої, за даними різних авторів, сягає 60–75 %, при цьому повна відсутність терапевтичного ефекту реєструється в 10–15 % спостережень.
Механізми розвитку толерантності до нітратів складні, і в даний час існує декілька гіпотез, що пояснюють цей феномен. Одна з них — метаболічна, згідно з якою постійно високий рівень нітратів у крові веде до виснаження запасів SH-груп, що забезпечують перетворення молекул нітратів у NO, внаслідок чого знижується реактивність судин і послаблюється вазодилатуюча дія нітратів. Це супроводжується зниженням ниркового кровотоку й підвищенням продукції контррегуляторних нейрогуморальних факторів у нирках. У першу чергу підвищується активність РААС. Саме ці механізми багато в чому пояснюють той факт, що для подолання толерантності до нітратів поряд з іншими заходами використовують призначення так званих препаратів-коректорів, що можуть служити донорами SH-груп. Безперечно, до таких препаратів належать ІАПФ, що містять SH-групу, — каптоприл і зофеноприл. Саме завдяки наявності в молекулі двох сульфгідрильних груп зофеноприл може посилювати вплив нітратів на ендотелій-релаксуючий фактор, що було показано в експериментальних і клінічних дослідженнях. У клінічній практиці це дозволяє підвищити толерантність до фізичних навантажень при тривалому лікуванні нітратами незалежно від системних судинних ефектів. З огляду на те, що зофеноприл, як зазначалось вище, здатен зменшувати кількість ангінозних нападів більше ніж в 3 рази, і з урахуванням його здатності гальмувати розвиток толерантності до нітратів є всі підстави розглядати саме цю молекулу як ІАПФ вибору для пацієнтів із вираженими клінічними проявами при хронічній ІХС.
Крім того, на відміну від більшості інгібіторів АПФ, зофеноприл не зменшує свою ефективність при одночасному прийомі з аспірином [2], що дуже важливо саме у хворих на ішемічну хворобу серця, оскільки практично всі вони повинні приймати аспірин, а більшість з них — й ІАПФ. Все це робить зофеноприл вельми привабливим препаратом не тільки для лікування хворих на АГ, але й для вторинної профілактики ІХС.
Список литературы
1. Borghi C. et al. Effects of zofenopril on myocardial ischemia in post-myocardial infarction patients with preserved left ventricular function: The Survival of Myocardial Infarction Long-term Evaluation (SMILE) — ISCHEMIA study // Am. Heart J. — 2007 Mar. — 153(3). — 445. e7-14.
2. Borghi C., Ambrosioni E. et al. Comparison between zofenopril and ramipril in combination with acetylsalicylic acid in patients with left ventricular systolic dysfunction after acute –myocardial infarction: results of a randomized, double-blind, parallel-group, multicenter, European study (SMILE-4) // Clin. Cardiol. — 2012. — 35. — 416-423.
3. Borghi C., Bacchelli S., Degli Esposti D. Long-term clinical experience with zofenopril // Expert Rev. Cardiovasc. Ther. — 2012. — 10. — 973-982.
4. Cai W.J. et al. The novel proangiogenic effect of hydrogen sulfide is dependent on аkt phosphorylation // Cardiovasc. Res. — 2007. — 76(1). — 29-40.
5. Calvert J.W., Elston M., Nicholson C.K., Gundewar S., Jha S., Elrod J.W., Ramachandran A., Lefer D.J. Genetic and pharmacologic hydrogen sulfide therapy attenuates ischemia-induced heart failure in mice // Circulation. — 2010. — 122. — 11-19.
6. Сleophas T.J. Properties of the ACE inhibitor zofenopril // Perfusion. — 2002. — 15. — 38-43.
7. Johansen D., Ytrehus K., Baxter G.F. Exogenous hydrogen sulfide (H2S) protects against regional myocardial ischemia-reperfusion injury — Evidence for a role of K ATP channels // Basic Res Cardiol. — 2006 Jan. — 101(1). — 53-60.
8. Lefer D.J. A new gaseous signaling molecule emerges: Cardioprotective role of hydrogen sulfide // PNAS. — 2007. — 104(46). — 17907-17908.
9. Meng Q.H. et al. Protective effect of hydrogen sulfide on balloon injury-induced neointima hyperplasia in rat carotid arteries // Am. J. Pathol. — 2007. — 170(4). — 1406-14.
10. Pasini A.F. et al. Effect of sulfhydryl and non-sulfhydryl angiotensin-converting enzyme inhibitors on endothelial function in essential hypertensive patients // Am. J. Hypertens. — 2007 Apr. — 20(4). — 443-50.
11. Terzuoli E., Monti M. et al. Characterization of zofenopril at as an inducer of functional angiogenesis through increased H2S availability // Br. J. Pharmacol. — 2015 Jun. — 172(12). — 2961-73.
12. Terzuoli E. et al. The endothelial protective ACE inhibitor Zofenopril at exerts anti-inflammatory activities through H2S production // H2S 2016 — 4th International Conference on The Biology of Hydrogen Sulfide. Naples (Italy), June 3rd-5th, 2016: Abstract book. — Р. 210.
13. Yaqi Shenetal // Oxidative Medicine and Cellular Longevity. — 2015. — 5. — 1-13.
14. Агеев Ф.Т., Овчинников А.Г., Плисюк А.Г. и др. Зофеноприл в терапии больных с артериальной гипертонией и стабильной ишемической болезнью сердца: влияние на окислительный стресс и потокзависимую вазодилатацию // Кардиоваскулярная терапия и профилактика. — 2011. — 10. — 15-21.
Уперше надруковано в газеті «Здоров’я України», 2017, № 5(402).

/6_u.jpg)