Неврологічні захворювання належать до найпоширеніших хвороб в Україні, до того ж поширеність їх останніми роками значно зросла. Серед них перше місце посідають цереброваскулярні захворювання (ЦВЗ). За останні 10 років кількість хворих на ЦВЗ у нашій країні збільшилася вдвічі, що пояснюється зростанням кількості хронічних повільно прогресуючих форм ЦВЗ (зокрема, дисциркуляторної енцефалопатії (ДЕ)) [1, 5].
Дисциркуляторна енцефалопатія — цереброваскулярна патологія, що розвивається при множинних вогнищевих або дифузних ураженнях мозку, в основі яких — неповноцінність кровообігу в судинах головного мозку [1].
У практичній діяльності лікаря-невролога поліклініки та лікарів первинної ланки медичної допомоги нерідко зустрічаються випадки, коли у хворих на дисциркуляторну енцефалопатію має місце зниження функціональної активності щитоподібної залози. В останнє десятиліття виникло важливе питання взаємозв’язку тиреоїдної та цереброваскулярної патології [3].
Хвороби щитоподібної залози належать до найбільш поширених неінфекційних захворювань людства та зай–мають провідне місце у структурі ендокринної патоло–гії (47,3 %) [2, 6, 8]. Останніми роками в Україні та інших країнах світу спостерігається підвищення частоти тиреопатій автоімунного генезу, серед яких переважають гіпофункціональні стани. Паралельно зростає число оперативних втручань із приводу вузлових форм зоба, пухлин тощо, що в подальшому призводить до гіпотиреозу. У даний час в Україні зареєстровано близько 80 тис. хворих на гіпотиреоз (у 1999 році — 53 тис.), на жаль, показники захворюваності щорічно зростають [6, 8, 9].
Патологічні зміни, що формуються на всіх структурно-функціональних рівнях головного мозку у хворих із коморбідною патологією (дисциркуляторна енцефалопатія та гіпотиреоз), призводять до дефіциту локального мозкового кровотоку та енергії. У зв’язку з цим головним напрямком лікування, окрім судинної, є нейропротекторна терапія.
У даний час велику увагу приділяють фармакологічним засобам, що справляють мембранопротекторний та антиоксидантний ефект [4, 7, 10]. Серед них виділяють цитиколін — цитидин-5-дифосфохолін. Цитиколін чинить нейрометаболічний, нейромедіаторний, антиагрегантний ефекти [10, 11]. Головним механізмом дії цитиколіну, що визначає його нейропротекторні властивості, є забезпечення збереження зовнішніх і внутрішніх (цитоплазматичних та мітохондріальних) нейрональних мембран [10, 11–13].
Таким чином, завдяки мембраностабілізуючій, антиоксидантній, антиапоптотичній, антиагрегантній дії, активуючи енергетичні процеси та підвищуючи функціональну та структурну пластичність мозку, цитиколін знайшов широке застосування при лікуванні хворих на дисциркуляторну енцефалопатію. Ми не зустрічали робіт, у яких розглядалися питання застосування ней–ропротекторної терапії при зазначеній коморбідній патології. Нові можливості використання нейропротекторної терапії, вплив на супутні ланки патогенезу при коморбідних станах сприятимуть запобіганню поліпрагмазії в лікуванні патології, що вивчається, та дозволять розробити лікувально-реабілітаційні програми для пацієнтів.
Метою нашого дослідження було вивчення особливостей електрогенезу головного мозку у хворих із гіпертонічною дисциркуляторною енцефалопатією (ГДЕ) та супутнім гіпотиреозом та визначення ефективності лікування цитиколіном зазначеної групи пацієнтів.
Матеріали та методи
Усі хворі з ГДЕ були поділені на дві групи, статистично порівнянні за основним захворюванням — гіпертонічною дисциркуляторною енцефалопатією, статтю та віком. У першу групу (основну) увійшли пацієнти (60 осіб), які, окрім ГДЕ, мали супутній гіпотиреоз. Другу групу (контрольну) становили 37 осіб без гіпотиреозу. Серед обстежених пацієнтів основної групи 57 (95 %) жінок, 3 (5 %) чоловіки, в контрольній групі — 31 (83,8 %) жінка, 6 (16,2 %) чоловіків. Вік хворих становив від 40 до 66 років (середній вік — 58,20 ± 0,91 року).
Пацієнти основної групи мали супутню гіпофункцію щитоподібної залози внаслідок автоімунного тиреоїдиту (39 осіб), після оперативних втручань на щитоподібній залозі (9 осіб), у 12 хворих був спонтанний гіпотиреоз.
Після проведення порівняльного аналізу комплексу обстеження хворих обох груп пацієнти основної групи (ГДЕ та супутній гіпотиреоз) для оцінки ефективності лікування були розподілені на дві групи:
— перша група (загальна) — 30 пацієнтів (середній вік — 61,9 ± 1,4 року; жінок — 27, чоловіків — 3) із гіпертонічною ДЕ та супутнім гіпотиреозом, яким на додаток до базисного (стандартного) лікування був призначений цитиколін;
— друга група (порівняння) — 30 пацієнтів (середній вік — 62,0 ± 1,8 року; жінок — 27, чоловіків — 3) із ГДЕ та супутнім гіпотиреозом, яким проводилося базисне лікування.
Цитиколін (Цитімакс-Дарниця) призначався у дозі 500 мг в 100 мл фізіологічного розчину хлориду натрію внутрішньовенно краплинно 1 раз на добу протягом 10 днів, а потім по 500 мг внутрішньом’язово ще 10 днів.
Електричний потенціал мозку реєстрували за допомогою 21-канального апарату «Тредекс» із комп’ютерною обробкою даних, що оптимізувало кількісний аналіз енцефалограм, дозволило оцінити спектральну потужність та отримати топографічне картування електричної активності мозку. Для зняття показників використовували стандартне накладання електродів, застосовувалися стандартні функціональні проби (гіпервентиляція, заплющення та розплющення очей, фото- та звукостимуляція) та повороти голови в обидва боки.
Отримані показники були занесені до електрон–ної бази даних та оброблені за допомогою програми Statistica 6.0 із застосуванням параметричних та непараметричних методів варіаційної статистики, різниця була вірогідною при р < 0,05.
Результати та обговорення
За результатами проведеної КЕЕГ виявлено, що у хворих із ГДЕ та супутнім гіпотиреозом переважав III тип ЕЕГ — 21 хворий (35,1 %) (за Жирмунським О.А.), що характеризувався дифузною десинхронізацією хвиль, зі зниженням α-ритму до 16–18 мкВ. У 16 (26,6 %) хворих реєструвався IV тип, нерегулярний, дезорганізований α-ритм зі зниженням амплітуди до 25–27 мкВ, окрім того, реєструвалися повільні хвилі (дельта- та тета-хвилі), що може свідчити про зацікавленість мезодіенцефальних структур головного мозку. II тип ЕЕГ (гіперсинхронний) реєструвався у 13 (21,7 %) обстежених пацієнтів з амплітудою α-ритму до 65–70 мкВ. I тип ЕЕГ (нормальний) виявлений у 10 (16, 6 %) пацієнтів (рис. 1).
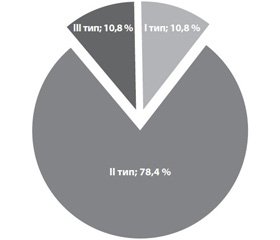
Як видно з рис. 2, серед пацієнтів із ГДЕ без супутнього гіпотиреозу I тип ЕЕГ реєструвався у 4 (10,8 %) осіб, II тип — у 29 (78,4 %), III тип ЕЕГ — у 4 (10,8 %).
Біоелектрична активність головного мозку у хворих із ГДЕ та супутнім гіпотиреозом характеризувалася переважно десинхронізацією та дезорганізацією кіркової ритміки. Визначені зміни на ЕЕГ свідчили про наявність метаболічних порушень та порушення кровопостачання головного мозку, що узгоджується з клінічними та гемодинамічними змінами, отриманими в результаті дослідження.
Незважаючи на те, що в обстежених хворих вихідний стан інтенсивності ритмів ЕЕГ у середньому був у фізіологічних межах, ми відзначили вірогідну наявність патологічних хвиль, а саме тета-хвиль, подразнення діенцефальних структур та міжпівкульову асиметрію (p < 0,05) у хворих із ГДЕ та супутнім гіпотиреозом порівняно з хворими без гіпотиреозу (табл. 1).
Таким чином, базуючись на отриманих результатах електрогенезу головного мозку, слід визнати, що гіпотиреоз негативно впливає на функціональну активність головного мозку. Це в першу чергу вказує на неадекватність кровозабезпечення стовбурових утворень із надсегментарними центрами регуляції гомеостазу, що свідчить про складність патогенезу коморбідної патології.
Після проведеного лікування із застосуванням базисной терапії та цитиколіну в пацієнтів першої групи відмічалося вірогідне покращення біоелектричної активності головного мозку (р < 0,05) за рахунок зменшення патологічних тета-хвиль, подразнення діенцефальних структур та міжпівкульової асиметрії. У пацієнтів другої групи після проведеної базисної антигіпертензивної терапії вірогідного покращення біоелектричної активності головного мозку не відмічалося (табл. 2).
Таким чином, при застосуванні в лікуванні хворих із коморбідною патологією (ГДЕ та супутній гіпотиреоз) цитиколіну за рахунок поліфакторного впливу на основні ланки патогенезу спостерігається покращення електроенцефалографічних показників головного мозку.
Висновки
1. Коморбідність ГДЕ та гіпотиреозу проявляється вірогідними змінами функціональної активності головного мозку, що є однією з патогенетичних ланок прогресування хронічної цереброваскулярної недостатності.
2. При застосуванні в лікуванні хворих на ГДЕ та супутній гіпотиреоз цитиколіну вірогідно покращуються показники електрогенезу головного мозку.
Список литературы
1. Мищенко Т.С. Дисциркуляторная энцефалопатия: устаревший термин или клиническая реальность? // Международный неврологический журнал. — 2013. — 2 (56).
2. Паньків В.І. Стан ендокринологічної служби України та перспективи розвитку медичної допомоги хворим з ендокринною патологією // Здоров’я України. 27.03.2015 // http://health-ua.com/articles/1342
3. Коваленко О.Є., Литвин О.В. Хронічна ішемія мозку у хворих з артеріальною гіпертензією та дисфункцією щитоподібної залози // Міжнародний ендокринологічний журнал. — 2017. — № 1. — С. 45-49.
4. Бурчинский С.Г. Нейропротекция при цереброваскулярной патологии: нейрональные и системные аспекты // Український неврологічний журнал. — 2015. — № 1. — С. 103-108.
5. Мищенко Т.С. Оптимизация терапии больных дисциркуляторной энцефалопатией / Т.С. Мищенко, В.Н. Мищенко, И.А. Лапшина // Український вісник психоневрології. — 2015. — Т. 23, вип. 1. — С. 37-41.
6. Паньків В.І., Юзвенко Т.Ю., Коритко О.О., Садов’як І.Д. та ін. Шляхи удосконалення надання медичної допомоги хворим на тиреопатії із супутньою патологією // Международный эндокринологический журнал. — 2014. — № 7(63). — С. 106-109.
7. Островая Т.В. Церебропротекция в аспекте доказательной медицины / Т.В. Островая, В.И. Черний // Медицина неотложных состояний. — 2007. — № 2 (9). — С. 48-52.
8. Паньків В.І. Особливості перебігу гіпотиреозу у поєднанні з ішемічною хворобою серця // Практична ангіологія. — 2009. — № 9–10 (28–29). — С. 52-56.
9. Товажнянська О.Л., Григорова І.А., Тихонова Л.В. Клінічні особливості та патогенетичні механізми формування неврологічних синдромів при первинному гіпотиреозі // Міжнародний неврологічний журнал. — 2010. — № 6 (36).
10. Saver J.L., David Geffen. Цитиколин: новые сведения о перспективном лекарственном средстве, осуществляющем нейропротекцию и нейрорепарацию // Международный неврологический журнал. — 2010. — № 1 (31).
11. Adibhatla R.M. Cytidine 5’-diphoshocholine (CDP-choline) in stroke and other CNS disorders / R.M. Adibhatla, J.F. Hatcher // Neurochem. Res. — 2005. — V. 30, № 1 (30). — Р. 15-23.
12. Mir C., Clotet J., Aledo R. CDP-choline prevents glutamate-mediated cell death in cerebellar granule neurons // J. Mol. Neurosci. — 2009. — V. 20. — P. 53-60.
13. Secades J., Lorenzo J. Citicoline: Pharmacological and Clinical Review, 2006 Update Methods Find // Exp. Clin. Pharmacol. — 2009. — 27 (Suppl. B). — P. 1-56.

/102-1.jpg )
/103-1.jpg )
/103-2.jpg )