Болезнь моя-моя (БММ) относится к хронической прогрессирующей сосудистой патологии головного мозга и характеризуется двусторонним стенозированием супраклиноидной части внутренних сонных артерий (ВСА) и начальных сегментов передней и средней мозговых артерий (ПМА и СМА) с последующим вовлечением вертебробазилярного бассейна, сопровождающимся развитием базальной сети анастомозов. БММ — сравнительно новая нозологическая форма, описанная впервые японскими авторами K. Takeuchi, T. Kudo в 1957 г. в японской литературе [14, 25]. Термин «болезнь моя-моя», введенный J. Suzuki в 1967 г., является общепризнанным названием заболевания [20, 21, 23] и в переводе с японского означает «нечто, подобное сигаретному дыму, плывущему в воздухе». Данное описание в полной мере соответствует ангиографической картине заболевания. БММ относится к группе редких заболеваний и ранее считалась специфичной для японцев. Встречается, по данным японских авторов, с частотой 1 случай на 1 млн населения [14, 17]. Однако с середины 1960-х — начала 1970-х годов появились публикации о случаях этого заболевания во всем мире [1, 5, 7–9, 16, 18, 26, 27]. В Республике Беларусь впервые упоминание об этой патологии отражено в работах Э.И. Злотника [3].
Патоморфологические нарушения при БММ проявляются изменением формы и размеров сосудов в виде плотных тяжей с узкими точечными просветами. Микроскопически стеноз сосудов происходит за счет резкого циркулярного утолщения интимы, в основе которой лежат разрастания эластической и коллагеновой ткани. В коллатералях наблюдаются дезорганизация эластического каркаса, разрывы внутренней эластической мембраны, некрозы гладкомышечных клеток, отечные изменения, перерастяжения стенок, их истончение и локальная дилатация [4, 6]. Патологический процесс начинается с уровня бифуркации ВСА. В этих условиях церебральный кровоток продолжает осуществляться через систему вертебрального бассейна, что проявляется формированием коллатеральной сети сосудов на основании мозга. По мере прогрессирования болезни в патологический процесс вовлекается и наружная сонная артерия с развитием анастомоза через глазничную артерию, что приводит к образованию в орбите второй сосудистой сети [4].
Этиология БММ остается невыясненной. Предполагается несколько возможных вариантов: генетическая аномалия артерий, которая часто ассоци–ируется с аномалиями кожи головы и шеи (ангиомы, аплазии); аутоиммунный воспалительный процесс, протекающий по типу неспецифического артериита, приводящий к повреждению интимы сосуда и последующему тромбозу; рецидивирующий спазм мозговых артерий. Кроме того, были описаны случаи сочетания БММ и неспецифического язвенного колита [10, 11, 19].
Заболевание чаще всего проявляется в возрасте от 10 до 30–40 лет, что делает данную патологию актуальной и значимой причиной функциональных нарушений у лиц молодого возраста. Клинически проявления БММ разнообразны и зависят от степени поражения магистральных сосудов, локализации, объема и характера очага поражения головного мозга. У детей возникают нарушения кровообращения головного мозга в виде инсультов и транзиторных ишемических атак. У взрослых пациентов наблюдаются ишемические инсульты и внутримозговые гематомы в равной степени [3].
Японским исследовательским комитетом по изучению БММ разработаны следующие диагностические критерии заболевания [24]: 1) стеноз или тромбоз внутренней сонной артерии на уровне бифуркации, а также проксимальных отделов передней и средней мозговой артерии; 2) характерное расширение базальных коллатеральных артерий, особенно лентикулостриарных и таламоперфорирующих; 3) двусторонний характер поражения. Общеклинические и биохимические исследования крови при БММ малоинформативны. В план обследования этой категории больных необходимо обязательно включать иммуноферментные исследования (тесты с волчаночным антикоагулянтом и кардиолипином). При компьютерной томографии (КТ) головного мозга выявляются неспецифические очаги пониженной плотности, локализованные в обоих каротидных бассейнах, атрофический процесс, сообщающаяся гидроцефалия или признаки внутричерепных кровоизлияний. Диагноз БММ становится достоверным на основании характерной ангиографической картины, состоящей из двустороннего стеноза или окклюзии интракраниального отдела внутренней сонной артерии и развитой коллатеральной сети на основании мозга, напоминающей дым сигарет. Предложена ангиографическая классификация заболевания: 1) выявляется только стеноз терминального супраклиноидного сегмента внутренней сонной артерии; 2) начало развития коллатеральной сети сосудов на основании мозга; 3) присоединение стеноза передней и средней мозговой артерии, развитие коллатеральной сети в области орбиты; 4) прогрессирующее исчезновение коллатеральной сети; 5) сужение задней мозговой артерии с едва видимыми передней и среднемозговой артериями; 6) тотальная облитерация артерий головного мозга, при этом мозговой кровоток поддерживается только через трансдуральные анастомозы. В настоящее время в диагностике БММ отдается предпочтение магнитно-резонансной ангиографии, являющейся безопасным, неинвазивным методом, результаты которого сопоставимы с данными ангиографии [24].
Лечение БММ. Хирургическое, медикаментозное лечение имеет лишь вспомогательное значение и не прекращает прогрессирование заболевания. Назначают антитромбоцитарные препараты, вазодилататоры и лекарственные средства, относящиеся к блокаторам кальциевых каналов.
Цель оперативного вмешательства — улучшение кровоснабжения головного мозга с исчезновением патологической коллатеральной циркуляции. Показания к операции выбирают на основании исследования перфузии головного мозга одним из методов (однофотонная эмиссионная томография с ацетазоламидом, перфузионная магнитно-резонансная томография (МРТ-перфузия), КТ-перфузия). Гипоперфузия участков головного мозга в покое или после введения ацетазоламида является показанием к проведению оперативного вмешательства. Хирургическое лечение состоит в создании прямого экстра-интракраниального микроартериального анастомоза и непрямого анастомоза — синангиоза. При прямом шунтировании соединяют поверхностную височную артерию (superficial temporal artery) со средней мозговой артерией (middle cerebral artery) (STA-MCA bypass, brain bypass). При создании синангиоза богато кровоснабженные мягкие ткани скальпа фиксируют к поверхности мозга, тем самым создавая условия для формирования новых сосудов — неоангиогенеза [12]. Возможно сочетание прямого и непрямого анастомозов. Как правило, к прямым анастомозам прибегают у взрослых, тогда как у детей результаты лечения лучше при использовании непрямых анастомозов. Иногда для полноценной реваскуляризации головного мозга требуется несколько операций [2].
Ранее (в 2008 году) на страницах «Международного неврологического журнала» мы уже сообщали о двух случаях диагностики БММ, один из которых был подтвержден на секции. За последующие годы к ним добавились еще 3 наблюдения, одно из которых представляет интерес с точки зрения сопоставления клинических данных и результатов современных нейровизуализационных методов обследования. Это и явилось целью нашей публикации. Приводим наше наблюдение.
Пациентка М., 32 года, работает диспетчером, поступила 18.10.2016 в неврологическое отделение № 2 УЗ «Минская областная клиническая больница» с жалобами на нарушение зрения и речи. Считает себя больной около двух лет, впервые развился инфаркт головного мозга в левом каротидном бассейне с правосторонним гемипарезом и афатическими нарушениями. Проходила лечение и курс реабилитации с положительной динамикой, приступила к работе. В августе 2016 года — повторный инфаркт головного мозга в одноименном бассейне с моторной афазией и правосторонним гемипарезом, затем присоединились зрительные нарушения. В анамнезе: частые простудные заболевания (хронический тонзиллит), повышение артериального давления (АД) до 160/90 мм рт.ст., хронический пиелонефрит, латентная форма. Семейно-наследственный анамнез не отягощен. Для уточнения характера и причины повторного инсульта пациентка госпитализи–рована.
Объективно при поступлении состояние относительно удовлетворительное, правильного телосложения, умеренного питания. Кожные покровы обычной окраски, чистые. Периферические лимфатические узлы не пальпируются. Полость рта — слизистая бледно-розовая, признаков воспалительного процесса в рото- и носоглотке на момент осмотра нет. Органы дыхания: в легких дыхание везикулярное, проводится во всех отделах, хрипов нет. Органы кровообращения: тоны сердца ритмичные, ясные, пульс 116 ударов в минуту, АД 160/80 мм рт.ст. Органы пищеварения: живот доступен глубокой пальпации, безболезненный. Органы мочевыделения: моче–испускание свободное, дизурических явлений не отмечается. Симптом поколачивания отрицательный. Неврологический статус: в сознании, ориентирована правильно, контактна. Умеренная моторная афазия, обращенную речь понимает, команды выполняет правильно. Черепные нервы: недостаточность VII и XII пар нервов справа по центральному типу. Силовых парезов конечностей нет, мышечный тонус не изменен, сухожильно-периостальные рефлексы оживлены D > S, клонус правой стопы; подошвенные, брюшные рефлексы ослаблены.
Нарушений чувствительности не выявлено. Координаторные пробы выполняет нечетко правыми конечностями, в позе Ромберга устойчива, менингеальных симптомов нет. При обследовании: общеклинические анализы крови и мочи без патологии, биохимический анализ крови без особенностей (холестерин — 3,4 ммоль/л, тромбоциты — 266 тыс/мкл). Гемостазиограмма: незначительное повышение уровня фибриногена. Иммунограмма: антител к иммуноглобулинам G, М, кардиолипиновых антител и c волчаночным антикоагулянтом не выявлено. Окулист: острота зрения 0,8–0,9 на оба глаза, непостоянное расходящееся косоглазие справа; глазное дно: диски зрительных нервов бледно-розовые, границы четкие, артерии сужены, вены извиты. Электрокардио–грамма: синусовая тахикардия, частота сердечных сокращений 122 уд/мин, вертикальное положение электрической оси сердца. Эхокардиография: камеры и клапаны сердца не изменены, сократительная способность миокарда не нарушена, в полости сердца тромбов не выявлено. Дополнительная хорда левого желудочка. Осмотр кардиолога: артериальная гипертензия II, риск 4.
Для нейровизуализационной диагностики использовались следующие методы обследования: мультиспиральная компьютерная томография (МСКТ) головного мозга, МСКТ-ангиография брахиоцефальных артерий, МСКТ-перфузия головного мозга проводилась на аппарате General Electric Optima CT-660, 64 среза. Магнитно-резонансная томография головного мозга, МРТ-перфузия головного мозга выполнена на аппарате Philips Ingenia 1,5 T; рентгеноэндоваскулярные исследования — на аппарате General Electric со специальной компьютерной обработкой данных, построением объемных реконструкций.
Результаты и обсуждение
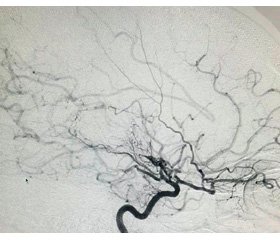
Церебральная ангиография выявила окклюзию сегментов А1, М1 справа, М1 слева, трифуркацию передней мозговой — передней соединительной артерии слева, дистальные отделы обеих средних мозговых артерий контрастируются через развитые коллатерали, что представлено на ангиограммах (рис. 1).
При выполнении МСКТ головного мозга выявляются постишемические изменения в лобно-–теменной области справа, теменной области слева. При болюсном контрастировании — КТ-признаки БММ (рис. 2).
/134-1.jpg )
МРТ головного мозга: кортикально, субкортикально и в белом веществе лобно-теменных областей обоих полушарий определяются обширные зоны множественных кистозно-глиозных изменений, срединные структуры не смещены, базальные цистерны, желудочки мозга, кортикальные борозды не расширены. На МР-перфузионных сканах данных о локальных изменениях перфузии не выявлено. Пациентка консультирована эндоваскулярным нейрохирургом — с учетом отсутствия нарушений перфузии головного мозга по результатам нейровизуализационных методов обследования показаний для оперативного лечения на момент наблюдения нет. Проведено лечение: курс нейропротекторной, ноотропной и вазоактивной терапии, аспикард 75 мг, клопидогрель 75 мг, бисопролол 2,5 мг, занятия с логопедом. Состояние пациентки с положительной динамикой: уменьшилась выраженность моторной афазии, нормализовалось АД. После выписки из стационара пациентка находится под наблюдением невролога, кардиолога, продолжает прием аспикарда и клопидогреля по 75 мг в сутки.
Таким образом, у 32-летней женщины имели место повторные инфаркты головного мозга в каротидных бассейнах, которые закончились формированием множественных кистозно-глиозных изменений головного мозга, что клинически проявилось умеренной моторной афазией. Результаты КТ-ангиографии выявили характерный для БММ паттерн — сужение артерий виллизиева круга, средние мозговые артерии с обеих сторон не дифференцируются и представлены густой сетью коллатералей, имеющих извитой, сложный ход.
Выводы
Ведущей патогенетической причиной развития болезни в данном случае явился феномен обкрадывания вследствие прогрессирующего тромбоза внутренней сонной артерии и ее ветвей, а также нельзя исключить и аутоиммунный механизм, что подтверждают частые воспалительные процессы в области лица и шеи, латентная форма хронического пиелонефрита. Диагностика ранних стадий БММ затруднена в связи с отсутствием характерных для БММ симптомов, однако развитие транзиторных ишемических атак или инфарктов мозга в молодом возрасте позволяет заподозрить данное заболевание. Дальнейшей тактикой ведения данного клинического случая выбрано продолжение консервативной терапии ввиду того, что у пациентки компенсаторные возможности коллатералей в настоящее время удовлетворительные, что обеспечивает адекватную перфузию головного мозга.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Буркова К.И., Ажермачева М.Н., Алифирова В.М. и др. Болезнь моя-моя (клиническое наблюдение) // Неврологический журнал. — 2014. — № 5. — С. 38-42.
2. Бывальцев В.А., Сузуки Й. Комбинированное лечение болезни моя-моя с использованием прямого анастомоза и реваскуляризации — опыт 225 операций // Вопросы нейрохирургии. — 2007. — № 3. — С. 11-16.
3. Злотник Э.И., Кузнецов В.Ф., Кастрицкая З.М., Без–зубик С.Д. Болезнь «мойя-мойя» // Вопросы нейрохирургии. — 1978. — № 2. — С. 41-46.
4. Медведев Ю.А., Мацко Д.Е. Аневризмы и пороки развития сосудов мозга: Этиология. Патогенез. Классификация. Патологическая анатомия. — СПб., 1993. — С. 74-76.
5. Одинaк М.М., Михайленко А.А., Иванов Ю.С., Семин Г.Ф. Сосудистые заболевания головного мозга. — СПб.: Гиппократ, 1997. — С. 39.
6. Пономарев В.В. Редкие неврологические синдромы и болезни. — СПб., 2005. — 216 с.
7. Скоромец А.А., Шулешова Н.В., Курилин А.П. К клинике и лечению болезни мойя-мойя // Вопросы нейрохирургии. — 1988. — № 2. — С. 28-31.
8. Чеботарева Н.М., Пуканов В.С. О болезни Nishimoto — Takeuchi — Kudo // Журнал невропатологии и психиатрии. — 1973. — № 12. — С. 1794-1800.
9. Calliauw L. Moyamoya // Neurochirurgie. — 1972. — Vol. 4. — P. 383-390.
10. Gorrotxategi P., Reguilon M., Gaztanaga R. et al. Moya-Moya disease in a child with multiple malformation // Rew. Nuerol. — 1995. — Vol. 23, № 120. — P. 403-405.
11. Ho C., Baraitser M. Neurological complications in one of a sibpair with aplasia cutis congenita // Clin. Dismorphol. — 1992. — Vol. 1, № 4. — P. 235-239.
12. Imaizumi T., Hayashi K. et al. Long-term outcomes of pediatric moyamoya disease monitored to adulthood // Pediatr. Neurol. — 1998. — Vol. 18. — P. 321-325.
13. Kong K., Chan K., Tan E. et al. Functional outcome in young strokes // Ann. Acad. Med. Singapore. — 1995. — Vol. 24(1). — Р. 172-176.
14. Kudo Т., Takayama R., Mikawakuchi K. et al. Occlusion of internal carotid artery // Brain Nerve (Tokyo). — 1957. — Vol. 9. — P. 757.
15. Kudo Т., Fukuda S. Spontaneous occlusion of the circle of Willis // Shinkei-shimpo. — 1976. — Vol. 20. — P. 750-757.
16. Leeds N.E., Abbott K.H. Collateral circulation in cerebrovascular disease in childhood via rete mirabile and perforating branches of anterior choroidal and posterior cerebral arteries // Radiology. — 1965. — Vol. 85. — P. 628-634.
17. Nishimoto A., Takeuchi S. Abnormal cerebrovascular network related to the internal carotid arteries // J. Neurosurg. — 1968. — Vol. 29. — P. 255-260.
18. Picard L., Andre J.M., Tridon P. Introduction. History of the Moyamoya // J. Neuroradiol. — 1974. — Vol. 1. — P. 47-54.
19. Shanahan P., Hutchinson M., Bohan A. et al. Hemichorea, moua-moua, and ulcerative colitis // Mov. Disord. — 2001. — Vol. 16, № 3. — P. 570-572.
20. Subirana A., Subirana M. Malformations vasculares du type de angiome arteriel racemeux // Rev. Neurol. (Paris). — 1962. — Vol. 107. — P. 545-550.
21. Suzuki J., Takaku A. Cerebrovascular «moyamoya» dise–ase: Disease showing abnormal net-like vessels in base of brain // Arch. Neurol. (Chic.). — 1969. — Vol. 20. — P. 288-299.
22. Suzuki J., Takaku A., Asahi M. Comments on «moyamoya disease» // A Disease with Abnormal Intracranial Vascular Networks. — Tokyo: Igakushion, 1967. — P. 73-75.
23. Suzuki J., Kodama N. Moyamoya disease: A review // Stroke. — 1983. — Vol. 14. — P. 104-109.
24. Suzuki J. Moyamoya Disease. — Berlin: Springer-Verlag, 1986.
25. Takeuchi K., Shimizu K. Hypoplasia of the bilateral internal carotid arteries // Brain Nerve (Tokyo). — 1957. — Vol. 9. — P. 37-43.
26. Taveras J. Multiple progressive intracranial arterial occlusions: A syndrome of children and young adults // Am. J. Roentgenol. — 1969. — № 106. — P. 235-268.
27. Weidner W., Hanafee W., Markham С.Н. Intracranial collateral circulation via leptomeningeal and rete mirabile anastomoses // Neurology. — 1968. — № 15. — P. 39-43.

/133-1.jpg )
/134-1.jpg )