Резюме
Актуальність. Однією з основних причин виникнення синдрому надлишкового бактеріального росту (СНБР) може бути ахлоргідрія будь-якого походження. Дані про цю проблему суперечливі, ряд дослідників заперечують зв’язок тривалого прийому інгібіторів протонної помпи (ІПП) з розвитком СНБР. Мета. Вивчення клінічних проявів та оцінювання стану мікробіоценозу верхніх відділів тонкої кишки у дітей, хворих на хронічний гастрит (ХГ) зі зниженою кислотоутворюючою функцією шлунка. Матеріали та методи. Обстежено 65 дітей, хворих на ХГ, віком 7–18 років. Методи дослідження включали: езофагогастродуоденоскопію, щиткову біопсію слизової оболонки шлунка на H. рylori, pH-метрію; ультразвукове дослідження органів черевної порожнини. Морфологічні зміни слизової оболонки оцінювали за візуально-аналоговою шкалою. Для верифікації СНБР усім пацієнтам проводився водневий дихальний тест (ВДТ) із використанням аналізатора Gastrolyzer та навантаженням лактулозою. Результати представлялися: кількістю спостережень, середніми значеннями показників, їх стандартними відхиленнями та помилками (М ± m для р < 0,05), відносними частотами (%). Результати. Серед 65 обстежених дітей, хворих на ХГ, виділено 27 осіб, у яких встановлено зниження кислотоутворюючої функції шлунка; середній показник pH становив 4,7 ± 0,4. У 17 дітей, хворих на ХГ, виявлено гастроезофагеальний рефлюкс (ГЕР). В обох групах хворих домінували симптоми діареї і метеоризму, проте в групі пацієнтів із ГЕР на тлі прийому ІПП частота і вираженість симптомів наростала зі збільшенням тривалості терапії. Встановлено, що інфекція H. рylori реєструвалася у 42 (64,6 %) серед усіх дітей, хворих на ХГ. За результатами ВДТ у більше ніж третини (44,4 %) пацієнтів виявлено СНРБ. У дітей, хворих на ХГ у поєднанні з ГЕР, позитивний ВДТ зареєстровано у 41,1 %. Відзначено, що частота виявлення СНБР у цих пацієнтів збільшується зі збільшенням тривалості прийому ІПП. Висновки. У дітей, хворих на ХГ із пониженою кислотопродукувальною функцією шлунка та у хворих дітей із ГЕР, які тривалий час отримували ІПП, відзначається висока частота скарг, пов’язаних із розвитком СНБР. Наявність СНБР у пацієнтів із ХГ і пацієнтів, які тривалий час отримували ІПП, підтверджується результатами ВДТ (44,4 і 41,1 % відповідно).
Актуальность. Одной из основных причин возникновения синдрома избыточного бактериального роста (СИБР) может быть ахлоргидрия любого происхождения. Данные об этой проблеме противоречивы, ряд исследователей отрицают связь длительного приема ингибиторов протонной помпы (ИПП) с развитием СИБР. Цель. Изучение клинических проявлений и оценивание состояния микробиоценоза верхних отделов тонкой кишки у детей с хроническим гастритом (ХГ) и пониженной кислотообразующей функцией желудка. Материалы и методы. Обследовано 65 детей с ХГ в возрасте 7–18 лет. Методы исследования включали: эзофагогастродуоденоскопию, щитковую биопсию слизистой оболочки желудка на H. рylori, pH-метрию; ультразвуковое исследование органов брюшной полости. Морфологические изменения слизистой оболочки оценивали по визуально-аналоговой шкале. Для верификации СИБР всем пациентам проводился водородный дыхательный тест (ВДТ) с использованием анализатора Gastrolyzer и нагрузкой лактулозой. Результаты представлялись: количеством наблюдений, средними значениями показателей, их стандартными отклонениями и ошибками (М ± m для р < 0,05), относительными частотами (%). Результаты. Среди 65 обследованных детей с ХГ выделены 27 человек, у которых установлено снижение кислотообразующей функции желудка; средний показатель pH составлял 4,7 ± 0,4. У 17 детей с ХГ обнаружен гастроэзофагеальный рефлюкс (ГЭР). В обеих группах больных доминировали симптомы диареи и метеоризма, однако в группе пациентов с ГЭР на фоне приема ИПП частота и выраженность симптомов нарастала с увеличением продолжительности терапии. По результатам исследования установлено, что инфекция H. рylori регистрировалась у 42 (64,6 %) из всех детей с ХГ. По результатам ВДТ у более чем трети (44,4 %) пациентов выявлен СИРБ. У детей с ХГ в сочетании с ГЭР положительный ВДТ зарегистрирован в 41,1 %. Отмечено, что частота выявления СИБР у этих пациентов увеличивается с увеличением продолжительности приема ИПП. Выводы. У детей с ХГ и пониженной кислотообразующей функцией желудка и у больных детей с ГЭР, длительно получавших ИПП, отмечается высокая частота жалоб, связанных с развитием СИБР. Наличие СИБР у пациентов с ХГ и пациентов, длительно получавших ИПП, подтверждается результатами ВДТ (44,4 и 41,1 % соответственно).
Background. Achlorhydria of any origin may be one of the main causes of bacterial overgrowth syndrome (BOS). The data on this controversial issue, some researchers argue the association of long-term use of proton pump inhibitors (PPI) with BOS development. The purpose was to study the clinical manifestations and the state of microbiota of the upper intestine in children with chronic gastritis and reduced gastric function. Materials and methods. The study involved 65 children with chronic gastritis (CG), aged 7–18 years. The study methods included esophasogastroduodenoscopy, biopsy of the gastric mucosa for H. pylori, pH-meter; ultrasound investigation of the abdominal cavity. Mucosa morphological changes were assessed by visual analogue scale. A hydrogen breath test (HBT) using the analyzer Gastrolyzer load lactulose was performed in all patients in order to verify BOS. The results were presented by the number of observations mean values and their standard deviation and error (M ± m for p < 0.05), relative frequency (%). Results. Of the 65 examined children suffering from CG, 27 persons had hypoacidy hastritis, the average pH was 4.7 ± 0.4. Seventeen children with CG had gastroesophageal reflux (GER). In both groups of patients symptoms of diarrhea and flatulence dominated, but in patients with GER receiving PPIs prevalence and severity of symptoms deteriorated with increasing duration of therapy. The study found that H. pylori infection was registered in 42 (64.6 %) of all children with CG. The HBT results demonstrated that more than a third (44.4 %) patients had BOS. In children with CG combined with GER positive HBT was registered in 41.1 % cases. The BOS incidence in these patients was found to enhance with increasing duration of PPI intake. Conclusions. A high incidence of complaints related to the BOS development was found in children with hypoacid CG and in patients with GER treated with PPIs. BOS in patients with CG and patients who have been treated with PPIs, was verified by HBT (44.4 % and 41.1 %, respectively).
Вступ
На сьогодні переконливо доведено, що загальна чисельність мікробіоти в організмі досягає 1014–1015 мікробних клітин, що на 1–2 порядки більше, ніж клітин людського організму. Деякі автори вважають, що на кожну соматичну клітину припадає до 1000 клітин-симбіонтів. При цьому встановлено, що частка людських генів у сукупному геномі людини та мікроорганізмів становить не більше 1 % [1, 2]. Вся нормальна мікрофлора поділена на резидентну (постійну), що становить майже 90 % від наявних в організмі мікроорганізмів, факультативну, що становить близько 9,5 %, і транзиторну (випадкову), кількість якої не перевищує 0,5 % [3].
Найбільш заселеним біотопом є шлунково-кишковий тракт, особливо товста кишка. Нині відзначається постійне зростання захворювань, пов’язаних із порушенням біологічної рівноваги між макроорганізмом, тобто людиною, та різноманітними популяціями мікробної флори його окремих органів і систем, що склалася в процесі еволюції [4]. Одним із таких порушень є синдром надлишкового бактеріального росту (СНБР) в тонкій кишці — патологічний стан, в основі якого лежить підвищена контамінація тонкої кишки (понад 105 КУО/мл аспірату) за рахунок умовно-патогенної мікрофлори, що надходить із верхніх відділів шлунково-кишкового тракту (або верхніх дихальних шляхів), або фекальної мікрофлори внаслідок ретроградної транслокації, що супроводжується синдромом хронічної діареї та мальабсорбції [5].
Однією з основних причин виникнення СНБР може бути ахлоргідрія будь-якого походження. Дані про цю проблему суперечливі, ряд дослідників заперечують зв’язок тривалого прийому інгібіторів протонної помпи (ІПП) з розвитком СНБР [6, 7]. Навпаки, за даними інших зарубіжних дослідників, 30–50 % пацієнтів, які тривалий час приймали ІПП, страждають від СНБР [7–9]. Крім того, в літературі практично немає даних про частоту розвитку СНБР при хронічному гастриті (ХГ) зі зниженою кислотоутворюючою функцією шлунка.
Мета дослідження: вивчити клінічні прояви та оцінити стан мікробіоценозу верхніх відділів тонкої кишки у дітей, хворих на ХГ зі зниженою кислотоутворюючою функцією шлунка.
Матеріали та методи
Обстежено 65 дітей, хворих на ХГ, віком 7–18 років. Діагноз верифікували за МКХ-10 та формулювали відповідно до наказу Міністерства охорони здоров’я України за № 59 від 29.01.2013 р. У дослідження залучалися хворі, в яких на фоні адекватної терапії основного захворювання виникали неспецифічні для основного захворювання скарги: здуття живота, діарея, дискомфорт і біль у животі.
Клінічні методи дослідження включали збір скарг та оцінку їх інтенсивності за 10-бальною візуально-аналоговою шкалою (ВАШ), анамнезу основного захворювання і фізикальний огляд. Лабораторне обстеження включало: клінічний аналіз крові; сечі; біохімічне дослідження крові.
Проведено додаткові методи дослідження: езофагогастродуоденоскопію за допомогою фіброгастродуоденоскопа Olympus з визначенням ендоскопічних критеріїв наявності гелікобактера (Нelicobacter pylori, H. pylori), щиткову біопсію слизової оболонки шлунка за загальноприйнятими правилами забору з подальшим приготуванням мазка-відбитка, забарвленням, бактеріоскопією; pH-метрію; фракційне дослідження функції шлунка; ультразвукове дослідження органів черевної порожнини; обстеження на наявність антитіл до H. pylori за допомогою імуноферментного аналізу. Морфологічні зміни слизової оболонки оцінювали за ВАШ. Для верифікації СНБР усім пацієнтам проводився водневий дихальний тест (ВДТ) із використанням аналізатора Gastrolyzer та навантаженням лактулозою. Отримані результати оброблялись статистично, з визначенням вірогідності за t-критерієм Стьюдента. Результати представлялися: кількістю спостережень, середніми значеннями показників, їх стандартними відхиленнями і помилками (М ± m для р < 0,05), відносними частотами (%).
Результати та обговорення
Діти обох груп були розподілені на підгрупи за віком та статтю (табл. 1).
/48-1.jpg)
Ретельний аналіз суб’єктивних та об’єктивних проявів ХГ залучених до обстеження дітей дозволив виділити три провідні синдроми: больовий (92,3 ± 1,3 %), диспептичний (76,9 ± 3,2 %), неспецифічної інтоксикації і вегетосудинної дисфункції (69,2 ± 2,6 %). Варто зауважити, що вірогідно частіше больовий синдром діагностувався серед дітей вікової підгрупи 12–18 років (95,5 ± 2,4 % щодо його частоти в дітей 7–11 років — 84,2 ± 2,6 %, φ = 2,12; р < 0,05), тоді як диспептичний синдром, синдром неспецифічної інтоксикації і вегетосудинної дисфункції у підгрупах дітей 7–11 та 12–18 років зустрічалися майже з однаковою частотою (78,9 ± 2,1 % та 78,6 ± 2,4 % відповідно, φ = 1,13; р > 0,05 і 65,8 ± 2,6 % та 67,9 ± 2,8 % відповідно, φ = 1,11; р > 0,05). Статевої різниці у частоті больового, диспептичного синдромів і неспецифічної інтоксикації та вегетосудинної дисфункції не виявлено. Як у хлопчиків, так і у дівчаток вірогідно частіше визначався больовий синдром (92,7 ± 2,4 % та 92,6 ± 2,2 % відповідно, φ = 1,11; р > 0,05,); синдром диспепсії (79,3 ± 2,5 % та 77,9 ± 2,3 % відповідно, φ = 1,14; р > 0,05, неспецифічної інтоксикації і вегетосудинної дисфункції (65,4 ± 2,1 % та 69,1 ± 2,2 % відповідно, φ = 1,12; р > 0,05) зустрічалися з меншою частотою в осіб обох статей.
У 40,0 ± 2,4 % дітей біль локалізувався в епігастральній ділянці та мав ізольований характер; у решти пацієнтів поєднувався з локалізацією в інших відділах живота. Так, у 7,6 ± 1,0 % дітей біль поєднувався з локалізацією у пілородуоденальній ділянці, у 23,1 ± 1,1 % дітей — навколо пупка, у 21,5 ± 1,2 % — у правому підребер’ї, у 3,1 ± 1,0 % — у лівому підребер’ї. Локалізацію болю по всьому животу відзначали 7,6 ± 1,0 % дітей. Отже, можна зазначити, що найбільш часто біль локалізується ізольовано в епігастральній ділянці (φ = 2,34; р < 0,05) та в комбінації з навколопупковою ділянкою (φ = 2,29; р < 0,05) і правим підребер’ям (φ = 2,34; р < 0,05).
Серед 65 обстежених дітей, хворих на ХГ, виділено 27 осіб, у яких встановлено зниження кислотоутворюючої функції шлунка, середній показник pH становив 4,7 ± 0,4. Частота контрольованих скарг у цієї групи пацієнтів подана на рис. 1.
Вираженість симптомів за шкалою ВАШ у пацієнтів, хворих на ХГ, становила: метеоризм — 7,72 ± 0,91; діарея — 6,62 ± 0,94; дискомфорт внизу живота — 4,77 ± 0,87; біль внизу живота — 3,99 ± 0,82.
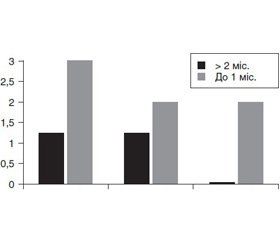
У 17 дітей, хворих на ХГ, виявлено гастроезофагеальний рефлюкс (ГЕР). Вираженість аналогічних скарг у пацієнтів із ГЕР на тлі прийому ІПП становила: до 1 міс.: метеоризм — 1,83 ± 0,49; діарея — 1,19 ± 0,44; дискомфорт внизу живота — 1,17 ± 0,27; біль внизу живота — 1,09 ± 0,12; до 2 міс. — метеоризм — 3,93 ± 0,59; діарея — 2,56 ± 0,54; дискомфорт внизу живота — 1,87 ± 0,29; біль внизу живота — 1,39 ± 0,22.
Отже, з наведених даних видно, що в обох групах хворих домінували симптоми діареї і метеоризму, проте в групі пацієнтів із ГЕР на тлі прийому ІПП частота і вираженість симптомів наростала зі збільшенням тривалості терапії.
За результатами дослідження встановлено, що інфекція H. рylori реєструвалася у 42 (64,6 %) серед усіх дітей, хворих на ХГ. У пацієнтів, хворих на ХГ зі зниженою кислотоутворюючою функцією шлунка, інфекція H. рylori виявлялася дещо рідше — у 12 осіб із 27, що становило 44,4 %.
Бальна оцінка больового синдрому показала, що найвищий бал реєструвався у дітей із Н. рylori-асоційованим ХГ ((7,37± 0,08 — у дітей із Н. рylori-асоційованим ХГ та 5,83 ± 0,08 — у дітей із Н. рylori-неасоційованим ХГ; р < 0,05), у старшій віковій підгрупі (7,37 ± 0,06 — у підгрупі дітей віком 12–18 років та 5,39 ± 0,03 — у підгрупі дітей віком 7–11 років; р < 0,05), у хлопчиків (6,14 ± 0,07 — у хлопчиків та 5,09 ± 0,04 — у дівчаток; р < 0,05).
Вірогідної різниці залежно від віку у частоті симптомів кишкової диспепсії (φ = 1,08; р > 0,05) не виявлено. Як у дітей віком 7–11 років, так і в дітей віком 12–18 років приблизно з однаковою частотою реєструвалися метеоризм (φ = 1,03; р > 0,05) та проноси (φ = 1,06; р > 0,05) із незначним переважанням останніх у дітей старшої вікової групи.
У дітей із тривалістю захворювання понад 3 роки схильність до проносу була частішою (38,1 ± 7,2 % щодо дітей із тривалістю хвороби до року — 18,4 ± 2,1 %, φ = 1,99; р < 0,05).
За результатами ВДТ у більше ніж третини (44,4 %) пацієнтів виявлено СНРБ. Розподіл хворих на ХГ з позитивним ВДТ за ступенем підвищення рівня водню в повітрі, що видихається. поданий на рис. 2.
У дітей, хворих на ХГ у поєднанні з ГЕР, позитивний ВДТ зареєстровано у 41,1 %. Відзначено, що частота виявлення СНБР у цих пацієнтів збільшується зі збільшенням тривалості прийому ІПП (рис. 3).
Розподіл дітей, хворих на ХГ у поєднанні з ГЕР, залежно від ступеня підвищення ВДТ і терміну прийому ІПП наведено на рис. 4.
Аналіз даних, отриманих під час дослідження, показує, що зниження кислотоутворюючої функції шлунка в дітей, хворих на ХГ, і тривалий прийом ІПП пацієнтами з поєднаним ХГ і ГЕР, супроводжує збільшення частоти та вираженості СНБР, що збігається з даними літератури [8].
Висновки
1. Клінічна симптоматика ХГ в дітей характеризується наявністю трьох провідних синдромів (больового, диспептичного та неспецифічної інтоксикації), вираженість яких залежить від інфікування H. pylori, порушення моторно-евакуаторної та кислотопродукувальної функцій шлунка.
2. У дітей, хворих на ХГ із пониженою кислотопродукувальною функцією шлунка та у хворих дітей із ГЕР, які тривалий час отримували ІПП, відзначається висока частота скарг, пов’язаних із розвитком СНБР.
3. У дітей, хворих на ХГ із пониженою кислотопродукувальною функцією шлунка, переважали скарги на метеоризм, діарею, дискомфорт внизу живота і біль внизу живота. У групі хворих, які тривалий час отримували ІПП, частота реєстрації скарг залежить від часу прийому препаратів: зі збільшенням терміну прийому ІПП частота їх наростає.
4. Наявність СНБР у пацієнтів із ХГ і пацієнтів, які тривалий час отримували ІПП, підтверджується результатами ВДТ (44,4 і 41,1 % відповідно).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Gill SR, Pop M, Deboy RT, Eckburg PB, Turnbaugh PJ, Samuel BS, Gordon JI, Relman DA, Fraser-Liggett CM, Nelson KE. Metagenomic analysis of the human distal gut microbiome. Science. 2006 Jun 2;312(5778):1355-9. doi:10.1126/science.1124234.
2. Tremaroli V, Backhed F. Functional interactions between the gut microbiota and host metabolism. Nature. 2012;489(7):242-9. doi: 10.1038/nature11552.
3. Sanders ME, Guarner F, Guerrant R, Holt PR, Quigley EM, Sartor RB, et al. An update on the use and investigation of probiotics in health and disease. Gut 2013;62(5):787-96. doi: 10.1136/gutjnl-2012-302504.
4. Lozupone CA, Stombaugh J, Gonzalez A, Ackermann G, Wendel D, Vázquez-Baeza Y, et al. Meta-analyses of studies of the human microbiota. Genome Res 2013 Oct;23(10):1704-14. doi: 10.1101/gr.151803.112.
5. Plotnykova EYu, Zakharova Yu. Diagnosis and treatment of the syndrome of bacterial overgrowth. Russkyy medytsynskyy zhurnal. 2015;13:767. (In Russian).
6. Spiegel BM, Chey WD, Chang L. Questioning the bacterial overgrowth hypothesis of irritable bowel syndrome: an epidemiologic and evolutionary perspective. Clin. Gastroenterol Hepatol. 2011;9(6):461-9. doi: 10.1016/j.cgh.2011.02.030.
7. Ershova IB, Mochalova AA, Osipova TF, Rezchikov VA. Topical issues of joint use of antibacterial drugs and probiotics. Aktualnaya infektologiya. 2015;3(8):25-30. (In Russian). doi: 10.22141/2312-413x.3.08.2015.78696.
8. Ratuapli SK, Ellington TG, O’Neill MT, Umar SB, Harris LA, Foxx-Orenstein AE, Burdick GE, Dibaise JK, Lacy BE, Crowell MD. Proton pump inhibitor therapy use does not predispose to small intestinal bacterial overgrowth. Am J Gastroenterol. 2012;107(5):730-5. doi: 10.1038/ajg.2012.4.
9. Lombardo L, Foti M, Ruggia O, Chiecchio A. Increased incidence of small intestinal bacterial overgrowth during proton pump inhibitor therapy. Clin Gastroenterol Hepatol. 2010;8(6):504-8. doi: 10.1016/j.cgh.2009.12.022.
/48-1.jpg)

/49-1.jpg)