Хроническая воспалительная демиелинизирующая полиневропатия (ХВДП) — это аутоиммунная полиневропатия, характеризующаяся медленно прогрессирующими двигательными и чувствительными нарушениями в конечностях и/или поражением краниальных нервов, достигающими максимума более чем за 8 недель [1].
По нашим данным, распространенность ХВДП в Республике Беларусь составляет 2,1 случая на 100 тыс. населения [2]. Многими исследователями высказывается мнение, что реальная частота ХВДП значительно выше, учитывая стертые и атипичные формы заболевания [3, 4].
Отмечается более частое поражение мужчин (соотношение заболевших мужчин и женщин составляет 1,55 : 1). Наиболее часто заболевание начинается в возрасте 35–48 лет, хотя нередки случаи ХВДП в детском и пожилом возрасте [2, 5]
Долгое время заболевание рассматривали как хронический вариант синдрома Гийена — Барре (СГБ), а в отдельную нозологическую форму эта патология выделена относительно недавно. Так, в 1975 году P.J. Dyck с соавт. первыми предложили термин «хроническая воспалительная полирадикулоневропатия» [6]. По сути, основными отличительными чертами СГБ и ХВДП являются клиническое течение и ответ на кортикостероиды. Но в последнее время характер развития симптомов тоже подвергается критической дискуссии, т.к. встречаются формы ХВДП с острым началом, а также описаны случаи рецидивов СГБ [7, 8]. Последняя особенность делает очень затруднительной достоверную диагностику при атипичных формах обоих заболеваний.
/78-1.jpg )
В настоящее время для диагностики ХВДП используют международные критерии, которые периодически меняются и дополняются (A.H. Ropper et al., 1991; G. Walton et al., 1994; INCAT (Inflammatory Neuropathy Cause and Treatment) Сriteria, 2001; Saperstein Criteria, 2001; EFNS/PNS (European Federation of Neurological Societies/Peripheral Nerve Society) Сriteria, 2010), что указывает на их недостаточную достоверность [9–11].
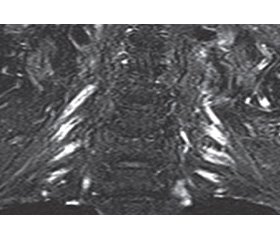
На сегодняшний день по-прежнему основополагающим методом диагностики остается электронейромио–графия (ЭНМГ) в сочетании с клинической картиной заболевания. При ЭНМГ обычно выявляются признаки демиелинизации периферического нерва, такие как снижение скорости проведения, увеличение дистальной латентности и временной дисперсии, блоки проведения, увеличение латентности F-волны по меньшей мере в двух двигательных нервах (рис. 1). При игольчатой ЭНМГ выявляется снижение потенциалов действия двигательных единиц с признаками мышечной реиннервации [12]. В критериях EFNS 2010 выделены также поддерживающие признаки диагностики ХВДП. К ним относятся: белково-клеточная диссоциация в спинномозговой жидкости (СМЖ), признаки гипертрофии и/или накопления контраста в нервах шейного и поясничного сплетений при выполнении магнитно-резонансной томографии (рис. 2), аномальные электрофизиологические показатели при исследовании сенсорных волокон, положительный эффект иммуномодулирующей терапии, признаки демиелинизации при биопсии периферического нерва [13].
/79-1.jpg )
С учетом наличия атипичных форм ХВДП, клинически схожих с другими хроническими дизиммунными невропатиями, частого сочетания с системной патологией диагностические ошибки могут превышать 30 % даже при соответствии всем клиническим и нейрофизиологическим критериям диагностики ХВДП [14]. Таким образом, остается открытым вопрос правильной и свое–временной диагностики этого заболевания. Многие авторы обращают внимание на необходимость дальнейшего изучения патогенеза заболевания для определения новых, более точных биомаркеров ХВДП. Однако на сегодняшний день существуют значительные пробелы в нашем понимании иммунопатогенеза ХВДП, отчасти из-за гетерогенной природы этого заболевания.
В течение последних трех десятилетий исследования аутоиммунных заболеваний периферической нервной системы концентрировались преимущественно на роли Т-клеточного звена иммунитета. Вклад активированных В-клеток в эти расстройства традиционно рассматривался как вторичная реакция вследствие нарушения Т-клеточной толерантности [15].
Этиопатогенез заболевания до сих пор остается окончательно не изученным. Такие пусковые факторы, как предшествующая инфекция, вакцинация, стресс, переохлаждение, выявлены только у 20 % пациентов с ХВДП [2].
Согласно основной патогенетической теории развития ХВДП, считается, что заболевание вызвано аномальной иммунной реакцией с участием аутореактивных Т-клеток и В-клеток, макрофагов, воспалительных цитокинов и хемокинов [16].
Основной мишенью аутоиммунных реакций при ХВДП служат ганглиозиды и гликолипиды, являющиеся компонентами миелиновой оболочки, выполняющей в нерве структурную и транспортную функции [17]. В последнее время в патогенезе ХВДП значительная роль отводится гуморальному звену иммунного ответа при участии В-лимфоцитов. Доказательством роли В-клеток в патогенезе ХВДП является осаждение иммуноглобулинов и комплемента на периферических нервах, а также наличие комплементсвязанных антител к миелинассоциированному гликопротеину (Anti-MAG) и ганглиозидов [18].
Важным фактором, контролирующим рост, выживание, дифференцировку и созревание аутореактивных В-клеток, является В-клеточный фактор активации (BAFF — B-cell activation factor), называемый также В-лимфоцитарным стимулятором (BLyS — B-lymphocyte stimulator). BAFF — это цитокин, относящийся к семейству фактора некроза опухоли α (ФНО-α) [19, 20]. По структуре BAFF представляет собой трансмембранный белок II типа и в определенных условиях может переходить в растворимую форму путем протеолиза [21]. Внеклеточный домен BAFF содержит фурин (семейство протеаз), который расщепляет мембраносвязанную форму BAFF (mBAFF) с последующим образованием растворимой формы (sBAFF). Миелоидные клетки (нейтрофилы, моноциты, макрофаги и дендритные клетки миелоидного происхождения) являются основными продуцентами как sBAFF, так и mBAFF [22, 23]. sBAFF является гомотримером, который взаимодействует со своими рецепторами [24]. Рецепторами для sBAFF служат: BCMA (В-cell maturation antigen — В-клеточный антиген созревания), TACI (transmembrane activator and calcium-modulating cyclophilin ligand interactor — трансмембранный активатор, модулятор кальция и активатор лиганда циклофилина) и BAFF-R (рецептор BAFF, BR3), которые экспрессируются на мембране В-клеток, плазматических клеток и отдельных субпопуляций Т-клеток [25]. Причем экспрессия и секреция mBAFF может усиливаться за счет активности провоспалительных цитокинов [26]. Взаимодействие sBAFF с рецептором различается по степени аффинности: так, с BR3 sBAFF связывается сильнее, чем с BCMA или TACI. sBAFF является единственным лигандом для BR3, в то время как TACI и BCMA могут связываться не только с sBAFF, но и с APRIL (a proliferation-inducing ligand — индуцирующий пролиферацию лиганд). Показано, что именно через BR3 sBAFF выполняет свои основные биологические функции [21]. У BR3-дефицитных мышей значительно уменьшалось количество зрелых В-клеток [27, 28]. Дефекты созревания периферических B-клеток сопровождаются гипогаммаглобулинемией [29]. У ВСМА-нулевых мышей количество зрелых В-клеток было нормальным, но отмечена ослабленная выживаемость плазматических клеток костного мозга [30]. И наконец, TACI-рецепторы имеют важное значение для гуморального ответа на Т-независимые антигены типа 2, а также влияют на B-клеточную гиперплазию. Показано, что TACI-рецепторы оказывают негативное воздействие на популяцию периферических В-клеток [31]. При введении BAFF-R-антител мышам выявляется истощение различных популяций В-клеток путем ингибирования BAFF-сигналов и активации антителозависимой клеточной цитотоксичности [32].
Неактивированные моноциты экспрессируют низкий уровень BAFF. Интерферон-гамма, интерферон-альфа и интерлейкин-10 повышают экспрессию BAFF на моноцитах, макрофагах и дендритных клетках. Бактериальные компоненты, такие как липополисахарид, также повышают экспрессию BAFF [22, 33]. Поэтому сигналы как от врожденного, так и от приобретенного иммунного ответа могут регулировать уровень BAFF на миелоидных клетках.
По данным исследований in vitro, BAFF является сильным костимулятором активации В-клеток, индуцирующим пролиферацию, дифференцировку, выживание плазматических клеток и переключение синтеза IgG [19].
Результаты исследований на животных моделях показали, что увеличение экспрессии BAFF может приводить к системному аутоиммунному заболеванию [34]. У BAFF-трансгенных животных выявляется гипергаммаглобулинемия, лимфопролиферация, B-клеточная гиперплазия, спленомегалия [35]. При старении у BAFF-трансгенных мышей развивается склонность к развитию B-клеточной лимфомы [36]. При избыточной экспрессии BAFF защищает B-клетки от апоптоза, тем самым способствуя аутоиммунитету и развитию злокачественных новообразований. Поскольку BAFF является одним из важнейших и мощных факторов для выживания и роста В-клеток, как нормальные, так и аутореактивные В-клетки конкурируют за свободный BAFF. Показано, что уровень BAFF регулирует порог выживаемости В-клеток. Аутореактивные B-клетки неконкурентоспособны в плане выживания, и они в большей степени зависят от BAFF [37, 38]. Повышенные уровни BAFF способствуют выживанию и созреванию аутореактивных В-клеток, таким образом нарушая иммунную аутотолерантность [39].
Актуальным является вопрос изучения BAFF при различных аутоиммунных заболеваниях, в том числе и заболеваниях нервной системы. BAFF-сывороточные уровни повышаются при различных В-клеточных нарушениях, включая аутоиммунные, такие как системная красная волчанка, ревматоидный артрит, миастения гравис, рассеянный склероз и идиопатические воспалительные миопатии [40–44].
В 2013 году Сандра Бик и соавторы показали, что уровни BAFF в сыворотке крови повышены у больных с ХВДП, а лечение в/в иммуноглобулинами привело к значительному снижению уровня сывороточного BAFF. In vitro показано, что в/в Ig ингибирует BAFF в моноцитах [45]. В 2014 году Кристиан Риттер и соавторы в своем исследовании подтвердили повышение уровня BAFF при ХВДП на большей когорте пациентов (23 человека). Кроме того, была выявлена прямая корреляция между уровнем BAFF в сыворотке крови и степенью тяжести клинических проявлений заболевания. Авторы предположили, что если эти данные подтвердятся на большей когорте пациентов, то уровень BAFF может служить биомаркером активности ХВДП [46].
Таким образом, изучение уровней BAFF у пациентов с ХВДП может быть полезным для уточнения патогенеза и улучшения диагностики этого заболевания и, как следствие, для назначения своевременного патогенетического лечения.
Целью нашего исследования является изучение взаимосвязи уровней BAFF в сыворотке крови и СМЖ у пациентов с ХВДП с данными клинической картины заболевания и электрофизиологическими характеристиками.
Задачи исследования включали:
1. Определение уровня BAFF в сыворотке крови и СМЖ у пациентов с ХВДП и в группе контроля.
2. Проведение анализа клинико-электрофизиологических характеристик у пациентов с ХВДП.
3. Определение корреляций между уровнями BAFF (в сыворотке крови и СМЖ) и клинико-электрофизиологическими показателями у пациентов с ХВДП.
Материалы и методы
С ноября 2014 по декабрь 2016 г. в неврологических отделениях 5-й больницы г. Минска наблюдали 59 пациентов (женщин — 26, мужчин — 33) в возрасте от 36 до 77 лет (средний возраст 58,2 ± 17,2 года), соответствующих международным критериям диагностики ХВДП (INCAT — Inflammatory Neuropathy Cause and Treatment, 2001) [47]. Длительность заболевания составляла от 6 месяцев до 8 лет. Группу контроля составили 30 человек, не имеющие неврологической патологии, аутоиммунных и онкологических заболеваний, сахарного диабета 1-го и 2-го типа, метаболических нарушений, токсических факторов воздействия, отягощенного наследственного анамнеза по полиневропатии. Неврологический статус оценивали по шкалам: TSS (Total Symptom Score — общая шкала неврологических симптомов), NIS (Neuropathy impairment score — шкала невропатических нарушений), mISS (modified INCAT sensory sumscore — модифицированная шкала чувствительных нарушений INCAT) [48]. Объективизация степени двигательных и сенсорных расстройств, а также изучение характера повреждений периферических нервов проведены с помощью стимуляционной ЭНМГ на нейрофизиологическом комплексе Нейро-МВП («Нейрософт», Россия). ЭНМГ выполнена всем пациентам основной и контрольной группы по стандартной методике. Минимальный объем исследования включал срединный и локтевой нервы (стимуляция ниже уровня локтевого сустава) на руке и малоберцовый (стимуляция ниже головки малоберцовой кости) и большеберцовый нервы на ноге. При анализе данных ЭНМГ учитывались следующие показатели: скорость проведения импульса (СПИ), амплитуда и длительность М-ответа, резидуальная латентность и латентность F-волны. У всех пациентов основной группы и группы контроля определили уровень BAFF в сыворотке крови. Уровень BAFF в спинномозговой жидкости (СМЖ) был определен у всех пациентов группы контроля и у 37 пациентов основной группы. BAFF определялся методом иммуноферментного анализа (ИФА) с помощью наборов Human BAFF/Blys/TNFSF13B Quantikine ELISA (R&D Systems, Inc.).
Полученные клинические, электрофизиологические и лабораторные данные обрабатывали с использованием параметрических и непараметрических методов статистики (использовались программы MS Excel и Statistica 6.0). Рассчитывали среднее арифметическое и стандартное отклонение. Степень достоверности определяли с помощью t-критерия Стьюдента. За уровень статистической достоверности принимали результаты при p < 0,05. Т-критерий Манна — Уитни использовали для сравнения двух групп при несоответствии выборки критериям использования параметрического метода. Оценку взаимосвязи количественных и/или порядковых признаков производили с помощью ранговой корреляции по Спирмену c определением коэффициента ранговой корреляции (r). Силу корреляции оценивали в зависимости от значения коэффициента r: r ≤ 0,25 — слабая корреляция; 0,25 < r < 0,75 — умеренная корреляция; r ≥ 0,75 — сильная корреляция. Обратную связь обнаруживали при отрицательном значении коэффициента корреляции, а прямую связь — при положительном значении.
Результаты и обсуждение
При анализе клинической картины отмечены следующие особенности. У 42 пациентов (71 %) заболевание начиналось с нарушения поверхностной чувствительности на стопах, а у 18 пациентов (31 %) — с двигательной симптоматики. Одновременное начало с двигательных и чувствительных нарушений зарегистрировано у 19 пациентов (32 %). Изолированного нарушения глубокой чувствительности не наблюдалось, а нарушение поверхностной и глубокой чувствительности было зарегистрировано у 24 пациентов (41 %). Двигательные нарушения на момент осмотра представляли собой симметричные, преимущественно дистальные периферические парезы конечностей. У 13 пациентов (22 %) наблюдались клинические признаки поражения черепных нервов. В большинстве случаев имел место восходящий тип развития клинических симптомов (51 пациент (86 %)), когда заболевание начиналось с поражения нижних конечностей. У 5 пациентов (8 %) клинические симптомы дебютировали одновременно с рук и ног. Нисходящий тип (дебют с верхних конечностей и/или черепных нервов) был зарегистрирован у 3 пациентов, у 2 из которых заболевание начиналось с поражения лицевого нерва. Наиболее значительные изменения ЭНМГ-показателей отмечались при исследовании чувствительных и двигательных нервов нижних конечностей. У всех пациентов с ХВДП кроме признаков демиелинизации выявлено снижение амплитуды М-ответа (медиана 1,69 мВ, 25% : 75% квартили — 0,32 : 2,31). При исследовании икроножных нервов выявлено существенное снижение амплитуды потенциала действия чувствительного нерва по сравнению с группой здоровых лиц (p < 0,05). У 21 пациента потенциал действия с nn.suralis не регистрировался вовсе. В результате выявленные особенности электрофизиологических показателей у пациентов с ХВДП свидетельствуют о наличии вторичной аксонопатии периферических нервов.
В основной группе медиана уровня BAFF в сыворотке крови составила 465,8 пг/мл (294,9; 596,8), а в группе контроля — 185,5 пг/мл (100,5; 251,2). Медиана уровня BAFF в СМЖ основной группы составила 68,8 пг/мл (52,4; 85,2), в группе контроля — 54,5 пг/мл (39,3; 62,5). При использовании критерия Манна — Уитни выявлено статистически значимое различие в содержании BAFF в сыворотке крови у пациентов с ХВДП и в группе контроля (p = 0,001) и в уровне BAFF в СМЖ пациентов основной группы по сравнению с группой контроля (p = 0,007). Уровни BAFF в сыворотке крови и СМЖ не коррелировали между собой как в основной группе (r = –0,14; p = 0,27), так и в группе контроля (r = –0,09; p = 0,42). Корреляционный анализ уровней BAFF (в сыворотке крови и СМЖ) и скорости проведения импульса (СПИ), амплитуды М-ответа и общего балла по шкале NIS у пациентов с ХВДП представлен в табл. 1.
/81-1.jpg)
Из данных, приведенных в табл. 1, следует, что имеет место прямая статистически значимая (p < 0,05) зависимость между уровнем BAFF (в сыворотке крови и СМЖ) и общим баллом шкалы NIS. В то же время имеется обратная корреляция между уровнем BAFF в сыворотке крови и ЭНМГ-показателями (СПИ, амплитуда М-ответа). Корреляции между уровнем BAFF в СМЖ и ЭНМГ-показателями (СПИ, амплитуда М-ответа) не выявлено.
Выводы
Таким образом, проведенное исследование выявило повышенные уровни BAFF в сыворотке крови и СМЖ у пациентов с ХВДП по сравнению с группой контроля. Данная особенность свидетельствует об участии в патогенезе заболевания не только клеточного звена иммунитета (что подтверждается многочисленными исследованиями, проведенными ранее), но и гуморального звена; а также о возможности использования BAFF как биомаркера аутоиммунного процесса, в том числе и при ХВДП. Факт наличия корреляционных связей между уровнем BAFF, степенью тяжести двигательных нарушений (общим баллом шкалы NIS) и показателями ЭНМГ говорит о том, что определение содержания BAFF в сыворотке крови и СМЖ может быть полезным для объективизации степени активности заболевания и, как следствие, для подбора правильного, своевременного патогенетического лечения. Полагаем, что выявленные нами особенности позволяют более точно дифференцировать ХВДП с другими полиневропатиями.
Конфликт интересов. Автор заявляет об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Levin O.S. Polyneuropathy. Medicinskoe informacionnoe agentstvo // Clinical guidelines. 2005; Р. 94-131. (in Russian).
2. Ponomarev V.V., Sialitski M.M., Karneyavets S.V. Epidemiological and clinical features of chronic inflammatory demyelinating polyneuropathy // ARS MEDICA, nevrologija i nejrohirurgija. 2011; 6(42): 100-106. (in Belarus).
3. Vallat J.M., Sommer C., Magy L. Chronic inflammatory demyelinating polyradiculoneuropathy: diagnostic and therapeutic challenges for a treatable condition // Lancet Neurol. 2010; 9: 402-412. doi: 10.1016/S1474-4422(10)70041-7.
4. Gorson K.C., Katz J. Chronic Inflammatory Demyelinating Polyneuropathy // Neurol. Clin. 2013; 3: 511-532. doi: 10.1016/j.ncl.2013.01.006.
5. Kurenkov A.L., Kuzenkova L.M., Nikitin S.S., Bursagova B.I. Chronic inflammatory demyelinating polyneuropathy in children: diagnosis and treatment // Voprosy sovremennoj pediatrii. 2014; 13(5): 47-53. (in Russian).
6. Dyck P.J., Lais A.C., Ohta M. et al. Chronic inflammatory polyradiculoneuropathy // Mayo Clin. Proc. 1975; 50: 621-637. PMID: 1186294.
7. Kanbayashi T., Sonoo M. Acute-Onset Chronic Inflammatory Demyelinating Polyradiculoneuropathy // Brain Nerve. 2015; 67(11): 1388-96. doi: 10.11477/mf.1416200311.
8. Ishii J., Yuki N., Kawamoto M., Yoshimura H., Kusunoki S., Kohara N. Recurrent Guillain-Barré syndrome, Miller Fisher syndrome and Bickerstaff brainstem encephalitis // J. Neurol. Sci. 2016; 15(364): 59-64. doi: 10.1016/j.jns.2016.03.008.
9. Research criteria for diagnosis of chronic inflammatory demyelinating polyneuropathy (CIDP): report from an ad hoc subcommittee of the American Academy of Neurology AIDS Task Force // Neurology. 1991; 41: 617-8. PMID: 2027473.
10. Saperstein D.S., Katz J.S., Amato A.A., Barohn R.J. Clinical spectrum of chronic acquired demyelinating polyneuropathies // Muscle Nerve. 2001; 24: 311-24. PMID: 11353415.
11. Hubertus K., Bernd C. Kieseier, Sebastian J. Chronic Inflammatory Demyelinating Polyneuropathy // N. Engl. J. Med. 2005; 352: 1343-56.
12. Nikolaev S.G. Atlas of Electromyography. — Ivanovo: PresSto, 2010. — 468 p. (in Russian).
13. Van den Bergha K., Haddenb M., Bouche P. et al. European Federation of Neurological Societies / Peripheral Nerve Society Guideline on management of chronic inflammatory demyelinating polyradi–culoneuropathy: Report of a joint task force of the European Federation of Neurological Societies and the Peripheral Nerve Society // European Journal of Neurology. 2010; 17: 356–363. doi: 10.1111/j.1468-1331.2009.02930.x.
14. Haibullin T.I., Habirov F.A., Averianova L.A., Ahme–dova G.M. Chronic inflammatory demyelinating polyradiculoneuropathy and pathogenetically similar syndroms: diagnosis and treatment // Prakticheskaja medicina. 2014; 78(2): 21-30. (in Russian).
15. Dalakas MC. B cells as therapeutic targets in autoimmune neurological disorders // Nature clinical practice (Neurology). 2008; 4: 557-567. doi: 10.1038/ncpneuro0901.
16. Dalakas M.C. Advances in the diagnosis, pathogenesis and treatment of CIDP // Nat. Rev. Neurol. 2011; 7: 507-517. doi: 10.1038/nrneurol.2011.121.
17. Zavalishin I.A., Piradov M.A., Boiko A.N., Nikitin S.S., Spirin N.N., Peresedova A.V. Autoimmune diseases in neurology. Clinical guidelines // Zdorov’e cheloveka. 2014; 2: 49-63. (in Russian).
18. Dalakas M.C., Engel W.K. Immunoglobulin and complement deposits in nerves of patients with chronic relapsing polyneuropathy // Arch. Neurol. 1980; 37: 637-640. PMID: 6252877.
19. Moore P.A., Belvedere O., Orr A. BLyS: member of the tumor necrosis factor family and B lymphocyte stimulator // Science. 1999; 285(5425): 260-263. PMID: 10398604.
20. Schneider P., Mackay F., Steiner V. BAFF, a novel ligand of the tumor necrosis factor family, stimulates B cell growth // Journal of Experimental Medicine. 1999; 189(11): 17471756. PMID: 10359578.
21. Cancro P.M. BLyS Ligands and Receptors. — New York: Humana Press, a part of Springer Science + Business Media, 2010. — 289 p.
22. Craxton A., Magaletti D., Ryan E.J., Clark E.A. Macrophage- and dendritic cell-dependent regulation of human B-cell proliferation requires the TNF family ligand BAFF // Blood. 2003; 101(11): 4464-4471. DOI: 10.1182/blood-2002-10-3123.
23. Gorelik L., Gilbride K., Dobles M., Kalled S.L., Zandman D., Scott M.L. Normal B cell homeostasis requires B cell activation factor production by radiation-resistant cells // Journal of Experimental Medicine. 2003; 198( 6): 937-945. DOI: 10.1084/jem.20030789.
24. Oren D.A., Li Y., Volovik Y. Structural basis of BLyS receptor recognition // Nature Structural Biology. 2002; 9(4): 288-292. DOI: 10.1038/nsb769.
25. Ng L.G., Mackay C.R., Mackay F. The BAFF/APRIL system: life beyond B lymphocytes // Mol. Immunol. 2005; 42(7): 763-72. DOI: 10.1016/j.molimm.2004.06.041.
26. Ohata J., Zvaifler N.J., Nishio M. Fibroblast-like synoviocytes of mesenchymal origin express functional B cell-activating factor of the TNF family in response to proinflammatory cytokines // J. Immunol. 2005; 174(2): 864-70. PMID: 15634908.
27. Sasaki Y., Casola S., Kutok J.L., Rajewsky K., Schmidt-Supprian M. TNF family member B cell-activating factor (BAFF) receptor-dependent and -independent roles for BAFF in B cell physiology // J. Immunol. 2004; 173(4): 2245-52. PMID: 15294936.
28. Shulga-Morskaya S., Dobles M., Walsh M.E. et al. B cell-activating factor belonging to the TNF family acts through separate receptors to support B cell survival and T cell-independent antibody formation // J. Immunol. 2004; 173(4): 2331-41. PMID: 15294946.
29. Schiemann B., Gommerman J.L., Vora K. et al. An essential role for BAFF in the normal development of B cells through a BCMA-independent pathway // Science. 2001; 293(5537): 2111-2114. DOI: 10.1126/science.1061964.
30. O‘Connor B.P., Raman V.S., Erickson L.D. et al. BCMA is essential for the survival of long-lived bone marrow plasma cells // J. Exp. Med. 2004; 199(1): 91-8. DOI: 10.1084/jem.20031330.
31. Seshasayee D., Valdez P., Yan M., Dixit V.M., Tumas D., Grewal I.S. Loss of TACI causes fatal lymphoproliferation and autoimmunity, establishing TACI as an inhibitory BLyS receptor // Immunity. 2003; 18(2): 279-88. PMID: 12594954.
32. Lin W.Y., Gong Q., Seshasayee D. et al. Anti-BR3 antibodies: a new class of B-cell immunotherapy combining cellular depletion and survival blockade // Blood. 2007; 110(12): 3959-67. DOI: 10.1182/blood-2007-04-088088.
33. Zhou L., Zhong R., Hao W. et al. Interleukin-10 and interferon-γ up-regulate the expression of B-cell activating factor in cultured human promyelocytic leukemia cells // Experimental and Molecular Pathology. 2009; 87(1): 54-58. DOI: 10.1016/j.yexmp.2009.04.002.
34. Gross J.A., Johnston J., Mudri S. et al. TACI and BCMA are receptors for a TNF homologue implicated in B-cell autoimmune dise–ase // Nature. 2000; 404(6781): 995-9. DOI: 10.1038/35010115.
35. Khare S.D., Sarosi I., Xia X.Z. et al. Severe B cell hyperplasia and autoimmune disease in TALL-1 transgenic mice // Proc. Natl. Acad. Sci USA. 2000; 97(7): 3370-3375. DOI: 10.1073/pnas.050580697.
36. Mackay F., Woodcock A.S., Lawton P. et al. Mice transgenic for BAFF develop lymphocytic disorders along with autoimmune manifestations // Journal of Experimental Medicine. 1999; 190(11): 1697-1710. PMID: 10587360.
37. Lesley R., Xu Y., Kalled S.L. et al. Reduced competitiveness of autoantigen-engaged B cells due to increased dependence on BAFF // Immunity. 2004; 20(4): 441-453. PMID: 15084273.
38. Thien M., Phan T.G., Gardam S. et al. Excess BAFF rescues self-reactive B cells from peripheral deletion and allows them to enter forbidden follicular and marginal zone niches // Immunity. 2004; 20(6): 785-798. DOI: 10.1016/j.immuni.2004.05.010.
39. Ota M., Duong B.H., Torkamani A. et al. Regulation of the B cell receptor repertoire and self-reactivity by BAFF // Journal of Immunology. 2010; 185(7): 4128-4136. DOI: 10.4049/jimmunol.1002176.
40. Vincent F.B., Morand E.F., Mackay F. et al. BAFF and innate immunity: new therapeutic targets for systemic lupus erythematosus // Immunol. Cell Biol. 2012; 90: 293-303. DOI: 10.1038/icb.2011.111.
41. Leandro M.J., Cambridge G. Expression of B cell activating factor (BAFF) and BAFF binding receptors in rheumatoid arthritis // J. Rheumatol. 2013; 40: 1247-1250. DOI: 10.3899/jrheum.130677.
42. Kim J.Y., Yang Y., Moon J.S. et al. Serum BAFF expression in patients with myasthenia gravis // J. Neuroimmunol. 2008; 199: 151-154. DOI: 10.1016/j.jneuroim.2008.05.010.
43. Kannel K., Alnek K., Vahter L., Gross-Paju K., Uibo R., Kisand K. Changes in Blood B Cell-Activating Factor (BAFF) Le–vels in Multiple Sclerosis: A Sign of Treatment Outcome // Plos. One. 2015; 10(11): e0143393. DOI: 10.1371/journal.pone.0143393.
44. Baek A., Park H.J., Na S.J. et al. The expression of BAFF in themuscles of patientswith dermatomyositis // J. Neuroimmunol. 2012; 249: 96-100. DOI: 10.1016/j.jneuroim.2012.04.006.
45. Bick S., Tschernatsch M., Karg A. et al. Intravenous immunoglobulin inhibits BAFF production in chronic inflammatory demyelinating polyneuropathy — a new mechanism of action? // J. Neuroimmunol. 2013; 256: 84-90. DOI: 10.1016/j.jneuroim.2013.01.001.
46. Ritter C., Förster D., Albrecht P., Hartung H., Kieseier Bernd C., Lehmann Helmar C. IVIG regulates BAFF expression in patients with chronic inflammatory demyelinating polyneuropathy // Journal of Neuroimmunology. 2014; 274: 225-229. DOI: 10.1016/j.jneuroim.2014.06.007.
47. Bromberg B.M. Review of the evolution of electrodiagnostic criteria for chronic inflammatory demyelinating polyradicoloneupathy // Muscle & Nerve. 2011; 780-794. DOI: 10.1002/mus.22038.
48. Sonja van Nes. Improving and standardising assessment of patients with immune-mediated neuropathies // Scholma Druk, Bedum; 2011. 264 p.

/78-1.jpg )
/79-1.jpg )
/81-1.jpg)