Вступ
Як відомо, інфекція сечових шляхів (ІСШ) дуже поширена та займає друге-третє місце серед усіх інфекцій дитячого віку, поступаючись лише захворюванням дихальних шляхів та кишковим інфекціям. У дітей до 2 років ІСШ є найпоширенішою бактеріальною інфекцією [1–3]. Зростаюча антибіотикорезистентність збудників вимагає швидкого, зваженого, адекватного лікування ІСШ з метою запобігання хронізації, що призводить до рубцювання паренхіми нирок та розвитку хронічної ниркової недостатності (ХНН). Тому проблема антибіотикотерапії повинна привертати увагу не тільки нефрологів, а й педіатрів, яким першим доводиться діагностувати ІСШ у дітей, та саме від їх тактики залежить успіх у лікуванні.
Визначення ІСШ дається в «Протоколі лікування дітей з інфекціями сечової системи і туболоінтерстиціальним нефритом» (наказ МОЗ України № 627 від 2008 р.).
Інфекція сечової системи — мікробно-запальне ураження органів сечових шляхів без уточнення топічного рівня ураження.
Пієлонефрит — неспецифічне мікробне запалення нирки з переважним осередковим ушкодженням тубулоінтерстиціальної тканини, чашечок та миски.
Цистит — неспецифічне мікробне запалення слизової оболонки сечового міхура.
Класифікація та ознаки ІСШ у дітей
Сучасні дослідження ІСШ вважають доцільними класифікаційні ознаки залежно від кількості епізодів, тяжкості процесу, ускладнень, обтяжуючих факторів і факторів ризику (рис. 1) [1–3].
Як відомо, клінічні ознаки ІСШ залежать від віку. У клінічній картині в дітей раннього віку переважають неспецифічні прояви запального процесу. У молодшому віці на тлі гіпертермії можуть бути блювання і пронос, розлитий біль у животі. Диференціально-діагностичною ознакою циститу та пієлонефриту є наявність при останньому організменої реакції: гіпертермії, інтоксикації, лейкоцитозу зі зсувом формули вліво, підвищенням ШОЕ, позитивним С-реактивним протеїном [1–3]. За визначенням педіатрів-нефрологів, для пієлонефриту характерна тріада синдромів: загальноінтоксикаційний, больовий (болі в животі/попереку залежно від віку дитини), сечовий (лейкоцитурія, бактері–урія тощо) [4].
У дітей раннього віку ізольовані прояви циститу зустрічаються рідко. Основною ознакою циститу в дітей старшого віку є дизурія [1, 4].
Найтяжчою ІСШ у дітей є пієлонефрит, що саме і призводить до розвитку ХНН. Клінічна нефрологія дитячого віку для встановлення діагнозу пієлонефриту використовує класифікацію, наведену в табл. 1.
Критерії встановлення діагнозу ІСШ відповідно до настанов Європейської асоціації урологів (EАU) 2011 р. використовуються до цього часу (табл. 2) [3, 5].
/62-2.jpg )
У табл. 2 наведені клініко-діагностичні ознаки всіх варіантів ІСШ. Для діагностики ІСШ у дитини в амбулаторних умовах необхідно дослідити сечу на наявність лейкоцитурії та бактеріурії. Сеча збирається повністю, за умови ризику контамінації і для посіву сечі використовують середню порцію. Для маленьких дітей застосовують спеціальні пластикові сумки, які приклеюються до геніталій для збору загального аналізу. Наявність більше ніж 10 лейкоцитів у полі зору (для хлопчиків — більше ніж 6) не потребує дублювання аналізу за Нечипоренком і вважається патогномонічною ознакою ІСШ. У той же час слід враховувати хибнопозитивні результати внаслідок дефекту забору сечі (контамінація мікроорганізмами сечоприймачів). Найбільш частими маркерами ІСШ є нітрити та лейкоцитарна естераза, вони, як правило, об’єднані у стік-тесті (індикаторній смужці), що можна використовувати для швидкості діагностики амбулаторно.
Сучасні рекомендації EАU 2015 року [2, 3] пропонують проведення фізикального обстеження дитини в амбулаторних умовах. Обов’язковим є огляд на наявність фімозу, зрощення статевих губ, ознак пієлонефриту , епідидимоорхіту і стигм розщеплення хребта (spina bifida) (наприклад, ділянок із надмірним оволосінням на шкірі крижів). Відсутність лихоманки не виключає наявності інфекційного процесу.
Методи візуалізації при ІСШ включають обов’язкове проведення УЗД нирок і сечового міхура. Мікційна цистограма після першого епізоду ІСШ хлопчикам і другого — дівчаткам проводиться після консультації нефролога, уролога в спеціалізованих відділеннях [2, 5].
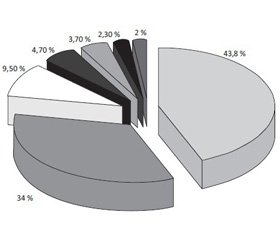
На першому році життя від ІСШ частіше страждають хлопчики (3,7 проти 2 % у дівчаток), потім спостерігається протилежне співвідношення [1–3]. Проте у хлопчиків до 3 років ІСШ є найбільш частою причиною лихоманки та нерідко розвиваються на тлі аномалій розвитку органів сечової системи. Тому узгодженість міждисциплінарного підходу є основою для своєчасної діагностики й лікування інфекцій сечової системи.
Відомо, що до розвитку ІСШ у дітей призводить ціла низка органічних та функціональних факторів, які впливають на характер уродинаміки та вимагають ранньої діагностики й корекції. Проте процес реалізації як гострих, так і хронічних ІСШ розгортається тільки при потраплянні та активній дії бактерій. Найбільш характерними патогенами є грамнегативні мікроорганізми, головним чином кишкові бактерії. Серед них E.coli є причиною 90 % епізодів ІСШ [1–4].
Особливості збудників ІСШ на сучасному етапі
Протягом останніх 20 років відбулася зміна уявлень про бактерії: раніше їх розглядали як строго одноклітинні організми, а зараз — як мікробні спілки, цілісні структури. Установлено, що колонії практично всіх видів бактерій мають здатність до формування багатоклітинних структур: біоплівок (англ. Biofilm), бактеріальних матів, плодових тіл тощо.
Питанню вивчення бактеріальних біоплівок присвячено багато повідомлень останніх років та оглядових публікацій [6–12].
Біоплівка — це мікробне угрупування, що характеризується клітинами, прикріпленими до поверхні та одна до одної, замкненими в матрикс синтезованих ними позаклітинних полімерних речовин. У біоплівці відбувається зміна фенотипу бактерій, що виражається зміною параметрів зростання та експресії специфічних генів, формується відчуття кворуму (Quorum Sensing) — комплексу взаємодій всіх членів колонії між собою (функції захисту, харчування, розмноження, передачі інформації про антибіотики тощо). Плівка включає зазвичай 15–20 % бактеріальної маси й 80–85 % захисного матриксу, що знижує ступінь впливу антибіотиків і антисептиків на мікрокультури-мішені в десятки, сотні і навіть тисячі разів. Біоплівки можна охарактеризувати як бактерії, вбудовані у товстий слизовий шар, що складається з цукрів і протеїнів та захищає мікроорганізми від зовнішнього впливу.
Біоплівки можуть складатися як з одного виду бактерій чи грибів, так і бути полімікробними (містити численні різноманітні види мікроорганізмів).
Мікроорганізми, які входять до складу біоплівки, існують у двох формах: фіксованій до поверхні та планктонній (вільноплаваючій), що є субстратом поширення інфекції з її первинного локусу. Планктонний фенотип бактерій зустрічається лише транзиторно й у мінімальній кількості, тоді як переважно бактеріальні популяції являють собою біоплівки.
Утворення біоплівок — одна з основних стратегій, що підвищує виживання бактерій у навколишньому середовищі, у тому числі в організмі людини. Здатність бактерій формувати біоплівки — істотний чинник патогенності та вірулентності бактерій [9].
Здатність мікроорганізмів існувати у складі біоплівок створює великі труднощі їх ерадикації, оскільки значно підвищується стійкість бактерій до антибактеріальних і дезінфікуючих засобів, до зміни значення рН, осмотичної сили, дії імунного захисту організму-господаря, бактеріофагів тощо [8–10, 12].
Утворення біоплівок відбувається так (рис. 2):
— 1-ша стадія — адгезія, адсорбція з оточуючого середовища — оборотна фіксація мікроорганізмів;
— 2-га стадія — необоротна фіксація мікробів, виділення позаклітинних полімерів;
— 3-тя стадія — дозрівання, утворення матриксу, початок розмноження;
— 4-та стадія — зростання, зрілий матрикс захищає від зовнішніх впливів;
— 5-та стадія — дисперсія, викид окремих клітин або фрагментів біоплівки, що створюють нові колонії.
Формування біоплівок відбувається швидко, оскільки від цього залежить виживання мікроорганізмів. Лабораторні дослідження показали, що планктонні бактерії, наприклад стафілококи, стрептококи, псевдомонади, кишкова паличка:
1) приєднуються одна до одної протягом декількох хвилин;
2) утворюють міцно приєднані мікроколонії протягом 2–4 годин;
3) виробляють позаклітинні полісахариди та стають відносно толерантними до біоцидів (антибіотики, антисептики, дезінфектанти) протягом 6–12 годин;
4) створюють повноцінні біоплівки та стають стійко резистентними до біоцидів та втрачають планктонні бактерії протягом 2–4 діб;
5) швидко відновлюються після механічного руйнування та знову створюють зрілу біоплівку протягом 24 годин.
Показано, що саме мікробні біоплівки відповідальні за етіологію та патогенез багатьох гострих і особливо хронічних бактеріальних інфекцій у людини [8, 13, 14]. Утворення бактеріальних біоплівок спричинює розвиток низки тяжких хронічних захворювань, що надзвичайно складно лікуються [17]. За даними Національного інституту здоров’я США, понад 60 % усіх мікробних інфекцій людини викликані біоплівками [10, 11, 13, 15].
Особливу активність у створенні біоплівок мають бактерії, які рухаються за рахунок джгутиків [12, 14, 16, 17], до яких відноситься E.сoli. Саме до захворювань, пов’язаних із наявністю біоплівок, відносяться ІСШ (пієлонефрит, цистит) [13–20]. На рис. 3 подано вигляд тридобової біоплівки Е.сoli, вкритої полісахаридним матриксом.
Таким чином, можна зробити висновки, що існування бактерій в середині біоплівок забезпечує їм багато переваг.
Для практичної медицини особливо важливо, що бактерії в біоплівках мають підвищене виживання за присутності агресивних речовин, факторів імунного захисту та антибіотиків [13–16]. Вважається, що в основі підвищеного виживання такого бактеріального утворення лежать захисні властивості мукосахаридного матриксу біоплівки (екзополімер фізично захищає бактеріальні клітини від бактеріофагів, антитіл, фагоцитів, затримує та уповільнює проникнення антибіотиків) і особливості клітин бактеріального консорціуму. Стійкість клітин біоплівок до антибактеріальних середників пов’язують зі зменшенням їх вільної поверхні за рахунок контактів (прилипання одна до одної) та формуванням бактерій, які отримали назву «персистери». Персистери не ростуть та не діляться, що зумовлює перебування хромосоми та білкових систем реплікації, репарації та транскрипції в інтактному стані (анабіозі). Білки персистерів вимикають роботу всіх мішеней дії антибіотиків, чим і опосередковують мультитолерантність до терапії (multi-drug tolerance) [20].
У даний час триває інтенсивне вивчення причин стійкості до антибіотиків у бактерій біоплівок. Адже антибіотики, ефективні проти планктонних бактерій, часто не ефективні щодо бактеріальних біоплівок. Це пов’язано з тим, що рутинний вибір антимікробних препаратів ґрунтується на чутливості бактеріальної культури, отриманої з планктонних бактерій.
Досліджено, що додавання до біоплівок аміноглікозидів (у випадку P.аeruginosa), амоксициліну та кліндаміцину (для Lactobacillus аcidophilus), ципро–флоксацину або метронідазолу (для E.сoli), еритроміцину або метронідазолу (для Gardnerella vaginalis) у максимальних концентраціях, що можуть бути створені, зумовлює те, що спочатку більшість бактеріальних клітин гине, однак надалі, щоб викликати загибель тих клітин, які вижили, концентрацію відповідного антибіотика необхідно підвищити в 100–1000 разів, що у клінічних умовах неможливо [6–13].
Тому вибір ефективного антибіотика при біоплівкових інфекціях є дуже обмеженим. Роботами В.В. Тец та ін. [10, 15] показано, що фторхінолони ІІІ покоління (особливо левофлоксацин) здатні проникати в біоплівки та діяти на бактерії, які там знаходяться, що проявлялося зменшенням маси біоплівки. Також левофлоксацин здатен пригнічувати ріст біоплівки основних збудників уроінфекцій, він проявляє активність як на стадії формування біоплівок, так і щодо сформованої біоплівки. Проте застосування фторхінолонів у дітей обмежене віком (згідно з наказом МОЗ України № 627 від 2008 р. дозволено після 18 років).
У даному контексті слід зупинитися на мікробіологічних дослідженнях, що використовуються при обстеженні пацієнтів з ІСШ. Враховуючи наведені дані про особливості існування збудників ІСШ, можна зробити висновки, що виявити збудника таким загальноклінічним методом, як посів сечі за методом Коха, можливо лише в його планктонній стадії, при утворенні біоплівки посіви матеріалу дають негативний результат. У процесі плівкоутворення планктонна стадія збудника триває лише протягом перших 2 діб від початку інфікування, коли діагноз ІСШ ще, як правило, не встановлюють, або впродовж перших 2 діб рецидиву хронічної ІСШ, коли з існуючих біоплівок іде викид вільноплаваючих форм бактерій для колонізації нової ділянки уроепітелію.
Ідентифікувати мікроорганізми в складі біоплівок дозволяють тільки такі методи, як електрофорез в гелі та рідинна хроматографія із флюоресцентною гібридизацією in situ, епіфлюоресцентна мікроскопія, скануюча електронна мікроскопія, конфокальна лазерна скануюча мікроскопія, полімеразна ланцюгова реакція зі зворотною транскриптазою тощо [13, 19], які в даний час широко не використовуються.
Згідно з нашими рутинними мікробіологічними дослідженнями за 2009–2015 роки (рис. 4), позитивні посіви виявлялися лише в половині (47,10–53,00 %) зразків, причому Е.сoli виділялася в 20,09–34,03 % посівів сечі, взятих у дітей при надходженні у стаціонар на 3-тю — 4-ту добу від початку захворювання та до початку антибіотикотерапії. Результати посівів сечі за 2015 р. наведені на рис. 5. Великий сектор St.epidеrmidis ми розцінювали як прояв дефекту забору матеріалу, оскільки кількість бактерій була незначною — до 5–102–3.
Е.соlі в діагностично значущій кількості займала перше місце, що збігається із загальновідомими даними.
Раніше відсутність росту патогенної флори в сечі вважалася артефактом, за сучасними уявленнями, цей факт цілком вкладається в теорію бактеріальних біоплівок, тобто втрати вже в цей період процесу ІСШ планктонних Е.сoli, утворення біоплівки. Тому відсутність бактеріурії на даному етапі хвороби зовсім не виключає наявності збудника у сечових шляхах та вимагає більш зваженого підходу до діагностики та антибактеріальної терапії.
Висівання різних видів бактерій із сечі пацієнтів упродовж хронічної ІСШ також вкладається в теорію полібактеріальних біоплівок, коли у планктонну форму переходять різні мікроорганізми.
Також нашими дослідженнями показано, що хронізація ІСШ відбувалася при призначенні антибактеріальної терапії пізніше ніж на 3-тю добу від початку захворювання (рис. 6), коли вже відбулося створення мікробного резервуару (біоплівки) на уроепітелії.
Таким чином, можна зробити висновки, що час призначення антибактеріальної терапії має важливе значення в ефективності терапії ІСШ у дітей. Саме тому, згідно з рекомендаціями National Institute for Health and Clinical Excellence та іншими клінічними настановами [20–22], загальний аналіз сечі слід проводити через 24–48 год лихоманки в дитини без видимих респіраторних проявів із можливістю використання катетеризації сечового міхура.
Як показали наші дослідження, час обумовлює ефективність лікування, оскільки елімінувати планктонні форми збудника простіше, ніж бактеріальну біоплівку. Однією з особливостей біоплівкових інфекцій є виражена інтоксикація [14–17].
Лікуваня ІСШ у дітей та вибір антибіотика
Згідно з наказом МОЗ України № 627 від 03.11.2008 «Про затвердження протоколу лікування дітей з інфекціями сечової системи і тубулоінтерстиціальним нефритом» та настановами EAU 2015 р. [1, 2], у лікуванні першого епізоду циститу в дітей препаратами першого вибору є фурамаг, сульфаметоксазол/триметроприм, фурагін, фурадонін протягом 5 діб, можлива профілактична терапія в дівчаток протягом 1–3 місяців (одним із перелічених препаратів, але не тим, яким проводилося лікування, або фітопрепаратом). Гострий цистит слід лікувати негайно для того, щоб уникнути можливих ускладнень. Парентеральне введення препаратів є невиправданим. При рецидиві циститу — консультація гінеколога або уролога та лікування у спеціалізованих відділеннях.
Для лікування ІСШ без визначення топіки застосовують цефалоспорини II–III покоління протягом 7 днів.
Можливості для лікування пієлонефриту подані на рис. 7.
За наявності тяжкої ІСШ лікування здійснюється в умовах стаціонару, в інших випадках — амбулаторно. Основним принципом лікування є індивідуальний підхід. Класифікацію тяжкої та легкої форми ІСШ подано в табл. 3.
Таблиця 3. Клінічна класифікація ІСШ у дітей,
за даними ЕАU 2015 р.
Тяжка ІСШ Легка (проста) ІСШ
— Лихоманка > 39 °С
— Стійке блювання
— Тяжка дегідратація
— Погана відповідь на лікування — М’яка гіпертермія
— Добре споживання рідини
— Незначне зневоднення
— Добра переносимість лікування
Дитина з легкою (простою) ІСШ (цистит) може мати тільки м’яку лихоманку, має змогу пити та приймати ліки всередину. Дитина не зневоднена і має хороший очікуваний рівень відповіді на терапію. Коли очікується низький рівень відповіді на терапію, дитину треба вести як таку, що має тяжку ІСШ. Тривалість перорального лікування при неускладнених ІСШ має становити 5–7 днів. Єдина парентеральна доза може бути використана у випадках сумнівної/слабкої відповіді та за умови нормальної будови сечових шляхів. Якщо відповідь слабка або розвиваються ускладнення, дитина повинна бути направлена в лікарню для парентерального лікування (що свідчить про високу ймовірність пієлонефриту ).
Тяжка ІСШ пов’язана з наявністю лихоманки > 39 °C, поганим самопочуттям, персистуючим блюванням і помірною або тяжкою дегідратацією. Тяжка ІСШ, що розглядається в Україні як нозологічна форма «пієлонефрит», потребує адекватного лікування в стаціонарі, відновлення дефіциту рідини парентеральним шляхом і відповідного антимікробного лікування.
Стартова антибактеріальна терапія пієлонефриту повинна тривати 10–14 діб. За відсутності результатів посіву сечі та антибіотикограми слід пам’ятати, що препарат емпіричної терапії повинен діяти на збудника, що найчастіше зустрічається, не бути нефротоксичним, мати переважно бактерицидний ефект, створювати терапевтичні концентрації в нирковій паренхімі та сечі.
Препаратами першого ряду є цефалоспорини переважно ІІІ покоління.
Рекомендована ступінчаста терапія, що в наш час дає позитивний клінічний результат. Передбачається використання антибіотиків з однією діючою речовиною, але у формах для парентерального та ентерального використання. Наприклад, цефтріаксон 3–4 доби внутрішньовенно інфузійно, після нормалізації температури — цефтріаксон per os 7–10 діб.
При збереженні інтоксикації, гіпертермії, сечового синдрому понад 3 доби проводять заміну препарату (бажано з урахуванням чутливості).
Ефективна антибактеріальна терапія завжди забезпечує успіх лікування.
Наведені особливості існування бактерій та перелік препаратів, зазначених у протоколі лікування ІСШ, власний клінічний досвід дозволяють зробити висновок, що час обумовлює вибір антибактеріального середника. Якщо в перші години захворювання можна обирати антибіотик, що впливає на планктонні форми збудника, то на 3-тю добу доцільним є призначення антибіотика, що впливає на бактеріальну біоплівку.
У той же час вірулентність Е.соlі зумовлюється не тільки здатністю до плівкоутворення, але і здатністю виробляти бета-лактамази широкого спектра (від 8,5 до 65 % штамів) [18]. Висока здатність Е.соlі до утворення бета-лактамаз також може бути пояснена з позицій існування 2 форм бактерій. Імовірно, їх виділяють планктонні форми до моменту утворення біоплівки.
Бета-лактамази та їх значення при ІСШ
Бета-лактамази (β-лактамази) — це група бактеріальних ферментів, що здатні розривати β-лактамне кільце деяких антибіотиків (пеніцилінів, цефало–споринів, карбапенемів, монобактамів), що відносяться до класу β-лактамів.
β-лактамази синтезуються грампозитивними і грамнегативними бактеріями, за рахунок чого ці бактерії отримують механізм резистентності до даних груп антибіотиків. β-лактамази розрізняються за своєю молекулярною масою, електрохімічними властивостями, послідовністю амінокислот та молекулярною структурою. Гени, що кодують синтез β-лактамаз, знаходяться в бактеріальних хромосомах або їх R-плазмідах і можуть передаватись іншим бактеріям шляхом трансдукції або трансформації. Саме цей факт може бути однією з причин антибіотикорезистентності.
Уперше β-лактамази були виявлені ще в 1940 році при дослідженні штамів E.coli, які мали здатність руйнувати молекулу пеніциліну, але значно поширилася інформація про ці ферменти у 80-х роках ХХ століття, коли в Аргентині, а пізніше в Німеччині були виявлені штами Klebsiella pneumoniae, що мали здатність інактивувати цефотаксим усього через рік після введення цього препарату в широку клінічну практику.
Частина грамнегативних бактерій, наприклад клебсієли, мають природну стійкість до β-лактамних антибіотиків (унаслідок вироблення великої кількості хромосомних бета-лактамаз), але більшість бактерій мають набуту стійкість до β-лактамних сполук внаслідок синтезу плазмідних β-лактамаз, які особливо поширені в родині Enterobacteriaceae та перейшли від них на інші збудники. Вироблення β-лактамаз бактеріями може бути обумовлене як генетичними, так і конституційними факторами мікроорганізмів, що пов’язані із перенесенням генетичної інформації плазмідами, а також може бути індукованим під впливом дії на мікроорганізми антибіотиків. За останні десятиліття у світі поширюються штами мікроорганізмів, що виробляють β-лактамази розширеного спектра, які не чутливі до всіх представників груп пеніцилінів та цефалоспоринів та малочутливі до інших груп антибіотиків (фторхінолонів, аміноглікозидів), із збереженою чутливістю лише до карбапенемів [18, 22–25]. Можливо, саме через обмін плазмідами резистентності в бактеріальній біоплівці виробляється антибіотикорезистентність планктонних бактерій при викиді їх з джерела персистування для створення нових біоплівок, що клінічно проявляється рецидивом ІСШ.
Дані про дію β-лактамаз стали поштовхом до вироблення групи захищених антибіотиків у комбінації з інгібіторами β-лактамаз. З огляду на високу клінічну ефективність та низьку токсичність β-лактамні антибіотики є основою антимікробної хіміотерапії на сучасному етапі, посідаючи провідне місце при лікуванні більшості інфекцій.
Найчастішими інгібіторами β-лактамаз є клавуланова кислота та сульбактам. Сульбактам — синтетичний препарат, що має β-лактамну структуру та застосовується разом з антибіотиками груп пеніцилінів та цефалоспоринів [23–27].
За механізмом дії сульбактам відноситься до так званих «суїцидних» інгібіторів β-лактамаз. За хімічною структурою сульбактам є похідним пеніцилінової кислоти. Сульбактам має власну антибактеріальну активність, переважно проти Acinetobacter spp., частини роду Bacteroides, а також Neisseria gonorrhoeae [25, 26].
Сульбактам проникає в бактеріальну клітину та викликає інактивацію ферментів бактерій шляхом утворення необоротного зв’язку із β-лактамазами бактерій, що призводить до ацетилювання й наступного гідролізу утвореного комплексу, дозволяючи антибіотику досягнути своєї мішені в бактеріальній клітині. Сульбактам переважно інгібує хромосомальні β-лактамази класів А, С та частково D. Сульбактам інгібує ферменти грамнегативних бактерій — Klebsiella рneumoniae, Haemophilus influenzae, Neisseria go–norrhoeae, Moraxella catarrhalis, Bacteroides fragilis, Escherichia coli, а також інгібує β-лактамази Staphylococcus aureus. Сульбактам має вищу стійкість до зміни рН розчину, що означає вищу здатність проникати у тканини при інфекційному процесі, при якому відбуваються значні зміни кислотності середовища [25, 26].
Сульбактам швидко всмоктується в організмі після як перорального, так і парентерального застосування. Максимальна концентрація в крові препарату досягається протягом 45–90 хвилин залежно від способу введення. Біодоступність сульбактаму при пероральному застосуванні становить 85 %. Сульбактам створює високі концентрації в більшості тканин організму, особливо у дихальній та сечовидільній системах. Виводиться сульбактам з організму переважно в незміненому вигляді нирками, частково виводиться із жовчю [24, 25].
Саме тому сульбактам застосовується разом з антибіотиками при інфекціях сечовидільних шляхів.
При застосуванні сульбактаму побічні ефекти, такі як діарея, посилена перистальтика кишечника, блювання, висипання на шкірі, спостерігаються рідше, ніж при застосуванні інших інгібіторів β-лактамаз (переважно клавуланової кислоти) [25, 26].
Таким чином, синтез β-лактамаз та створення біоплівок Е.соlі можуть бути ймовірною причиною антибіотикорезистентності в лікуванні ІСШ та переходу у хронічну форму.
Саме тому в наказі МОЗ України № 627 від 03.11.2008 «Про затвердження протоколу лікування дітей з інфекціями сечової системи і тубулоінтерстиціальним нефритом» та в оновлених рекомендаціях серед препаратів емпіричного вибору в лікуванні ІСШ є захищені цефалоспорини III покоління (Сульбактомакс).
Антибактеріальна активність цефалоспоринів обумовлена гальмуванням синтезу пептидоглікану — структурної основи мікробної стінки. Важливо підкреслити, що бактерицидний ефект цефалоспоринів реалізується тільки в процесі росту й розмноження мікроорганізмів, тоді як «спочиваюча» клітина є невразливою до дії антибіотиків.
У 1944 році італійський дослідник Джузеппе Брот припустив, що періодичне самоочищення стічних вод в Сардинії обумовлене інгібуючою активністю особливих мікроорганізмів. У 1945 році був виділений гриб Cephalosporin acremonium, що має виражену антибактеріальну активність щодо грампозитивних і грамнегативних мікроорганізмів. З 1955 по 1962 р. велося активне вивчення цього гриба і продуктів його життєдіяльності, була виділена бактерицидна субстанція — цефалоспорин С, що стала вихідною речовиною для отримання структурної основи цефалоспоринів. У 1970 році лікарський світ ознайомився з цефалексином, а в 1971 р. — із цефазоліном.
Цефуроксим був створений у 1970 р. та став першим середником II покоління цефалоспоринів.
У 1980 і 1982 рр. з’являються цефотаксим і цефтріаксон — ключові препарати III покоління цефалоспоринів, у 1983 році — цефтазидим.
Біодоступність цефтріаксону становить 100 % як при внутрішньовенному, так і при внутрішньо–м’язовому введенні. Після одноразового внутрішньо–м’язового введення 1 г цефтріаксону максимальна концентрація в крові досягається протягом 2–3 годин після введення, при внутрішньовенному введенні — до закінчення ін’єкції.
Цефалоспорини всіх генерацій мають переважно нирковий шлях елімінації в незміненому вигляді. Це є найважливішим фактом для використання їх у лікуванні ІСШ, але при цьому слід враховувати функцію нирок [29, 30].
Серед побічних ефектів цефалоспоринів III покоління є здатність підвищувати активність трансаміназ, високі дози цефтріаксону можуть викликати холестаз і псевдохолелітіаз та впливати на вироблення і всмоктування вітаміну К через пригнічення кишкової мікрофлори.
Говорячи про представників III покоління цефалоспоринів, слід звернути увагу на наявність в їх родині інгібіторозахищених цефалоспоринів — цефоперазону/сульбактаму та цефтріаксону/сульбактаму. Завдяки співвідношенню двох компонентів вдається досягти інактивації більшості β-лактамаз розширеного спектра, які в першу чергу виділяють Enterobacteriaceae [29, 30]. Схематична дія комбінованого середника Сульбактомаксу (Mili Healthcare, Великобританія) зображена на рис. 8.
/68-1.jpg )
Важливо, що цефтріаксон і сульбактам не взаємодіють та не змінюють фармакокінетичні показники один одного [30]. У той же час з огляду на побічні дії цефтріаксону комбінація з сульбактамом дає змогу посилити антибактеріальний ефект, не збільшуючи дозу самого середника. Здатність сульбактаму запобігати інактивації цефалоспоринів ферментами мікроорганізмів була підтверджена в дослідженнях із використанням резистентних штамів, щодо яких сульбактам виявляє синергізм із цефалоспоринами. Сульбактам також зв’язується з деякими білками, що зв’язують цефтріаксон, тому Сульбактомакс часто виявляє більш виражену дію на штами, чутливі до цефтріаксону, ніж сам цефтріаксон. Особливість дії сульбактаму полягає в тому, що під час розпаду його молекули відбувається руйнування ферменту цефтріаксонази [33].
Вчасна терапія ІСШ запобігає переходу гострої інфекції в хронічну, зменшує частоту рецидивів при хронічних захворюваннях, тобто розриває порочне коло інфекційного процесу та покращує якість життя пацієнтів. Необхідною умовою для ерадикації мікробів при лікуванні ІСШ є:
— активність антибіотика щодо збудників;
— достатня концентрація у вогнищі;
— підтримка концентрації, що гальмує ріст бактерій, протягом необхідного часу.
Таким вимогам відповідає препарат Сульбактомакс (Mili Healthcare, Великобританія).
Дослідження мікробіологів Manu Chaudhary, Shailesh Kumar, Anurag Payasi, які були викладені в «Journal of Microbial & Biochemical Technology» у 2013 р., показали руйнуючий вплив на біоплівку Е.соlі низки антибіотиків, серед яких Сульбактомакс мав найнижчу мінімальну пригнічуючу концентрацію (МПК) (рис. 9).
Враховуючи дію Сульбактомаксу на бета-лактамази та біоплівки (рис. 8, 9), наявність ін’єкційної форми, призначення цього середника є найбільш обґрунтованим при ІСШ в умовах стаціонару.
Дослідженнями проф. Д.Д. Іванова та доц. С.В. Кушніренко у 2010 р. показано клінічну ефективність Сульбактомаксу (Mili Healthcare, Великобританія) в дозі 50–75 мг/кг двічі на добу при лікуванні гострого пієлонефриту в 95 % дітей на 10-ту добу ступінчастої терапії (Сульбактомакс 3–4 доби інфузійно з переходом на пероральний цефіксим) та хронічного пієлонефриту (14-денний курс лікування хронічного пієлонефриту із застосуванням Сульбактомаксу у ступінчастій терапії з цефіксимом) у 85 % пацієнтів. Сульбактомакс використовувався інфузійно в поєднанні з дезінтоксикаційною терапією. Помірна ефективність лікування відмічена в 10 % пацієнтів І групи і в 15 % пацієнтів ІІ групи відповідно [31]. Роботою Редько О.К. та співавт. продемонстровано ефективність Сульбактомаксу в терапії інфекційних захворювань у дітей, у тому числі пієлонефриту [32].
Одже, вплив захищеного цефалоспорину Сульбактомаксу (Mili Healthcare, Великобританія), враховуючи властивість Е.соlі утворювати β-лактамази та біоплівки, в лікуванні ІСШ дає позитивний ефект.
Згідно з інструкцією до застосування Сульбактомаксу, дітям віком понад 12 років препарат призначається по 1–2 г (у перерахуванні на цефтріаксон) 1 раз на добу (кожні 24 години). У тяжких випадках або при інфекціях, збудники яких мають знижену чутливість до цефтріаксону, добову дозу можна збільшувати до 4 г (у перерахуванні на цефтріаксон).
Для новонароджених до 14 днів дозування ведеться з розрахунку на цефтріаксон: 20–50 мг/кг маси тіла 1 раз на добу. Добова доза не має перевищувати 50 мг/кг маси тіла. Для недоношених дітей дозу не коригують.
Новонародженим віком від 15 днів та дітям віком до 12 років дози наведені з розрахунку на цефтріаксон: 20–80 мг/кг маси тіла 1 раз на добу. Дітям із масою тіла понад 50 кг призначають дози для дорослих.
Загальна добова доза для дітей не має перевищувати 2 г (у перерахуванні на цефтріаксон).
Внутрішньовенні введення дози понад 50 мг/кг (у перерахуванні на цефтріаксон) здійснюються краплинно повільно (протягом 30–60 хвилин).
Враховуючи особливості Е.соlі, механізми дії Сульбактомаксу, доцільне використання цього середника в стартовій терапії ІСШ при гострому пієлонефриті з вираженою інтоксикацією та при рецидиві ІСШ, особливо коли при попередніх епізодах уже був використаний цефтріаксон.
Клінічні спостереження використання Сульбактомаксу (Mili Healthcare, Великобританія) в дозі 50–75 мг/кг у дітей з ІСШ показали позитивний ефект у нефрологічному відділенні Львівської МДКЛ. Наш досвід може свідчити про ефективність застосування Сульбактомаксу дітям раннього віку в добовій дозі до 1 г інфузійно 1 раз на добу та старшим дітям, у яких добова доза перевищувала 1 г, двічі на добу в рівних кількостях протягом 3–4 діб із переходом на пероральний цефтріаксон до 7–8 діб (разом 10–14 діб). Сульбактомакс призначався дітям при гострому пієлонефриті з вираженою інтоксикацією (активність запального процесу ІІІ ст. [1]) та при рецидиві хронічного пієлонефриту, коли при попередніх загостреннях був використаний незахищений цефтріаксон. Розведення препарату проводилося фізіологічним розчином згідно з інструкцією. Тривалість інфузії становила 30 хв. Виражених побічних реакцій, які б вимагали відміни препарату, нами не спостерігалося. Одночасно проводилася інфузійна дезінтоксикаційна терапія за загальноприйнятими схемами. У всіх випадках спостерігалися клініко-лабораторні позитивні зміни стану дітей, підстав змінювати антибіотик не було.
Висновки
1. Особливі властивості збудників ІСШ формувати біоплівки та переважання загальноклінічних проявів захворювання в дітей у дебюті ІСШ є підставою для її швидкої діагностики (аналізи сечі в перші 2 доби).
2. Враховуючи здатність збудників утворювати бактеріальні біоплівки та набувати антибіотикорезистентності, для ефективності лікування в дітей та запобігання хронізації інфекції антибіотикотерапію слід призначати в перші 2 доби захворювання або рецидиву ІСШ.
3. Враховуючи здатність Е.соlі та інших ентеробактерій на першому етапі життєдіяльності до синтезу бета-лактамаз широко спектра та утворення біоплівок на другому етапі, доцільно для стартової терапії ІСШ використовувати захищені цефалоспорини III покоління та ті, які здатні блокувати бета-лактамази та руйнувати біоплівки (Сульбактомакс, Mili Healthcare, Великобританія).
Конфлікт інтересів. Не заявлений.
Список литературы
1. Nakaz MOZ Ukraїni N 627 vіd 03.11. 2008 pro zatverdzhennja Protokolu lіkuvannja dіtej z іnfekcіjami sechovoї sistemi і tuboloіntersticіal'nim nefritom [Order of the Ministry of Health of Ukraine N 627 dd 03/11/2008 about approval of the Protocol of treatment of children with urinary infections and tubulo-interstitial nephritis]. (In Ukrainian). Available from: http://www.moz.gov.ua/ua/portal/dn_20081103_627.html/
2. M. Grabe et al. Guidelines on Urological Infections, 2015. Available from: https://uroweb.org/wp-content/uploads/19-Urological-infections_LR2.pdf
3. Ivanov DD. 2015 update in treatment of urinary infections in children. Zdorov’ja Ukrajini. 2016 Suppl Urology. Nephrology. Andrology;3(7):21-2. (In Ukrainian).
4. maidannyl VG. Pedіatrіja [Pediatrics]. Kharkiv: Folio; 2002. 1125 p.
5. Tekgül S, Dogan HS, Kocvara R, Nijman JM, Radmayr C, Stein R. Guidelines Associates: Silay MS, Undre S, Quaedackers J. Guideline on pediatric urology, 2012. Available from: http://uroweb.org/guideline/paediatric-urology/
6. Chernjavsky VI. Bacterial biofilms and infection (lecture). Annals of Mechnikov Institute. 2013;1:86-90. (In Ukrainian).
7. Vorobei ES, Voronkova OS, Vinnikov AI. Bacterial biofilms. Quorum sensing in bacteria in biofilms. Vіsnik Dnіpropetrovs'kogo unіversitetu. Bіologіja. Ekologіja. 2012:20(1):223-7. (In Russian).
8. Bezrodnyi BG, Petrenko OM. Biofilms of pathogenic bacteria and their role in chronicity of infectious process. Zdorov`ja Ukrajini. 2014;3:25-9 (In Ukrainian).
9. Sidashenko OI, Voronkova OS, Sirokvasha OA, Vinnikov AI. Biofilm as a specific form of bacteria organization and their role in infectious process. Vіsnik problem bіologіji і medicine. 2013; Issue 3 (2; 103):36-41 (In Russian).
10. Tets VV. Bakterial'nye soobshhestva [Bacterial associations]. In: Tets V, editor. Kletochnye soobshhestva [Cellular associations]. Saint-Petersburg: Izdatel'stvo SPbGMU; 1998. pp. 15-73. (In Russian).
11. Maltsev SV, Mansurova GS. What is biofilm? Prirodnaja medicina. 2013;1(13):86-9. (In Russian).
12. Marushko YuV, Hyshchak TV. Biofilm formation in respiratory diseases. influence of ambroxol on airway biofilms (literature review). Zdorov’ye Rebenka. 2016;2(70):88-94. doi: 10.22141/2224-0551.2.70.2016.73816. (In Ukranian).
13. Petukhova IN. Role of biofilms in chronicity of urinary tract. Urologija segodnja. 2013;2:14-5. (In Russian).
14. Lagun LV, Atanasova YuV, Tapalsky DV. Formation of microbial biofilms in causative agents of acute and chronic pyelonephritis. Zhurnal mikrobiologii, epidemiologii i immunobiologii. 2013;3:18-23. (In Russian).
15. Tets VV, Artemenko NK. Biofilms of agents induced urinary infections and use of fluroquinolone. Consilium Medicum. 2008;10(4). (In Ukrainian).
16. Choong S, Whitfield H. Biofilms and their role in infections in urology. BJU international. 2000;86(3):935-41. PMID: 11069430.
17. Kumon H. Management of biofilm infection in the urinary tract. World J Surg. 2000 Oct;24(10):1193-96. PMID: 11071460.
18. Solomon Wikero, et al. Molecular characterization of extended spectrum beta-lactamase producing Escherichia coli isolates in Brong-Ahafo regional hospital, Ghana. European Scientific Journal. 2017;13(9):365-77. doi: 10.19044/esj.2017.v13n9p365.
19. Tenke P, et al. Update on biofilm infections in the urinary tract. World Journal of Urology. 2012 Feb;30(1):51-7. PMID: 21590469. PMCID: PMC4629855. doi: 10.1007/s00345-011-0689-9.
20. NICE clinical guideline [CG54]. Urinary tract infection in under 16s: diagnosis and management. 2007. Available from: https://www.nice.org.uk/guidance/cg54 Accepted: August 207.
21. Fisher DJ, Steele RW, et al. Pediatric Urinary Tract Infection. Available from: http://emedicine.medscape.com/article/969643-overview Accepted: Aug 2016.
22. Joan L Robinson, Jane C Finlay, Mia Eileen Lang, Robert Bortolussi and Canadian Paediatric Society, Community Paediatrics Committee, Infectious Diseases and Immunization Committee. Urinary tract infection in infants and children: Diagnosis and management. Paediatr Child Health. 2014;19(6):315-9. PMCID: PMC4173959.
23. Alves MJ, Barreira JCM, Carvalho I, Trinta L, Perreira L, Ferreira ICFR, Pintado.M. Propensity for biofilm formation by clinical isolates from urinary tract infections: developing a multifactorial predictive model to improve antibiotherapy. Journal of Medical Microbiology. 2014 Mar;63(pt 3): 471-7. PMID: 24430252. doi: 10.1099/jmm.0.071746-0.
24. Glava 15.4 Osnovnye principy antibakterial'noj terapii [Chapter 15.4 Basic principles of antibiotic therapy]. Glava 15.4.3 Komponenta “mikroorganizm” [Chapter 15.4.3 Component microorganism]. Glava 15.4.3.2 Rezistentnost' k antibіotikam [Chapter 15.4.3.2. Antibiotic resistence]. In: Belousov YB, Moiseev VS, Lepakhin VK, editors. Klinicheskaja farmakologija i farmakoterapija [Clinical pharmacology and drug therapy]. Moscow; 1997. (In Russian).
25. Strachounski LS. Extended spectrum β-lactamases – rapidly spreading and underestimated problem. Klinicheskaja mikrobiologija i antimikrobnaja himioterapija. 2005;7(1):92-6. (In Russian).
26. Bogun LV. Beta-lactamses-induced resistance of microorganisms and the ways for its overcoming. Novosti meditsiny i farmatsii. 2007;19(227):20-1. (In Russian).
27. Khan AU, Musharraf A. Plasmid-mediated multiple antibiotic resistance in Proteus mirabilis isolated from patients with urinary tract infection. Med Sci Monit. 2004;10(11):598-602. PMID: 15507850.
28. Absalon CP, Ymele-Leki, Watnick PI. The Bacterial biofilm matrix as a platform for protein delivery. MBio. 2012;3(4):e00127-12. doi: 10.1128 /mBio.00127-12.
29. Mostovoi YM. Cephalosporins: disappointments and optimism. Novosti meditsiny i farmatsii. 2011;19(391):12-4. (In Russian).
30. Yudina LV. Role of protected cephalosporins in treatment of lower respiratory tract. Ukraїns'kij medichnij chasopis. 2016;4(114):3-15. (In Russian).
31. Ivanov DD, Kushnirenko SV. Clinical experience in sulbactomax usage for pyelonephritis treatment in children. Novosti meditsiny i farmatsii. 2010;59311):11-2. (In Ukrainian).
32. Redko OK, Zagorodnii IM, Ponor OB. Antimicrobial resistance and benefits of protected cephalosporins III generation in treatment of children. Bolezni i antibiotiki. 2011;2(05):17-9. (In Ukrainian).
33. Prescribing information for Sulbactomax. Available from: http://compendium.com.ua/info/170655/sul_baktomaks.

/62-1.jpg )
/62-2.jpg )
/63-1.jpg )
/64-1.jpg )
/65-1.jpg )
/65-2.jpg )
/66-1.jpg )
/66-2.jpg )
/68-1.jpg )
/69-1.jpg )