Неинфекционные заболевания, к которым относится хроническая болезнь почек (ХБП), являются наиболее распространенными причинами заболеваемости и преждевременной смерти. ХБП считается глобальной проблемой общественного здравоохранения в мире. Широкая распространенность ХБП среди населения (более 10 %) приводит к утрате трудоспособности, сердечно-сосудистым осложнениям и смертности из-за развития терминальной почечной недостаточности [1, 2]. В последние годы внимание исследователей привлечено к новым биомаркерам ХБП. Этими маркерами являются белок Klotho и фактор роста фибробластов (Fibroblast Growth Factor — FGF23), которые принимают участие в метаболизме фосфата, кальция и витамина D при ХБП.
Белок Klotho
Ген белка Klotho был идентифицирован Kuro-o и др. [3] в 1997 г. при изучении трансгенных мышей, экспрессирующих натрий-протонный обменник. Японскими исследователями случайно был поврежден локус соседнего гена, и мыши (Klotho –/–) показали поразительный феномен, напоминающий старение человека, что проявлялось замедлением роста, гипогонадизмом, атрофией кожи, тимуса, кальцификацией сосудов и мягких тканей, остеопорозом, легочной эмфиземой и короткой продолжительностью жизни. Наоборот, избыточная экспрессия Klotho у мышей приводила к увеличению продолжительности жизни. Поэтому Klotho считается антивозрастным геном [4] (рис. 1).
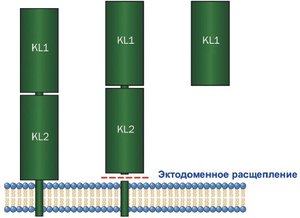
Название гена Klotho происходит от греческой богини Клото (дочери Зевса). В греческой мифологии богини Клото, Лахесис и Атропос, контролируя нить жизни, определяли, какой будет длительность жизни каждого смертного. При этом они соответственно пряли, измеряли и обрезали нити жизни. Белок Klotho имеет молекулярный вес ~ 130 кДа и состоит из 1014 аминокислот, имеет сигнальную последовательность на N-конце и трансмембранный домен с коротким цитоплазматическим доменом на С-конце. Внеклеточный домен Klotho состоит их 2 внутренних повторов (KL1 and KL2) гомологичных последовательностей β-глюкозидазы [5] (рис. 2).
В геноме млекопитающих идентифицировали 3 члена семейства Klotho, являющихся трансмембранными белками различной длины (рис. 3). Растворимые формы α-Klotho могут быть получены протеолитическим расщеплением трансмембранной формы β-секретазами.
/133-1.jpg)
Белок Klotho экспрессируется во многих тканях, но особенно в больших количествах в почках. Выраженная экспрессия Klotho обнаружена в дистальных и проксимальных канальцах почек, а также в эпителиальных клетках паращитовидных желез [6]. Мембранная форма является корецептором для FGF23, индуцирует отрицательный фосфатный баланс путем стимулирования экскреции почечного фосфата и снижения уровня сывороточного дигидроксивитамина D3 (1,25(ОН)2VD3). Кроме мембранной формы, существует экстрацеллюлярная форма белка Klotho, которая образуется посредством секретазы, а также сплайсинга и высвобождается во внеклеточное пространство, где функционирует как эндокринный фактор. Растворимая форма белка Klotho играет важную роль в различных процессах организма, включая транспорт ионов, трансдукции сигнала, участвует в регуляции метаболизма кальция, паратиреоидного гормона (РТН) и др. Растворимая форма белка Klotho находится в крови, моче и спинномозговой жидкости [7] (рис. 4).
/133-2.jpg)
Функции, физиологические процессы и заболевания, связанные с белком Klotho в организме человека, представлены в табл. 1.
На снижение экспрессии белка Klotho при ХБП/терминальной стадии почечной недостаточности влияют многие потенциальные факторы, в том числе снижение массы почек, сверхпродуцирование провоспалительных цитокинов, таких как фактор некроза опухолей (TNF) и интерферона (INF), дислипидемия и гипергликемия, повышение уремического токсина (индоксил сульфата), окислительный стресс. Дефицит Klotho стимулирует синтез FGF23, уровень которого повышается с увеличением фосфата крови. Высокий уровень FGF23 в крови подав–ляет синтез 1,25(ОН)2VD3, что еще больше способствует ингибированию Klotho. Снижение уровня 1,25(ОН)2VD3 не только уменьшает экспрессию Klotho, но и стимулирует ренин-ангиотензиновую систему, которая подавляет продуцирование Klotho, что приводит к уменьшению экскреции фосфата с мочой (рис. 5).
Факторы роста фибробластов
Факторы роста фибробластов представляют собой большое суперсемейство пептидов, которые оказывают плейотропное воздействие на широкий диапазон биологических процессов, включая эмбриональное развитие, органогенез и метаболизм веществ через связывание и активацию FGF-рецептора (FGFR) [9, 10]. Факторы роста фибробластов продуцируются фибробластами, хондроцитами, кератиноцитами, эндотелиальными, гладкомышечными, тучными, глиальными клетками и стимулируют их пролиферацию. У человека идентифицировано 22 члена фактора роста фибробластов, состоящие из 7 субсемейств (рис. 6).
Субсемейство FGF19 состоит из FGF19, FGF21 и FGF23 [10]. Эти факторы роста фибробластов оказывают свою специфическую физиологическую активность в регуляции энергии и минерального обмена как эндокринные факторы или гормоны [11]. FGF15/19, FGF21 и FGF23 экспрессируются в основном в тонком кишечнике, печени и костях (рис. 7).
Уникальной структурной особенностью данных эндокринных FGF является отсутствие гепарин–связывающего домена, который присутствует во всех паракринных/аутокринных FGF. Этот гепарин-связывающий домен является важным для функционирования FGF по двум причинам. Во-первых, при связывании гепарин-сульфата (HS) во внеклеточном матриксе он уменьшает секрецию FGF и увеличивает их локальную концентрацию. Во-вторых, HS активирует рецептор GFG для образования комплекса HS : GFG : GFGR (2 : 2 : 2). В эндокринных GFG вместо гепарин-сульфата функционирует белок Klotho.
FGF23
Ген FGF23 расположен на 12-й хромосоме и состоит из 3 экзонов, кодирующих белок, состоящий из 251 аминокислоты (рис. 8). FGF23 имеет молекулярный вес 32 кДа и продуцируется остеоцитами и остеобластами кости.
Белок FGF23 содержит сигнальный пептид, состоящий из 24 аминокислот, 154-аминокислотный N-терминальный пептид и С-терминальный рецептор, состоящий из 73 аминокислот. После отщеп–ления 24-аминокислотной сигнальной последовательности белок 25FGF23251 секретируется в кровь. В кровотоке белок GFG23 циркулирует в двух разных формах: полноразмерной зрелой форме — 25FGF23251 и более короткой — 25FGF23179, не обладающей уникальной 73-аминокислотной последовательностью. Активной является только полная форма FGF23, так как С-терминальный домен необходим для взаимодействия с кофактором α-Klotho и последующей активацией рецептора FGF [12] (рис. 9).
/136-1.jpg)
Рецепторы GFGR (синий цвет) имеют три иммуноглобулиноподобных домена (D1, D2, D3), которые стабилизированы внутренними дисульфидными мостиками. Гепаринсвязывающая область показана фиолетовым цветом. Для эндокринных FGF-лигандов корецептор гепарин-сульфата заменен на Klotho. α-Klotho формирует комплексы с FGFR1c, FGFR3c, FGFR4 и служит в качестве высокоаффинного рецептора для FGF23. Лигандсвязывающая область (зеленый цвет) взаимодействует с С-терминальным концом FGF23. Белок Klotho имеет небольшую внутриклеточную область, тогда как FGFR обладает двумя киназными доменами, которые поддерживают передачу сигнала.
Физиологическая роль FGF23
Основная физиологическая функция FGF23 заключается в регуляции метаболизма фосфата, витамина D и паратиреоидного гормона (PTH). Последствиями избыточного содержания FGF23 являются гипофосфатемия, изменение метаболизма витамина D, нарушение роста и остеомаляция [13]. И наоборот, снижение уровня FGF23 приводит к гиперфосфатемии, избытку 1,25(OH)2D и кальцификации мягких тканей [14]. В физиологических условиях FGF23 контролирует экскрецию фосфатов почками в соответствии с потребностями организма. Кроме того, FGF23 влияет на витамин D путем ингибирования 1-α-гидроксилазы, которая превращает 25(ОН)D в активную форму 1,25(ОН)2D. Увеличение 1,25(ОН)2D способствует поглощению кальция и фосфата в желудочно-кишечном тракте. Прирост концентрации кальция вместе с 1,25(ОН)2D влияет на паращитовидную железу. При этом подавляется действие РТН и увеличивается экскреция кальция с мочой.
Белок Klotho как корецептор FGF23
В отличие от большинства факторов роста фиб–робластов у FGF23 отсутствует гепарин-сульфатсвязывающий центр, поэтому FGF23 имеет низкую аффинность к рецепторам FGF. В 2006 г. группа ученых из Японии идентифицировала mKL как особый кофактор для сигнализации FGF23, позволяющий высокоаффинно связываться с рецепторами FGF1c, -3c, -4с с последующим активированием пути MAПK (митогенактивированные протеинкиназы) [18] (рис. 10).
Белок Klotho и FGF23 при ХБП
Изменения концентрации белка Klotho (снижение) и FGF23 (повышение) начинаются уже со II–III стадии ХБП и являются более ранними маркерами прогрессирования данного заболевания в отличие от уровней PTH и фосфата [20] (рис. 11).
Определение растворимого белка Klotho и FGF23 применяют для диагностики ХБП. Y. Shima–mura и др. показали, что Klotho постепенно снижается на ранних стадиях ХБП с уменьшением скорости клубочковой фильтрации [21]. При этом одновременно происходит увеличение FGF23 [22], а при достижении конечной стадии почечной недостаточности концентрация FGF23 в несколько десятков раз превышает норму [23] (рис. 12).
Методы определения белка Klotho и FGF23
1. Белок Klotho
Коммерчески доступным набором для определения концентрации растворимого белка Klotho является Human soluble α-Klotho Assay Kit от компании IBL International GmbH (Германия). В наборе применяется твердофазный сэндвич-метод ELISA (Enzyme-linked immunosorbent assay) с использованием двух видов высокоспецифических антител. Определение растворимого α-Klotho осуществляется в сыворотке или плазме, область определения — 93,75–6000 пг/мл, чувствительность — 6,15 пг/мл.
Пример стандартной кривой показан на рис. 13.
2. FGF23
Для определения концентрации FGF23 используется набор Human FGF23 ELISA Kit от компании LifeSpan BioSciences (США). В качестве образцов могут использоваться сыворотка, моча, супернатант культуры клеток, гомогенат клеток. Область определения — 3,12–200 пг/мл, чувствительность — 0,78 пг/мл. Типичный график кривой представлен на рис. 14.
Выводы
1. При хронической болезни почек происходят снижение белка Klotho и повышение GFG23.
2. Уровни белка Klotho и FGF23 являются ранними, чувствительными и специфичными диагностическими биомаркерами при хронической болезни почек.
3. Белок Klotho и FGF23 имеют диагностическую ценность для прогнозирования прогрессирования осложнений при заболевании почек.
Конфликт интересов. Автор заявляет об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Levey A.S., Atkins R., Coresh J. et al. Chronic kidney dise–ase as a global public health problem: approaches and initiatives — a position statement from Kidney Disease Improving Global Outcomes // Kidney Int. — 2007. — 72. — 247-59. doi: 10.1038/sj.ki.5002343.
2. Couser W.G., Remuzzi G., Mendis S., Tonelli M. The contribution of chronic kidney disease to the global burden of major noncommunicable diseases // Kidney Int. — 2011 Dec. — 80(12). — 1258-70. doi: 10.1038/ki.2011.368.
3. Kuro-o M., Matsumura Y., Aizawa H. et al. Mutation of the mouse klotho gene leads to a synd-rome resembling ageing // Nature. — 1997. — 390(6555). — 45-51. doi: 10.1038/36285.
4. Kurosu H., Yamamoto M., Clark J.D. et al. Suppression of aging in mice by the hormone Klotho // Science. — 2005. — 309. — 1829-33. doi: 10.1126/science.1112766.
5. Nabeshima Y. The discovery of α-Klotho and FGF23 unveiled new insight into calcium and phosphate homeostasis // Cell. Mol. Life Sci. — 2008 Oct. — 65(20). — 3218-30. doi: 10.1007/s00018-008-8177-0.
6. Forster R.E., Jurutka P.W., Hsieh J.C. et al. Vitamin D receptor controls expression of the anti-aging klotho gene in mouse and human renal cells // Biochem. Biophys. Res. Commun. — 2011 Oct 28. — 414(3). — 557-62. doi: 10.1016/j.bbrc.2011.09.117.
7. Hu M.C., Shi M., Zhang J. et al. Klotho: a novel phosphaturic substance acting as an autocrine enzyme in the renal proximal tubule // FASEB J. — 2010 Sep. — 24(9). — 3438-50. doi: 10.1096/fj.10-154765.
8. Eswarakumar V.P., Lax I., Schlessinger J. Cellular signaling by fibroblast growth factor receptors // Cytokine Growth Factor Rev. — 2005. — 16. — 139-49. doi: 10.1016/j.cytogfr.2005.01.001.
9. Mohammadi M., Olsen S.K., Ibrahimi O.A. Structural basis for fibroblast growth factor receptor activation // Cytokine Growth Factor Rev. — 2005. — 16(2). — 107-37. doi: 10.1016/j.cytogfr.2005.01.008.
10. Beenken A., Mohammadi M. The structural biology of the FGF19 subfamily // Adv. Exp. Med. Biol. — 2012. — 728. — 1-24. doi: 10.1007/978-1-4614-0887-1_1.
11. Kuro-o M. Endocrine FGFs and Klothos. — Austin, TX/New York: Landes Biosci./Springer, 2012. — 233 p.
12. Goetz R., Beenken A., Ibrahimi O.A. et al. Molecular insights into the klotho depen-dent, endocrine mode of action of fibroblast growth factor 19 subfamily members // Mol. Cell. Biol. — 2007. — 27. — 3417-28. doi: 10.1128/MCB.02249-06.
13. Fukumoto S., Yamashita T. Fibroblast growth factor-23 is the phosphaturic factor in tumor-induced osteomalacia and may be phosphatonin // Curr. Opin. Nephrol. Hypertens. — 2002. — 11(4). — 385-9. — PMID: 12105387.
14. Shimada T., Kakitani M., Yamazaki Y. et al. Targeted ablation of Fgf23 demonstrates an essential physiological role of FGF23 in phosphate and vitamin D metabolism // J. Clin. Invest. — 2004. — 113(4). — 561-8. doi: 10.1172/JCI19081.
15. Komaba H., Fukagawa M. FGF23: a key player in mine–ral and bone disorder in CKD // Nefrologia. — 2009. — 29(5). — 392-396. doi:10.3265/Nefrologia.2009.29.5.5400.en.full.
16. Martin A., David V., Quarles L.D. Regulation and function of the FGF23/Klotho endocrine pathways // Physiol. Rev. — 2012. — 92. — 131-55. — doi: 10.1152/physrev.00002.2011.
17. Memon F., El-Abbadi M., Nakatani T. Does Fgf23- klotho activity influence vascular and soft tissue calcification through regulating mineral ion metabolism? // Kidney Int. — 2008 Sep. — 74(5). — 566-70. doi: 10.1038/ki.2008.218.
18. Urakawa I., Yamazaki Y., Shimada T. et al. Klotho converts canonical FGF receptor into a specific receptor for FGF23 // Nature. — 2006. — 444. — 770-4. doi: 10.1038/nature05315.
19. Ichikawa S., Imel E.A., Kreiter M.L. et al. A homozygous missense mutation in human KLOTHO causes severe tumoral calcinosis // J. Clin. Invest. — 2007. — 117. — 2684-91. doi: 10.1172/JCI31330.
20. Hu M.C., Kuro-o M., Moe O.W. Klotho and Chronic Kidney Disease // Contrib. Nephrol. — 2013. — 180. — 47-63. doi: 10.1159/000346778.
21. Shimamura Y., Hamada K., Inoue K. et al. Serum levels of soluble secreted α-Klotho are decreased in the early stages of chronic kidney disease, making it a probable novel biomarker for early diagnosis // Clin. Exp. Nephrol. — 2012 Oct. — 16(5). — 722-9. doi: 10.1007/s10157-012-0621-7.
22. Kuro-o M. Klotho in chronic kidney disease — What’s new? // Nephrol. Dial. Transplant. — 2009 Jun. — 24(6). — 1705-8. doi: 10.1093/ndt/gfp069.
23. Wolf M. Update on fibroblast growth factor 23 in chronic kidney disease // Kidney Int. — 2012. — 82(7). — 737-47. doi: 10.1038/ki.2012.176.

/133-1.jpg)
/133-2.jpg)
/134-3.jpg)
/134-1.jpg)
/134-2.jpg)
/135-2.jpg)
/135-1.jpg)
/136-1.jpg)
/136-2.jpg)
/137-1.jpg)