Журнал «» 4 (54) 2017
Альдостеронсинтаза, полиморфизм ее гена CYP11B2 при артериальной гипертензии и ассоциированных с нею кардиоваскулярных заболеваниях (обзор литературы)
Авторы: Милославский Д.К., Коваль С.Н., Снегурская И.А., Божко В.В., Щенявская Е.Н.
ГУ «Национальный институт терапии имени Л.Т. Малой НАМН Украины», г. Харьков, Украина
Рубрики: Кардиология
Разделы: Справочник специалиста
Резюме
В огляді надані дані зарубіжної та вітчизняної літератури щодо патогенетичної ролі альдостерону, рівнів альдостеронсинтази і поліморфізмів гена даного ферменту у хворих на різні форми артеріальної гіпертензії, при асоційованих з нею захворюваннях серця і судин, фібриляції передсердь, метаболічному синдромі, патології нирок, головного мозку. Розглядаються функції альдостерону, рівнів альдостеронсинтази і поліморфізмів гена даного ферменту в серцево-судинному ремоделюванні, можливості застосування даних маркерів для диференційно-діагностичних цілей, перспективи терапевтичного використання інгібіторів альдостеронсинтази серед різних категорій хворих з ознаками артеріальної гіпертензії.
В обзоре представлены данные зарубежной и отечественной литературы о патогенетической роли альдостерона, уровней альдостеронсинтазы и полиморфизмов гена данного фермента у больных различными формами артериальной гипертензии, при ассоциированных с нею заболеваниях сердца и сосудов, фибрилляции предсердий, метаболическом синдроме, патологии почек, головного мозга. Рассматриваются функции альдостерона, уровней альдостеронсинтазы и полиморфизмов гена данного фермента в сердечно-сосудистом ремоделировании, возможности применения данных маркеров для дифференциально-диагностических целей, перспективы терапевтического использования ингибиторов альдостеронсинтазы среди различных категорий больных с признаками артериальной гипертензии.
The article presents the data of foreign and national literature on the pathogenetic role of aldosterone (AL), levels of aldosterone synthase (AS) and gene polymorphisms of this enzyme in patients with various forms of arterial hypertension, associated with diseases of the heart and vessels, such as hypertrophic cardiomyopathy, atrial fibrillation, brain pathology etc. The activation of circulating and local renin-angiotensin system results in increased secretion of the powerful vasoconstrictor angiotensin II, which stimulates AL production in an auto- and paracrine way. Angiotensin II and AL have independent regulatory effect on the function and structure of the heart and blood vessels, kidneys and brain. Both hormones stimulate hypertrophy of cardiomyocytes and vascular smooth muscle cells, hyperplasia of myocardial fibroblasts, synthesis of connective tissue matrix. As a result, the left ventricular hypertrophy is formed, cardiac remodeling is progressing, in which processes AL is involved. The main humoral, metabolic, cellular, immune-inflammatory and profibrogenic effects of aldosterone are considered. The AS gene CYP11B2 catalyzes the last stage of the synthesis of AL from desoxycorticosterone. The gene is located in the g21 region of chromosome 8, and consists of nine exons and eight introns. Single nucleotide polymorphisms are known in the promoter region of AL and in the AS gene. The polymorphism of the 5th section of this gene, which manifests itself by replacing cytosine (C) with thymine (T) at the 344th position of the 344 T/C nucleotide sequence, rs1799998, has been most fully investigated. MiR-766 can be used to suppress the expression of the AS gene in an experiment, as well as in humans, and reduce blood pressure level in people having the –344T allele. The determination of the single nucleotide replacement of T by C at position 344 of the CYP11B2 gene is carried out by polymerase chain reaction with polymorphism of the length of restriction fragment analysis. Currently, a list of forward and reverse primers, which are used in the amplification of the CYP11B2 gene, has been compiled. In the number of studies, the relationship between AS gene polymorphism and risk factors of cardiovascular and endocrine pathology were studied, the sex, gender and ethnic characteristics of AS gene polymorphism were considered, and the results of population studies of gene polymorphism of AS in several European and Asian countries were received. The information is provided on the AS levels and gene polymorphisms of this enzyme in arterial hypertension, including its resistant form, in the combination of ischemic heart disease, postinfarction cardiosclerosis, their participation in cardiovascular remodeling, the formation of left ventricular hypertrophy, in hypertensive nephropathy, cerebral stroke, heart failure. The levels of AL and gene polymorphism of AS also can be used as differential diagnostic criteria for hypertension with low plasma renin activity, with renovascular and resistant hypertension, at hyperaldosteronism types 1 and 2, aldosteromas, apparent mineralocorticoid excess syndrome, congenital adrenal hyperplasia. The congenital defects of enzymatic activity of AS, insufficiency of AS and aldosteronism (arterial hypertension), which are cured by glucocorticoids, are described. The results of several studies provide conflicting data on the degree of response to antihypertensive therapy by various first-line drugs and mineralocorticoid receptor antagonists, depending on the haplotype CYP11B2, are presented. The prospects of therapeutic use of a new class of drugs — aldosterone synthase inhibitors among various categories of patients with symptoms of arterial hypertension are considered.
Ключевые слова
артеріальна гіпертензія; асоційовані кардіоваскулярні захворювання; альдостерон; рівні альдостеронсинтази; поліморфізм гена альдостеронсинтази; диференційно-діагностичне застосування; терапевтичне використання інгібіторів альдостеронсинтази; огляд
артериальная гипертензия; ассоциированные кардиоваскулярные заболевания; альдостерон; уровни альдостеронсинтазы; полиморфизм гена альдостеронсинтазы; дифференциально-диагностическое применение; терапевтическое использование ингибиторов альдостеронсинтазы; обзор
The article presents the data of foreign and national literature on the pathogenetic role of aldosterone (AL), levels of aldosterone synthase (AS) and gene polymorphisms of this enzyme in patients with various forms of arterial hypertension, associated with diseases of the heart and vessels, such as hypertrophic cardiomyopathy, atrial fibrillation, brain pathology etc. The activation of circulating and local renin-angiotensin system results in increased secretion of the powerful vasoconstrictor angiotensin II, which stimulates AL production in an auto- and paracrine way. Angiotensin II and AL have independent regulatory effect on the function and structure of the heart and blood vessels, kidneys and brain. Both hormones stimulate hypertrophy of cardiomyocytes and vascular smooth muscle cells, hyperplasia of myocardial fibroblasts, synthesis of connective tissue matrix. As a result, the left ventricular hypertrophy is formed, cardiac remodeling is progressing, in which processes AL is involved. The main humoral, metabolic, cellular, immune-inflammatory and profibrogenic effects of aldosterone are considered. The AS gene CYP11B2 catalyzes the last stage of the synthesis of AL from desoxycorticosterone. The gene is located in the g21 region of chromosome 8, and consists of nine exons and eight introns. Single nucleotide polymorphisms are known in the promoter region of AL and in the AS gene. The polymorphism of the 5th section of this gene, which manifests itself by replacing cytosine (C) with thymine (T) at the 344th position of the 344 T/C nucleotide sequence, rs1799998, has been most fully investigated. MiR-766 can be used to suppress the expression of the AS gene in an experiment, as well as in humans, and reduce blood pressure level in people having the –344T allele. The determination of the single nucleotide replacement of T by C at position 344 of the CYP11B2 gene is carried out by polymerase chain reaction with polymorphism of the length of restriction fragment analysis. Currently, a list of forward and reverse primers, which are used in the amplification of the CYP11B2 gene, has been compiled. In the number of studies, the relationship between AS gene polymorphism and risk factors of cardiovascular and endocrine pathology were studied, the sex, gender and ethnic characteristics of AS gene polymorphism were considered, and the results of population studies of gene polymorphism of AS in several European and Asian countries were received. The information is provided on the AS levels and gene polymorphisms of this enzyme in arterial hypertension, including its resistant form, in the combination of ischemic heart disease, postinfarction cardiosclerosis, their participation in cardiovascular remodeling, the formation of left ventricular hypertrophy, in hypertensive nephropathy, cerebral stroke, heart failure. The levels of AL and gene polymorphism of AS also can be used as differential diagnostic criteria for hypertension with low plasma renin activity, with renovascular and resistant hypertension, at hyperaldosteronism types 1 and 2, aldosteromas, apparent mineralocorticoid excess syndrome, congenital adrenal hyperplasia. The congenital defects of enzymatic activity of AS, insufficiency of AS and aldosteronism (arterial hypertension), which are cured by glucocorticoids, are described. The results of several studies provide conflicting data on the degree of response to antihypertensive therapy by various first-line drugs and mineralocorticoid receptor antagonists, depending on the haplotype CYP11B2, are presented. The prospects of therapeutic use of a new class of drugs — aldosterone synthase inhibitors among various categories of patients with symptoms of arterial hypertension are considered.
Среди патофизиологических механизмов становления и прогрессирования артериальной гипертензии (АГ), разработки дифференцированных стратегий лечения и профилактики гипертензивных состояний, их первичных, вторичных и резистентных форм, в последнее десятилетие значимое место отводится гормональным факторам надпочечникового происхождения. Среди них прежде всего следует отметить альдостерон (АЛ), фермент альдостеронсинтазу (АС), который принимает непосредственное участие в образовании данного гормона, а также генные полиморфизмы АС, имеющие не только молекулярно-генетическое, но и дифференциально-диагностическое и терапевтическое значение при АГ и ассоциированных с нею кардиоваскулярных заболеваниях [1–4].
Альдостерон — стероидный (минералокортикоидный) гормон коры надпочечников, который синтезируется из холестерина преимущественно в гломерулярной зоне надпочечников, высвобождается под действием ангиотензина II (А II) и ионов калия. Действие АЛ опосредовано через соответствующие минералокортикоидные рецепторы (МКР) [5, 6]. Процесс секреции гормона зависит от уровня натрия (Na+) и магния в крови, активности ренин-ангиотензиновой системы (РАС), гипоталамо-гипофизарных факторов — адренокортикотропного гормона (АКТГ) и дофамина. Основные эффекты АЛ состоят в регуляции водно-солевого обмена, увеличении объема циркулирующей крови, повышении артериального давления (АД). Повышать уровни АЛ могут высокосолевая диета; мочегонные; слабительные; калий; физическая нагрузка; стресс, снижать — блокаторы АТ1-рецепторов, ингибиторы ренина, длительный прием гепарина, β-блокаторов, кортикостероидов [6–8].
Активация локальной ренин-ангиотензиновой системы приводит к усиленной секреции мощного вазоконстриктора А II, который стимулирует продукцию АЛ ауто- и паракринным путем. А II и АЛ имеют независимое регуляторное действие на функцию и структуру сердца и сосудов, почек, мозга. Оба гормона стимулируют гипертрофию кардиомио–цитов (КМЦ) и сосудистых гладкомышечных клеток, гиперплазию фибробластов миокарда, синтез соединительнотканного матрикса. В итоге формируется гипертрофия левого желудочка (ГЛЖ), прогрессирует ремоделирование сердца, в которых в большей степени задействован АЛ [9, 10].
На клеточном уровне АЛ усиливает экспрессию ядерного фактора транскрипции kВ (NF-kB) с возрастанием продукции супероксидного радикала в стенке сосудов. АЛ вызывает дисфункцию эндотелия и вазоконстрикцию, индуцирует малоинтенсивное воспаление в сосудистой стенке, миокарде и почках, приводя к развитию миокардиосклероза, нефросклероза и нарушениям фибринолиза. Мембранными рецепторами АЛ обладают клетки различных тканей, в миокарде опосредованно через них активируется синтез коллагена. АЛ вызывает также инфильтрацию интимы макрофагами с усиленной экспрессией генов циклооксигеназы-2, остеопонтина, фокальными некротическими изменениями, способствуя гипертрофии и склеротическим изменениям в миокарде, апоптозу КМЦ, особенно при развитии АГ. АЛ вызывает значимые метаболические нарушения, его параметры в крови прямо коррелируют с уровнями глюкозы, инсулина, С-пептида и величиной индекса инсулинорезистентности (HOMA-ИР) [11, 12].
При АГ и сердечной недостаточности (СН) активно высвобождается не только А II, но и АЛ. Повышенный уровень АЛ установлен у лиц с резистентной АГ, при патологии почек. При АГ, ишемической болезни сердца (ИБС) и СН синтез АЛ активирован в стенке сосудов, сердце, в этих тканях экспрессия гена АС достигает 1/15 экспрессии в надпочечниках, причем высокосолевая диета только повышает синтез АЛ. Применение спиронолактона (Сп) тормозит негативные эффекты АЛ, по–этому назначение блокаторов МКР в большей мере оправдано у таких лиц, чем применение блокаторов рецепторов А II [7–12].
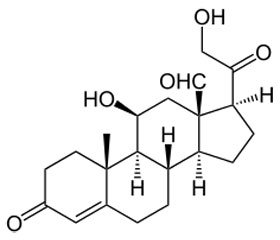
Альдостеронсинтаза — митохондриальный фермент человека, кодируемый геном CYP11B2 (англ. cytochrome P450, family 11, subfamily B, polypeptide 2), расположен на 8-й хромосоме. АС принадлежит к суперсемейству цитохрома P450 и регулирует синтез гормона АЛ. АС как фермент катализирует три ключевые реакции в синтезе АЛ из дезоксикортикостерона (КС) (11-гидроксилирование, 18-гидроксилирование и, наконец, 18-окисление). Вначале происходит 11-бета-гидроксилирование 11-дезоксиКС до КС, затем 18-гидроксилирование КС до 18-гидроксиКС и, наконец, 18-оксидирование 18-гидроксиКС до АЛ.
Ген CYP11B2 кодирует ключевой фермент синтеза АЛ 18-гидроксилазу, которая присоединяет гидроксильную группу (ОН) к С18 остатку. Этот ген в высокой степени гомологичен гену CYP11B1, кодирующему также митохондриальный фермент 11-бета-гидроксилазу, который участвует в синтезе кортизола и стероидогенезе и присоединяет ОН группу к С11 остатку. Понимание точной роли полиморфизма C-344T для синтеза АЛ и регуляции АД, вероятно, будет сложным без разграничения функционального значения других, тесно связанных вариантов гена в локусе CYP11B1-CYP11B2 [13, 14].
Ген CYP11B2 катализирует последнюю стадию синтеза АЛ из дезоксиКС. Ген расположен в области g21 хромосомы 8 и состоит из девяти экзонов и восьми интронов. Известны такие основные виды полиморфизмов гена АС: однонуклеотидные полиморфизмы (single nucleotide polymorphism, SNP) в промоторной области АЛ, однонуклеотидные полиморфизмы в гене АС. Полиморфизмы гена АС представлены однонуклеотидными полиморфизмами в экзоне 3 гена АС, в экзоне 5 гена АС, в экзоне 6 гена АС, в экзоне 7 гена АС, в экзоне 9 гена АС. Ген CYP11B2 человека имеет T/C-полиморфизм при -344 положениях в его 5'-нетранслируемой области (UTR), а аллель -344T связана с АГ. Ген CYP11B2 имеет полиморфизм A/G в положении 735 в его 3'-UTR (rs28491316), который находится в неравновес–ном сцеплении с однонуклеотидным полиморфизмом при -344 положении. В научных работах часто изучают SNP полиморфизмы гена АС, такие как 5312Т, Intron 2, Lys-173/Arg; T-344C, 3097 С/А. Наи–более полно исследован полиморфизм 5-го участка данного гена, проявляющийся заменой цитозина (С) на тимин (Т) в 344-м положении нуклеотидной последовательности 344 T/C, rs1799998. Согласно базе данных Национального центра биотехнологической информации (NCBI), 227 SNP гена АС были идентифицированы в разных популяциях. Европейцы, азиаты, африканцы и североамериканцы входили в их число и были генотипированы по CYP11B2. Нуклеотидный полиморфизм гена АС, согласно последним исследованиям, воздействует на уровень АЛ-ренинового соотношения, а 344Т-аллель гена CYP11B2 ассоциирована с повышением АЛ-рениновой активности в плазме [15, 16].
По данным S. Maharijan (2014), полиморфизм генов АС представлен соответствующей мРНК, которая и регулирует экспрессию генов [17]. Автор показала, что повышенная экспрессия АС увеличивает уровни АД и вызывает ГЛЖ у транс–генных мышей. Исследователи считают, что микроРНК (miR) -766 связывается с 735G-аллелью, а не с 735A-аллелью гена CYP11B2 и трансфекция miR-766 уменьшает мРНК и уровень белка АС человека в адренокортикальных клетках. Эта работа также показывает, что miR-766 может подавлять экспрессию гена АС человека и снижать АД у людей, содержащих аллель -344T.
Методы определения полиморфизмов гена АС. Определение однонуклеотидной замены T на C в положении -344 гена CYP11B2 проводят методом полимеразной цепной реакции с анализом полиморфизма длины рестрикционных фрагментов. Высокомолекулярную ДНК из крови выделяют с использованием экстракции смесью фенол-хлороформ. Используется также определение полиморфизмов АС с помощью секвенирования ДНК, с применением методов очистки и амплификации ДНК. В настоящее время составлен список прямых и обратных праймеров, которые используются при амплификации гена CYP11B2.
Полиморфизм гена АС при АГ и ассоциированных с нею заболеваниях. Среди известных SNP положение -344 C/T в области промотора 5` CYP11B2 может играть роль в развитии АГ. Хотя исследования, –изучающие взаимосвязь между этим полиморфизмом АС и развитием АГ дали противоречивые данные. Большинство исследований показывает, что аллель T связана с АГ [18]. Другие работы подтверждают роль аллели C в развитии АГ и связывают ее с увеличением синтеза АЛ. Кроме того, обнаружено, что аллель -344 С связывает транскрипционный стероидогенный фактор 1 (SF-1) в 4 раза активнее, чем аллель Т, что приводит к увеличению уровня АС. Получены данные, что C-аллель гена CYP11B2 была более значимо связана с наличием АГ в японской популяции. Однако другие исследователи не нашли существенной связи между этим полиморфизмом и АГ. Связанный с АГ полиморфизм гена CYP11B2 обу–словлен заменой А в G в нуклеотиде 2721 в экзоне 3, приводящем к замещению аргинина (Arg) лизином (Lys) в положении 173 в белковой последовательности, которая была описана в чилийском исследовании пациентов [19]. В другом исследовании гипертензивные лица женского пола имели значительно более высокие частоты Lys по сравнению с контролем, уменьшенная же частота варианта Arg была связана с развитием АГ.
В ряде работ была изучена взаимосвязь генного полиморфизма АС с факторами риска кардиоваскулярной и эндокринной патологии. Y.Q. Pan (2010) была изучена взаимосвязь генного полиморфизма АС с употреблением алкоголя, связь уровней АД с полиморфизмом гена АС подтверждена E. Casiglia (2007), установлена корреляция между массой миокарда левого желудочка (ММЛЖ), мочевой экскрецией Na+ и специфическими генотипами гена CYP 1B2, вклад полиморфизма гена АС в синтез стероидов и регуляцию АД, влияние генного полиморфизма АС на развитие АГ и уровни АД у японских мужчин [20–23].
Некоторые несоответствия в полученных результатах, вероятно, объясняются различиями в отношении пола, возраста, методов отбора проб и факторов окружающей среды, такие как потребление Na среди населения, используемые в этих исследованиях, но могут быть связаны и с этнической принадлежностью обследованных.
Этнические особенности и популяционные исследования полиморфизмов гена АС были проведены в ряде европейских и азиатских стран, таких как Чехия, Франция, Китай, Индия, Япония, Тибет, Тайвань, Карелия, Саудовская Аравия, Беларусь [3, 24–30]. Среди работ последних лет следует отметить исследования полиморфизмов АС и ЭГ в индийской популяции (Vamsi U.М., 2016), связь генного полиморфизма АС, МКР, цитохрома Р450 с заболеваниями сосудов в Тайване (Chou C.H., 2016), генетический полиморфизм CYP11B2 обусловливает наличие эссенциальной АГ (ЭАГ) среди тибетской популяции северо-западного Китая (Li W., 2016).
S. Rajan и соавт. (2010) [31] было проведено исследование по изучению связи между полиморфизмом CYP11B2 C-344T и гипертонической болезнью (ГБ) в южноиндийской популяции. Исследование проводилось на 406 пациентах с ГБ и 424 здоровых лицах группы контроля из тамильского населения. Генотип гомозиготного варианта 344TT (отношение рисков (OR) 1,8; 95% доверительный интервал (ДИ) 1,1–2,8; P = 0,02) и Т-аллель (Р = 0,007) оказались значимо связанными с ГБ. При гендерном анализе риск был значительно выше у гипертензивных мужчин (ОР 1,8; 95% ДИ 1,0–3,6; Р = 0,05), а не у женщин. Z. Hlubocká и соавт. (2009) [32] изучали связь полиморфизма -344T/C гена CYP11B2 с наличием и тяжестью ГБ в исследовании «случай — контроль» в чешской популяции. Обследовали 139 пациентов с контролируемой ГБ, 74 — с резистентной АГ и 156 здоровых нормотензивных лиц. Распределение генотипов у нормотензивных лиц и больных ГБ было таковым: TT — 25,6 против 31,9 %, TC — 51,9 против 57,3 % и CC — 22,4 против 10,8 %. Вариант -344 T/C был связан с ГБ, лица, несущие аллель -344T, имели больший риск ГБ по сравнению с теми, которые имели аллель С (χ2 = 5,89; р < 0,05). Частота генотипа СС была значительно ниже у пациентов с ГБ, чем у нормотензивных лиц (χ2 = 9,44; р < 0,01). Кроме вышеизложенного, авторы не нашли ассоциации варианта -344T/C с устойчивостью пациентов к комбинированной терапии, но наблюдали связь полиморфизма -344T/C гена АС с повышенным риском ГБ.
Э.В. Гуровым и соавт. (2011) [33] была изучена связь полиморфного маркера -344Т/С гена АС с риском развития ряда сердечно-сосудистых заболеваний (ССЗ) у жителей Республики Карелия. Показано, что в группе здоровых людей преобладали аллель С и генотип СС, а в группе пациентов с ССЗ — аллель Т и генотип ТТ. Оказалось, что женщины, носители аллели Т и генотипа ТТ, были меньше подвержены риску развития АГ и кардиоваскулярных расстройств, чем мужчины.
Интересна работа G.H. Dweihi Al-Qahtani (2009) [34], касающаяся вопросов распространенности полиморфизмов гена АС у гипертензивных пациентов Саудовской Аравии. В исследовании участвовали 100 человек в возрасте 25–80 лет с документированной АГ и группа из 100 сопоставимых по возрасту саудовских индивидуумов без АГ. В данной популяции было обнаружено 20 SNP, 6 из которых были новыми. Три из них (ns4960, ns4970 и ns4986) были найдены в экзоне 7, а 3 (ns6401, ns6847 и ns6849) были идентифицированы в экзоне 9 гена АС. Среди идентифицированных SNP 3 показали связь с АГ (2 — в экзоне 6 и 1 — в экзоне 9) гена. Полиморфизм rs4544 (4454 T > C) встречался в экзоне 6 гена АС и приводил к изменению аминокислоты в положении 340 белка с изолейцина на треонин. Результаты исследования также показали, что частота аллели C была значительно выше у пациентов с АГ, чем у контрольных лиц (9,5 против 4,5 %; P = 0,048). Исследование также предполагает, что аллель A rs4538 полиморфизма в экзоне 6 гена АС играет протективную роль по сравнению с аллелью C. Данные исследования показывают, что генотип АА более распространен в контроле, чем у пациентов с АГ (57 против 47 %; Р = 0,034). Кроме того, было обнаружено, что генотип ТТ (rs3802230) ассоциируется с АГ при замене гуанина тимином в положении 6396. Результаты этого исследования также показали, что мутантного полиморфного ТТ генотипа АС у пациентов этой популяции больше, чем в контроле (77,5 % — в контроле и 82 % — в группе АГ).
Возрастные и половые взаимосвязи 344T/C гена АС с уровнями АД в европейской популяции были изучены Р. Russo (2007) [35]. О.С. Павловой и соавт. [36] проведено исследование ассоциации полиморфизма С(-344)Т гена АС (CYP11B2) с развитием ЭАГ у 585 этнических белорусов (391 пациент с АГ и 194 человека с оптимальным АД). Распределение генотипов полиморфизма С(-344)Т гена CYP11В2 не отличалось между группами пациентов с АГ. Среди пациентов с впервые выявленной АГ или нерегулярным антигипертензивным лечением достоверных различий по уровню АД, степени заболевания в зависимости от генотипов и аллелей полиморфизма С(-344)Т гена CYP11В2 получено также не было. У пациентов с АГ белорусской этнической популяции наблюдалось равновесное распределение С (50,1 %) и Т (49,9 %) аллелей полиморфизма С(-344)Т гена CYP11В2, а полиморфизм С(-344)Т гена CYP11В2 не был ассоциирован с развитием ЭАГ как в возрастных группах до или после 45 лет, так и с учетом гендерных различий.
G. Giacchetti и соавт. получены данные, свидетельствующие о более высоком уровне экспрессии гена АС у лиц с генотипом -344СС по варианту промоторной области этого гена. В связи с этим у лиц с вариантом -344СС повышен риск развития идиопатического гиперальдостеронизма и ЭАГ. Casiglia et al. получены доказательства того, что аллель CYP11B2 -344T связана с высоким уровнем АД и повышенным отношением АЛ/активностью ренина плазмы (АРП).
Гипертрофия левого желудочка является самостоятельным фактором риска развития сердечно-сосудистой заболеваемости и смертности. Среди больных с ГЛЖ большой процент составляют пациенты с наличием АГ, сопутствующей ИБС и/или фибрилляцией предсердий (ФП). У лиц с АГ при избытке АЛ ГЛЖ выражена непропорционально степени повышения АД. В исследованиях последних лет показано наличие усиленного синтеза АЛ в сердце при АГ и СН, аналогичный эффект отмечен в эксперименте у крыс, связанном с получением высокосолевой диеты. Установлено, что АЛ, особенно на фоне повышенного содержания Na+, индуцирует развитие ГЛЖ, тогда как при низком тканевом содержании Na+ этот эффект малохарактерен.
Изменения уровней АЛ и АС, по данным ряда авторов, прямо пропорциональны тяжести дисфункции ЛЖ и выраженности миокардиального фиброза. Как и при анализе других полиморфизмов генов-модификаторов, информация об ассоциации полиморфизма гена CYP11B2 с массой миокарда левого желудочка является противоречивой. Экспрессия АС является независимым фактором, влияющим на ММЛЖ, объем полости ЛЖ и диастолическую функцию (ДФ) у здоровых лиц. В то же время в исследовании H. Schunkert et al. не выявлено корреляции полиморфизма гена АС ни с АГ, ни с уровнем АЛ, ни с поражением органов-мишеней. В метаанализе [37] полиморфизм трех генов РАС, в том числе CYP11B2, был не ассоциирован с уровнем АД и солечувствительностью в азиатской популяции.
По данным М.М. Долженко (2015) [38], полиморфизм АС ассоциирован с увеличением размеров ЛЖ, нарушением его функции, ростом ММЛЖ у пациентов с АГ и ССЗ. МРНК гена АС и его полиморфизм влияют на синтез проколлагена ІІІ в мышце сердца. По данным ряда исследований, вариант ТТ полиморфизма гена АС связан с увеличением толщины задней стенки (ТЗС), а конечный диастолический и систолический диаметры ЛЖ более высокие при СС варианте гена CYP11B2. У европейцев наблюдается существенный рост ММЛЖ и индекса ММЛЖ (ИММЛЖ) при СС фенотипе, у азиатов при ТТ фенотипе гена АС наблюдается преимущественно увеличение толщины межжелудочковой перегородки (ТМЖП) и ТЗС. Роль полиморфизмов гена АС в геометрии ЛЖ, параметрах ММЛЖ и фенотипах расслабления структур ЛЖ изучена в работе S. Sookoian (2008), генетические основы ГЛЖ в узбекской популяции и связь с геном АС исследовали Д. Курбанова (2010) и Г.А. Хамидуллаева (2007) [39–41]. Метаанализ L. Wang (2015) рассматривает аналогичные ассоциации между структурой и геометрией левого желудочка по данным эхокардио–графии (ЭхоКГ) и вариантами полиморфизма гена АС [42].
Д.А. Яхонтов и соавт. [43] изучили полиморфизмы гена АС у больных АГ в сочетании с ИБС с различной ММЛЖ. Обследовано 63 мужчины с АГ в сочетании с ИБС, в их числе 32 — с признаками ГЛЖ и 31 мужчина — с нормальным индексом ММЛЖ. Авторами установлено, что генотип CYP11В2 T/С был ассоциирован с повышением уровня АЛ и признаками ГЛЖ. При этом для больных с ГЛЖ характерны генотип CYP11В2 T/С — в 62,5 % случаев и выявление аллели Т — в 1,3 раза чаще, чем у пациентов без ГЛЖ. При нормальной массе миокарда эти фенотипы были более редкими, чем вариант CYP11В2 T/T, а также выявление аллели С. Д.А. Деришева [44] изучала характер поражения коронарного русла и полиморфизм гена АС у больных ИБС в сочетании с АГ при различной ММЛЖ и степени поражения коронарных артерий (КА). Исследование показало, что частота встречаемости генотипов полиморфного локуса С-344Т гена АС в группах больных ИБС в сочетании с АГ соответствовало таковому у европеоидов. Генотип CYP11В2 T/С был ассоциирован с повышением уровня АЛ, признаками ГЛЖ, многососудистым поражением КА, в то время как при генотипе CYP11В2 T/Т, напротив, эти сдвиги отмечаются значительно реже. Для больных с ГЛЖ были характерны: генотип CYP11В2 Т/С (62,5 %) и наличие аллели Т, выявленной в 1,3 раза чаще, чем у больных с нормальным ИММЛЖ. При этом у больных с ГЛЖ в 3 раза реже встречается вариант генотипа CYP11В2 Т/Т и в 1,5 раза реже выявляется аллель С. У больных ИБС в сочетании с АГ генотип CYP11В2 T/С был ассоциирован с повышением уровня АЛ независимо от показателя ИММЛЖ. Полиморфизм гена АС определяет эффективность ответа больных ССЗ на блокатор МКР Сп.
С.А. Тихонова и соавт. (2008, 2015) [45] исследовали прогностическую значимость полиморфных аллельных вариантов гена АС при АГ, гипертензивной нефропатии, мозговом инсульте, а также среди мужчин в одесской популяции.
Одной из причин развития резистентной формы АГ может служить «феномен усиления» синтеза АЛ. [6]. В то же время, по данным R. Lacсhini (2009) [46], Т-аллель гена АС не была ассоциирована с резистентной формой АГ.
Взаимосвязи полиморфизма гена АС с факторами риска постинфарктного кардиосклероза исследовал Т. Baird (2007). По данным [47, 48], полиморфизм 344T/C гена АС после инфаркта миокарда (ИМ) у больных АГ сопровождается дилатацией ЛЖ, ремоделированием левых полостей сердца, что может быть связано с повышенным синтезом АЛ. В исследованиях пациентов с первичным ГА и АГ установлены возрастание риска развития ИМ и худший прогноз после перенесенного ИМ. Y. Normaznah (2015) [48] исследовал полиморфизм гена АС у пациентов с ИБС и доноров крови в Малайзии; роль генного полиморфизма АС при кардиоваскулярных заболеваниях изучал А. Bodula (2007) [49]. Рядом авторов показано, что применение блокатора МКР эплеренона на 3-и — 14-е сутки после острого ИМ у лиц с АГ сочеталось с выраженным уменьшением частоты развития конечных точек.
У больных с АГ, которая часто сочетается с фибрилляцией предсердий, отмечается фиброз КМЦ, активация синтеза АЛ в предсердиях, нарушается структурное и электрическое ремоделирование левого предсердия. Взаимосвязи между полиморфизмом CYP11В2 и ФП были исследованы в метаанализе Х. Fu (2015) и других авторов [50–52]; в работе Х. Sun (2011) [1] изучены ассоциации между полиморфизмами генов АС с наличием ФП у больных ЭАГ. Е.С. Яцкевич и соавт. [53, 54] у пациентов с ИБС и АГ изучены особенности предсердного ремоделирования, установлена их взаимосвязь с особенностями полиморфизма С-344/Т CYP11B2 и риск развития неклапанной ФП с уровнем АС и наличием ГЛЖ. Исследование включило 45 пациентов с ИБС, АГ и ФП и 39 относительно здоровых лиц без сердечно-сосудистой патологии. В группе пациентов с ФП частота встречаемости генотипа CYP11B2 T/T достоверно выше, чем в группе относительно здоровых пациентов. Выявление аллели Т достоверно чаще наблюдается у пациентов с ФП. У пациентов с пароксизмальной и персистирующей формой неклапанной ФП и ГЛЖ достоверно чаще встречается генотип СС. У пациентов с ФП уровень АС плазмы крови достоверно не отличался от такового у лиц без ССЗ в анамнезе. Не выявлено достоверных отличий уровня АС в зависимости от генотипов полиморфного С-344Т гена CYP11B2 и толщины МЖП. Блокатор МКР Сп может позитивно влиять на выраженность как АГ, так и ФП.
W. Chai опубликовали данные работы о роли полиморфизма гена АС в формировании ГЛЖ у больных гипертрофической кардиомиопатией (ГКМП). В исследование вошли 79 генетически разнородных больных ГКМП. Оценивали ТМЖП и индекс ММЛЖ при проведении ЭхоКГ, уровни АРП и концентрации альдостерона в плазме крови (КАП), полиморфизм CYP11B2, -344 T/C. Установлено, что ТМЖП была больше у носителей Т-аллели CYP11B2 мужского пола, что следует связывать с повышением циркулирующего АЛ. Назначение ингибитора МКР Сп способно устранять склерозирование, уменьшать беспорядочность ориентации КМЦ и улучшать ДФ сердца у этой категории пациентов.
Адипоцитзависимая продукция АЛ вовлечена в развитие ИР при хронической болезни почек (ХБП), синтез АЛ адипоцитами стимулируется и при патологии почек. А.Ж. Карабаевой и соавт. (2009) установлено, что больные с АГ и ХБП и С/С генотипом гена АС имели более высокий уровень систолического АД (САД) и среднего АД в сравнении с генотипами Т/С и Т/Т [55]. Авторы изучали ассоциации полиморфизма гена АС с величиной КАП, степенью АГ и наличием ГЛЖ у больных АГ с V стадией ХБП, получающих программный гемодиализ. Было обследовано 84 пациента с V стадией ХБП. У 21 пациента (25 %) определен С/С генотип, у 33 (39,3 %) — С/Т генотип и у 30 (35,7 %) — Т/Т генотип. У всех пациентов, независимо от нуклеотидного полиморфизма гена АС, отмечено резкое повышение КАП. Носители С/С генотипа АС имели достоверно более высокие цифры АД, большую ММЛЖ, ИММЛЖ и самый высокий процент концентрической ГЛЖ, что сопряжено с более неблагоприятным прогнозом. Прием Сп в дозе 25 мг/сут в течение 6 месяцев приводит к уменьшению ТЗСЛЖ и ММЛЖ и уровня КАП, по-видимому, связанному с нарастанием уровня свободного циркулирующего АЛ, легко диффундирующего через диализирующую мембрану. Генный полиморфизм АС во взаимосвязи с проявлениями фокального сегментарного гломерулосклероза и признаками IgA нефропатии исследовал С. Bantis (2011) [56].
Полиморфизм гена АС может влиять на уровни глюкозы плазмы крови и глюкозный гомеостаз организма. Изучены следующие SNP полиморфизмы АС — T-344C; Lys-173/Arg; Intron 2 у 1368 лиц из китайской и японской популяций с нарушенной толерантностью к глюкозе во взаимосвязи с АС генотипом. Сходные данные получены и в более поздней работе Y.M. Li по изучению взаимосвязей полиморфизма гена АС, возникновения ЭАГ и гомеостаза глюкозы в исследовании «случай — конт–роль» в китайской популяции.
По данным [57, 58], полиморфизм 344T/C гена АС был ассоциирован с повышенной частотой ишемического мозгового инсульта (МИ), что обусловлено воспалением сосудистой стенки, дисфункцией эндотелия, ремоделированием сосудов, альдостероновыми механизмами, изменением плотности МКР. При блокаде МКР Сп отмечено снижение числа случаев МИ. Полиморфизм гена АС, объем МИ и возрастные изменения аортального пульса у лиц с АГ исследованы М. Safar (2009), ассоциацию между АС полиморфизмом и ишемическим инсультом в китайской популяции изучал С. Xan (2012), ассоциацию между АГ, МИ и полиморфизмом гена АС обнаружил А. Munshi (2010) [59].
В клинических исследованиях на протяжении ряда лет установлено участие АЛ и АС в развитии СН, в определении скорости прогрессирования данного состояния посредством усиления задержки Na+, развития гипокалиемии и т.п. По результатам A-HeFT Trial, полиморфизм промотера гена АС определяет негативные исходы у афроамериканцев с СН и может быть связан с фульминантным отеком легких S. Srivastava (2012) [60].
Уровни АЛ и полиморфизм гена АС также могут служить дифференциально-диагностическими критериями при АГ с низкой активностью ренина плазмы, при реноваскулярной и резистентной АГ, при 1-м и 2-м гиперальдостеронизме, альдостеромах, синдроме мнимого избытка минералокортикоидов, врожденной гиперплазии коры надпочечников. Описаны врожденные дефекты ферментной активности АС, недостаточность АС и альдостеронизм (артериальная гипертензия), излечиваемый глюкокортикоидами (GRA).
Терапевтические возможности использования полиморфизма гена АС
Результаты ряда исследований предоставляют противоречивые данные о степени ответа на антигипертензивную терапию (АГТ) различными препаратами первого ряда в зависимости от гаплотипа CYP11B2. Так, Х. Ji (2015) исследовал ассоциации между полиморфизмом CYP11В2 и антигипертензивным ответом на валсартан у китайцев с ЭАГ [61]. По данным Н. Yu (2008), полиморфизм конверсии интрон-2 был связан со степенью снижения диастолического АД у пациентов с ГБ, получавших ингибиторы АПФ [62]. С.А. Тихонова и соавт. (2016) изучали роль полиморфизма -344С/Т гена CYP11B2 в сочетании с традиционными факторами риска (ФР) в контроле АД у пациентов с АГ. По данным авторов, наличие Т-аллели и TТ-генотип -344С/Т CYP11B2 в сочетании с множественными ФР ассоциировалось с недостаточным контролем АД, независимо от АГТ [45]. V. Fontana (2014) изучил полиморфизм гена АС, уровень АЛ и применение блокатора МКР Сп при резистентной АГ [63]. С.М. Комиссаровой и соавт. [64] изучена эффективность комбинированного лечения лозартаном и Сп у пациентов с ГКМП, исследовался полиморфизм гена СYP11B2, ответственного за фармакодинамику Сп. Выявлено, что сочетанный прием лозартана и Сп тормозит прогрессирование диастолической дисфункции. Наибольший эффект от лечения наблюдался у большинства носителей гетерозиготных генотипов СТ и у носителей гомозиготных генотипов ТТ, тогда как у носителей генотипа СС в 70,0 % случаев наблюдалась рефрактерность к лечению. Проведение генотипирования пациентов по гену СYP11B2 до начала терапии позволит при назначении препарата учитывать генетические факторы чувствительности к нему. Y. Li (2012) изучил полиморфизм гена АС, активность РАС и ответ АД на прием гидрохлортиазида [65]. Анти-АЛ-механизм действия присущ и диуретику торасемиду [66].
В последние годы сформировалось несколько перспективных терапевтических направлений для борьбы с резистентностью АГ к лечению, новые фармакологические классы антигипертензивных препаратов (ингибиторы вазопептидаз, ингибиторы АС LCI699 фаза 2*) [67–69].
Блокаторы МКР Сп и эплеренон все чаще назначаются не только для лечения первичного ГА, но и для пациентов с резистентной АГ. Однако низкая селективность Сп к МКР часто ассоциируется с его неблагоприятными эффектами. Оба препарата могут привести к развитию гиперкалиемии, особенно у пациентов с нарушением функции почек и сахарным диабетом 2-го типа. Эплеренон как более селективный ингибитор МКР имеет меньше побочных эффектов. Однако использование антагонистов АЛ связано с реактивным увеличением плазменной концентрации АЛ, что может усилить его влияние независимо от воздействия на транскрипцию генов [63, 64].
Во избежание таких побочных эффектов и для снижения сывороточной концентрации АЛ и созданы ингибиторы альдостеронсинтазы (ИАС), представляющие собой новую терапевтическую опцию по предотвращению неблагоприятных эффектов антагонистов АЛ [69–72]. LCI699 был первым в классе перорально используемых ИАС. У 524 пациентов с первичной АГ прием 10 мг LCI699 один раз в день в течение 4 недель существенно снижал среднесуточное САД по сравнению с плацебо (р = 0,046) аналогично эффекту при приеме эплеренона 50 мг дважды в день. В настоящий момент исследования сосредоточены на высокоселективных ингибиторах АС без влияния на нормальную стимуляцию синтеза кортизола АКТГ. Проект направлен на создание нового поколения специфичных ингибиторов биосинтеза АЛ с целью применения их при комбинированной терапии АГ и ряда других ССЗ. Следующее поколение ИАС должно снижать уровень АЛ в крови, подавляя фермент, отвечающий за его синтез, — АС. Новые ингибиторы АС будут не только эффективно снижать АД, но и предотвращать развитие неблагоприятных последствий, продлевая жизнь пациентов и способствуя снижению высокого уровня общей смертности от данной патологии [73–80].
Суммируя приведенные в обзоре данные, следует считать, что ген АС представляет собой перспективный кандидатный ген в европейской и азиатской популяции не только для эссенциальной АГ, но и для ряда ассоциированных с ней сердечно-сосудистых заболеваний. Полиморфизм гена АС, несмотря на некоторую противоречивость в исследованиях, тесно связан с формированием гипертрофии ЛЖ, особенно ее концентрического типа, может отражать гиперпродукцию АЛ при АГ, ассоциированной с фибрилляцией предсердий, ИБС, патологией почек, головного мозга. Генотипирование полиморфизмов гена АС облегчает дифференциально-диагностические алгоритмы у больных с эссенциальной и вторичными формами артериальной гипертензии, при патологии надпочечников. Применение нового класса антигипертензивных препаратов — ингибиторов АС может иметь значительные перспективы. Наряду с антагонистами МКР и блокаторами РАС, с учетом уровней АЛ и генотипов АС позволит индувидуализировать терапию у лиц высокого риска и резистентностью к лечению.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Информация о вкладе каждого автора
Милославский Д.К.: систематизация литературных источников и написание обзора.
Коваль С.Н.: общее руководство работой, постановка проблематики, написание вступления и выводов.
Снегурская И.А.: поиск литературных источников, обсуждение названия и выводов.
Божко В.В.: поиск литературных источников.
Щенявская Е.Н.: оформление текста обзора и списка литературных источников.
Список литературы
1. Sun X. Relationship between -344T/C polymorphism in the aldosterone synthase gene and atrial fibrillation in patients with essential hypertension / Sun X., Yang J., Hou X. [et al.] // J. Renin Angiotensin Aldosterone Syst. — 2011. — Vol. 12(4). — Р. 557-63.
2. Sun X.J. Association of aldosterone synthase gene -344 T/C polymorphism with early renal damage in Han nationa–lity with essential hypertension / Sun X.J., Liu S.R., Zhang C.H. [et al.] // Zhonghua Yi Xue Yi Chuan Xue Za Zhi. — 2007. — Vol. 24(2). — Р. 153-6.
3. Vamsi U.M. Haplotype association and synergistic effect of human aldosterone synthase (CYP11B2) gene polymorphisms causing susceptibility to essential hypertension in Indian patients / Vamsi U.M., Swapna N., Padma G. [et al.] // Clin. Exp. Hypertens. — 2016. — Vol. 38(8). — Р. 659-665.
4. Wang L. Association between single-nucleotide polymorphisms in six hypertensive candidate genes and hypertension among northern Han Chinese individuals / Wang L., Zhang B., Li M. [et al.] // Hypertens Res. — 2014. — Vol. 37(12). — Р. 1068-74.
5. Sia S.K. Distribution and phenotypic expression of mine–ralocorticoid receptor and CYP11B2 T-344C polymorphisms in a Taiwanese hypertensive population / Sia S.K., Chiou H.L., Chen S.C. [et al.] // Mol. Biol. Rep. — 2013. — Vol. 40(5). — Р. 3705-11.
6. Whaley-Connell A. Aldosterone: role in the cardiometabolic syndrome and resistant hypertension / Whaley-Connell A., Johnson M.S., Sowers J.R. // Prog. Cardiovasc. Dis. — 2010. — Vol. 52. — P. 401-409.
7. Garg R. Aldosterone and the Mineralocorticoid Receptor: Risk Factors for Cardiometabolic Disorders / Garg R., Adler G.K. // Curr. Hypertens. Rep. — 2015. — Vol. 17(7). — P. 52. — doi: 10.1007/s11906-015-0567-8.
8. Ruhs S., Nolze A., Hübschmann R., Grossmann C. 30 years of the mineralocorticoid receptor: Nongenomic effects via the mineralocorticoid receptor // J. Endocrinol. — 2017 Jul. — № 234(1). — T107-T124. — doi: 10.1530/JOE-16-0659. Epub 2017 Mar 27. Review.
9. Schütten M.T. The Link Between Adipose Tissue Renin-Angiotensin-Aldosterone System Signaling and Obesity-Associated Hypertension / Schütten M.T., Houben A.J., de Leeuw P.W., Stehouwer C.D. // Physiology (Bethesda). — 2017. — Vol. 32(3). — P. 197-209. — doi: 10.1152/physiol.00037.2016.
10. Kawarazaki W., Fujita T. The Role of Aldosterone in Obesity-Related Hypertension // Am. J. Hypertens. — 2016 Apr. — № 29(4). — Р. 415-23. — doi: 10.1093/ajh/hpw003. Epub 2016 Feb 28. Review.
11. Hall J.E., do Carmo J.M., da Silva A.A., Wang Z., Hall M.E. Obesity-induced hypertension: interaction of neurohumoral and renal mechanisms // Circ. Res. — 2015 Mar 13. — № 116(6). — Р. 991-1006. — doi: 10.1161/CIRCRESAHA.116.305697. Review.
12. Underwood P.C., Adler G.K. The renin angiotensin aldosterone system and insulin resistance in humans // Curr. Hypertens. Rep. — 2013 Feb. — № 15(1). — Р. 59-70. — doi: 10.1007/s11906-012-0323-2. Review.
13. Alvarez-Madrazo S. Common polymorphisms in the CYP11B1 and CYP11B2 genes: evidence for a digenic influence on hypertension / Alvarez-Madrazo S., Mackenzie S.M., Davies E. [et al.] // Hypertension. — 2013. — Vol. 61(1). — Р. 232-9.
14. MacKenzie S.M. Analysis of the Aldosterone Synthase (CYP11B2) and 11β-Hydroxylase (CYP11B1) Genes / MacKenzie S.M., Davies E., Alvarez-Madrazo S. // Methods Mol. Biol. — 2017. — Vol. 1527. — P. 139-150. — doi: 10.1007/978-1-4939-6625-7-11.
15. Nejatizadeh A., Kumar R., Stobdan T. [et al.] CYP11B2 gene haplotypes independently and in concurrence with aldosterone and aldosterone to renin ratio increase the risk of hypertension / Nejatizadeh A., Kumar R., Stobdan T. [et al.] // Clin. Biochem. — 2010. — Vol. 43(1–2). — Р. 136-41.
16. Newton-Cheh C. Clinical and genetic correlates of aldosterone-to-renin ratio and relations to blood pressure in a community sample / Newton-Cheh C., Guo C.Y., Gona P. [et al.] // Hypertens. — 2007. — Vol. 49. — P. 846-856.
17. Maharjan S. Human aldosterone synthase gene polymorphism promotes miRNA binding and regulates gene expression / Maharjan S., Mopidevi B., Kaw M.K. [et al.] // Physiol. Geno–mics. — 2014. — Vol. 46(24). — Р. 860-5.
18. Ye W.J. Meta analysis on the association of CYP11B2 gene polymorphism and essential hypertension in Chinese Han population / Ye W.J., Zheng L., Wang Z.H., Chen H.H. // Zhonghua Xin Xue Guan Bing Za Zhi. — 2013. — Vol. 41(9). — Р. 795-9.
19. Niu W.Q. Genetic and functional analyses of aldosterone synthase gene C-344T polymorphism with essential hypertension / Niu W.Q., Guo S.J., Zhang Y. [et al.] // J. Hum. Hypertens. — 2010. — Vol. 24(6). — Р. 427-9.
20. Pan X.Q. Association of aldosterone synthase (CYP11B2) gene -344T/C polymorphism with essential hypertension in Mongolian nationality / Pan X.Q., Liu Y.Y., Wang L.F. [et al.] // Zhonghua Yu Fang Yi Xue Za Zhi. — 2010. — Vol. 44(9). — Р. 800-5.
21. Pan X.Q. Impact of gene-environment interaction between the C(-344)T polymorphism of CYP11B2 and drinking index on the risk of hypertension under multifactor dimensionality reduction model in Chinese Mongolian population / Pan X.Q., Liu Y.Y., Zhang X.Y. [et al.] // Zhonghua Liu Xing Bing Xue Za Zhi. — 2009. — Vol. 30(9). — Р. 955-9.
22. Pan X.Q. Interaction between the C(-344)T polymorphism of CYP11B2 and alcohol consumption on the risk of essential hypertension in a Chinese Mongolian population / Pan X.Q., Zhang Y.H., Liu Y.Y., Tong W.J. // Eur. J. Epidemiol. — 2010. — Vol. 25(11). — Р. 813-21.
23. Song Y. Influence of CYP11B2 gene polymorphism on the prevalence of hypertension and the blood pressure in Japanese men: interaction with dietary salt intake / Song Y., Miyaki K., Araki J. [et al.] // J. Nutrigenet. Nutrigenomics. — 2008. — Vol. 1(5). — Р. 252-8.
24. Blacher J. Preferential association of aldosterone synthase gene polymorphism with central blood pressure and wave reflections in hypertensive individuals / Blacher J., Kakou A., Lacombe J.M., Safar M.E. // J. Hum. Hypertens. — 2010. — Vol. 24(4). — Р. 291-9.
25. Byrd J.B., Auchus R.J., White P.C. Aldosterone Synthase Promoter Polymorphism and Cardiovascular Phenotypes in a Large, Multiethnic Population-Based Study / Byrd J.B., Auchus R.J., White P.C. // J. Investig. Med. — 2015. — Vol. 63(7). — Р. 862-6.
26. Chen B. Association of the human CYP11B2 gene and essential hypertension in southwest Han Chinese population: a haplotype-based case-control study / Chen B., Nie S., Luo S. [et al.] // Clin. Exp. Hypertens. — 2011. — Vol. 33(2). — Р. 106-12.
27. Cheng X. A systemic review of the relationship between aldosterone synthase -344 C/T polymorphism and hypertension in Han / Cheng X., Xu G. // Clin. Exp. Hypertens. — 2010. — Vol. 32(5). — Р. 301-7.
28. Chou C.H. Relationship of Genetic Polymorphisms of Aldosterone Synthase Gene Cytochrome P450 11B2 and Mine–ralocorticoid Receptors with Coronary Artery Disease in Taiwan / Chou C.H., Ueng K.C., Yang S.F. [et al.] // Int. J. Med. Sci. — 2016. — Vol. 13(2). — Р. 117-23.
29. Li W. The -344C/T polymorphism in the CYP11B2 gene is associated with essential hypertension in the Chinese / Li W., Liu C. // J. Renin Angiotensin Aldosterone Syst. — 2014. — Vol. 15(2). — Р. 150-5.
30. Li X. CYP11B2 gene polymorphism and essential hypertension among Tibetan, Dongxiang and Han populations from northwest of China / Li X., Xie P., He J. [et al.] // Clin. Exp. Hypertens. — 2016. — Vol. 38(4). — Р. 375-80.
31. Rajan S. Association of aldosterone synthase (CYP11B2 C-344T) gene polymorphism & amp. — Vol. susceptibility to essential hypertension in a south Indian Tamil population / Rajan S., Ramu P., Umamaheswaran G., Adithan C. // Indian J. Med. Res. — 2010. — Vol. 132. — Р. 379-85.
32. Hlubocká Z. Association of the -344T/C aldosterone synthase gene variant with essential hypertension / Hlubock Z., Jáchymová M., Heller S. [et al.] // Physiol. Res. — 2009. — Vol. 58(6). — Р. 785-92.
33. Гуров Э.В. Роль полиморфного маркера -344T/C гена альдостеронсинтазы в генетической предрасположенности жителей Карелии к сердечно-сосудистым заболеваниям / Гуров Э.В., Топчиева Л.В., Коломейчук С.Н. [и др.] // Медицинская генетика. — 2011. — № 5(107).
34. Gamra Hamad Dweihi Al-Qahtani. Prevalence of Aldosterone Synthase Gene Polymorphisms in Saudi Hypertensive Patients // In Partial Fulfillment of the Requirement for the Master’s Degree in Pharmacology at The Department of Pharmacology College of Pharmacy. — King Saud University, 2009. — Р. 52.
35. Russo P. Agе- and gender-dependent association of the -344C/T polymorphism of CYP11B2 with blood pressure in European populations / Russo P., Loguercio M., Lauria F. [et al.]; European Collaborative Group of the IMMIDIET Project // J. Hum. Hypertens. — 2007. — Vol. 21(4). — Р. 333-6.
36. Павлова О.С. Полиморфизм С(-344)Т гена альдостеронсинтазы и эссенциальная артериальная гипертензия / Павлова О.С., Огурцова С.Э., Ливенцева М.М. [и др.] // Евразийский кардиологический журнал. — 2016. — № 4. — С. 42-47.
37. Patnaik M. Aldosterone synthase C-344T, angiotensin II type 1 receptor A1166C and 11-β hydroxysteroid dehydrogenase G534A gene polymorphisms and essential hypertension in the population of Odisha, India / Patnaik M., Pati P., Swain S.N. [et al.] // J. Genet. — 2014. — Vol. 93(3). — Р. 799-808.
38. Долженко М.М. Вплив поліморфізму гена альдостеронсинтази (CYP11B2) на серцево-судинну систему / Дол–женко М.М., Лобач Л.Є., Поташев С.В. // Український кардіологічний журнал. — 2015. — № 5. — С. 104-109.
39. Sookoian S. Role of the C-344T aldosterone synthase gene variant in left ventricular mass and left ventricular structure-related phenotypes / Sookoian S., Gianotti T.F., Pirola C.J. // Heart. — 2008. — Vol. 94(7). — Р. 903-10.
40. Kurbanova D. Genetic background of left ventricular hypertrophy in Uzbek hypertensive men / Kurbanova D., Eliseyeva M. // Turk Kardiyol. Dern. Ars. — 2010. — Vol. 38(7). — Р. 466-72.
41. Khamidullaeva G.A. Specifics of distribution of polymorphic markers of the renin-angiotensin-system genes, relation to ventricular hypertrophy in patients with essential hypertension of Uzbek nationality / Khamidullaeva G.A., Eliseeva M.R., Srozhiddinova N.Z., Abdullaeva G.Zh. // Kardiologiia. — 2007. — Vol. 47(4). — Р. 54-8.
42. Wang L. Association of echocardiographic left ventricular structure and -344C/T aldosterone synthase gene variant: A meta-analysis / Wang L., Zhou J., Zhang B. [et al.] // J. Renin Angiotensin Aldosterone Syst. — 2015. — Vol. 16(4). — Р. 858-71.
43. Яхонтов Д.А. Полиморфизм гена альдостеронсинтазы у больных артериальной гипертензией в сочетании с ишемической болезнью сердца при различной массе миокарда левого желудочка / Яхонтов Д.А., Деришева Д.А., Гуляева Л.Ф. // Системные гипертензии. — 2014. — № 1. — С. 16-20.
44. Деришева Д.А. Поражение коронарного русла и полиморфизм гена альдостеронсинтазы у больных ишемической болезнью сердца в сочетании с артериальной гипертензией при различной массе миокарда левого желудочка / Деришева Д.А. // Врач-аспирант. — 2013. — Т. 61, № 6.2. — С. 312-319.
45. Тихонова С.А. Аналіз клінічних, генетичних і гендерних детермінант неефективного лікування в пацієнтів з артеріальною гіпертензією / Тихонова С.А. // Артеріальна гіпертензія. — 2016. — № 3. — С. 98-100.
46. Lacchini R. T allele of -344 C/T polymorphism in aldosterone synthase gene is not associated with resistant hypertension / Lacchini R., Sabha M., Coeli F.B. [et al.] // Hypertens. Res. — 2009. — Vol. 32(2). — Р. 159-62.
47. Baird T.E. Association of the aldosterone synthase gene C-344T polymorphism with risk factors and survival in a post-myocardial infarction cohort / Baird T.E., Palmer B.R., Frampton C.M. [et al.] // J. Hum. Hypertens. — 2007. — Vol. 21(3). — Р. 256-8.
48. Normaznah Y. CYP11B2 gene polymorphism among coronary heart disease patients and blood donors in Malaysia / Normaznah Y., Azizah M.R., Kuak S.H., Rosli M.A. // Malays J. Pathol. — 2015. — Vol. 37(1). — Р. 45-7.
49. Boduła A. The role of the -344C/T polymorphism of the aldosterone synthase gene (CYP11B2) in cardiovascular disea–ses / Boduła A., Dołyk A., Protasiewicz J., Adamiec R. // Postepy Hig. Med. Dosw. (Online). — 2007. — Vol. 61. — Р. 838-47.
50. Cao F.F. Associations of the genetic polymorphisms in CYP11B2 gene with nonfamilial structural atrial fibrillation / Cao F.F., Chen X.D., Wang Q.S. [et al.] // Zhonghua Liu Xing Bing Xue Za Zhi. — 2009 . — Vol. 30(10). — Р. 1069-72.
51. Fu X., Ma X., Zhong L., Song Z. Relationship between CYP11B2-344T>. — Vol. C polymorphsim and atrial fibrillation: A meta-analysis / Fu X., Ma X., Zhong L., Song Z. // J. Renin Angiotensin Aldosterone Syst. — 2015. — Vol. 16(1). — Р. 185-8.
52. Huang M. Functional polymorphisms in ACE and CYP11B2 genes and atrial fibrillation in patients with hypertensive heart disease / Huang M., Gai X., Yang X. [et al.] // Clin. Chem. Lab. Med. — 2009. — Vol. 47(1). — Р. 32-7.
53. Яцкевич Е.С. Ассоциация полиморфизма -С/344Т гена альдостеронсинтазы (CYP11B2) с гипертрофией левого желудочка и уровнем альдостеронсинтазы плазмы у пациентов с неклапанной фибрилляцией предсердий / Е.С. Яцкевич, В.А. Снежицкий // Медицинский журнал. — 2015. — № 2. — С. 118-123.
54. Яцкевич Е.С. Взаимосвязь структурно-функционального ремоделирования предсердий с уровнем гомоцистеина, пролина, глицина и полиморфизмом С-344/Т гена альдостеронсинтазы у пациентов с фибрилляцией предсердий: Автореф. дис... канд. мед. наук: 14.01.05 / Яцкевич Е.С. — Гродно, 2015.
55. Карабаева А.Ж. Ассоциация полиморфизма гена альдостеронсинтазы с концентрацией альдостерона плазмы, артериальной гипертензией и ремоделированием миокарда у больных на программном гемодиализе / Карабаева А.Ж., Есаян A.M., Каюков И.Г. // Нефрология. — 2007. — Т. 11, № 3. — С. 48-52.
56. Bantis C. Influence of aldosterone synthase gene C-344T polymorphism on focal segmental glomerulosclerosis / Bantis C., Heering P.J., Stangou M. [et al.] // Nephrology (Carlton). — 2011. — Vol. 16(8). — Р. 730-5.
57. Saidi S. Aldosterone synthase gene (CYP11B2) promoter polymorphism as a risk factor for ischaemic stroke in Tunisian Arabs / Saidi S., Mahjoub T., Almawi W.Y. // J. Renin Angiotensin Aldosterone Syst. — 2010. — Vol. 11(3). — Р. 180-6.
58. Yan G. Association of CYP11B2 gene polymorphism with ischemic stroke in the north Chinese Han population / Yan G., Wang Y. // Neurol. India. — 2012. — Vol. 60(5). — Р. 504-9.
59. Munshi A. Association of the -344C/T aldosterone synthase (CYP11B2) gene variant with hypertension and stroke / Munshi A., Sharma V., Kaul S. [et al.] // Mol. Biol. Rep. — 2012. — Vol. 39(2). — P. 1677-82. — doi: 10.1007/s11033-011-0907-y.
60. Srivastava S. Association of polymorphisms in angiotensin and aldosterone synthase genes of the renin-angiotensin-aldosterone system with high-altitude pulmonary edema / Srivastava S., Bhagi S., Kumari B. [et al.] // J. Renin Angiotensin Aldosterone Syst. — 2012. — Vol. 13(1). — Р. 155-60.
61. Ji X. Associations between human aldosterone synthase CYP11B2 (-344T/C) gene polymorphism and antihypertensive response to valsartan in Chinese patients with essential hypertension / Ji X., Qi H., Li D.B. [et al.] // Int. J. Clin. Exp. Med. — 2015. — Vol. 8(1). — Р. 1173-7.
62. Yu H., Lin S., Zhang Y., Liu G. Intron-2 conversion polymorphism of the aldosterone synthase gene and the antihypertensive response to angiotensin-converting enzyme inhibitors / Yu H., Lin S., Zhang Y., Liu G. // J. Hypertens. — 2008. — Vol. 26(2). — Р. 251-6.
63. Fontana V. Modulation of aldosterone levels by -344 C/T CYP11B2 polymorphism and spironolactone use in resistant hypertension / Fontana V., de Faria A.P., Barbaro N.R. [et al.] // J. Am. Soc. Hypertens. — 2014. — Vol. 8(3). — Р. 146-51.
64. Комиссарова С.М. Применение лозартана и его комбинации со спиронолактоном у пациентов с гипертрофической кардиомиопатией и влияние полиморфизма гена альдостеронсинтазы на эффективность комбинированной терапии / Комиссарова С.М., Чакова Н.Н., –Ниязова С.С. [и др.] // Кардиология в Беларуси. — 2014. — № 2. — С. 139-150.
65. Li Y. Interaction of ACE and CYP11B2 genes on blood pressure response to hydrochlorothiazide in Han Chinese hypertensive patients / Li Y., Zhou Y., Yang P. [et al.] // Clin. Exp. Hypertens. — 2011. — Vol. 33(3). — Р. 141-6.
66. Adam O. Inhibition of aldosterone synthase (CYP11B2) by torasemide prevents atrial fibrosis and atrial fibrillation in mice / Adam O., Zimmer C., Hanke N. [et al.] // J. Mol. Cell. Cardiol. — 2015. — Vol. 85. — Р. 140-50.
67. Кобалава Ж.Д. Перспективы лечения артериальной гипертонии / Кобалава Ж.Д., Котовская Ю.В., Виллевальде С.В. [и др.] // Артериальная гипертензия. — 2013. — Т. 19, № 4. — С. 280-28.
68. Oparil S. New approaches in the treatment of hypertension / Oparil S., Schmieder R.E. // Circ. Res. — 2015. — Vol. 116(6). — Р. 1074-95.
69. Andersen K. Aldosterone synthase inhibition in hypertension / Andersen K. // Curr. Hypertens Rep. — 2013. — Vol. 15(5). — Р. 484-8.
70. Martin R.E. Synthesis of annulated pyridines as inhibitors of aldosterone synthase (CYP11B2) / Martin R.E., Lehmann J., Alzieu T. [et al.] // Org. Biomol. Chem. — 2016. — Vol. 14(25). — Р. 5922-7.
71. Namsolleck P. Aldosterone synthase inhibitors in cardiovascular and renal diseases / Namsolleck P., Unger T. // Nephrol. Dial. Transplant. — 2014. — Vol. 29(Suppl. 1). — P. i62-i68.
72. Blass B. Aldosterone synthase inhibitors / Blass B. // ACS Med. Chem. Lett. — 2013. — Vol. 4(4). — Р. 375-6.
73. Cerny M.A. Progress towards clinically useful aldosterone synthase inhibitors / Cerny M.A. // Curr. Top. Med. Chem. — 2013. — Vol. 13(12). — Р. 1385-401.
74. Gromotowicz-Poplawska A. New agents modula–ting the renin-angiotensin-aldosterone system-Will there be a new therapeutic option? / Gromotowicz-Poplawska A., Szoka P., Kolodziejczyk P. [et al.] // Exp. Biol. Med. (Maywood). — 2016. — Vol. 241(17). — Р. 1888-1899.
75. Hargovan M. Aldosterone synthase inhibitors in hypertension: current status and future possibilities / Hargovan M., Ferro A. // JRSM Cardiovasc. Dis. — 2014. — Vol. 3. — 2048004014522440.
76. Hoyt S.B. Discovery of indazole aldosterone synthase (CYP11B2) inhibitors as potential treatments for hypertension / Hoyt S.B., Taylor J., London C. [et al.] // Bioorg. Med. Chem. Lett. — 2017. — Vol. 27(11). — Р. 2384-2388.
77. Hu Q. Novel pyridyl substituted 4,5-dihydro-[1,2,4]triazolo[4,3-a]quinolines as potent and selective aldosterone synthase inhibitors with improved in vitro metabolic stability / Hu Q., Yin L., Ali A. [et al.] // J. Med. Chem. — 2015. — Vol. 58(5). — Р. 2530-7.
78. Petrilli W.L. Discovery of Spirocyclic Aldosterone Synthase Inhibitors as Potential Treatments for Resistant Hypertension / Petrilli W.L., Hoyt S.B., London C. [et al.] // ACS Med. Chem. Lett. — 2016. — Vol. 8(1). — Р. 128-132.
79. Schumacher C.D. Aldosterone synthase inhibition for the treatment of hypertension and the derived mechanistic requirements for a new therapeutic strategy / Schumac–her C.D., Steele R.E., Brunner H.R. // J. Hypertens. — 2013. — Vol. 31(10). — Р. 2085-93.
80. Whitehead B.R. Imidazopyridyl compounds as aldosterone synthase inhibitors / Whitehead B.R., Lo M.M., Ali A. [et al.] // Bioorg. Med. Chem. Lett. — 2017. — Vol. 27(2). — Р. 143-146.