Газета «Новости медицины и фармации» Акушерство и гинекология (620) 2017 (тематический номер)
Вернуться к номеру
Используемые в практике и перспективные информативные маркеры системы гемостаза в процедуре экстракорпорального оплодотворения
Авторы: Мельник А.А., к.б.н.,
руководитель проекта специализированного медицинского центра «Оптима Фарм», г. Киев, Украина
Рубрики: Акушерство и гинекология
Разделы: Справочник специалиста
Версия для печати
Проблема бесплодия на сегодняшний день является актуальной во всем мире. Согласно мировой статистике, эффективность процедуры с использованием экстракорпорального оплодотворения (ЭКО) варьирует от 20 до 35 % [1]. Основными причинами неудачного ЭКО считаются гормональные сбои, снижение овариального резерва, заболевания маточных труб, недостаточная реакция яичников на стимуляцию овуляции, низкое качество полученных эмбрионов, аутоиммунные факторы, возраст матери, патология эндометрия, высокий индекс массы тела, ожирение, инфекции и др. В последние годы в отдельную группу причин репродуктивных потерь выделены нарушения в системе гемостаза.
В изучении патогенеза осложнений беременности при использовании ЭКО большое внимание уделяют гиперкоагуляции, обусловленной как тромбофилией, так и нарушением отдельных звеньев системы гемостаза, что приводит к повышенному риску тромботических осложнений [2–6].
После процедуры ЭКО в связи с применением массивной гормональной терапии на всех этапах программы процесс имплантации наиболее уязвим, что характеризуется активацией факторов свертывающей системы крови. Гормональная терапия является пусковым механизмом активации как аутоиммунных процессов, вирусно-бактериальных инфекций, так и тромбофилических состояний. Высокая концентрация стероидных гормонов в плазме крови в программе стимуляции суперовуляции на фоне различной сопутствующей экстрагенитальной патологии ведет к гиперкоагуляции, нарушению микроциркуляции и формированию микротромбозов с локализацией прежде всего в эндометрии, что может оказывать влияние на эффективность ЭКО и исход индуцированных беременностей. В связи с тем, что использование процедуры ЭКО связано с повышенным риском тромботических осложнений, важными являются проведение оценки риска тромбообразования у женщин, планирующих лечение бесплодия методом ЭКО, а также дальнейшее применение тромбопрофилактики при выявлении факторов риска тромбообразования [7].
Гормональная стимуляция овуляции оказывает влияние на систему гемостаза и может приводить к развитию тромбофилии (генетически обусловленной), антифосфолипидному синдрому (приобретенному), снижению протеина С и S, антитромбина III, повышению уровня фибриногена, фактора фон Виллебранда, фактора VIII, фрагментов протромбина 1 + 2, D-димера.
Тромбофилии
Осложнения в акушерской практике, связанные с тромбофилией, заключаются в том, что снижается глубина инвазии трофобласта и имплантация становится неполноценной. Это приводит к эндотелиопатии и является причиной бесплодия и ранних предэмбриональных потерь. Новая эра в понимании этиологии и патогенеза бесплодия и неудач ЭКО началась с открытия новых наиболее часто встречающихся в общей популяции генетических дефектов гемостаза тромбофилического характера, а также с установления роли тромбофилии в патологии процессов имплантации плодного яйца, плацентации и более поздних нарушениях маточно-плацентарной перфузии.
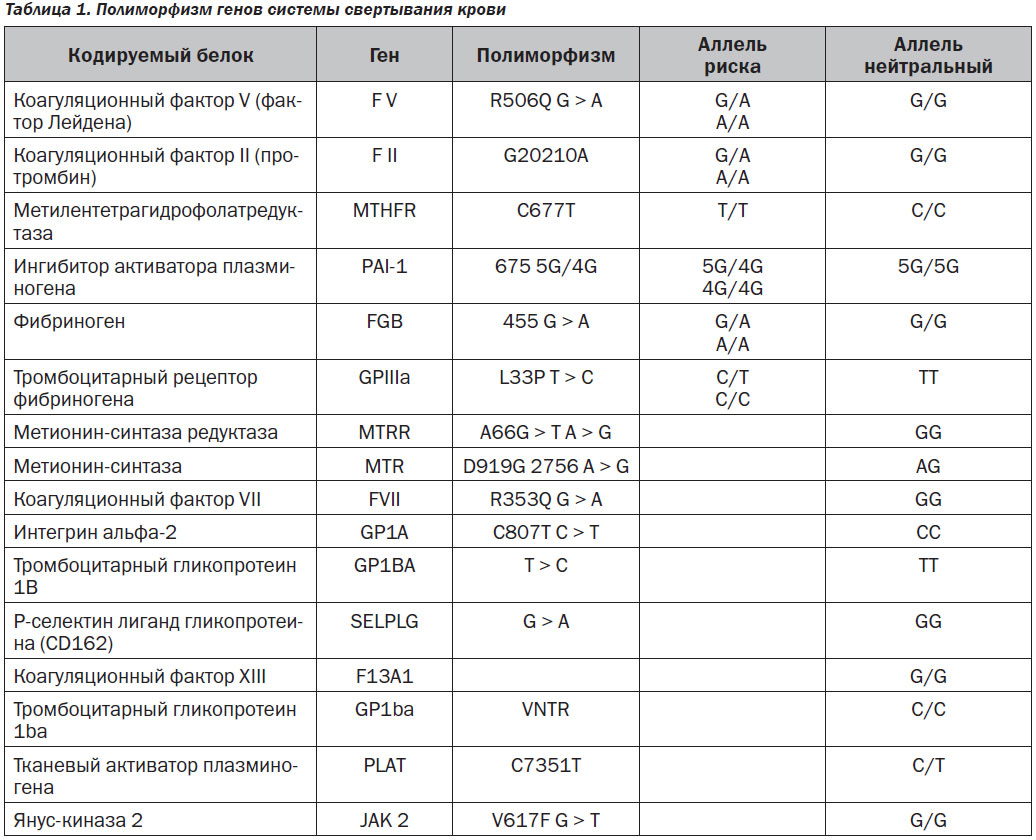
В настоящее время стало возможным объяснение случаев тромботических осложнений в связи с открытием ряда ранее неизвестных дефектов гемостаза, предрасполагающих к тромбозу, имеющее высокое прогностическое значение. Прежде всего это касается полиморфизма генов системы гемостаза (табл. 1).
К наиболее изученным и распространенным тромбофилиям относятся генетические тромбофилии — мутация фактора V Лейдена, мутация протромбина G20210A, мутация метилентетрагидрофолатредуктазы (MTHFR), ингибитор активатора плазминогена (PAI-1),
фибриноген.
1. Мутация гена фактора V (F V) (мутация Лейдена)
В результате мутации гена фактора V, известной как мутация Лейдена, происходит замена нуклеотида гуанин на нуклеотид аденин (G-- > A в положении 1691 гена), что приводит к замещению аминокислоты аргинин в положении 506 на аминокислоту глицин (Arg-506-- > Gln) в полипептидной цепи фактора V. При этом полипептид утрачивает один из сайтов расщепления активированного протеина С (AПC), что приводит к формированию фенотипа AПС-резистент-
ности, сопровождаемого повышенной свертываемостью крови.
В ряде работ была показана более высокая распространенность лейденской мутации у пациенток с бесплодием и неэффективными попытками ЭКО [9, 17]. Вместе с тем статистически значимой ассоциации между лейденской мутацией и неудачами ЭКО не установлено. Возможно, это объясняется малым количеством наблюдений [10].
Парадоксальным образом у носителей лейденской мутации частота успеха подсадок зародышей при ЭКО примерно в 2 раза выше, чем среди пациенток, не являющихся носителями данной мутации [9]. Эти любопытные данные указывают на то, что, несмотря на повышенную вероятность развития осложнений, фертильность пациенток с лейденской мутацией (вероятность наступления беременности в каждом цикле) может быть выше. По мнению З.С. Ходжаевой [18], парадоксальный «протективный» эффект генетических дефектов гемостаза при успехе беременности связан с физиологически необходимой гипоксией на ранних сроках, так как избыточное поступление кислорода может оказывать повреждающее влияние на эмбриональном этапе развития. Другой причиной может быть необходимость гиперкоагуляции непосредственно в момент инвазии. Эффективное тромбирование сосудов в месте имплантации является важным условием успеха самых первых этапов взаимодействия зародыша со слизистой оболочкой матки. Именно поэтому избыточная гипокоагуляция не рекомендуется в дни подсадки зародышей и в предполагаемые дни имплантации при лечении нарушений репродуктивной функции, связанных с тромбофилией [19].
2. Мутация гена фактора II (F II) (протромбина)
Мутация гена протромбина G20210A характеризуется заменой нуклеотида гуанина на нуклеотид аденин в позиции 20210. При наличии данной мутации обнаруживаются повышенные количества химически нормального протромбина. Уровень протромбина может быть в 1,5–2 раза выше, чем в норме. Мутация G20210A — вторая по частоте причина повышенного риска тромбообразования, обу-словленного генетическими нарушениями. Риск развития тромбоэмболии при наличии этой мутации возрастает в 3 раза.
3. Мутация метилентетрагидрофолатредуктазы (MTHFR)
MTHFR — фермент, принимающий участие в метаболизме фолиевой кислоты, которая играет важную роль в оплодотворении и эмбриональном развитии. Полиморфизм гена MTHFR (C677 > T) вызывает увеличение уровня гомоцистеина в крови (> 15 мкмоль/л), что влияет на репродуктивную функцию. Ген MTHFR локализован на хромосоме 1р36.3. Наиболее изученной мутацией является вариант, в котором нуклеотид цитозин (C) в позиции 677 заменен тимидином (T), что приводит к замене аминокислотного остатка аланина на остаток валина (позиция 222) в сайте связывания фолата. Такой полиморфизм MTHFR обозначается как мутация C677T.
Дефицит фолатов и гипергомоцистеинемию связывают с нарушением деления клеток, увеличением продукции воспалительных цитокинов, усилением реакций оксидативного стресса и апоптоза, что может влиять на развитие ооцитов, формирование рецептивности эндометрия и имплантации. Дефицит MTHFR способствует не только тератогенному (повреждающему плод), но и мутагенному (повреждающему ДНК) действию. В работе Boxmeer и соавт. [24] было показано, что при высоком уровне гомоцистеина в фолликулярной жидкости наблюдались более низкое качество эмбрионов и снижение частоты имплантации в программах ЭКО [24].
4. Мутация ингибитора активатора плазминогена (PAI-1)
Этот белок, известный также как SERPINE1, —один из основных компонентов тромболитической плазминоген-плазминовой системы. PAI-1 ингибирует тканевой и урокиназный активаторы плазминогена. Наряду с регуляцией фибринолиза PAI-1 участвует в протеолитическом каскаде, вовлеченном в физиологические и патологические процессы инвазии и ремоделирования тканей. Чрезмерно высокий уровень PAI-1 в эндометрии связывают со снижением глубины инвазии трофобласта и снижением вероятности имплантации при ЭКО.
5. Мутация гена фибриногена (FGB)
Ген FGB кодирует бета-полипептидную цепь белка фибриногена, растворимого белка плазмы крови, который относится к группе глобулинов (фактор I свертывания крови). Под действием фермента тромбина этот белок способен превращаться в фибрин. Участок ДНК в регуляторной области гена FGB, в котором происходит замена гуанина (G) на аденин (А) в позиции 455, обозначается как генетический маркер G(-455)A. Наличие замены влияет на интенсивность синтеза белка фибриногена.
По мнению большинства ученых, единичные генетические маркеры предрасположенности к тромбофилии не так значимы для нарушения имплантации. Более важно сочетание нескольких факторов при проведении программы ЭКО [20, 21].
Антифосфолипидный синдром
В многочисленных исследованиях был показан повышенный уровень антифосфолипидных антител (АФА) у женщин с бесплодием. Важным фактором, влияющим на результаты ЭКО, является антифосфолипидный синдром (АФС), диагностированный у каждой третьей пациентки с ЭКО, не завершившимся развитием беременности [11]. При АФС отмечается циркуляция в крови антител, иммуноглобулинов класса М, G, А к фосфолипидным детерминантам клеточных мембран. Эти антитела самостоятельно или при образовании комплексов с другими белками плазмы — так называемыми кофакторами: β2-гликопротеином 1, аннексином V, протромбином и др. — способны повреждать мембраны эндотелия, нарушая баланс в звене естественных антикоагулянтов и ингибиторов свертывания и провоцировать тромбофилическую ситуацию. Достаточно часто (15–48 %) антитела к фосфолипидам выявляются у женщин с искусственным оплодотворением, которые влияют на исход ЭКО [14, 15]. Согласно данным литературы [12, 13], гибель эмбриона/плода без лечения у женщин с АФА составляет 80–95 %.
Влияние циркулирующих антифосфолипидных антител в ЭКО проявляется в следующем:
— усиливают протромботические механизмы, десинхронизируют процессы фибринолиза;
— могут изменять поверхностные предимплантационные характеристики плодного яйца (заряд и конфигурацию);
— блокируют продукцию трофобластом хорионического гонадотропина человека (ХГЧ) и проявляют эндокринные эффекты;
— задерживают дифференцировку цитотрофобласта в синцитиотрофобласт;
— повышают экспрессию ингибитора активатора плазминогена 1 (PAI-1) и тканевого фактора (TF), что усиливает протромботические механизмы и снижает активность фибринолиза, что, в свою очередь, приводит к дефектам имплантации и снижению глубины децидуальной инвазии трофобласта.
Гистологические исследования плаценты пациенток с АФС демонстрируют несомненную роль тромбообразования в патогенезе потерь плода: тромбоз спиральных сосудов, избыточное отложение фибрина на поверхности трофобласта и в межворсинчатом пространстве, тромбоз основных сосудов плода и хориона.
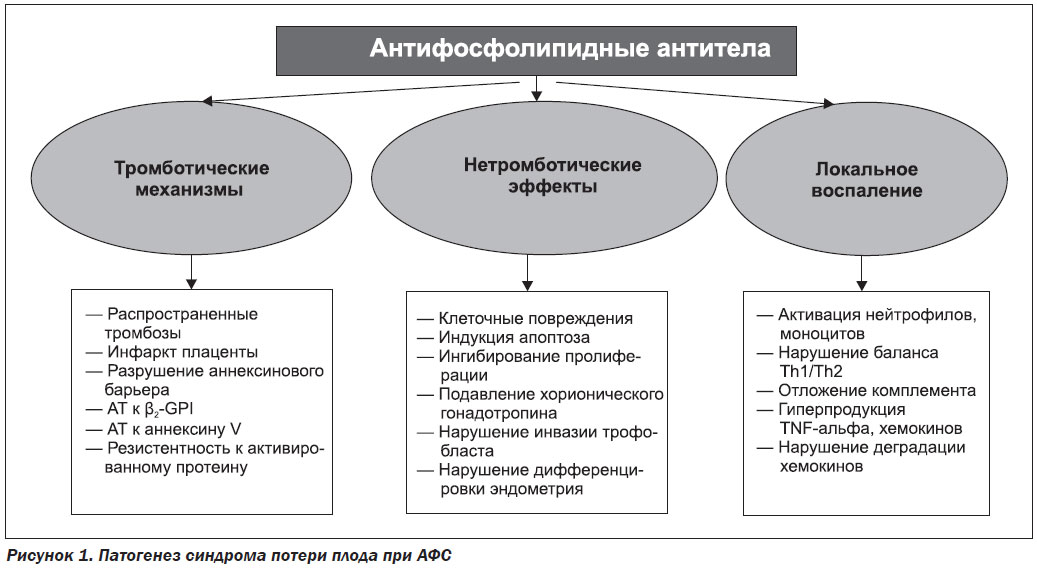
Тромботическая составляющая АФС является следствием тяжелого поражения естественных антикоагулянтных механизмов системы гемостаза, когда отмечается «тройной удар» на важнейшие антикоагулянтные системы — АТIII, протеин С, системы фибринолиза и активации коагуляции (рис. 1).
Анализ литературы свидетельствует о неоднозначности мнения ученых относительно роли полиморфизмов генов, мутаций и антифосфолипидного синдрома в развитии бесплодия и неудач в программах ЭКО. Нет прямой связи между генетической предрасположенностью и развитием тромбоза. Можно ожидать высокой вероятности развития тромбоза, но когда и в какой мере — прогнозировать невозможно.
Учитывая данные факты, Американская ассоциация по репродуктивной медицине (American Society of Reproductive Medicine, 2008) не считает нужным обследование на выявление различных форм тромбофилии у женщин, проходящих лечение в программах ЭКО [22]. Однако мнение Американской ассоциации по репродуктивной иммунологии (American Society for Reproductive Immunology) в этом вопросе является противоположным [23].
Перспективные информативные маркеры системы гемостаза
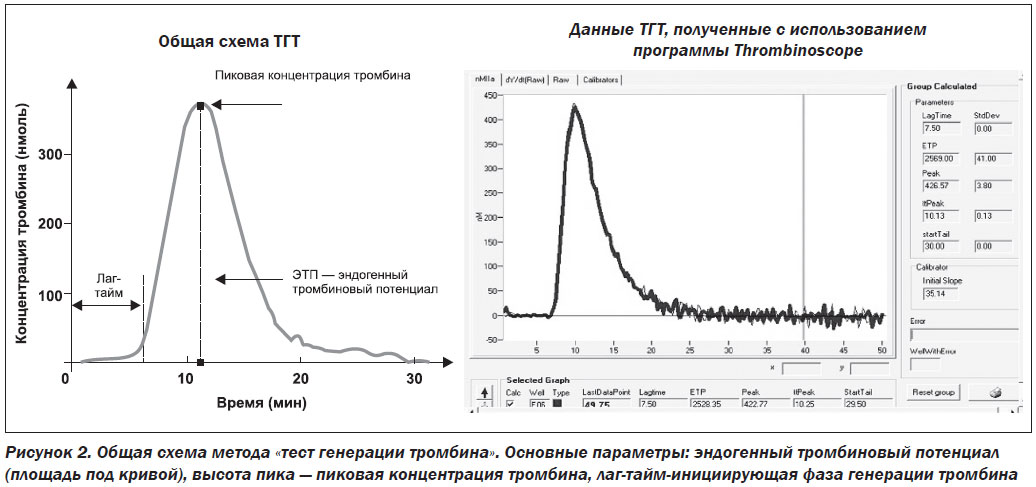
I. Тест генерации тромбина — глобальный тест исследования гемостаза
Некоторые ученые [25–27] считают, что связь между тромбофилиями (наследственными, приобретенными) и неудачами ЭКО существует. Перспективным подходом в этой области является мониторирование результатов так называемых глобальных тестов исследования гемостаза. С этой точки зрения заслуживает внимания тест генерации тромбина (ТГТ), который характеризует динамику и интенсивность образования тромбина в плазме крови — ключевого фермента гемостаза. В 2012 г. E. Westerlund и соавт. [28] опубликовали важные данные об особенностях ТГТ во время прохождения процедуры ЭКО. В данном исследовании был использован метод для определения ТГТ, предложенный Hemker и соавт. [29] (рис. 2).
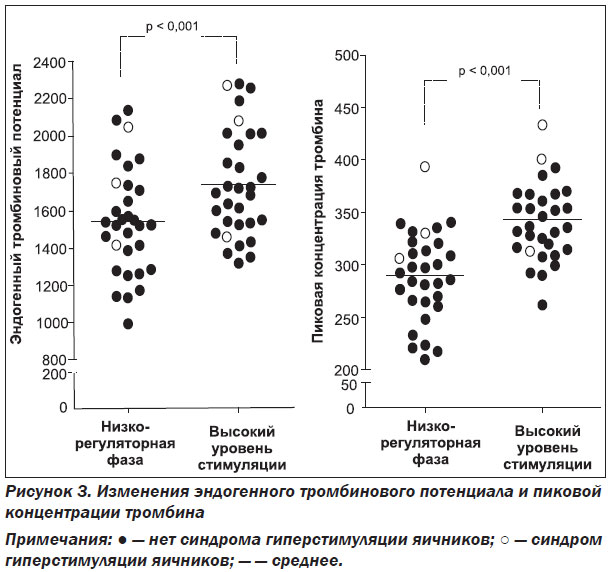
Результаты работы E. Westerlund [28] показали, что увеличение циркулирующих эстрогенов в программе ЭКО приводит к сдвигу в гемостатическом равновесии в сторону гиперкоагуляции. Это изменение может способствовать повышенному риску тромбоэмболических осложнений. Генерация тромбина повышается при ЭКО, что приводит к увеличению эндогенного тромбинового потенциала (ЭТП) и пиковой концентрации тромбина (рис. 3). Аналогичную картину наблюдали в других исследованиях, когда эти параметры были проанализированы в отношении повышенных уровней эстрогена во время нормальной беременности [30], при преэклампсии [31] и использовании пероральных контрацептивов [32].
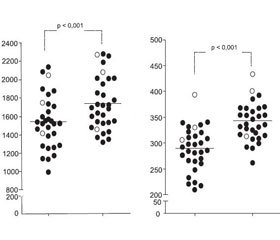
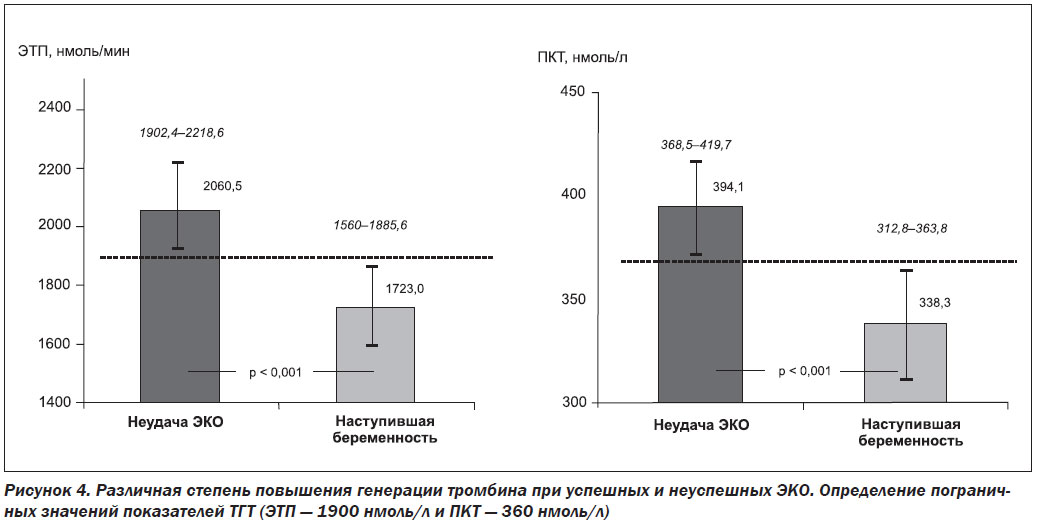
В работе А.П. Момот и соавт. [25] установлено, что степень повышения генерации тромбина различна при успешных и неуспешных исходах ЭКО. В частности, величина таких показателей, как ЭТП и пиковая концентрация тромбина (ПКТ), была выше в случае неудачи ЭКО по сравнению с аналогичными данными у пациенток с наступившей беременностью (рис. 4). С учетом полученных результатов авторы считают границей значений для положительного решения вопроса о проведении гепаринопрофилактики следующие критерии: величина ЭТП более 1900 нмоль/мин и/или увеличение показателя ПКТ более 360 нмоль/л. Коррекция системы гемостаза при избыточной генерации тромбина предусматривала в данной работе проведение гепаринопрофилактики путем введения фраксипарина подкожно по 0,3 мл 2 раза в сутки на протяжении 12–14 дней. При этом обоснованное назначение низкомолекулярного гепарина при высокой генерации тромбина способствовало увеличению числа случаев наступления беременности в 6,4 раза.
II. Индекс активирующей фибринолиз способности эндотелия (АФСЭ)
Коррекция гипофибринолиза при ЭКО представляет определенные трудности, так как в литературе нет описания успешного применения соответствующей лекарственной терапии. Однако известно, что такие стимулы, как венозная окклюзия, физическая нагрузка, десмопрессин, вызывают ускорение фибринолитических реакций, обусловленных быстрым увеличением активности t-PA в крови.
По данным ряда авторов [33, 34], эффект перемежающей пневматической компрессии (ППК) повышает фибринолитическую активность крови и t-PA после механического воздействия на сосуды.
Исходя из того, что важными участниками фибринолитических реакций являются тканевый активатор плазминогена (t-PA) и ингибитор активатора плазминогена (PAI-1), которые являются антагонистами по отношению друг к другу и имеют общее происхождение (эндотелий кровеносных сосудов), было предложено использовать расчетный индекс активирующей фибринолиз способности эндотелия (индекс АФСЭ) по формуле [25]:
Именно соотношение активности этих важнейших участников фибринолитической системы определяет ее эффективность в целом.
Расчетный показатель индекса АФСЭ, учитывающий соотношение активности t-PA и PAI-1, составляет 11 %. Основанием для начала терапии ППК является снижение индекса АФСЭ ниже 11 %. При изолированном применении ППК индекс АФСЭ увеличился в 2 раза, что способствовало увеличению числа случаев беременности в 3 раза [25].
Таким образом, в настоящее время установлено, что, кроме общепринятых тестов, используемых для улучшения результатов ЭКО (исследования тромбофилии (наследственной и приобретенной), природных антикоагулянтов, некоторых факторов свертывания, D-димера и др.), существуют новые возможности на основе выявления и коррекции патологии гемостаза и фибринолиза с применением теста генерации тромбина и расчетного индекса АФСЭ. В ближайшее время ТГТ и АФСЭ могут послужить основой для выработки новых рекомендаций и стандартов, позволяющих улучшить эффективность современных репродуктивных технологий.
Список литературы
1. Macklon N.S., Stouffer R.L., Giudice L.C., Fauser B.C. The science behind 25 years of ovarian stimulation for in vitro fertilization // Endocr. Rev. — 2006. — 27. — 170-207.
2. Момот А.П. Невынашивание беременности и генетически обусловленные тромбофилии / А.П. Момот, В.А. Гурьева, Г.В. Сердюк и др. // Вестник Российского университета дружбы народов. — 2009. — № 6. — C. 379-385.
3. Степанова А.А. Современные подходы к ведению беременных с тромбофилиями: Автореф. дис… канд. мед. наук: 14.00.01/Степанова Анастасия Анатольевна. — Омск, 2009. — 21 с.
4. Стрельченко М.Б. Особенности течения беременности после ЭКО и ПЭ: Автореф. дис... канд. мед. наук: 14.00.01/Стрельченко Марианна Борисовна. — М., 2002. — 23 с.
5. Зайнулина М.С. Тромбофилии в акушерской практике: Методические рекомендации / М.С. Зайнулина. — СПб.: Изд-во Н-Л, 2009. — 53 с.
6. Brenner B. Thrombophilia and adverse pregnancy outcome / B. Brenner // Obstet. Gynecol. Clin. North Am. — 2006. — Vol. 33, № 3. — P. 443-456.
7. Bates S.M., Greer I.A., Middeldorp S. et al. VTE, thrombophilia, antithrombotic therapy, and pregnancy: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed.: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines // Chest. — 2012. — Vol. 141, Suppl. 2. — P. 691-736.
8. Ricci G. с соавт. Мутации фактора V Лейдена и гена протромбина G20210A и ЭКО: проспективное когортное исследование // Hum. Repr. — 2011. — Т. 26. — С. 3068-77.
9. Gopel W., Ludwig M., Junge A.K. et. al. Selection pressure for the factor-V-Leiden mutation and embryo implantation // Lancet. — 2001. — 358(9289). — 1238-39.
10. Rudick D., Su H.I., Sammel M.D., Kovalevsky G., Shaunik A., Barnhart K. Is factor V Leiden mutation a cause of in vitro fertilization failure? // Fert. Steril. — 2009. — 92(4). — 1256-9.
11. Зосимовский А.Ю. Влияние иммуноморфологических факторов на эффективность ЭКО: Дис... канд. мед. наук. — М., 1997.
12. Джанджгава Ж.Г., Бицадзе В.О. Неудачи ЭКО и материнская тромбофилия // Проблемы репродукции. — 2005. — 11(5). — 41-43.
13. Бицадзе В.О., Макацария А.Д., Хизроева Д.Х., Макацария Н.А., Яшенина Е.В. Тромбофилия как важнейшее звено патогенеза осложнений беременности // Практическая медицина. — 2012. — 5(60). — 22-9.
14. Kutteh W.H., Yetman D.L. et al. Effect of antiphospholipid antibodies in women undergoing in-vitro fertilization: role of heparin and aspirin // Hum. Reprod. — 1997. — 12. — 6. — 1171-1175.
15. Sher G., Fisch J., Maassarani G., Matzner W. et al. Antibodies to phosphatidylethanolamine and phosphatidylserine are associated with increased natural killer cell acti–vity in non-male factor infertility patients // Hum. Reprod. — 2000. — 15. — 9. — 1932-1936.
16. Исмаилова М.К., Мехдиева Ю.Д. Частота встречаемости генетических тромбофилий среди женщин, проходивших программу экстракорпорального оплодотворения в Баку // Клиническая и экспериментальная хирургия. — 2012.
17. Qublan H., Amarin Z., Dabbas M., Farraj A.E. et al. Low-molecular-weight haparin in the treatment of recurrent IVF-ET failure and thrombophilia: a prospective rando-mized placebo-controlled trial // Hum. Fertil. (Camb). — 2008. — 11(4). — 246-53.
18. Ходжаева З.С. Основы профилактики и лечения наследственных тромбофилий // Эффективная фармакотерапия в акушерстве и гинекологии. — 2010. — 4. — 26-31.
19. Сидельникова В.М., Сухих Г.Т. Невынашивание беременности: Руководство для практикующих врачей. — М.: МИА, 2010. — 225-7.
20. Джангава Ж.Г. Клиническое значение выявления тромбофилии у пациенток с бесплодием и неудачами ЭКО: Дис… канд. мед. наук. — М., 2005. — 120 с.
21. Nelson S.M., Greer I.A. The potential role of heparin in assisted conception // Hum. Reprod. Update. — 2008. — 14(6). — 623-45.
22. Practice Committee of American Society for Reproductive Medicine. Antiphospholipid antibodies do not affect IVF success // Fertil. Steril. — 2008. — 90(5, Suppl.). — Р. 172-3.
23. American Society for Reproductive Immunology Antiphospholipid Antibody Committee. A rational basis for antiphospholipid antibody testing and selective immunotherapy in assisted reproduction: a rebuttal to the American Society for for Reproductive Medicine Practice Committiee Opinion // Fertil. Steril. — 2000. — 74(4). — 631-4.
24. Boxmeer J.C., Macklon N.S., Lindemans J., Bec-ker N.G. et al. IVF outcomes are associated with biomarkers of the homocysteine pathway in monofollicular fluid // Hum. Reprod. — 2009. — 24(5). — 1059-1066.
25. Момот А.П., Лыдина И.В., Борисова О.Г., Елыкомов В.А., Цывкина Л.П. Экстракорпоральное оплодотворение и управление гемостазом // Проблемы репродукции. — 2012. — 6. — 47-55.
26. Zaynulina M., Mirashvili M. The prevalence of congenital and acquired thrombophilia and hyperhomocestei-nemia in women with repeated in vitro fertilization failure // J. Thrombos. Res. — 2012. — 130. — 1. — Р. 160.
27. Khizroeva D., Bitsadze V. Clinical value of thrombophilia diagnostics in wormen with repeated IVF failure // J. Thrombos. Res. — 2012. — 130. — 1. — Р. 160.
28. Westerlund E., Henriksson P., Wallen H. et al. Detection of a procoagulable state during controlled ovarian hyperstimulation for in vitro fertilization with global of haemostasis // Throm. Res. — 2012. — 46. — 4. — 417-425.
29. Hemker H.C., Aldieri R., De Smedt E., Beguin S. Thrombin generation, a function test of the haemostatic-thrombotic system // Thromb. Haemost. — 2006. — 96. — 553-61.
30. Dargaud Y., Hierso S., Rugeri L., Battie C. et al. Endogenous thrombin potential, prothrombin fragment 1+2 and D-dimers during pregnancy // Thromb. Haemost. — 2010. — 103. — 469-71.
31. Macey M.G., Bevan S., Alam S. et al. Platelet activition and endogenous thrombin potential in preeclampsia // Throm. Res. — 2010. — 125. — 76-81.
32. Tchaikovski S.N., van Viet H.A. et al. Effect of oral contraceptives on thrombin generation measured via calibrated autonated thrombography // Thromb. Haemost. — 2007. — 98. — 1350-6.
33. Christen Y., Wutscher R., Weimer D. et al. Effects of intermittent pneumatic compression on venous haemodynamics and fibrinolyte activity // Blood Coagul. Fibrinolys. — 1997. — 8. — 185-190.
34. Salzman E.W., McManama G.P., Shapiro A.H. et al. Effect of optimization of hemodynamics on fibrinolytie activity and antithrombotic efficacy of external pneumatic calf compression // Ann. Surg. — 1987. — 206. — 636-641.