Біль у попереку є надзвичайно поширеною проблемою, що в той чи інший момент життя виникає у більшості людей. Виникнення скелетно-м’язового болю у попереку відзначають приблизно 90 % людей, і саме цей вид болю посідає друге місце за поширеністю серед гострих больових синдромів після головного болю.
Щорічно хоча б один епізод болю в спині виникає у 16,8 % населення, у 90 % з них біль минає самостійно протягом шести тижнів (у тому числі в 50 % протягом тижня, у 75 % протягом місяця), і лише у 10 % пацієнтів біль у спині викликає стійку непрацездатність [10].
Класифікація болю у попереку та причини його виникнення [11]:
1. Простий, «механічний» біль у попереку:
— механічний біль з наявністю м’язового спазму і розтягнення зв’язок або без такого;
— фасет-синдром;
— спондильоз і спондилолістез;
— сколіоз (первинний або вторинний щодо спондильозу);
— травматичні переломи;
— рецидивуючий або хронічний біль у попереку.
2. Біль у попереку з радикулопатією:
— грижа міжхребцевого диска;
— стеноз хребтового каналу на поперековому рівні;
— синдром кінського хвоста.
3. Метаболічні порушення:
— переломи внаслідок остеопорозу.
4. Запальні процеси:
— спондилоартрит і сакроілеїт;
— септичний дисцит.
5. Пухлини:
— метастази;
— множинна мієлома;
— первинні пухлини кісток.
Найбільш частою (близько 90 %) причиною болю в спині є дисфункція м’язового і суглобово-зв’язкового апарату хребта. Клінічні дані, що сигналізують про наявність серйозного захворювання, але уявляються як загальні, несерйозні захворювання опорно-рухового апарату, зазвичай описуються як «червоні прапорці» (red flags) [12]. Міжнародні керівництва використовують «червоні прапорці» для оцінки болю в попереку і виключення серйозної патології та включають:
1) вік дебюту болю: у пацієнтів віком понад 55 років і менше 20 років;
2) збереження болю в спокої, ранкова скутість;
3) незалежність болю від положення тіла та рухів у хребті, пульсуючий характер болю, значна травма в недавньому минулому (падіння з висоти і т. ін.);
4) наявність в анамнезі злоякісного новоутворення;
5) безпричинне зниження маси тіла та/або лихоманка;
6) болючість при пальпації та перкусії хребта;
7) наявність в анамнезі наркотичної залежності, ВІЛ-інфекції, застосування імуносупресантів;
8) тривале застосування кортикостероїдів;
9) симптоми ураження спинного мозку (розлади чутливості в ділянці тулуба й кінцівок (провідникові порушення чутливості), слабкість у кінцівках, тазові розлади;
10) відсутність поліпшення через 1 місяць оптимального лікування.
Використання «червоних прапорців» не повинно замінювати клінічне мислення, але повинно використовуватись як доповнення до процесу.
У всіх перерахованих випадках необхідна рентгенографія відповідних відділів хребта в прямій і бічній проекціях, проведення загального аналізу крові та сечі, а при підозрі на остеомієліт, епідуральний абсцес, ураження спинного мозку й корінців, а також у діагностично сумнівних випадках — проведення магнітно-резонансної томографії попереково-крижового відділу хребта. За необхідності уточнення стану кісткових структур у ряді випадків після проведення рентгенографії показана комп’ютерна томографія (КТ) і сцинтиграфія хребта.
При підозрі на злоякісне новоутворення передміхурової залози необхідно досліджувати рівень специфічного антигену простати. За наявності травми в анамнезі (падіння з висоти, дорожньо-транспортна пригода), а також при тривалому застосуванні кортикостероїдів і віці пацієнтів старше 55 років необхідно провести рентгенографію хребта з функціональними пробами, а при недостатній її інформативності та збереженні болю понад 10 днів — сцинтиграфію або КТ хребта для виключення компресійного й іншого травматичного перелому хребців. Всім пацієнтам з інтенсивним больовим синдромом тривалістю понад 1 місяць, а також усім хворим із хронічними болями в спині показано одноразове проведення рентгенографії хребта в прямій і бічній проекціях з метою виключення в першу чергу пухлинного або інфекційного ураження хребта, а також остеопорозу.
При обстеженні пацієнтів з явними ортопедичними дефектами у вигляді грубого сколіозу, спондилолістезу, нестабільності поперекового відділу хребта, асиметрії довжини ніг, патології тазостегнових суглобів визначити етіологію болю не становить великих труднощів. А ось точне виявлення джерел больової імпульсації, особливо при хронічному неспецифічному болі в спині, досить складне [13–15].
Відповідно до рекомендацій Всесвітньої організації охорони здоров’я (ВООЗ) щодо лікування больового синдрому призначаються нестероїдні протизапальні препарати (НПЗП). Саме НПЗП найчастіше використовують при наявності болю в попереку. НПЗП одночасно мають і протизапальну, і аналгетичну дію, однак більшість позитивних ефектів (пригнічення запального процесу, болю, лихоманки) пов’язують з інгібіцією циклооксигенази-2 (ЦОГ-2), а розвиток побічних реакцій (головним чином у вигляді ураження шлунково-кишкового тракту) — з пригніченням синтезу ЦОГ-1.
Одним із препаратів класу «нестероїдні протизапальні препарати», що широко застосовуються сьогодні, є диклофенак. Його висока ефективність при різних больових синдромах, зокрема при суглобово-м’язовій патології, дозволяє розглядати диклофенак як еталонний знеболюючий препарат. У зв’язку з наявністю особливих фармакологічних ефектів, таких як пригнічення обох ізоформ ЦОГ, застосування диклофенаку може бути пов’язано з певною ульцерогенною дією. Внаслідок цього значний інтерес становить пошук ад’ювантних засобів, що підвищують протибольову дію диклофенаку та дозволяють досягати знеболюючого ефекту із застосуванням менших разових і добових доз препарату та скорочення термінів лікування. Саме такий підхід забезпечить зниження ризику розвитку побічних ефектів. У наш час диклофенак застосовується в багатьох галузях медицини: в хірургії, травматології та спортивній медицині — при ураженні опорно-рухового апарату, пошкодженні м’яких тканин, для післяопераційного знеболювання; в неврології — для лікування болю в спині, тунельних синдромів, мігрені; в гінекології — при дисменореї, аднекситах; в онкології — як засіб першого ступеня знеболювання згідно з рекомендаціями ВООЗ.
Аналгетичний ефект диклофенаку обумовлений впливом на різні рівні й ланки патогенезу больового синдрому. Крім знеболюючого ефекту, пов’язаного зі зниженням запалення в зоні ушкодження за рахунок пригнічення простагландинів (ЦОГ-1 і ЦОГ-2), диклофенак може знижувати біль, зменшуючи запалення і через інші механізми (стримуючи міграцію лейкоцитів у вогнище запалення, впливаючи на баланс цитокінів), впливаючи на калієві канали на периферичному рівні, а також зменшувати сприйняття болю через центральні механізми (за рахунок збільшення синтезу попередника серотоніну (триптофану) в мозковій тканині).
Диклофенак метаболізується печінкою та нирками. Близько 65 і 35 % дози виводиться відповідно з сечею та жовчю у вигляді кон’югатів та метаболітів; менше 1 % дози виводиться в незміненому вигляді.
Фармакокінетика диклофенаку у пацієнтів із легкою печінковою або легкою та помірною нирковою недостатністю аналогічна такій у здорових людей [3]. Вживання диклофенаку не рекомендується у пацієнтів з помірною й тяжкою печінковою та нирковою недостатністю [2].
Незважаючи на ефективну болезаспокійливу, протизапальну та жарознижуючу дію цих сполук, при тривалому прийомі більшості НПЗП відзначаються різні побічні ефекти, що включають підвищений ризик серцевого нападу, інсульту, а також шлунково-кишкових розладів, порушення функції нирок та печінки.
Дотепер невідомий конкретний механізм розвитку безпосередньої дії на серце. Одним з можливих механізмів, пов’язаних із побічними ефектами НПЗП, є інгібування ЦОГ в активованих тромбоцитах або ендотеліальних клітинах, що призводить до порушення гомеостазу між біосинтезом ейкозаноїдів, таких як тромбоксан і простациклін [4].
Як відомо, використання комбінованих препаратів у багатьох випадках має більш позитивні результати порівняно з монотерапією. Комбіноване призначення диклофенаку та вітамінів групи В у пацієнтів з дегенеративними захворюваннями хребта досліджували ще в 1988 р. G. Vetter, G. Brüggemann (Німеччина). Цікавість до даної проблематики цілком зрозуміла, оскільки ефективність використання вітамінів групи В була недостатньо досліджена.
Нейротропні комплекси, що містять великі дози вітамінів групи В (В1, В6, В12), використовуються для активації регенеративних процесів у периферичних нервах. Ряд досліджень довів, що застосування вітаміну В12 сприяє не тільки ремієлінізації, але і зниженню больового синдрому. Піридоксин бере участь у синтезі сфінгозину — структурного елемента мембрани нервового волокна і нейромедіаторів (серотоніну, нор–адреналіну). Таким чином, обидва нейротропних компонента збільшують швидкість проведення нервового імпульсу та покращують його репаративні властивості. Також доведено патогенетичний вплив тіаміну на поліпшення аксоплазматичного струму та відновлення трофічної функції нейрона.
Клінічний досвід показує, що парентеральне використання комбінації тіаміну, піридоксину та ціанокобаламіну добре усуває біль, порушення чутливості, нормалізує рефлекторні реакції. Тому при больових синдромах лікарі нерідко вдаються до використання вітамінів групи В як ізольовано, так і в комбінації з іншими препаратами.
Застосування вітамінів у комплексному лікуванні больового синдрому
Сьогодні накопичено значний досвід одночасного застосування НПЗП і комбінації вітамінів групи В, що обумовлено їх активною участю в метаболізмі нервової тканини. Численними дослідженнями, проведеними як в умовах експерименту, так і в клінічній практиці, показано, що вітаміни групи В виступають як коферменти у великому спектрі біохімічних реакцій. Тіамін (вітамін В1) залучений у процеси декарбоксилювання пірувату й метаболізму α-кетоглутарової кислоти в циклі Кребса, бере участь в білоксинтезуючих процесах. Тіамін також має здатність перемикати метаболізм глюкози на пентозофосфатний шлях, завдяки чому забезпечуються енергетичні потреби клітини, створюються запаси субстратів для синтезу нуклеїнових кислот. Піридоксин (вітамін В6) виявляє властивості коферменту в реакціях декарбоксилювання і трансамінування амінокислот у тканині центральної та периферичної нервової системи. Ціанокобаламін (вітамін В12), метаболізуючись у кофактор — кобамід, входить до складу численних ферментів, зокрема редуктази, що відновлює фолієву кислоту в тетрагідрофолієву. Він також бере участь у перенесенні метильних і інших одновуглецевих фрагментів, будучи необхідним для утворення дезоксирибози і ДНК, креатину, метіоніну — донора метильних груп, в синтезі ліпотропного фактора — холіну, для перетворення метилмалонової кислоти в бурштинову, що входить до складу мієліну, для утилізації пропіонової кислоти. При комбінованому застосуванні вітаміни групи В мають здатність потенціювати дію один одного та стимулюють репаративно-регенеративні процеси в нервовій тканині за рахунок комплексних нейрометаболічних ефектів [16].
Ефективність призначення комбінації диклофенаку та вітамінів групи В була доведена результатами дослідження, опублікованими в листопаді 2015 р. (Systemic Review on the Use of Diclofenac/B Complex as an Anti-Inflammatory Treatment with Pain Relief Effect for Patients with Acute Lower Back Pain. Mexico, США). Метою дослідження було вивчення ефективності призначення комбінації диклофенаку та комплексу вітамінів групи В порівняно з монотерапією НПЗП. Вивчали клінічну ефективність поєднання диклофенаку з вітамінами групи В у 418 пацієнтів з болем у нижній частині спини. Оцінка за шкалою інтенсивності болю (Hoppe Pain Questionnaire) показала кращі результати у вигляді зменшення больового синдрому у групі, де застосовувалась комбінована терапія. Також оцінювали тривалість лікування у 256 пацієнтів з болем у нижній частині спини, які були розподілені на дві групи (обидві групи отримували диклофенак, одній з груп додавали до лікування комплекс вітамінів В1, В6, В12).
Результати оцінювали за шкалою Hoppe Pain Questionnaire та шкалою Лайкерта (Likert scale) і показали перевагу призначення комбінованої терапії. Отже, можна зробити висновок, що поєднання диклофенаку з комплексом вітамінів групи В має кращий знеболювальний, протизапальний і синергічний нейрорегенеративний ефект, що і було доведено в декількох клінічних дослідженнях.
Диклофенак і кардіоваскулярний ризик
Результати клінічних випробувань і метааналізів показують, що НПЗП викликають важливі несприятливі серцево-судинні ефекти, що включають підвищений ризик розвитку інфаркту міокарда, ішемічної хвороби серця, серцевої недостатності та артеріальної гіпертензії. Останніми роками були отримані дані про те, що індукований окислювальний стрес відіграє важливу роль в патогенезі серцево-судинних захворювань [9].
Дані, зібрані протягом останніх 10 років, повідомили про залежність між дозою та підвищенням серцево-судинного ризику, пов’язаного з використанням диклофенаку.
У наш час є доступними нові препарати з низьким дозуванням диклофенаку, що дозволяє зменшити системний вплив, ступінь інгібування ЦОГ-2 і, можливо, ризик виникнення серцево-судинних подій. Тому ці нові препарати можуть являти собою ідеальний засіб для лікування болю [8].
Вплив дози на серцево-судинний ризик
Сучасні дослідження вказують на користь залежності між дозою диклофенаку та серцево-судинним ризиком. Як наслідок, низькі дози можуть бути ключем для зменшення побічних ефектів диклофенаку. Дослідженнями Garcia Rodriguez et al. було показано вплив широкого спектра доступних доз диклофенаку в межах від 50 до 150 мг на розвиток інфаркту міокарда (ІМ) у загальній популяції. Вони виявили слабкий зв’язок при застосуванні дози 50 мг [1,12 (від 0,60 до 2,20)] та 75 мг [1,31 (від 0,80 до 2,16)], в той час як ризик зростав зі збільшенням дози до 100 мг [1,65 (від 1,26 до 2,18)] і 150 мг на добу [1,80 (від 1,49 до 2,18)].
У недавньому дослідженні Odom et al. виконали мета-регресійний аналіз з використанням даних, що надходять з 11 спостережних досліджень, і продемонстрували лінійну залежність між дозою диклофенаку та кардіоваскулярним ризиком: 1,13 (1,08–1,18) — для дози 50 мг; 1,26 (1,17–1,35) — для дози 100 мг і 1,39 (1,25–1,53) для дози 150 мг [8].
Ризик розвитку кардіоваскулярних патологій, пов’язаних із застосуванням диклофенаку, пропор–ційно збільшується з тривалістю лікування. Але чи
є безпечне часове вікно? Garcia Rodriguez et al.
проаналізували дані та виявили, що використання диклофенаку менше 1 місяця не пов’язане з підвищенням серцево-судинних ускладнень. Відносний ризик при цьому становить 0,99 (0,73–1,35). З іншого боку, для тривалості в діапазоні від 31 до 365 днів відносний ризик збільшився до 1,19 (0,92–1,53), досягнувши 1,38 (1,00 до 1,90) при прийомі понад 1 рік [8].
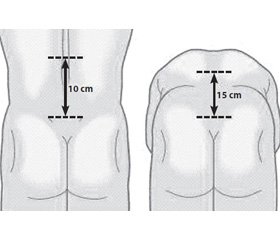
Тест «відстань «палець — підлога» реєстрували після інструктажу пацієнта щодо правильності виконання цього тесту. Відстань між середнім пальцем пацієнта і підлогою була виміряна й зареєстрована в сантиметрах (см). Результати тесту Шобера (рис. 1) були записані так: пацієнт стоїть рівно, дослідник ставить позначку на остистому відростку 5-го поперекового хребця, відміряє 10 см вище і знову ставить позначку, після чого просить пацієнта зігнутися максимально вперед і відміряє відстань між двома точками (см). Пацієнти, рандомізовані на лікування в дослідженні Dolor, були розподілені на дві групи лікування: група DB (n = 187) отримувала комбінацію диклофенаку з вітамінами групи В і група D (n = 185) отримувала монотерапію диклофенаком. Стан пацієнтів реєструвався перед призначенням препаратів, на 2-му огляді (після 3 днів лікування), на 3-му (після 5 днів лікування), а також на 4-му (через 7 днів після початку терапії).
/64-1.jpg )
При 2-му та 3-му оглядах зі значним клінічним поліпшенням 87 пацієнтів у групі DB і 55 пацієнтів у групі D достроково припинили лікування та вийшли з дослідження через значне поліпшення стану. Покращення було визначено за візуальною аналоговою шкалою болю (VAS, 100 мм) при значеннях, рівних або менше 20 мм за даною шкалою, та суб’єктивним відчуттям пацієнтів зі зменшенням болю. В результаті продовжували лікування 87 пацієнтів у групі DB і 120 пацієнтів у групі D. При 3-му огляді 71 пацієнт вийшов з дослідження в групі DB і 52 пацієнти в групі D, після чого 16 суб’єктів продовжили лікування в групі DB і 68 — в групі D.
Перед початком лікування середня відстань «палець — підлога» в групі DB була 19,57 см (± 6,27), у той час як у групі D — 21,19 см (± 6,05). Після 3 днів лікування відповідні бали даного тесту становили 13,72 см (± 7,116) для групи DB (статистично значуща зміна перед лікуванням: р < 0,0001) і 16,64 см (± 7,265) для групи D (статистично значуща зміна перед лікуванням: р < 0,0001).
Середні бали за тестом «відстань «палець — підлога» на 2-му візиті були значно нижче серед суб’єктів DB групи (р = 0,0001). Середні бали за тестом «відстань «палець — підлога» у подальші 5 днів лікування були: 9,899 см (± 5,722) для групи DB і 12,86 см (± 4,992) для групи D. На 3-му візиті бали за тестом «відстань «палець — підлога» були значно нижче в групі DB (р = 0,0001). При 4-му візиті середня відстань «палець — підлога» в групі DB була 8,813 см (± 3,559) і 10,49 см (± 4,755) в групі D, без статистично значущої різниці між групами (р = 0,1881).
Результати тесту Шобера до лікування були 16,01 см (± 2,587) в групі DB і 16,1 см (± 2,343) в групі D. При 2-му огляді в групі DB відстань збільшилася статистично значущим (р < 0,0001) способом до 17,23 см (± 2,431), у групі D — до 16,8 см (± 2,26) (р < 0,001 щодо попередніх оброблених значень). У той час як середні результати тестів Шобера в групі DB були вище, ніж у групі D під час 2-го огляду, ця різниця не досягла статистичної значущості (p = 0,087). При 3-му огляді середні значення тесту Шобера в групі DB були 17,76 см (± 2,214), у групі D — 17,22 см (± 1,845).
У той час як середні результати тестів Шобера в групі DB були вище, ніж у групі D, при 3-му огляді ця різниця не досягла статистичної значущості (p = 0,0565). При 4-му огляді результати тестів Шобера серед суб’єктів групи DB дорівнювали 17,81 см (± 2,073) і 17,56 см (± 2,589) в групі D, без статистично значущої різниці між групами (p = 0,7229).
Другим найбільш частим симптомом, пов’язаним з причиною відвідування лікаря після застуди, є біль у нижній частині спини. Від цього захворювання страждає близько 84 % дорослого населення в певний момент часу. Біль у попереку несе значні економічні витрати з точки зору втрати працездатності, інвалідності. Важливо відзначити, що у пацієнтів із болями в спині, в яких наявні як суб’єктивні, так і об’єктивні зміни функціонального стану, значно порушується здатність виконувати щоденні дії і, отже, відзначається істотний вплив на якість життя. Руховий режим і, відповідно, можливість виконання повсякденної роботи є важливою складовою покращення якості життя пацієнтів з болем у спині. Значне зниження болю та покращення рухливості спостерігалися в обох групах лікування.
Середні значення тесту «відстань «палець — підлога» показали перевагу комбінованої терапії диклофенаком і вітамінами групи В на відміну від монотерапії на 3-й та 5-й день лікування, але не було ніякої різниці між групами на 7-й день лікування. Показники тесту Шобера були вище у DB групі при 2-му і 3-му оглядах.
У роботі R. Shetty (2015) в дослідженні in vivo було показано, що вітаміни групи B можуть викликати знеболюючий або антиноцицептивний ефект або шляхом підвищення рівня серотоніну в різних ділянках головного мозку, посиленням інгібування аферентних ноцицептивних нейронів у спинному мозку, зменшуючи реакцію таламуса на ноцицептивні стимули, або шляхом активації опіоїдних рецепторів. Крім того, вітамін B12 поліпшує реепітелізацію і реіннервацію після травми [6].
У дослідженні Reyes-Garcia знеболюючий ефект вітаміну B12 був вищий, ніж вітамінів В6 і В1 відповідно [7].
У доповіді Magana-Villa показано, що диклофенак в поєднанні з вітамінами групи В має кращий анальгезуючий ефект порівняно з монотерапією диклофенаком. Крім того, в дослідженні Bruggemann повідомляється про кращий знеболюючий ефект диклофенаку разом із комплексом вітамінів групи В для зменшення болю в нижній частині спини. У дослідженні Hector знеболюючий ефект комплексу диклофенаку з вітамінами групи B було виділено як ефективний і водночас бюджетний підхід до полегшення болю до і після операції [7].
За відсутності надійних кардіопротекторних препаратів вітаміни групи В відіграють важливу роль у профілактиці серцево-судинних захворювань [9].
Висновки
Результати даного ретроспективного аналізу показують, що комбінована терапія диклофенаком разом із вітамінами В1, В6, В12 має додатковий позитивний ефект на відновлення рухливості серед пацієнтів у дослідженні Dolor, і служать для виділення кореляції між рухливістю й інтенсивністю болю серед пацієнтів із болями в нижній частині спини. У цьому разі поєднання диклофенаку з вітамінами групи В особливо ефективне в досягненні обох цих цілей [1].
Резюмуючи наявні в наш час експериментальні та клінічні дані про патогенетичну дію й клінічну ефективність диклофенаку в поєднанні з комбінацією вітамінів групи В, становить інтерес розробка препарату, що містить комбінацію диклофенаку та вітамінів групи В. Препарат Нейродикловіт містить 50 мг диклофенаку, 50 мг тіаміну гідрохлориду, 50 мг піридоксину гідрохлориду і 0,25 мг ціанокобаламіну [17]. Завдяки своєму складу Нейродикловіт знімає біль і запалення та на відміну від інших НПЗП відновлює ушкоджені нейрони. Показаннями до застосування препарату є запальні та дегенеративні форми ревматичних захворювань: хронічний поліартрит, анкілозуючий спондиліт (хвороба Бехтерева), артроз, спондилоартрит, гострий подагричний артрит, позасуглобовий ревматизм м’яких тканин, неврит і невралгії, такі як цервікальний синдром, люмбаго, ішіалгії. Рекомендоване застосування: дорослим Нейродикловіт призначають по 1 капсулі 1–3 рази/добу на початку лікування, як підтримуюча доза — 1–2 рази/добу. Тривалість терапії залежить від характеру й тяжкості захворювання.
Доцільність застосування вітамінів групи В у поєднанні з диклофенаком для зменшення дози та терміну прийому НПЗП довела ефективність лікування з урахуванням профілактики серцево-судинних ускладнень, особливо у кардіоневрологічних пацієнтів і коморбідних хворих за цереброваскулярної патології.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Mauro Geller, Marco Antonio Mibielli, Carlos Pereira Nunes, Adenilson de Souza da Fonseca, Stephanie Wrobel Goldberg and Lisa Oliveira. Comparison of the action of diclofenac alone versus diclofenac plus B vitamins on mobility in patients with low back pain // Journal of drug assessment. — 2016. — Vol. 5, N 1. — P. 1-3. http://dx.doi.org/10.3109/21556660.2016.1163263
2. Sheridan M. Hoy. Diclofenac Sodium Bolus Injection (DylojectTM): A Review in Acute Pain Management // Springer International Publishing Switzerland 2016. Doi: 10.1007/s40265-016-0619-7.
3. Hospira Inc. A Pfizer Company. DylojectTM (diclofenac sodium) injection, for intravenous use. 2016. http://www.fda.gov/. Accessed 1 Jul 2016.
4. Rajeshwary Ghosh, Sumanta K. Goswami, Luis Felipe B.B. Feitoza, Bruce Hammock, Aldrin V. Gomes. Diclofenac induces proteasome and mitochondrial dysfunction in murine cardiomyocytes and hearts // International Journal of Cardiology. 2016; 223: 923-935.
5. Francesco Lapi, Carlo Piccinni, Monica Simonetti, Miriam Levi, Pierangelo Lora Aprile, Iacopo Cricelli, Claudio Cricelli, Andrea Fanelli. Non-steroidal anti-inflammatory drugs and risk of cerebrovascular events in patients with osteoarthritis: a nested case-control study // Intern Emerg Med. doi: 10.1007/s11739-015-1288-3.
6. Rohit Shetty, DNB, FRCS, Kalyani Deshpande, MS, FICO, Arkasubhra Ghosh, PhD, Swaminathan Sethu, BDS, MSc, PhD. Management of Ocular Neuropathic Pain With Vitamin B12 Supplements: A Case Report // Cornea. — October 2015. — Vol. 34, N 10.
7. Morteza Dehghan. Comparative Effectiveness of B and E Vitamins with Diclofenac in Reducing Pain Due to Osteoarthritis of the Knee // Med Arh. 2015 Apr; 69(2): 103-106. doi:10.5455/medarh.2015.69.103-106.
8. Franceschi F., Saviano L., Petruzziello C., Gabrielli M., Santa–relli L., Capaldi L., Di Leo M., Migneco A., Gilardi E., Merra G., Ojetti V. Safety and efficacy of low doses of diclofenac on acute pain in the emergency setting // European Review for Medical and Pharmacological Sciences. 2016 Oct; 20(20): 4401-4408.
9. Abdulmajeed N.А., Alnahdi H.S., Ayas N.О., Mohamed A.M. Amelioration of cardiotoxic impacts of diclofenac sodium by vitamin B complex // European Review for Medical and Pharmacological Sciences. 2015; 19: 671-681.
10. Баринов А.Н., Пархоменко Е.В., Махинов К.А. Причины отрицательных исходов лечения боли в спине и способы их преодоления // Эффективная фармакотерапия. Неврология. — 2014. — № 5(49).
11. Hoy D., Brooks P., Blyth F. et al. The global burden of low back pain: estimates from the Global Burden of Disease 2010 study // Ann Rheum Dis. 2014; 0: 1-7. doi: 10.1136/annrheumdis-2013-204428.
12. Koes B., van Tulder M., Lin C., Macedo L., McAuley J., Maher C. An updated overview of clinical guidelines for the ma–nagement of non-specific low back pain in primary care // European Spine Journal. 2010; 19(12): 2075-94.
13. Алексеев В.В., Алексеева Л.И. Хондропротекторы в терапии неспецифической боли в спине // Российский журнал боли. — 2013. — № 1. — С. 31.
14. Баринов А.Н., Мурашко Н.К., Терентьева Н.В., Яворский В.В. Невропатическая боль при поражении периферической нервной системы: стратификация лечения // Медицинский совет. — 2013. — № 4. — С. 54-62.
15. Яхно Н.Н., Баринов А.Н., Подчуфарова Е.В. Невропатическая и скелетно-мышечная боль. Современные подходы к диагностике и лечению // Клиническая медицина. — 2008. — Т. 86, № 11. — С. 9-15.
16. Умарова Х.Я., Чугунов А.В. Проблема эффективности и безопасности лечения пациента с поясничной болью // Справочник поликлинического врача. — 2013. — № 9.
17. Строков И.А., Дроконова О.О., Ахмеджанова Л.Т. Комбинированная терапия боли в спине витаминами группы В и нестероидными противовоспалительными средствами // Медицинский совет. — 2013. — № 12.

/64-1.jpg )