Нестероїдні протизапальні препарати (НПЗП) є важливим інструментом аналгетичної терапії при гострих та хронічних больових синдромах [1]. Вдала комбінація знеболюючих, протизапальних і жаро–знижуючих ефектів визначає очевидні переваги цієї групи препаратів порівняно з іншими аналгетиками. Фактично пероральні неселективні або селективні щодо циклооксигенази-2 (ЦОГ-2) НПЗП забезпечують більш суттєве полегшення симптомів, аніж парацетамол [22], при цьому вираженість ефекту щодо болю становить 0,29 (0,22–0,35), що вдвічі перевищує вплив парацетамолу.
НПЗП широко застосовуються в ревматології, лікуванні хронічних больових синдромів у пацієнтів з остеоартритом, ревматоїдним артритом, спондилоартритами, люмбалгіями та дорсалгіями тощо. Утім, незважаючи на великий спектр клінічних ситуацій, у яких використовуються НПЗП, їх застосування може асоціюватися із значними небажаними побічними ефектами та призводити до серйозних ускладнень. Традиційно вважається, що прийом неселективних НПЗП асоціюється з більшим ризиком шлунково-кишкових ускладнень та розвитком НПЗП-гастропатії/НПЗП-ентеропатії, а застосування селективних інгібіторів ЦОГ-2 — із підвищеним ризиком серцево-судинних подій [13].
Питання гастробезпеки є ключовою проблемою при застосуванні неселективних НПЗП, прийом яких стійко асоціюється із розвитком НПЗП-гастропатії та підвищеним ризиком кровотеч і перфорацій шлунково-кишкового тракту. Поява нової групи селективних інгібіторів циклооксигенази-2 дозволила знизити число ускладнень з боку шлунково-кишкового тракту. Але виявилося, що ці ліки можуть викликати різні серйозні небажані ефекти з боку серцево-судинної системи: від дестабілізації артеріального тиску до інфаркту міокарда, цереброваскулярних ішемічних розладів і раптової коронарної смерті [3]. Так, при аналізі результатів першого великого дослідження, присвяченого оцінці шлунково-кишкової безпеки специфічного інгібітору ЦОГ-2 рофекоксибу (50 мг/добу) порівняно з неселективним НПЗП напроксеном (1000 мг/добу) у хворих на ревматоїдний артрит (дослідження VIGOR), було виявлено, що інфаркт міокарда розвивався вірогідно частіше в пацієнтів, які отримували рофекоксиб, — 0,4 % випадків порівняно з 0,1 % у групі напроксену [8]. Через відсутність у дослідженні групи плацебо залишалося неясним, чи ця проблема була результатом підвищення серцево-судинного ризику в результаті прийому рофекоксибу, чи була проявом кардіопротективного (аспіриноподібного) ефекту напроксену, чи це був просто випадковий збіг. Відповідь на це питання була отримана при проведенні практично одночасно ще двох плацебо-контрольованих досліджень, які підтвердили майже дворазове перевищення тромбоемболічних подій (інфаркти міокарда, інсульти) у пацієнтів, які отримували коксиби (1,5 випадку на 100 пацієнто-років), порівняно з групою плацебо (0,78 випадку на 100 пацієнто-років, р = 0,008) [9]. З того часу кардіоваскулярна безпека селективних інгібіторів ЦОГ-2 є предметом постійних дискусій, і незабаром почали висловлюватися аналогічні побоювання щодо безпеки традиційних НПЗП. Нещодавно отримані дані дозволяють припустити, що коксиби також істотно підвищують ризик розвитку ускладнень у верхньому відділі шлунково-кишкового тракту порівняно з плацебо, хоча і з нижчою частотою, ніж неселективні НПЗП [7]. Водночас ризик виникнення серцево-судинних катастроф також приписують деяким неселективним НПЗП.
Зв’язок НПЗП із підвищеним серцево-судинним ризиком є складним питанням: окрім прямого впливу на дисбаланс простаноїдів [13], може існувати й непрямий вплив, пов’язаний із підвищенням артеріального тиску, застійною серцевою недостатністю і нирковою дисфункцією. Відомо, що кардіоваскулярні катастрофи обумовлені впливом НПЗП на баланс синтезу тромбоксану А2 (ЦОГ-1-залежний процес) — індуктора адгезії й агрегації тромбоцитів, а також на синтез антитромботичного й вазодилатуючого простацикліну (ЦОГ-2-залежний процес) у бік тромбоутворення. Дестабілізація артеріального тиску міцно пов’язана з впливом НПЗП на простагландинові механізми контролю артеріальної гіпертензії. Окрім того, є дані, що ризик розвитку ускладнень з боку серцево-судинної системи підвищується при використанні високих терапевтичних доз будь-яких НПЗП упродовж тривалого періоду часу. Імовірність розвитку серйозних небажаних кардіоваскулярних явищ пов’язана з наявністю чинників ризику: діагностовані кардіологічні захворювання, зокрема артеріальна гіпертензія, надмірна маса тіла, куріння, порушення ліпідного обміну, цукровий діабет, тромбози периферичних судин, оперативні втручання на серці й судинах [4].
Небезпека розвитку загрозливих станів зі сторони шлунково-кишкового тракту й серцево-судинної системи набагато вища за наявності певних факторів ризику, тому їх урахування становить основу для планування раціональної профілактики та призначення НПЗП. У табл. 1 вказані основні чинники ризику розвитку НПЗП-асоційованих ускладнень [1, 7].
Тому найважливішим критерієм вибору НПЗП для довготривалого лікування (інтермітуюча терапія чи тривалі цикли прийому) є безпека цих засобів. І якщо раніше основне значення надавалося добрій переносимості препарату стосовно шлунково-кишкового тракту, то сьогодні на тлі зміни пріоритетів профілактики чи не найбільш значущою перевагою того чи іншого НПЗП вважається низький ризик розвитку кардіоваскулярних ускладнень.
/69-1.jpg)
Серед НПЗП напроксен є одним з найбезпечніших для серцево-судинної системи. Найнижчий ризик серцево-судинних подій серед НПЗП, що впевнено демонструє напроксен в експериментальних і клінічних дослідженнях, пояснюється особливістю впливу на ЦОГ-асоційовані системи агрегації тромбоцитів (тромбоксан А2) і ендотелійзалежної вазодилатації (простациклін). Викликаючи так званий аспіриноподібний ефект, напроксен оборотно зв’язується з ЦОГ-1 тромбоцитів, знижуючи при цьому утворення тромбоксану А2 — відомого простагландину з проагрегантною активністю. Зниження рівня тромбоксану А2 в крові забезпечує зменшення ризику тромбоемболічних ускладнень на тлі терапії НПЗП. У той же час напроксен набагато меншою мірою, ніж інші (особливо ЦОГ-2-селективні) НПЗП, пригнічує утворення простацикліну — речовини з вазодилатуючим ефектом, що робить його застосування більш безпечним з погляду можливих вазоспастичних явищ мікроциркуляторного русла. Такий особливий вплив напроксену на дані системи уможливлює проведення терапії НПЗП з мінімальними ризиками серцево-судинних ускладнень, а світовій науковій громадськості дає підстави характеризувати напроксен як препарат вибору для пацієнтів із наявністю кардіоваскулярних ризиків в анамнезі [2].
Антитромбоцитарний ефект напроксену в різних дозах (220 мг двічі/тричі на день та 550 мг двічі на день) виявився порівнянним з дією аспірину. Так, при визначення ступеня інгібування сироваткового тромбоксану В2 як маркера гальмування ЦОГ-1 тромбоцитів через 24 год і через 7 днів було виявлено однотипні зміни для напроксену та аспірину: через 7 днів інгібування тромбоксану В2 становило ≥ 98 % для всіх доз напроксену та ≥ 98 % для аспірину [18]. Отже, близький до дії аспірину ефект спостерігається навіть при використанні низьких доз напроксену [18].
Аспіриноподібний ефект напроксену є цілком достатнім для досягнення антиагрегантного й кардіопротективного ефектів. Тому в пацієнтів із відсутнім, низьким чи середнім кардіоваскулярним ризиком не рекомендується посилювати антитромбоцитарний ефект напроксену додатковим прийомом аспірину. Ситуація може змінитися лише в пацієнтів із високим серцево-судинним ризиком та після перенесених кардіоваскулярних катастроф. Одночасне застосування напроксену та аспірину може перешкоджати необоротному інгібуванню ЦОГ-1 тромбоцитів аспірином. Тому при одночасному прийомі цих препаратів напроксен необхідно застосовувати не менше ніж через 2 години після аспірину [6].
Незважаючи на високу протибольову й протизапальну активність напроксену, що доведена в багатьох (РКД), інтерес до напроксену визначається все ж таки не його ефективністю. Головним достоїнством цього препарату є те, що за результатами РКД, наглядових і епідеміологічних досліджень він демонструє найменший порівняно з усіма іншими НПЗП (за винятком аспірину) ризик розвитку кардіоваскулярних ускладнень [1].
Доказом цього став результат метааналізу 31 рандомізованого клінічного дослідження (сумарно 116 429 хворих, 117 218 пацієнто-років спостереження), у яких визначалася кардіоваскулярна безпека неселективних НПЗП (напроксену, диклофенаку, ібупрофену) і селективних НПЗП (целекоксиб, еторикоксиб). Критерієм оцінки слугувала частота епізодів інфаркту міокарда, інсульту й смерті з кардіоваскулярних причин. Найважливіший показник — ризик летального кінця через інфаркт міокарда або інсульт, а також сумарний ризик ускладнень (число нефатальних інфарктів міокарда + нефатальні інсульти + усі випадки загибелі через кардіоваскулярні катастрофи), що був найнижчим для напроксену [20]. Частота інфаркту міокарда визначалася у 29 РКД (554 випадки). Для трьох препаратів (напроксен, диклофенак і еторикоксиб) ризик інфаркту міокарда не перевищував такий при використанні плацебо. Для інших НПЗП порівняно з плацебо відносний ризик інфаркту міокарда був вище від запланованої статистичної межі 1,3: в ібупрофену — 1,61 (95% ДІ 0,50–5,77), у целекоксибу — 1,35 (95% ДІ 0,71–2,72), у луміракоксибу — 2,00 (95% ДІ 0,71–6,21). Частота інсульту була оцінена за даними 26 РКД (377 випадків). Застосування будь-яких НПЗП супроводжувалося збільшенням відносного ризику розвитку інсульту порівняно з плацебо. При цьому найменший ризик відзначався знову ж таки при використанні напроксену — 1,76 (95% ДІ 0,91–3,33), істотно відрізняючись у кращий бік від показників ібупрофену — 3,36 (95% ДІ 1,00–11,60), диклофенаку — 2,86 (95% ДІ 1,09–8,36) та еторикоксибу — 2,67 (95% ДІ 0,82–8,72). У табл. 2 подані результати цього метааналізу.
/70-1.jpg)
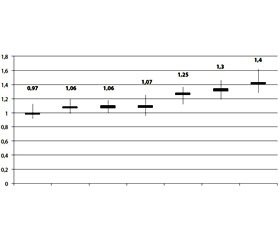
Аналогічні дані отримані при метааналізі 25 епідеміологічних досліджень, проведених у 18 незалежних популяціях, що визначали індивідуальний ризик кардіоваскулярних ускладнень при використанні різних НПЗП. Критерієм оцінки була частота фатального й нефатального інфарктів міокарда, розвиток яких зафіксовано приблизно в 100 000 пацієнтів. Для напроксену, як і очікувалося, був показаний найменший ризик — відношення шансів становило 1,06 (95% ДІ 0,94–1,2), на наступній сходинці був целекоксиб — 1,12 (95% ДІ 1,00–1,24), далі йшли ібупрофен — 1,14 (95% ДІ 0,98–1,31), мелоксикам — 1,25 (95% ДІ 1,04–1,49), рофекоксиб — 1,34 (95% ДІ 1,22–1,48), диклофенак — 1,38 (95% ДІ 1,26–1,52), індометацин — 1,40 (95% ДІ 1,21–1,62), етодолак — 1,55 (95% ДІ 1,16–2,06) і еторикоксиб — 1,97 (95% ДІ 1,35–2,89) [21].
Одним із наймасштабніших аналізів ризику розвитку основних серцево-судинних подій на фоні прийому НПЗП видається метааналіз [7] з охопленням 639 РКД. Дані порівняння коксибів із плацебо були оцінені в 184 дослідженнях (88 367 учасників, 52 466 людино-років) і коксибів із неселективними НПЗП — у 113 дослідженнях (диклофенак — у 33 дослідженнях, 61 572 учасники, 90 644 людино-роки; ібупрофен — у 22 дослідженнях, 22 225 учасників, 11 668 людино-років; напроксен — у 48 дослідженнях, 48 706 учасників, 31 631 людино-рік; інші НПЗП цього класу в 14 дослідженнях, 6192 учасники, 928 людино-років). Ризик судинної смертності був значно підвищений при прийомі коксибів (1,58; 95% ДІ 1,00–2,49; р = 0,0103), незначно збільшувався при використанні ібупрофену (1,90; 95% ДІ 0,56–6,41; р = 0,17) і не збільшувався при прийомі напроксену (1,08; 95% ДІ 0,48–2,47; р = 0,80). Ризик смерті від будь-якої причини був значно збільшеним (приблизно на 25 %) у групі коксибів (1,22; 95% ДІ 1,04–1,44; р = 0,0139). При цьому не було значних ексцесів смерті від будь-якої причини в групі ібупрофену в низьких дозах (1,61; 95% ДІ 0,90–2,88; р = 0,11) або напроксену (1,03; 95% ДІ 0,71–1,49; р = 0,88) [7].
Ще в одному популяційному обсерваційному дослідженні (із аналізом подій у 2,7 млн пацієнтів) встановлено найвищі ризики розвитку серцево-судинних подій при застосуванні рофекоксибу — 1,45 (95% ДІ 1,33–1,59) та диклофенаку — 1,40 (95% ДІ 1,27–1,55), а найнижчий — для ібупрофену — 1,18 (95% ДІ 1,11–1,25) і напроксену — 1,09 (95% ДІ 1,02–1,16). З інших, менш досліджених препаратів, найвищі ризики також мали еторикоксиб, етодолак та індометацин [16].
Ще в одному дослідженні цих же авторів також був продемонстрований найнижчий ризик розвитку гострого інфаркту міокарда для напроксену — 0,97 (95% ДІ 0,94–1,2) [15]. Ці були дані отримані при метааналізі 17 досліджень типу «випадок — контроль», до якого було залучено 86 193 пацієнтів зі встановленим діагнозом інфаркту міокарда. Контрольна група включала 527 236 спостережень (рис. 1).
/71-1.jpg)
З моменту появи в клініці групи НПЗП були проведені численні дослідження їх ефективності й безпечності. Так, у проведеному в Бостоні (США) дослідженні проаналізовано прийом НПЗП 4425 пацієнтами, які перенесли інфаркт міокарда, і 17 700 особами з групи контролю. У цілому прийом НПЗП не знижував ризик розвитку інфаркту міокарда. Водночас прийом напроксену його значно зменшував: стандартизоване відношення шансів становило 0,86, що було найнижчим показником серед усіх досліджених НПЗП [19]. В аналогічному канадському дослідженні, куди увійшли 14 163 пацієнти з інфарктом міокарда і 14 160 осіб із групи контролю, відношення шансів для напроксену становило 0,71.
Ще одним вагомим доказом низького кардіоваскулярного ризику при використанні напроксену стало когортне дослідження (n = 610 001) американських вчених C. Roumie і співавт. [17]. У досліджуваній когорті 84 752 особи страждали від захворювань серцево-–судинної системи. У цій підгрупі, яка включала, по суті, пацієнтів із дуже високим кардіоваскулярним ризиком, навіть без використання НПЗП частота інфаркту міокарда, інсульту і коронарної смерті становила 28,3 на 1000 в рік. Це було майже в 4 рази більше, ніж в осіб, які не мали захворювань серцево-судинної системи і не отримували НПЗП (7,9 на 1000). Показово, що в осіб із максимальним ризиком ускладнень використання напроксену, на відміну від інших НПЗП, асоціювалося зі зниженням частоти кардіоваскулярних катастроф (22,66 на 1000).
Цікавими також видаються дослідження впливу НПЗП на розвиток та прогресування серцевої недостатності. Так, G. Gislason і співавт. [14] вивчили порівняльний вплив різних НПЗП на наслідки серцевої недостатності. Було обстежено 107 092 хворих з даною патологією, внесених у національний реєстр Данії з 1995 по 2004 р. З них 36 354 пацієнтам за період спостереження хоча б один раз призначали НПЗП. 60 974 (56,9 %) хворі померли від прогресуючої серцевої недостатності. В осіб, які приймали будь-які НПЗП, ризик смерті виявився вищим, ніж у пацієнтів, які не отримували їх. Однак напроксен демонстрував мінімальний ризик (відношення ризиків — 1,22; 95% ДІ 1,07–1,39) порівняно із рофекоксибом (1,7), целекоксибом (1,75), ібупрофеном (1,31) і диклофенаком (2,08).
Отже, результати великомасштабних РКД показують, що серцево-судинний ризик може бути підвищеним при використанні як коксибів, так і деяких неселективних НПЗП. Водночас усі дослідження вказують на найнижчий ризик розвитку фатальних і нефатальних кардіоваскулярних подій при застосуванні напроксену.
Фахівці Адміністрації з контролю за продуктами і ліками США (FDA) встановили, що напроксен викликає найменше число серцево-судинних подій серед усіх НПЗП, водночас його застосування не пов’язане з високою ймовірністю розвитку інфарктів, інсультів і тромбозів [20]. У зв’язку з цим експерти FDA рекомендували відобразити на упаковці інформацію про безпеку лікарського засобу для пацієнтів, віднесених до групи ризику за серцево-судинними захворюваннями.
Завдяки унікальній особливості — кардіозахисному впливу порівняно з усіма іншими НПЗП напроксен внесений у численні рекомендації з лікування хронічних скелетно-м’язових больових синдромів як препарат із найкращим профілем кардіоваскулярної безпеки. Так, у 2007 році були опубліковані рекомендації з контролю скелетно-м’язового болю, створені Асоціацією американських кардіологів (American Heart Association, AHA). Їх метою було зниження до мінімальних значень небезпеки серцево-судинних ускладнень при використанні аналгетиків і НПЗП. Згідно з цими рекомендаціями, вибір НПЗП слід розпочинати з напроксену — найбільш безпечного препарату щодо серцево-судинної системи [5].
Нарада експертів Європейської спільноти з ревматології (EULAR) також визнала застосування напроксену в комбінації з інгібіторами протонної помпи найбільш прийнятною стратегією в тих випадках, коли ймовірність розвитку ускладнень із боку серцево-судинної системи оцінюється як висока. Цікаво, що для спрощення вибору того чи іншого препарату даної групи з урахуванням наявності факторів ризику (як кардіоваскулярних, так і гастроінтестинальних) було запропоновано використовувати спеціальну комп’ютерну програму, у яку необхідно ввести відповідні дані про конкретного пацієнта, щоб негайно отримати рекомендацію за призначенням, — так званий калькулятор вибору НПЗП залежно від ризиків [12].
У 2014 році був вперше опублікований, а в 2016 році — оновлений алгоритм з менеджменту остеоартриту колінного суглоба, розроблений та запропонований Європейським товариством з клінічних і економічних аспектів остеопорозу та остеоартриту (ESCEO) [10, 11]. Згідно із цим алгоритмом, застосування НПЗП рекомендується на 2-му кроці за умови недостатнього ефекту парацетамолу, повільнодіючих симптом-модифікуючих препаратів та локальних форм НПЗП. При цьому вибір НПЗП рекомендується базувати на оцінці чинників ризику та безпеці препаратів: за наявності кардіоваскулярного ризику перевагу слід надавати напроксену. При цьому також рекомендується уникати високих доз диклофенаку й ібупрофену та ЦОГ-2-селективних НПЗП.
Отже, напроксен у дозі 1000 мг/добу не збільшує ризик серцево-судинних подій. Численні РКД продемонстрували, що напроксен здатний потужно гальмувати ЦОГ-1, ця дія є достатньо тривалою та інтенсивною, щоб зумовити гальмування агрегації тромбоцитів, а отже, сприяти послабленню будь-яких несприятливих судинних ефектів гальмування ЦОГ-2 [2].
Отже, найважливішою перевагою напроксену, що якісно вирізняє його від інших НПЗП, є низький ризик кардіоваскулярних ускладнень. Сьогодні це має принципове значення, оскільки небезпека розвитку серцево-судинних катастроф розглядається як основний фактор, що обмежує застосування всього класу НПЗП. Слід врахувати, що пацієнти з патологією суглобів і хребта, головним чином люди похилого віку, мають супутні захворювання серцево-судинної системи та високий індекс коморбідності, що посилює кардіоваскулярні чинники ризику. Саме для таких пацієнтів напроксен може стати препаратом вибору в боротьбі з хронічним больовим синдромом [3].
Створений у 1976 році, напроксен вже понад 30 років з успіхом використовується в Європі та вважається одним із найбільш часто вживаних НПЗП. Безперечно, що він може посісти достойне місце й у клінічній практиці українських лікарів. На сьогодні випускається Налгезін® форте — європейський напроксен у вигляді солі натрію. Завдяки такій солі таблетки Налгезін® форте швидко розчиняються й всмоктуються із шлунково-кишкового тракту, що забезпечує швидке настання знеболювального ефекту.
Напроксен має весь необхідний спектр терапевтичної активності в поєднанні з найбільш високим серед НПЗП профілем кардіоваскулярної безпеки. Таке вдале поєднання робить його ідеальним препаратом для тривалого контролю основних симптомів хронічних ревматичних захворювань.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Каратеев А.Е. Напроксен: универсальный анальгетик с минимальным риском кардиоваскулярных осложнений // Современная ревматология. — 2016. — 2. — 70-77.
2. Свиридова Н.К. Напроксен: новая стратегия снижения сердечно-сосудистого риска нестероидных противовоспалительных препаратов (научный обзор) // Международный неврологический журнал. — 2016. — 5(83). — 99-108.
3. Широков В.А. Выбор нестероидных противовоспалительных препаратов в лечении болевого синдрома с позиции кардиоваскулярной безопасности // РМЖ. — 2015. — 12. — 716-719.
4. Яременко О.Б., Федьков Д.Л. Раціональний підхід у виборі нестероїдних протизапальних препаратів для лікування хворих на остеоартроз // Український медичний часопис. — 2014. — 6(104). — 61-66.
5. Antman E., Bennett J., Daugherty A. et al. Use of Nonsteroidal Antiinflammatory Drugs. An Update for Clinicians: A Scientific Statement From the American Heart Association // Circulation. — 2007. — 115(12). — 1634-1642.
6. Anzellotti P., Capone M.L., Jeyam A. et al. Low-dose napro–xen interferes with the antiplatelet effects of aspirin in healthy subjects: recommendations to minimize the functional consequences // Arthritis Rheum. — 2011. — 63(3). — 850-859.
7. Bhala N., Emberson J., Merhi A. et al. Coxib and traditional NSAID Trialists’ (CNT) Collaboration. Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: metaanalyses of individual participant data from randomised trials // Lancet. — 2013. — 382(9894). — 769-779.
8. Bombardier C., Laine L., Reicin A. et al. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis // N. Engl. J. Med. — 2000. — 343. — 1520-1528.
9. Bresalier R.S., Sandier R.S., Quan H. et al. Cardiovascular events associated with rofecoxib in a colorectal adenoma chemoprevention trial // N. Engl. J. Med. — 2005. — 352. — 1092-1102.
10. Bruyere O., Cooper C., Pelletier J.P. et al. An algorithm recommendation for the management of knee osteoarthritis in Europe and internationally: A report from a task force of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) // Semin. Arthritis Rheum. — 2014. — 44. — 253-263.
11. Bruyère O., Cooper C., Pelletier J.-P. et al. A consensus statement on the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) algorithm for the management of knee osteoarthritis — From evidence-based medicine to the real-life setting // Semin. Arthritis Rheum. — 2016. — 45(4). — S3-S11.
12. Burmester G., Lanas A., Biasucci L. et al. The appropriate use of non-steroidal antiinflammatory drugs in rheumatic disease: opinions of a multidisciplinary European expert panel // Ann. Rheum. Dis. — 2011. — 70(5). — 818-822.
13. Fitzgerald G.A. Coxibs and cardiovascular disease // N. Engl. J. Med. — 2004. — 351. — 1709-1711.
14. Gislason G., Rasmussen J., Abildstrom S. et al. Increased mortality and cardiovascular morbidity associated with use of nonsteroidal anti-inflammatory drugs in chronic heart failure // Arch. Intern. Med. — 2009. — 169(2). — 141-149.
15. McGettigan P., Henry D. Cardiovascular risk and inhibition of cyclooxygenase // JAMA. — 2006. — 296. — 1633-1644.
16. McGettigan P., Henry D. Cardiovascular Risk with Non-Steroidal Anti-Inflammatory Drugs: Systematic Review of Population-Based Controlled Observational Studies // PLoS Med. — 2011. — 8(9). — e1001098.
17. Roumie C., Choma N., Kaltenbach L. et al. Non-aspirin NSAIDs, cyclooxygenase-2 inhibitors and risk for cardiovascular eventsstroke, acute myocardial infarction, and death from coronary heart disease // Pharmacoepidemiol. Drug Saf. — 2009. — 18(11). — 1053-1063.
18. Schiff M., Hochberg M.C., Oldenhof J., Brune K. Platelet inhibitory effects of OTC doses of naproxen sodium compared with prescription dose naproxen sodium and low-dose aspirin // Curr. Med. Res Opin. — 2009. — 25(10). — 2471-2477.
19. Solomon D., Glynn R., Levin R., Avarn J. Nonsteroidal anti-inflammatory drug use and acute myocardial infarction // Arch. Intern. Med. — 2002. — 162. — 1099-1094.
20. Trelle S., Reichenbach S., Wandel S., et al. Cardiovascular safety of non-steroidal antiinflammatory drugs: network meta-analysis // BMJ. — 2011. — 342. — 7086.
21. Varas-Lorenzo С., Riera-Guardia N., Calingaert B., et al. Myocardial infarction and individual nonsteroidal anti-inflammatory drugs meta-analysis of observational studies // Pharmacoepidemiol. Drug Saf. — 2013. — 22(6). — 559-570.
22. Zhang W., Jones A., Doherty M. Does paracetamol (acetaminophen) reduce the pain of osteoarthritis? A meta-analysis of randomised controlled trials // Ann. Rheum. Dis. — 2004. — 63. — 901-907.

/69-1.jpg)
/70-1.jpg)
/71-1.jpg)