Вступ
Неалкогольна жирова хвороба печінки (НАЖХП) розглядається в рамках печінкового компонента метаболічного синдрому й асоційована з абдомінальним ожирінням (ОЖ), інсулінорезистентністю, дисліпідемією [7–10]. Підвищення індексу маси тіла (ІМТ) понад 30 кг/м2 у 95–100 % випадків супроводжується розвитком стеатозу печінки і в 20–47 % — розвитком неалкогольного стеатогепатиту (НАСГ) [12]. Спектр клініко-морфологічних захворювань, що вкладаються у поняття жирової хвороби печінки (ЖХП), сягає від стеатозу печінки, стеатогепатиту до фіброзу печінки (ФП), цирозу печінки (ЦП) та гепатоцелюлярної карциноми (ГЦК). НАЖХП займає важливе місце в структурі не лише гастроентерологічної, але і загальнотерапевтичної патології в цілому [4].
Розвиток НАЖХП на тлі ожиріння і біліарної патології поглиблює розлад морфологічних параметрів, тому своєчасне розпізнавання стеатозу, запобігання його трансформації в стеатогепатит, який може прогресувати з формуванням фіброзу та ЦП, призводити до печінково-–клітинної недостатності та навіть до ГЦК, є однією з актуальних медико-соціальних проблем [4, 13].
На сьогодні діагностика хронічних дифузних захворювань печінки в умовах терапевтичного або гастроентерологічного стаціонару являє певні труднощі. Так, наприклад, при НАЖХП у 70 % пацієнтів відсутні відхилення в лабораторних аналізах [10, 13]. Морфологічна діагностики займає лідируючі позиції при встановленні діагнозу ЖХП різної етіології. Оскільки печінкові тести неспецифічні та не завжди корелюють з гістологічними змінами (ушкодження, запалення, фіброз), біопсія печінки, точніше її адекватна оцінка, посідає центральне місце в діагностиці ЖХП і визначенні ефективності терапевтичної дії. У наш час біопсія печінки є методом підтвердження або спростування стеатозу й залишається золотим стандартом для визначення гістологічної активності НАЖХП і ступеня фіброзу [5].
Отже, наявні морфологічні критерії дозволяють діагностувати НАЖХП і проводити диференціальну діагностику з іншими дифузними ураженнями печінки. Незважаючи на численні дослідження при НАЖХП, не до кінця залишаються з’ясованими процеси формування різних типів ФП за наявності коморбідної патології, морфологічна характеристика змін печінки на тлі ожиріння та патології біліарного тракту (БТ).
Мета дослідження — вивчення гістопатологічних особливостей стеатозу, стеатогепатиту та ФП при ЖХП неалкогольної етіології, встановлення наявності взаємозалежності між ступенем стеатозу печінки, гістологічними маркерами фіброзу та збільшенням показників ІМТ у пацієнтів з неалкогольним стеатозом печінки (НАСП) і НАСГ у поєднанні з ОЖ і патологією БТ.
Матеріали та методи
Під спостереженням перебували 70 хворих із НАЖХП, у тому числі: 48 хворих із НАСП у поєднанні з ОЖ (1 група), 22 хворі із НАСГ з ОЖ (2 група). Усі пацієнти мали супутню патологію з боку БТ: хронічний некалькульозний холецистит, хронічний калькульозний холецистит; також були хворі після лапароскопічної холецистектомії. Серед хворих було 14 (20,0 %) чоловіків та 56 (80,0 %) жінок. Середній вік пацієнтів — (53,3 ± 1,28) року.
Діагноз НАЖХП, ОЖ і патології БТ встановлено згідно з глобальними практичними рекомендаціями Всесвітньої гастроентерологічної організації (2013) WGO Global Guideline Obesity [11], стандартизованими протоколами діагностики та лікування хвороб органів травлення згідно з наказом МОЗ України № 271 від 13.06.2005 р., уніфікованим клінічним протоколом первинної, вторинної (спеціалізованої) медичної допомоги «Неалкогольний стеатогепатит» [1, 2], МКХ-10. Хворі, залучені в дослідження, не зловживали алкоголем (споживання < 50 г етанолу/тиждень для чоловіків, < 30 г етанолу/тиждень для жінок протягом останнього року). В обстежених осіб не виявлено сироваткових маркерів вірусних гепатитів В і С, автоімунних та спадкових захворювань печінки.
ІМТ визначали за формулою Кетле. Залежно від ступеня збільшення ІМТ кожна з груп хворих із НАСП (n = 48), НАСГ (n = 22) і супутнім ОЖ була розподілена на три підгрупи: з ІМТ 25–29,9 кг/м2 — надлишкова маса тіла (НМТ); з ІМТ 30–34,9 кг/м2 — ОЖ І ступеня; з ІМТ 35–39,9 кг/м2 — ОЖ ІІ ступеня.
Пункційна біопсія проводилась двома способами: інтраопераційна (під час проведення хірургічного лікування калькульозного холециститу — лапаро–скопічної холецистектомії) і черезшкірна пункційна трепан-біопсія печінки (ЧПТБП) у хворих, яким оперативне лікування не проводилось. ЧПТБП виконувалась спеціальними голками MAGNUM за допомогою загальноприйнятої методики, що полягає в аспірації матеріалу шляхом проколу печінки в дев’ятому або десятому міжребер’ях справа між передньою і середньою аксилярними лініями, в місці найбільшої печінкової тупості. Одноразово у кожного пацієнта були взяті 3 біоптати з різних зон печінки (V, VII сегменти). ЧПТБП виконували під безперервним ультразвуковим контролем, під місцевою анестезією, голкою MAGNUM розміром 16G × 20 см. Після втручання здійснювався динамічний ультразвуковий контроль упродовж 48 годин.
Матеріал фіксували в рідині Буена протягом доби при кімнатній температурі. Потім його проводили в ряді спиртів висхідної міцності через суміш спирту і хлороформу, парафінову «кашу», поміщали в парафін. Тонкі гістологічні зрізи завтовшки 5 мкм отримували за допомогою роторного мікротома. Для гістологічного дослідження зрізи забарвлювали гематоксиліном і еозином за методикою Маллорі — Слінченка [3]. Стан гістоструктури печінки оцінювали напівкількісно в системі ступенів (0 — відсутня; 1 — незначна, 3–5 %; 2 — помірна; 3 — виражена, 60–100 %), тип холестазу, ступінь хронічного запалення, ступінь білкової та жирової дистрофії. Гістологічні препарати вивчали за допомогою світлового мікроскопа «Люмам-И2».
У гістологічній діагностиці НАСП/НАСГ, а також для визначення стадії ФП використовували критерії МЕТАVIR і BRUNT [6, 14]. У діагностиці стеатозу печінки виділяли макровезикулярну, мікровезикулярну та змішану форми. Вираженість стеатозу визначали за охопленням стеатозом частин печінкових часточок: легкий стеатоз (частина перивенулярної зони), помірний стеатоз (вся перивенулярна зона) і виражений (охоплює дві або три зони печінкових часток).
Для статистичного аналізу даних використовували ліцензійну програму Statistica 6.1®. Для порівняння відносних показників у всіх підгрупах використовували критерій xі-квадрат Пірсона (χ2) і точний критерій Фішера. Для оцінки взаємозв’язку між ознаками проводився кореляційний аналіз із розрахунком коефіцієнтів рангової кореляції Спірмена (rs).
Результати та обговорення
Згідно з отриманими результатами, серед обстежених хворих на НАСП (табл. 1), що розвинувся на тлі ОЖ і патології БТ, встановлені ознаки жирової дистрофії гепатоцитів: у 28 (58,3 %) — макровезикулярного типу (рис. 1), у 9 (18,8 %) хворих — мікровезикулярного, в 11 (22,9 %) — змішаного типу, що переважно локалізувалася в зоні 3 (за Rappoport).
У більшості випадків НАСГ — 10 (45,4 %) — було встановлено макровезикулярний стеатоз (табл. 1, рис. 1), переважно у зоні 3 (центролобулярно), який характеризувався наявністю великих поодиноких ліпідних крапель, «пустих» вакуолей у цитоплазмі гепатоцитів зі зсувом ядра до периферії клітини.
/43-1.jpg )
З однаковою частотою спостерігали мікровезикулярний стеатоз — у 6 хворих (27,3 %), при якому в гепатоцитах виявляли безліч дрібних ліпідних крапель із центральним розташуванням ядра, та змішаний — у 6 хворих (27,3 %). Із частотою 72,7 % у 16 хворих при НАСГ виявляли тільця Mallory (аморфні еозинофільні скупчення гіаліну, що свідчать про виражену активність патологічного процесу в печінці). Спостерігалася лімфоїдна — у 19 (86,4 %) — або лейкоцитарна — в 11 хворих (50,0 %) — вогнищева інфільтрація навколо гепатоцитів. НАСГ у поєднанні з ОЖ і патологією БТ характеризувався наявністю фокальних центролобулярних некрозів — у 10 (45,5 %). Виявлялися перипортальні ступінчасті — у 14 (63,6 %) — або мостоподібні — у 9 хворих (40,9 %) — портоцентральні некрози гепатоцитів.
Застосування гістологічної класифікації НАСГ E. Brunt [6] дало можливість оцінити ступінь ураження гепатоцитів стеатозом (табл. 1). Зокрема, І ступінь стеатозу (м’який), при якому уражено до 33 % гепатоцитів, був встановлений у 25 (52,1 %) пацієнтів із НАСП та лише у 2 (9,1 %) хворих із НАСГ (р < 0,001). ІІ ступінь ураження стеатозом — помірний (від 33 до 66 % площі), спостерігався у 10 (20,8 %) хворих із НАСП та 13 (59,1 %) хворих із НАСГ (р < 0,05 між групами), ІІІ ступінь — виражений, було зареєстровано у 13 (27,1 %) хворих із НАСП та 7 (31,8 %) хворих із НАСГ.
За результатами кореляційного аналізу було підтверджено вищевказані припущення про те, що різні клінічні форми НАЖХП, а саме НАСП і НАСГ, призводять до формування різних ступенів стеатозу печінки (rs = 0,288; p < 0,05). Так, при НАСП частіше спостерігався м’який ступінь стеатозу, а при НАСГ — помірний.
Згідно з класифікацією E. Brunt, розрізняють три ступені гістологічної активності НАСГ. Ступінь 1 (м’який) передбачає поширення стеатозу до 66 %, наявність поодиноких гепатоцитів із балонною дистрофією (переважно в зоні 3), центролобулярну інфільтрацію нейтрофілами та лімфоцитами з відсутнім або м’яким портальним запаленням. Ступеню 1 (за E. Brunt) відповідала гістологічна картина у 4 (18,2 %) хворих із НАСГ. Ступінь 2 (помірний) передбачає стеатоз будь-якого ступеня з істотною жировою та білковою дистрофією зони 3, внутрішньочасточковою та портальною поліморфноклітинною інфільтрацією від м’якого до помірного ступеня, перицелюлярним, перисинусоїдальним фіброзом зони 3. Ступеню 2 за класифікацією E. Brunt відповідала гістологічна картина у 13 (59,1 %) хворих із НАСГ. Ступінь 3 (тяжкий) характеризується наявністю панацинарного стеатозу, балонної дистрофії гепатоцитів, внутрішньочасточкового запалення з поліморфноклітинною інфільтрацією та помірного ступеня запалення портальних трактів. Така гістологічна картина спостерігалась у 5 (22,7 %) хворих із НАСГ.
Проведений порівняльний аналіз результатів морфологічного дослідження біоптатів печінки у хворих із НАЖХП залежно від стадії процесу, типу та ступеня стеатозу дозволив у подальшому виявити залежність ступенів стеатозу печінки від параметрів ІМТ (табл. 2).
Так, у пацієнтів із НАСП і НМТ спостерігався лише І ступінь стеатозу печінки — у 17 (100 %) порівняно з 7 (43,8 %) хворими на ОЖ І ст. (р < 0,001) та 1 (6,7 %) хворим на ОЖ ІІ ст. (р < 0,001). Водночас ІІІ ступінь стеатозу був у більшої частини хворих на ОЖ ІІ ст. — 11 (73,3 %) (р < 0,001 порівняно з відповідними підгрупами хворих на НМТ і ОЖ І ст.). Слід зазначити, що при НАСГ за наявності ОЖ ІІ ст. переважав виражений стеатоз — у 6 (66,7 %) хворих, а при супутньому ОЖ І ст. у більшої частини хворих (80 %) виявлявся помірний стеатоз. М’який стеатоз у хворих із НАСГ і НМТ реєструвався лише в 2 (25 %) випадках (р < 0,001 порівняно з відповідною підгрупою пацієнтів з НАСП).
Пряму залежність вираженості стеатозу печінки у хворих із різними клінічними формами ЖХП від ІМТ підтверджено і результатами кореляційного аналізу: при НАСП — rs = 0,798 (p < 0,001), при НАСГ — rs = 0,678 (p < 0,001).
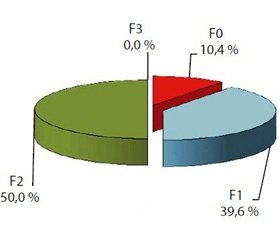
Аналіз результатів гістопатологічного дослідження формування ФП у хворих із НАЖХП у поєднанні з ОЖ і патологією БТ виявив (рис. 2), що фіброз першої стадії (F1) за E. Brunt та згідно з METAVIR спостерігався у 19 (39,6 %) пацієнтів з НАСП та у 5 (22,7 %) з НАСГ (р > 0,05). Друга стадія фіброзу (F2) фіксувалася у 24 (50,0 %) хворих із НАСП та у 7 (31,8 %) із НАСГ (р > 0,05). F3 стадія фіброзу виявлялася лише в групі хворих із НАСГ — у 10 (45,5 %) (р < 0,001). Водночас у хворих із НАСП на тлі ожиріння у 5 (10,4 %) випадках реєстрували нульову стадію фіброзу. Таким чином, у хворих із НАСП частіше спостерігалася F1 та F2 стадії фіброзу (50,0 %), у той час як у пацієнтів з НАСГ частіше були зареєстровані F2 та F3 стадії фіброзу (77,3 %) (р < 0,05 між групами НАСП і НАСГ). Про наявність помірного взаємозв’язку між стадією ФП і клінічними формами НАЖХП свідчить і вірогідний коефіцієнт кореляції — rs = 0,452 (p < 0,001). F4 стадію у цього контингенту осіб виявлено не було.
Аналізуючи особливості фібротичних змін у печінці хворих із НАЖХП у поєднанні з ОЖ і патологією БТ, а саме їх локалізацію та поширеність, авторами було встановлено наявність усіх видів фіброзу, притаманних хронічним дифузним захворюванням печінки, однак вони зустрічалися з різною частотою та ступенем вираженості (рис. 3). Встановлено, що серед хворих із НАЖХП фіброз навколо гепатоцитів (перицелюлярний) спостерігався у 34 (70,8 %) пацієнтів з НАСП (рис. 4) та у 18 (81,8 %) випадках при НАСГ (р > 0,05 між групами). Характерною особливістю фіброзу при НАЖХП є первинний розвиток перивенулярного фіброзу 3 зони гепатоцитів, який виявлявся як на ранніх стадіях НАЖХП, а саме у хворих із НАСП — у 23 (47,9 %), так і при прогресуванні захворювання у хворих із НАСГ (рис. 5) — у 13 (59,1 %).
/45-1.jpg )
При формуванні надмірного синтезу позаклітинного матриксу та відкладенні його у просторі Діссе у хворих із НАЖХП розвивається перисинусоїдальний тип фіброзу, який ми спостерігали приблизно з однаковою частотою у 16 (33,3 %) хворих із НАСП та у 7 (31,8 %) хворих із НАСГ. Відповідно до класифікації Е. Brunt, різний ступінь розвитку перицелюлярного, перивенулярного та перисинусоїдального фіброзу характерний для F1 стадії фіброзу при НАЖХП. Перехід до F2 стадії асоційований із приєднанням до зазначених типів фіброзу перипортального та/або портального фіброзу, що частіше відзначались у хворих із НАСГ, ніж у хворих із НАСП. Так, частота перипортального фіброзу при НАСГ (77,3 %) у 2,2 раза перевищувала таку при НАСП (35,4 %) з р < 0,001, а портальний фіброз при НАСГ (рис. 5) виявлявся у 1,4 раза частіше — у 15 (68,2 %), ніж при НАСП — у 23 (47,9 %). Мостоподібний тип фіброзу, що виявляється при переході до F3 стадії фібротичних змін, у нашому дослідженні також спостерігався частіше у хворих із НАСГ — у 9 (40,9 %) проти 4 (8,3 %) хворих із НАСП (р < 0,001). Слід відзначити, що такий тип фіброзу печінки, за даними літератури [14], в основному спостерігається при різних хронічних гепатитах і сприяє ускладненому кровопостачанню тканин печінки. Із вищевикладеного зрозуміло, що у хворих із НАЖХП у поєднанні з ОЖ і патологією БТ найчастіше зустрічається змішаний тип фібротичних змін. Водночас у 6 (27,3 %) хворих із НАСГ був зареєстрований перидуктулярний тип фіброзу (р < 0,001 порівняно з групою НАСП), який характеризується розростанням фіброзної тканини навколо жовчних канальців.
Таким чином, у хворих із НАЖХП у поєднанні з ОЖ і патологією БТ було встановлено фіброз печінки змішаного типу з переважанням перипортального, портального, мостоподібного та перидуктулярного фіброзу в групі пацієнтів з НАСГ і порівнянною частотою перицелюлярного, перивенулярного та перисинусоїдального фіброзу при НАСП та НАСГ.
Істотну роль у прогресуванні досліджуваної коморбідної патології відіграє збільшення параметрів ІМТ, тому нами в подальшому було проведено аналіз розподілу хворих залежно від стадії фіброзу та ІМТ (рис. 6).
Згідно з отриманими даними, у пацієнтів з НАСП у поєднанні з ОЖ і патологією БТ при наявності НМТ частіше спостерігалася F1 стадія ФП — у 10 (58,8 %) хворих, у той час як при ОЖ І ст. та ОЖ ІІ ст. переважала F2 стадія фібротичних змін — у 8 (50,0 %) і 12 (80,0 %) випадках відповідно.
На відміну від групи НАСП у пацієнтів з НАСГ у поєднанні з ОЖ і патологією БТ (рис. 6) стадія F0 не виявлялася зовсім. Для хворих із НМТ була здебільшого характерна F1 стадія ФП — у 5 (62,5 %), а при наявності ОЖ І та ОЖ ІІ ступеня — F3 стадія фібротичних змін — у 3 (60,0 %) та 7 (77,8 %) випадках відповідно (р < 0,01 і р < 0,001 порівняно з відповідними показниками у групі НАСП).
Отже, при збільшенні параметрів ІМТ у хворих досліджуваних груп поглиблюються фібротичні процеси з наявністю F0 стадії при НМТ у хворих із НАСП до F3 стадії при ОЖ ІІ ст. у пацієнтів з НАСГ. Означені закономірності підтверджені результатами кореляційного аналізу: коефіцієнти кореляції між ІМТ і стадією ФП дорівнюють при НАСП — rs = 0,464 (p < 0,001), при НАСГ — rs = 0,759 (p < 0,001).
Результати проведених досліджень свідчать про необхідність аналізу структури фібротичних змін за локалізацією та поширеністю у хворих із НАЖХП у поєднанні з ОЖ і патологією БТ залежно від параметрів ІМТ (табл. 3).
У табл. 3 наведені дані пацієнтів з НАСП, у яких перипортальний і портальний ФП вірогідно частіше спостерігався при супутньому ОЖ ІІ ст. — у 8 (53,3 %) та 12 (80,0 %) відповідно, ніж у хворих із НМТ (від р < 0,05 до р < 0,001). Водночас мостоподібний фіброз виявлявся лише у 4 (26,7 %) пацієнтів з ОЖ ІІ ст. при р < 0,05 щодо хворих із НМТ та ОЖ І ст. Отримані дані, ймовірно, свідчать, що при збільшенні ІМТ поглиблюються фібротичні зміни у печінці від перицелюлярного та перисинусоїдального ФП, що, згідно з класифікацією Е. Brunt, виявляються при F1 стадії ФП, до портального та мостоподібного фіброзу при F3 стадії у хворих з ОЖ ІІ ст.
Пряма залежність формування перипортальних, портальних і мостоподібних фібротичних змін у печінці хворих із НАСП від ІМТ підтверджена і даними кореляційного аналізу — rs = 0,360 (p < 0,05), rs = 0,509 (p < 0,001) і rs = 0,381 (p < 0,01) відповідно.
Проведений розподіл ФП за локалізацією та поширеністю у хворих із НАСГ залежно від ІМТ демонструє аналогічний напрямок змін (табл. 4). Зокрема, мостоподібний ФП і поява перидуктулярного ФП виявлялися в більшості випадків — 7 (77,8 %) та 5 (55,6 %) відповідно, при наявності ОЖ ІІ ст. щодо пацієнтів з НМТ та ОЖ І ст. (від р < 0,05 до р < 0,01).
За результатами кореляційного аналізу було підтверджено вказані вище припущення про те, що підвищення ІМТ у хворих із НАСГ у поєднанні з ОЖ і патологією БТ призводить до різного поглиблення фібротичних змін у печінці, а саме формування мостоподібного фіброзу (rs = 0,694; p < 0,001) та появи перидуктулярного фіброзу (rs = 0,439; p < 0,05).
Таким чином, у хворих із НАЖХП у поєднанні з ОЖ і патологією БТ встановлено наявність фібротичних змін у печінковій тканині вже на етапі розвитку стеатозу печінки. При НАСП переважають F1 та F2 стадії ФП, при НАСГ — F2 та F3 стадії. При збільшенні параметрів ІМТ серед хворих досліджуваних груп поглиблюються фібротичні процеси з наявністю F0 стадії при НМТ у хворих із НАСП до F3 стадії при ОЖ ІІ ст. у пацієнтів з НАСГ. При коморбідному перебігу НАЖХП характерним є змішаний тип фіброзу з первинним розвитком перицелюлярного, перисинусоїдального, перивенулярного фіброзу та розвитком при подальшому прогресуванні портального, мостоподібного та в деяких випадках перидуктулярного типу ФП за наявності супутнього ОЖ ІІ ст. у пацієнтів з НАСГ.
Узагальнені патоморфологічні параметри НАСП і НАСГ у поєднанні з ОЖ і патологією БТ наведені у табл. 5.
Аналізуючи отримані дані, автори виявили, що за коморбідного перебігу НАЖХП у хворих із НАСГ, який розвинувся на тлі ОЖ і БП, основними складовими можна вважати більш виражений стеатоз (р > 0,05), наявність некрозів з вираженою більшістю ступінчастих некрозів (р < 0,001), змішаний фіброз з переважанням перигепатоцелюлярного (р > 0,05), перивенулярного (р > 0,05), портального (р > 0,05) і перипортального (р < 0,001) типів, з появою мостоподібного (р < 0,001) та перидуктулярного типів (р < 0,001), наявність тілець Mallory (р < 0,001) на тлі лімфо- та лейкоцитарної інфільтрації (р < 0,001) портальних трактів, вогнищ некрозу з наявністю цитоплазматичного холестазу (р < 0,001), що значно відрізняє цих пацієнтів від хворих із коморбідним перебігом НАСП.
Висновки
1. У більшості випадків НАСП (58,3 %) та НАСГ (45,4 %) було встановлено макровезикулярний стеатоз. Різні клінічні форми НАЖХП, а саме НАСП і НАСГ, призводять до формування різних ступенів стеатозу печінки (rs = 0,288; p < 0,05), зокрема, при НАСП частіше спостерігався м’який ступінь стеатозу (52,1 %), а при НАСГ — помірний (59,1 %).
2. Виявлено пряму залежність вираженості стеатозу печінки у хворих із різними клінічними формами ЖХП від ІМТ: коефіцієнти кореляції при НАСП — rs = 0,798 (p < 0,001), при НАСГ — rs = 0,678 (p < 0,001).
3. У хворих із НАСП частіше спостерігалися F1 та F2 стадії фіброзу (50,0 %), у той час як у пацієнтів з НАСГ частіше були зареєстровані F2 та F3 стадії фіброзу (77,3 %) (р < 0,05 між групами НАСП і НАСГ). Про наявність помірного взаємозв’язку між стадією ФП і клінічними формами НАЖХП свідчив і вірогідний коефіцієнт кореляції — rs = 0,452 (p < 0,001).
4. При збільшенні параметрів ІМТ серед хворих досліджуваних груп поглиблюються фібротичні процеси з наявністю F0 стадії при НМТ у хворих із НАСП до F3 стадії при ОЖ ІІ ст. у пацієнтів з НАСГ. Означені закономірності підтверджені результатами кореляційного аналізу: коефіцієнти кореляції між ІМТ і стадією ФП дорівнюють при НАСП — rs = 0,464 (p < 0,001), при НАСГ — rs = 0,759 (p < 0,001).
5. При коморбідному перебігу НАЖХП характерним є змішаний тип фіброзу з первинним розвитком перицелюлярного, перисинусоїдального, перивенулярного фіброзу у хворих із НАСП і розвитком при подальшому прогресуванні портального, мостоподібного та в деяких випадках перидуктулярного типу ФП за наявності супутнього ОЖ ІІ ст. у пацієнтів із НАСГ.
Перспективи подальших досліджень полягають у вивченні морфологічних особливостей у хворих із коморбідним перебігом НАЖХП залежно від наявності різної патології з боку біліарного тракту.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/43-2.jpg )
/43-1.jpg )
/44-1.jpg )
/45-1.jpg )
/46-1.jpg )
/47-1.jpg )
/48-1.jpg )