Введение
Увеличение лимфатических узлов (ЛУ) — один из наиболее часто встречающихся симптомов в практике врачей многих специальностей, особенно педиатров [1–5].
ЛУ вместе с селезенкой, миндалинами и лимфоидной тканью относятся к периферическим органам иммунной системы, препятствуя поступлению в лимфу и кровь различных микроорганизмов и их токсинов. Поэтому при многих инфекционных заболеваниях отмечается реакция ЛУ в виде их увеличения, воспаления или пролиферации, обозначаемая общим термином «лимфаденопатия» (ЛАП) [6–10].
ЛАП является ранним симптомом как инфекционных, так и других сложных для диагностики заболеваний: болезней накопления, лимфопролиферативных заболеваний, злокачественных опухолей [11–15].
Поэтому вопросы дифференциальной диагностики ЛАП различной этиологии всегда остаются актуальными.
Цель: предоставить клинико-этиологическую характеристику ЛАП у детей, находившихся под наблюдением в областной детской инфекционной клинической больнице г. Харькова.
Материалы и методы
В работе представлены данные наблюдения и обследования 87 больных в возрасте от 4 до 18 лет с синдромом ЛАП различного генеза.
Использовались клинико-анамнестические, серологические, цитологические, гистологические, иммуногистохимические, а также инструментальные (ультразвуковое исследование (УЗИ), компьютерная томография) методы диагностики.
Серологическая диагностика осуществлялась методом иммуноферментного анализа с определением специфических антител IgM, IgG в сыворотке крови к следующим инфекционным агентам: герпесвирусам (1–6-го типов), вирусу краснухи, парвовирусу В19, а также Chlamidia pneumoniae, Mycoplasma, Toxoplasma gondii. К ряду инфекционных агентов определялся индекс авидности антител IgG, а также использовался молекулярно-генетический метод — полимеразная цепная реакция (ПЦР), ее количественный или качественный анализ.
Правильному ведению больного с ЛАП способствовал тщательно собраный анамнез с уточнением эпидемиологического анамнеза, длительности заболевания, наличия воспалительных очагов в органах. Проводилась пальпация всех групп ЛУ, определялась спаянность их с кожей и между собой.
Результаты и обсуждение
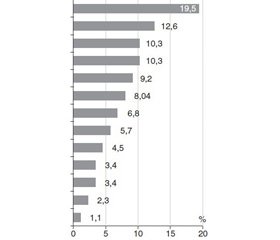
Проведенные исследования показали, что у 68 (78,7 %) больных ЛАП была проявлением инфекционных или паразитарных заболеваний; у 2 (2,3 %) диагностирован туберкулез, у 1 (1,1 %) диагностирована ВИЧ-инфекция. У 7 (8,04 %) детей увеличение ЛУ оказалось результатом лимфопролиферативных заболеваний. У 9 (10,3 %) больных этиологию ЛАП уточнить не удалось (рис. 1).
Среди инфекционных патогенов преобладали представители семейства герпесвирусов в виде моно- или микст-инфекции. Наиболее часто определялся вирус Эпштейна — Барр (ВЭБ) — 19,5 %, реже — цитомегаловирус (ЦМВ) — 9,2 %. Среди смешанной герпесвирусной инфекции выявлялось сочетание 2 или 3 вирусов: ВЭБ + ЦМВ, ВЭБ + ВГЧ-6, ВЭБ + ЦМВ + ВГЧ-6. У таких детей наряду с синдромом ЛАП отмечался длительный субфебрилитет (более 1 мес.), гепатолиенальный синдром. Это обусловлено способностью β- и γ-герпесвирусов поражать иммунокомпетентные клетки с развитием иммунопатологических реакций и хронического процесса.
ЛАП, обусловленные боррелиями, хламидиями, составили 10,3 и 6,8 % соответственно. В единичных случаях причиной заболевания были стрептококк, паразитарные инвазии. У 9 (10,3 %) больных этиологию ЛАП уточнить не удалось. Интересным оказался тот факт, что у большинства пациентов (6) в семье жили кошки, неоднократно у больных на коже отмечались царапины. Исследования на хламидиоз и токсоплазмоз получены отрицательные. Мы предполагаем в этой группе больных бартонеллез, но, к сожалению, возможности его диагностики ограниченны.
Основным клиническим симптомом независимо от этиологии заболевания у всех больных была ЛАП. Увеличенными считались шейные и подмышечные ЛУ более 1 см, паховые — более 1,5 см.
При инфекционных заболеваниях в патологический процесс наиболее часто вовлекались подчелюстные, шейные, затылочные, подмышечные ЛУ. Увеличение шейных ЛУ встречалось более чем в 50 % от всех случаев их гиперплазии. Локализация не была строго специфичной, в то время как при онкогематологических заболеваниях характерным было поражение надключичных, шейных, мезентериальных, медиастинальных ЛУ (табл. 1). Обращали на себя внимание размеры ЛУ. Чем больше ЛУ, тем выше вероятность злокачественного процесса, особенно если увеличение ЛУ отмечалось длительное время, сопровождалось лихорадкой неясного генеза, снижением массы тела, потливостью, общим недомоганием ребенка.
Для таких заболеваний, как боррелиоз, фелиноз (болезнь кошачьих царапин), характерна локализованная ЛАП (увеличение шейных, подмышечных или кубитальных ЛУ), которая может быть ранним, а иногда и единственным проявлением заболевания.
Известно, что патогномоничным симптомом ранней стадии Лайм-боррелиоза (ЛБ) является кольцевидная мигрирующая эритема — специфическое поражение кожи, появляющееся на месте присасывания клеща и часто сопровождающееся регионарной ЛАП. Однако большое количество случаев ЛБ протекает без мигрирующей эритемы, в этом случае диагноз вызывает определенные трудности.
Интересным является следующее наблюдение. Больной Л., 6 лет, заболел остро, когда через 2 недели после укуса клеща в правую мочку уха повысилась температура тела до 38 °С, увеличился переднешейный ЛУ справа до 1,5–2 см в диаметре, отмечалась болезненность при пальпации. Лечился амбулаторно под наблюдением педиатра, получал лексин в течение 5 дней. Состояние улучшилось, температура тела нормализовалась, ЛАП сохранялась. Через месяц после укуса клеща состояние ребенка ухудшилось, появилась неврологическая симптоматика: асимметрия лица, слабость мышц лица справа, логофтальм, сглаженность носогубной складки, опущение угла рта при оскале, слезотечение, затем присоединилось поражение лицевого нерва слева. Диагностирована двусторонняя нейропатия лицевых нервов. Лихорадка, положительные менингеальные симптомы, головная боль дали возможность заподозрить менингит. Была проведена люмбальная пункция, выявлены воспалительные изменения в ликворе (цитоз — 233 × 106/л (лимфоциты — 97 %, нейтрофилы — 3 %), белок — 0,55 г/л; содержание сахара и хлоридов — в пределах нормы), указывающие на серозный менингит. В результате обследования сыворотки крови методом иммуноферментного анализа были выявлены специфические антитела (IgM и IgG к Borrelia burgdorferi), что позволило диагностировать системный клещевой боррелиоз, безэритемную форму, острое течение, серозный менингит, двустороннюю нейропатию лицевого нерва.
На фоне проведенной комплексной терапии системного боррелиоза состояние ребенка улучшилось: санирован ликвор, регрессировала неврологическая симптоматика. Выписан по выздоровлению без остаточных явлений.
Клиническое наблюдение свидетельствует о том, что маркером ранней стадии ЛБ может быть регионарная ЛАП без эритематозной формы. Назначение адекватной антибактериальной терапии на стадии ЛАП позволило бы избежать вовлечения в патологический процесс нервной системы и значительно улучшить течение и прогноз при ЛБ.
У 7 (8,04 %) больных увеличение ЛУ оказалось результатом онко- и лимфопролиферативных заболеваний. В данном случае наиболее часто были поражены шейные или надключичные ЛУ.
Традиционные методы исследования не позволили установить этиологию ЛАП, поэтому проводилась биопсия ЛУ с последующим гистологическим исследованием. Гистологическое исследование показало, что у 4 больных имела место лимфома Ходжкина (лимфогранулематоз — ЛГМ), у 3 — неходжкинская лимфома.
Диагноз лимфомы Ходжкина устанавливался на основании клинико-анамнестических данных (длительность заболевания, лихорадка до 38 °С в вечернее время, повышенная потливость, особенно в ночное время, потеря массы тела от 5 до 10 % в течение 4–6 месяцев), выявления в гистологических препаратах специфических гигантских многоядерных клеток Березовского — Рида — Штейнберга или их предшественников — клеток Ходжкина.
Использование гистологического, а для идентификации лимфом — иммуногистохимического исследования позволило диагностировать лимфобластную лимфому (2), а также лимфому Беркитта спорадического типа (1). Кроме этих исследований, в последние годы появилась возможность для уточнения иммунофенотипа опухоли проводить проточную цитофлю–ориметрию, цитогенетическое исследование и молекулярную ПЦР.
Сложность дифференциальной диагностики ЛАП и ведущее значение в этих случаях цитологического и гистологического методов исследования показывает следующее клиническое наблюдение.
Больной К., 18 лет, обратился к врачу по месту жительства с жалобами на субфебрильную температуру тела в течение 2 недель, повышенную утомляемость, увеличение лимфоузлов. Лечился амбулаторно (гропринозин, нурофен), состояние не улучшалось. Клинические симптомы заболевания сохранялись, в связи с чем был направлен на консультацию к инфекционисту с диагнозом «инфекционный мононуклеоз».
В анамнезе частые острые респираторные инфекции, инфекционный мононуклеоз. При осмотре кожный покров бледный, чистый. Слизистая оболочка ротоглотки незначительно гиперемирована в области дужек, миндалины увеличены, свободны от налетов. Справа пальпировались увеличенные до 1,5 см шейные и подчелюстные лимфоузлы, не спаянные с окружающими тканями, безболезненные; слева на шее определялся конгломерат плотных, безболезненных лимфатических узлов. Печень пальпировалась до 2 см ниже края реберной дуги, селезенка увеличена до 3 см.
В клиническом анализе крови: Hb — 102 г/л, эр. — 3,8 × 1012/л, L — 17 × 109/л, п/я — 4 %, с/я — 46 %, л. — 42 %, м. — 8 %, скорость оседания эритроцитов — 33 мм/ч. Биохимические пробы печени — в пределах нормы.
В связи с подозрением на ИМ обследован на маркеры ВЭБ, ЦМВ, ВГЧ-6. Обнаружены EBV-VCA IgG и EBV-NA IgG к ВЭБ в высоком титре (2,34 при норме до 0,3), маркеры острой фазы отрицательные.
На основании клинико-лабораторных данных у больного диагностирована ВЭБ-инфекция, хроническая форма, инфекционный мононуклеоз? Назначена противовирусная терапия (ацикловир). Самочувствие несколько улучшилось, нормализовалась температура тела, однако синдром лимфаденопатии сохранялся. Через 7 дней после отмены терапии вновь отмечался подъем температуры до субфебрильных цифр. Больной был направлен на консультацию к онкологу для исключения лимфопролиферативного заболевания.
Больному были проведены рентгеноскопия легких, ультразвуковое исследование всех групп лимфоузлов. Установлено увеличение подчелюстных лимфатических узлов справа и шейных с двух сторон. Произведена пункционная биопсия лимфатических узлов шеи слева. При цитологическом исследовании в пунктате обнаружены клетки Березовского — Штернберга. Гистологическое заключение — лимфогистиоцитарный вариант ЛГМ. Учитывая поражение двух групп лимфатических узлов по одну сторону диафрагмы, установлен диагноз «лимфома Ходжкина IIБ стадии». Персистирующая ВЭБ-инфекция, возможно, явилась триггерным фактором в развитии лимфопролиферативного заболевания.
Проведенные исследования позволили разработать алгоритм дифференциальной диагностики поражений ЛУ у детей. В предполагаемом алгоритме дифференциальная диагностика проводится на нескольких уровнях:
— клинико-анамнестическом;
— гематологическом;
— иммунологическом;
— серологическом;
— инструментальном (УЗИ, компьютерная томо–графия);
— морфологическом;
— иммуногистохимическом.
Только совокупность нескольких диагностических критериев разного уровня помогает разрешить сомнения в постановке правильного диагноза.
Выводы
1. ЛАП является только симптомом, а не нозологической формой заболевания, которое требует этиологической расшифровки.
2. В этиологии ЛАП у детей в 78 % случаев выявлена инфекционная патология, в структуре которой преобладают вирусные агенты. Наиболее часто диагностированы ВЭБ (19,5 %) или смешанная герпесвирусная инфекция (12,6 %).
3. У 8 % детей увеличение ЛУ оказалось результатом лимфопролиферативных заболеваний. В этих случаях биопсия ЛУ с последующим морфологическим или иммуногистохимическим исследованием является решающей в постановке окончательного диагноза.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Kornienko GV, Dmitriakov VA, Svekatun VN. A clinical case of tuberculous cervical lymphadenitis in a 10-year-old-boy. Sovremennaya pediatriya. 2017;4(84):120-123 (in Russian). doi 10.15574/SP.2017.84.120.
2. Pasiyeshvili LM. Lymphadenopathy: definytion and diagnosis. Skhіdnoєvropeis'kii zhurnal vnutrіshn'oї ta sіmeinoї meditsini. 2016;1:46-56 (in Russian).
3. Sаvvо ОM. Klіnіko-іmunologіchna kharakteristika perebіgu lіmfadenopatії u dіtei, iakі chasto khvorіiut' [Clinical-immune cha–racteristic of lymphadenopathy course at often ill children]. Donetsk: Donets. nats. med. un-t іm. M. Gor'kogo; 2011. 20 p. (in Ukrainian).
4. Goncharov IaP, Sapozhnikov AR, Petrusha AO. Differential diagnosis of generalized lymphadenopathy. Terapiia. 2011;9:66-70 (in Russian).
5. Sarsu SB, Sahin K. A retrospective evaluation of lymphadenopathy in children in a single center's experience. J Pak Med Assoc. 2016;66(6):654-7. PMID: 27339563.
6. Kopcha VS, Kadubets OIa. Peripeteias of bartonellosis diagnostics. Іnfektsіinі khvorobi. 2016;1:73-76 (in Ukrainian). doi: 10.11603/1681-2727.2016.1.5964.
7. Sokolova TF, Dolgikh TI, Turok NE. Clinical and laboratory parallels of herpesviral infections associated with lymphadenopathy in children. Pediatriya. 2011;4:70-72 (in Russian).
8. Bogadel'nikov IV, Khamid F, Kubyshkin AV. Limfadenopatii pri infektsionnykh zabolevaniiakh u detei [Lymphadenopathy in infectious diseases in children]. Donetsk: Zaslavskii A.Iu; 2013. 224 p. (in Russian).
9. Nkaoui M, El Bardouni A, Lazrek O et al. Elbow abscess revealing cat-scratch disease: about a case. Pan Afr Med J. 2017;27:67. doi: 10.11604/pamj.2017.27.67.12427 (in French).
10. Popgeorgiev N, Michel G, Lepidi H, Raoult D, Desnues C. Marseillevirus adenitis in an 11-month-old child. J Clin Microbiol. 2013;51(12):4102-5. doi: 10.1128/JCM.01918-13.
11. Jalilov AF. Non-Hodgkin’s lymphoma: principles of classification and immunocytochemical diagnosis. Onkologiia. 2013;4:264-272 (in Russian).
12. Samochatova EV, Shelikhova LN, Miakova NV, Litvinov DV. Opportunities and problems of modern therapy for non-Hodgkin's lymphomas in children and adolescents. Pediatriya. 2011;4:37-43 (in Russian).
13. Papp ZE, Kelemen I, Horváth A. Early symptoms of childhood malignant diseases. Orv Hetil. 2017;158(21):829-834. doi: 10.1556/650.2017.30756.
14. Farndon S, Behjati S, Jonas N, Messahel B. How to use… lymph node biopsy in paediatrics. Arch Dis Child Educ Pract Ed. 2017;102(5):244-248. doi: 10.1136/archdischild-2015-309634.
15. Celenk F, Baysal E, Aytac I et al. Incidence and predictors of malignancy in children with persistent cervical lymphadenopathy. Int J Pediatr Otorhinolaryngol. 2013;77(12):2004-7. doi: 10.1016/j.ijporl.2013.09.022.

/25-1.jpg)