Несмотря на то что назначение эффективных препаратов, изменяющих течение рассеянного склероза (ПИТРС), снижает риск частоты развития обострений, проблема лечения обострений сохраняется. Среди препаратов, одобренных FDA в период с 1993 по 1996 год: интерферон (ИФН) бета-1а снижает среднегодовую частоту рецидивов на 18 %; интерферон бета-1b — на 31 %; глатирамера ацетат — на 29 %. Среди препаратов, одобренных FDA в период с 2004 по 2013 год: натализумаб снижает среднегодовую частоту рецидивов на 67 %; финголимод — на 55 %; терифлуномид — на 36 %; диметилфумарат — на 53 %. Эти результаты показывают, что остаточный риск обострений сохраняется, несмотря на прием ПИТРС [1–4]. Представленные данные получены в разных клинических исследованиях, поэтому надо признать, что прямое сопоставление данных не вполне корректно, сравнительные же исследования проводятся недостаточно.
Обострение рассеянного склероза (РС) — появление нового или ухудшение уже имевшихся симптомов, возникающее после стабильного состояния или периода улучшения, длившегося не менее 1 месяца [5], представляет собой формирование нового очага/очагов воспаления с развитием демиелинизации, расположенных в любом сегменте центральной нервной системы (ЦНС) [6]. Каждый эпизод обострения вносит вклад в развитие стойкого неврологического дефицита и, как следствие, приводит к развитию инвалидизации.
Различная локализация воспалительных очагов в ЦНС обусловливает многообразие клинических проявлений. Особое внимание следует уделить клинически значимым зонам — инфратенториальные очаги (расположены ниже намета мозжечка) часто локализуются в ножках мозжечка; очаги в мосту нередко прилежат к четвертому желудочку; к ним приравниваются очаги в спинном мозге. Возможно появление очагов в «немых зонах», которые не сопровождаются клиническими проявлениями. Применение гадолиния позволяет проводить дифференциальную диагностику между очагами активного воспаления, очагами в стадии затухающего обострения и хроническими неактивными очагами [7, 8]. Многие авторы считают, что процесс можно отнести к активному, если при динамическом контроле отмечается: появление новых бляшек; реактивация старых поражений; увеличение размеров поражений (на 70 % при первоначальном размере бляшки до 1 см и на 10 % — при большем первоначальном объеме) [9].
Следует отметить, что динамический контроль далеко не всегда позволяет однозначно оценить активность заболевания в связи с наблюдаемой пестрой картиной: одни бляшки исчезают, другие появляются, зоны поражения увеличиваются и уменьшаются в размерах одновременно [9, 10]. Демиелинизация как очередная стадия развития очагов при рассеянном склерозе также может быть определена на магнитно-резонансной томографии (МРТ) (выпадение короткого эхо Т2-сигнала). На данном этапе целесообразно использование магнитно-резонансной спектроскопии (МРС), с помощью которой возможно определить активность процесса на ранних стадиях и, кроме того, оценить биохимические и нейрофизиологические проявления демиелинизации [11]. Активные очаги обычно прогрессируют к хроническим необратимым очагам (с различной степенью потери нейронов/аксонов), поскольку воспалительная активность уменьшается, отек устраняется, репаративные механизмы, такие как ремиелинизация, становятся активными. Эти патологические изменения также могут быть продемонстрированы с использованием 1H-MRS и рассматриваются как изменения спектральной картины [12, 13]. Среди более общепризнанных изменений наблюдается прогрессивное возвращение лактата (Lac) к нормальному уровню в течение недель, в то время как уровни Cho и липидов уменьшаются в течение нескольких месяцев, но не всегда возвращаются к нормальным значениям. Также может быть обнаружено умеренное увеличение Cr, вероятно, связанное с глиозом и ремиелинизацией [13]. NAA может далее уменьшаться, указывая на прогрессирующее повреждение нейронов/аксонов, или демонстрировать частичное восстановление в течение нескольких месяцев без достижения нормального уровня. Это выздоровление не может быть объяснено просто устранением отеков и воспалений; важную роль также играют другие процессы, такие как увеличение диаметра ранее пораженных аксонов, вторичных по отношению к ремиелинизации, и обратимые метаболические изменения в нейронных митохондриях [14, 15].
В ряде случаев терапия обострений РС вызывает определенные сложности. Клиницист должен различать истинные обострения, колебания симптомов и псевдообострения. Провоцирование явлений, сходных с обострениями, возможно при приеме горячих ванн, резком повышении температуры окружающей среды, переезде в другой климатический пояс, приеме ряда медикаментов.
Значительное время лечение РС сводилось к лечению обострений, которое имеет длительную историю. В середине прошлого века в лечении обострений РС в качестве золотого стандарта стали использовать адренокортикотропный гормон (АКТГ), тогда же было проведено первое контролируемое клиническое испытание Н. Miller (1961) [17]. В наше время основным методом лечения обострений РС считается внутривенное введение метилпреднизолона. В некоторых случаях, особенно при тяжелых обострениях и высокой их частоте, используется короткий курс дексаметазона внутривенно (реже — внутримышечно). Также возможно использование плазмафереза, цитостатиков и их сочетания с кортикостероидами при тяжелых обострениях РС. В некоторых случаях, особенно при высокой частоте обострений, непереносимости метилпреднизолона или прогрессировании заболевания, используют синтетический аналог АКТГ — синактен депо (по 1,0 мл в день внутримышечно ежедневно в течение 3 дней, затем по 1,0 мл в день внутримышечно через 2 дня на 3-й — 7 раз).
Нам представилось целесообразным описать собственное клиническое наблюдение терапии сложного обострения РС с выполнением МР-спектроскопии как оценки метаболического ответа на терапию до и после курса лечения.
Пациентка Д.П., 1972 года рождения, поступила в отделение функциональной неврологии Института мозга человека им. Н.П. Бехтеревой с жалобами на выраженную слабость, повышенную утомляемость, головокружение, шаткость при ходьбе (походка неустойчивого характера), птоз правого века.
Анамнез заболевания. Первые симптомы заболевания появились в июле 2012 года — на 5-м месяце беременности эпизод слабости в левой ноге 2 часа, к врачу не обращалась, купировался самостоятельно. В августе 2012 возникла слабость/неловкость в левой руке. К врачу также не обращалась, полное регрессирование симптомов в течение 1–1,5 месяца. В ноябре 2012 на 8-м месяце беременности остро развилась шаткость походки, к врачу не обращалась. Март 2013 года — нарастание шаткости походки, нечеткость речи. МРТ головного мозга (ГМ) — множественные очаги, типичные для РС. Диагноз «рассеянный склероз» установлен в мае 2014 года (ГЦРС), назначена терапия ПИТРС — высокодозные интерфероны (инфибета, ребиф). В 2015 году переведена на терапию глатирамера ацетатом вследствие непереносимости высокодозных интерферонов. Декабрь 2016 года — усиление шаткости, головокружения, птоз правого верхнего века. EDSS 6,5 балла. Проведена пульс-терапия солу-медролом 1000 № 5 с незначительным улучшением (1 неделя), однако с января состояние ухудшилось — выраженная шаткость при ходьбе, головокружение, усиление птоза. МРТ ГМ с контрастированием 28.01.17 — множественные очаги демиелинизации, активная фаза. С 02.02.17 прошла курс плазмафереза. После третьей процедуры плазмафереза EDSS прежний, субъективно — нарастание шаткости при ходьбе.
При поступлении. Общее состояние удовлетворительное. Эмоциональный фон стабилен. Зрение не нарушено. Зрачки D = S. Фотореакция живая. Движения глазных яблок: полностью ограничено отведение влево обоих глазных яблок. Элементы правосторонней МЯО. Диплопии нет. Нистагм умеренный от 30 градусов при взгляде вправо, вверх. Мимические пробы выполняет симметрично. Глотание не нарушено. Легкая дизартрия. Мышечный тонус слегка повышен в левой руке. Сила мышц: снижена дельтовидная мышца слева — 4 балла, сгибатели предплечья слева — 4 балла, сгибатели и разгибатели кисти слева — 3 балла, межкостные мышцы слева — 3 балла, справа снижена до 4 баллов в сгибателях кисти и межкостных мышцах; в ногах — справа сила полная, слева снижена до 3 баллов в сгибателях бедра, в сгибателях голени, до 4 баллов — в остальных мышечных группах. Сухожильные рефлексы S > D, патологических рефлексов нет. Вибрационная чувствительность снижена до 6 секунд в ногах, в кистях — 8 секунд. Координационные пробы выполняет с умеренной атаксией и интенционным тремором, более выраженным слева, диадохокинез в руках, слева, атаксия в ногах, больше слева. В позе Ромберга шаткость без сторонности с открытыми и закрытыми глазами. Ходьба с односторонней поддержкой, без поддержки — 20 м. Тазовые функции: учащенное мочеиспускание ежедневно. Менингеальных симптомов нет.
Данные шкал. Зрительные нарушения — 0, стволовые нарушения — 3, двигательная сфера — 3, мозжечковые нарушения — 3, чувствительные нарушения — 1, тазовые нарушения — 1, когнитивные нарушения — 0. EDSS 6,5 балла.
На фоне проведенной терапии препаратом синактен депо в/м (№ 7), симптоматической терапии состояние несколько улучшилось: по данным шкал FS стволовые нарушения с 3 уменьшились до 1 балла, тазовые нарушения — 0, мозжечковые нарушения с 3 уменьшились до 1.
Выписана с диагнозом «рассеянный склероз, рецидивирующе-ремиттирующее течение (согласно критериям McDonald 2005/2010). ПИТРС 1-й линии: непереносимость высокодозных интерферонов (инфибета, ребиф). Резистентность к глатирамера ацетату (обострения, МР-активность). Обострение от 13.12.16. EDSS 5,5 балла. С учетом отрицательного титра АТ к JCV поставлена в лист ожидания натализумаба».
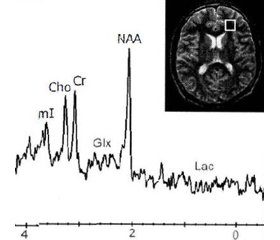
До (рис. 1а) и после (рис. 1б) проведения курса синактена депо выполнена МР-спектроскопия.
Выявленное снижение показателей соотношения Cho/Cr свидетельствует об уменьшении степени повреждения клеточной мембраны, снижение показателей соотношения глутаматной группы/Cr свидетельствует об уменьшении степени воспаления и эксайтотоксичности. Таким образом, данные показатели нейрональных изменений могут описывать биохимический субстрат регресса воспаления в очаге демиелинизации.
Выводы
Естественный ход большинства обострений РС, как правило, завершается периодом восстановления, приводящим к клинической ремиссии, а иногда, особенно на ранних стадиях течения болезни, к полному восстановлению или минимальному остаточному дефициту. Тем не менее остаточный дефицит после обострения может сохраняться и внести свой вклад в постепенное развитие инвалидизации [18]. Таким образом, лечение обострений РС важно, так как это может замедлить развитие инвалидности. Необходимо тщательно продумывать все риски и преимущества различных вариантов лечения рецидива.
R. Berkovich [19] предлагает алгоритм лечения при обострении РС (табл. 1).
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Гусев Е.И., Бойко А.Н., Столяров И.Д. Рассеянный склероз: справочник терминов. — М.: Здоровье человека, 2015. — 436 с.
2. Hilas O., Patel P.N., Lam S. Disease modifying agents for multiple sclerosis // Open Neurol. J. — 2010. — 26(4). — P. 15-24.
3. Jacobs L.D., Cookfair D.L., Rudick R.A et al. Intramuscular interferon beta-1a for disease progression in relapsing multiple sclerosis. The Multiple Sclerosis Collaborative Research Group (MSCRG) // Ann. Neurol. — 1996. — 39(3). — P. 285-294.
4. Johnson K.P., Brooks B.R., Cohen J.A. et al. Copolymer 1 reduces relapse rate and improves disability in relapsing-remitting multiple sclerosis: results of a phase III multicenter, double-blind placebo-controlled trial. The Copolymer 1 Multiple Sclerosis Study Group // Neurology. — 1995. — 45(7). — P. 1268-1276.
5. Бойко А.Н., Степанова И.О., Шмидт Т.Е. Методические рекомендации. Ведение больных с рассеянным склерозом / Под ред. Н.Н. Спирина. — М.: Здоровье человека, 2015. — 68 с.
6. Frohman E.M., Shah A., Eggenberger E. et al. Corticosteroids for multiple sclerosis: I. Application for treating exacerbations // Neurotherapeutics. — 2007. — № 4. — P. 618-62.
7. Miller D.H., Frank J.A. Magnetic resonance imaging techniques to monitor short term evolution of multiple sclerosis and to use in preliminary trials // J. Neurol. Neurosurg. Psychiatry. — 1998. — 64(1). — P. 44-46.
8. Трофимова Т.Н., Тотолян Н.А., Пахомов А.В. Лучевая диагностика рассеянного склероза. — СПб.: ЭЛБИ-СПб, 2010. — 128 с.
9. Жулев Н.М., Скоромец A.A., Трофимова Т.Н., Тотолян H.A. Современная диагностика рассеянного склероза. — СПб., 1998. — 28 с.
10. Kermode A.G., Thompson A.J., Tofts P. et al. Breakdown of the blood-brain barrier precedes symptoms and other MRI signs of new lesions in multiple sclerosis // Pathogenetic and clinical implications (Brain.). — 1990. — 113(Pt. 5). — P. 1477-89.
11. Wallace C.J., Seland T.P., Fong T.C. Multiple sclerosis: the impact of MR imaging // Am. J. Roentgenol. — 1992. — 158(4). — P. 849-857.
12. Arnold D.L., Matthews P.M., Francis G.S. et al. Proton magnetic resonance spectroscopic imaging for metabolic characterization of demyelinating plaques // Ann. Neurol. — 1992. — 31(3). — P. 235-241.
13. Mader I., Roser W., Kappos L. et al. Serial proton MR spectroscopy of contrast-enhancing multiple sclerosis plaques: absolute metabolic values over 2 years during a clinical pharmacological study // Am. J. Neuroradiol. — 2000. — 21(7). — P. 1220-1227.
14. Ingle G.T., Miller D.H., Stevenson V.L. et al. Two-year follow-up study of primary and transitional progressive multiple sclerosis // Mult. Scler. — 2002. — 8(2). — P. 108-114.
15. Sajja B.R., Wolinsky J.S., Narayana P.A. Proton magnetic resonance spectroscopy in multiple sclerosis // Neuroimaging Clin. N. Am. — 2009. — 19(1). — P. 45-58.
16. Rovira À., Auger C., Alonso J. Magnetic resonance monitoring of lesion evolution in multiple sclerosis // Ther. Adv. Neurol. Disord. — 2013. — 6(5). — P. 298-310.
17. Miller H., Newell D.J., Ridley A. Multiple sclerosis. Treatment of acute exacerbations with corticotrophin (A.C.T.H.) // Lancet. — 1961. — 18. — P. 1120-2.
18. Lublin F.D., Baier M., Cutter G. Effect of relapses on development of residual deficit in multiple sclerosis // Neurology. — 2003. — 61. — P. 1528-1532.
19. Berkovich R. Treatment of acute relapses in multiple sclerosis // Neurotherapeutics. — 2013. — 10(1). — P. 97-105.

/107-1.jpg)
/107-2.jpg)