Введение
Под острым коронарным синдромом (ОКС) принято понимать обострение ишемической болезни сердца, которое может проявляться в виде инфаркта миокарда (ИМ) или нестабильной стенокардии. Патогенетические механизмы обоих вариантов ОКС одни и те же, ведущим из них является тромбоз разрывом атеросклеротической бляшки или эрозией эндотелия коронарной артерии с последующими дистальными тромбоэмболиями. Предпосылкой для введения понятия ОКС было понимание необходимости решения вопроса о применении активных методов лечения, в частности такого, как тромболитическая терапия, до окончательного выявления наличия или отсутствия крупноочагового ИМ. Диагноз ОКС имеет характер рабочего, предварительного, и его установление способствует выделению больных с высокой вероятностью развития ИМ или нестабильной стенокардии [1].
Механизмы, ведущие к развитию ОКС, являются в то же время причиной острой сердечной недостаточности (ОСН) [2], которая может перейти в кардиогенный шок. ОСН развивается у 15–28 % больных с ОКС, а у 5–15 % пациентов с ИМ развивается кардиогенный шок [3].
Среди болезней системы кровообращения, являющихся основной причиной смерти среди лиц среднего и пожилого возраста во многих развитых странах мира, ишемическая болезнь сердца является одной из наиболее распространенных, причем заболеваемость ишемической болезнью сердца со временем возрастает. Не последнюю роль в этом играют высокая частота факторов риска и отсутствие единого подхода к предупреждению их воздействия на организм и борьбе с уже развившимися результатами этого воздействия [4]. Этим определяется важность поисков оптимальных путей лечения больных данной категории [5].
Операции с искусственным кровообращением (ИК) по реваскуляризации миокарда с помощью разных вариантов шунтирования коронарных артерий остаются наиболее эффективным, а в ряде случаев — единственно возможным методом радикального лечения при кардиологических заболеваниях, основой которых является ишемия [6–9]. Ишемия же может вызвать развитие ОСН за считанные часы по причине увеличения жесткости стенок миокарда и снижения его сократительной способности [10]. Безусловно, это ставит перед анестезиологом серьезные требования по поддержанию адекватного кровообращения как перед переводом пациента на ИК, так и особенно после его прекращения, тем более что после коронарного шунтирования часто развивается депрессия систолической функции, восстановление которой может занять до 2 суток [11], хотя другие исследователи считают, что хирургическое восстановление коронарного кровотока значительно улучшает локальную и глобальную сократимость миокарда левого желудочка (ЛЖ) уже в раннем постперфузионном периоде [15–17], а если этого не происходит, то следует говорить об осложненном течении операции [5]. В целом литературные данные свидетельствуют об отсутствии ясных представлений о динамике насосной функции сердца в раннем периоде после коронарного шунтирования.
Целью нашего исследования явилось изучение течения периоперационного периода у больных, подвергшихся аортокоронарному шунтирования по поводу ОКС.
Материалы и методы
Течение анестезии и раннего послеоперационного периода изучено у 37 больных с ОКС, которым было произведено аортокоронарное шунтирование. После коронарографии больные поступали в предоперационную, где после индукции в наркоз (пропофол 1,5–2 мг/кг, фентанил 1,5–3 мкг/кг, ардуан 0,08 мг/кг) интубировали трахею и начинали искусственную вентиляцию легких. С целью преду–преждения фибрилляции и достижения коронаролитического эффекта вводили β1-адреноблокатор беталок (2–2,5 мг). После этого пациенты переводились в операционную. Базис-наркоз сево–флураном по полузакрытому контуру (1,5–5 об%), газоток 3,2–3,7 л/мин, анальгезия — фентанил 3–5 мкг/кг/ч. После наложения на аорту кисетного шва вводился гепарин в дозе 300 Ед/кг под контролем аспартатаминотрансферазы (целевой уровень не менее 450), и начиналось ИК. Газоток в легкие составлял 0,45–0,9 л/мин под PEEP 4 мм H2O, испаритель –севофлурана подключался к газовой линии АИК (1,5–2,5 об%). По окончании основного этапа операции ИК прекращалось, пациента согревали, по достижении температуры тела 34–35 °C проводили электрическую дефибрилляцию энергией 10 Дж и начинали инфузию добутамина, дозу которого контролировали по давлению в левом предсердии (целевой уровень — 8–12 мм рт.ст.). Для нормализации общего периферического сопротивления сосудов использовали норадреналин в дозе 20–200 нг/кг • мин, для обеспечения коронаролитического эффекта — нитроглицерин в дозе 2–4 мкг/кг • мин, для предупреждения фибрилляции — беталок 3–7 мг болюсно. Время от индукции в наркоз до перевода пациента из операционной составляло 4,1 ± 0,7 часа.
Исследования осуществляли на следующих этапах: 1) перед операцией; 2) на выходе из перфузии; 3) при поступлении в отделение интенсивной терапии (ОИТ); 4) при переводе из ОИТ. На этих этапах фиксировали конечно-диастолический (КДО) и конечно-систолический объем (КСО) ЛЖ (іE33 фірми Philips, США), частоту сердечных сокращений, концентрацию гемоглобина, гематокрит, насыщение гемоглобина кислородом (SO2), парциальное напряжение кислорода в крови (pO2), концентрацию лактата в крови. На основании полученных результатов рассчитывали фракцию выброса (ФВ) ЛЖ, ударный индекс (УИ), сердечный индекс (СИ), доставку, потребление и коэффициент экстракции кислорода (TO2, VO2, EO2).
Результаты и обсуждение
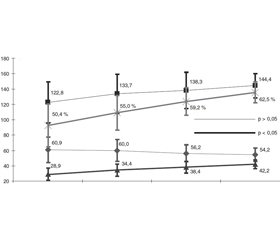
Характер изменений показателей центральной гемодинамики представлен на рис. 1. Графики иллюстрируют, что под влиянием приведенного выше протокола анестезии КДО постепенно увеличивался со 122,8 ± 26,8 мл перед операцией до 144,4 ± 16,0 мл (p < 0,05 между первым и последним этапом), а КСО так же постепенно уменьшался — с 60,9 ± 16,5 мл до 54,2 ± 8,6 мл (p < 0,05 между первым и последним этапом). Приведенная динамика свидетельствует о повышении сократительной способности миокарда, что подтверждается результатами расчетов ФВ, УИ и СИ. Так, ФВ достоверно повышалась на каждом этапе исследования и соответственно им составляла 50,4 ± 7,9, 55,0 ± 6,3, 59,2 ± 5,1 и 62,5 ± 3,9 %. При этом если до операции у 26 (70,3 ± 7,5 %) пациентов ФВ была менее 55 %, то на выходе из перфузии таких больных было уже 16 (43,2 ± 8,1 %), при переводе в ОИТ — 7 (18,9 ± 6,4 %), а на момент перевода из ОИТ — только 1. Подобная динамика наблюдалась и в отношении УИ и СИ. УИ достоверно повышался на каждом этапе исследования и находился на уровнях 28,9 ± 7,9, 34,4 ± 8,1, 38,4 ± 7,8 и 42,2 ± 5,6 мл/м2 соответственно этапам. Количество больных с УИ < 40 мл/м2 перед операцией составляло 32 (86,5 ± 5,6 %), на выходе из перфузии — 26 (70,3 ± 7,5 %), перед переводом в ОИТ — 19 (51,4 ± 8,2 %), на момент перевода из ОИТ — 8 (21,6 ± 6,8 %). Наиболее существенные подъемы СИ отмечались на выходе из перфузии — с 2,24 ± 0,62 до 2,67 ± 0,48 л/мин/м2 (p < 0,05) и перед переводом в ОИТ — до 3,00 ± 0,52 л/мин/м2 (p < 0,05). Перед переводом из ОИТ СИ повысился незначительно — до 3,13 ± 0,30 л/мин/м2 (p > 0,05). Количество больных с СИ менее 2,5 л/мин/м2 перед операцией составляло 27 (73,0 ± 7,3 %), на выходе из перфузии — 15 (40,5 ± 8,1 %), при переводе в ОИТ — 8 (21,6 ± 6,8 %), а перед переводом из ОИТ — только 2 пациента (5,4 ± 3,7 %). Описанные результаты были достигнуты при скорости инфузии добутамина на этапе выхода из перфузии 6,3 ± 2,3 мкг/кг/мин, которая перед переводом в ОИТ снизилась до 5,1 ± 1,8 мкг/кг/мин (p < 0,05).
Показатели кислородного бюджета у обследованных больных менялись следующим образом. В гемическом звене транспорта кислорода на этапе выхода из перфузии произошли значительные изменения, что связано с гемодилюцией при осуществлении ИК. Концентрация гемоглобина снизилась со 135,1 ± 9,2 до 95,1 ± 10,0 г/л (p < 0,0001) и к концу исследования повысилась незначительно — до 99,2 ± 13,2 г/л (p > 0,05), гематокрит уменьшился с 39,6 ± 4,3 до 28,3 ± 3,5 %, повысившись к концу исследования до 30,5 ± 3,1 %. Насыщение гемоглобина кислородом в течение наблюдения существенно не изменялось, артериовенозная разница ΔSO2 уменьшилась с 22,8 ± 4,0 до 21,0 ± 5,8 % (p > 0,05), но при этом отмечена выраженная отрицательная корреляционная зависимость ΔSO2 от СИ, коэффициент корреляции Пирсона соответственно этапам исследования составлял –0,71 ± 0,08, –0,67 ± 0,09, –0,80 ± 0,06 и 0,59 ± 0,11. Газовый состав крови существенно не изменялся, РaO2 находился на уровне (86,8 ± 5,5)–(88,2 ± 4,4) мм рт.ст., pvO2 — (39,6 ± 4,5)–(41,0 ± 4,3) мм рт.ст.
Динамика рассчитанного содержания кислорода в крови отображена на рис. 2. Как видно из графиков, к выходу из перфузии содержание кислорода в крови, как в артериальной, так и в венозной, значительно снизилось: в артериальной — с 0,194 ± 0,012 до 0,143 ± 0,013 л/л (p < 0,0001). В дальнейшем эти показатели существенно не изменились.
/91-1.jpg)
Другие показатели кислородного бюджета имели отличную от содержания кислорода в крови динамику (рис. 3). К выходу из перфузии доставка кислорода, как и его содержание в крови, тоже достоверно снизилась с 0,435 ± 0,128 перед операцией до 0,382 ± 0,071 л/мин/м2(p < 0,03). Однако перед переводом в ОИТ, несмотря на продолжавшую оставаться сниженной кислородную емкость крови, транспорт кислорода достоверно возрос до пред–операционного уровня — 0,443 ± 0,084 л/мин/м2 (p > 0,7 по сравнению с исходной величиной), незначительно увеличившись до 0,462 ± 0,068 л/мин/м2 (p > 0,3). Потребление кислорода достоверно возросло лишь к моменту перевода пациентов в ОИТ — с 0,106 ± 0,018 до 0,119 ± 0,020 л/мин/м2 (p < 0,01), что можно связать с улучшением микроциркуляции под влиянием нитроглицерина.
Коэффициент экстракции кислорода достоверно не изменялся, но с момента выхода из перфузии постепенно уменьшался, обнаруживая при этом отрицательную корреляционную связь с СИ (до операции коэффициент корреляции Пирсона составлял –0,80 ± 0,06, на выходе из перфузии — –0,69 ± 0,09, при переводе в ОИТ — –0,83 ± 0,05, перед переводом из ОИТ — –0,58 ± 0,11).
Уровень лактата (рис. 4) достоверно повысился на выходе из перфузии — с 1,78 ± 0,68 до 2,59 ± 0,61 ммоль/л (p < 0,001), оставаясь таким же перед переводом в ОИТ — 2,57 ± 0,60 ммоль/л, но на момент перевода из ОИТ он снизился до 1,01 ± 0,27 ммоль/л (p < 0,0001 по сравнению с исходным уровнем). Количество больных с уровнем лактата выше 1,5 ммоль/л перед операцией было равным 23 (62,2 ± 8,0 %), на выходе из перфузии и перед переводом в ОИТ — 36 (97,3 ± 2,7 %), а перед переводом из ОИТ — только 2 (5,4 ± 3,7 %). Уровень лактата тесно коррелировал с коэффициентом экстракции кислорода, коэффициент корреляции Пирсона соответственно этапам составлял 0,64 ± 0,10, 0,74 ± 0,07, 0,71 ± 0,08 и 0,63 ± 0,10.
Выводы
Острый коронарный синдром сопровождается в большинстве случаев развитием острой сердечной недостаточности, что подтверждается снижением сердечного индекса до уровня менее 2,5 л/мин/м2 у 73,0 ± 7,3 % больных. При использовании протокола анестезии при аортокоронарном шунтировании, включающего применение β1-адреноблокатора метопролола тартрата и нитроглицерина на фоне инфузии добутамина, удается нормализовать сердечный индекс у 94,6 ± 3,7 % пациентов с ОКС. Данный протокол анестезии позволяет сохранить на предоперационном уровне доставку кислорода, несмотря на снижение кислородной емкости крови, и нормализовать уровень лактата у подавляющего большинства пациентов (94,6 ± 5,4 %).
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Saenger A.K., Jaffe A.S. The Use of Biomarkers for the Evaluation and Treatment of Patients with Acute Coronary Syndromes // Med. Clin. N. Amer. — 2007. — Vol. 91. — P. 657-681.
2. Response to Letter by Zaugg et al. STAT5 Activation and Cardioprotection by Remote Ischemic Preconditioning in Patients Undergoing Coronary Revascularization During Isoflurane Anesthesia / G. Heusch, J. Musiolik, E. Kottenberg, J. Peters, H. Jakob, M. Thielmann // Circulation Research. — 2012. — Vol. 110. — 44-45.
3. Epidemiology and Prevention of CV Disease: Physiology, Pharmacology and Lifestyle — Session Title: Obesity in CVD Risk and Prevention II 18164: Obesity Paradox in the Extremely Obese: Evaluaion of In-Hospital and Long Term Clinical Outcomes After Percutaneous Coronary Interventions / M. Singh, A. Mishra, D. Sporn // Circulation. — 2014. — Vol. 130. — A18164.
4. Editor’s Perspective Percutaneous Coronary Interventions in ST-Segment–Elevation Myocardial Infarction: Shifting Paradigms and Future Perspectives / Dominick J. Angiolillo, Theodore A. Bass // Circ. Cardiovasc. Interv. — 2013. — Vol. 6. — P. 593-595.
5. Coronary Interventions Optical Coherence Tomography Guided Percutaneous Coronary Intervention With Nobori Stent Implantation in Patients With Non-ST-Segment-Elevation Myocardial Infarction (OCTACS) Trial: Difference in Strut Coverage and Dynamic Malapposition Patterns at 6 Months / L. Antonsen, P. Thayssen, A. Maehara, H.S. Hansen, A. Junker, K. Veien, K. Hansen, M. Hougaard, G.S. Mintz, L. Jensen // Circ. Cardiovasc. Interv. — 2015. — Vol. 8. — e002446.
6. Coronary Physiologic Assessment and Imaging Assessment of Fractional Flow Reserve in Patients With Recent Non–ST-Segment–Elevation Myocardial Infarction: Comparative Study With 3-T Stress Perfusion Cardiac Magnetic Resonance Ima–ging / J. Layland, S. Rauhalammi, S. Watkins, N. Ahmed, J. McClure, M.Y. Lee, D. Carrick, A. O’Donnell, A. Sood, M.C. Petrie, H. Eteiba, M. Lindsay, M. McEntegart, K.G. Oldroyd, A. Radjenovic, C. Berry // Circ. Cardiovasc. Interv. — 2015. — Vol. 8. — e002207.
7. Editorial Non-ST-Segment-Elevation Myocardial Infarction: A Novel and Robust Approach for Early Detection of Patients at Risk / Robert L. Lux // J. Am. Heart Assoc. — 2015. — Vol. 4. — e002279.
8. Correspondence Response to Letter Regarding Article, “Evolution From Fibrinolytic Therapy to a Fibrinolytic Strategy for Patients With ST-Segment–Elevation Myocardial Infarction” / Eric R. Bates // Circulation. — 2015. — Vol. 132. — 12.
9. Editorial Oxygen for ST-Segment-Elevation Myocardial Infarction: Still Up in the Air / Zoran S. Nedeljkovic, Alice K. Jacobs // Circulation. — 2015. — Vol. 131. — P. 2101-2103.
10. Epidemiology and Prevention Atrial Fibrillation and Risk of ST-Segment-Elevation Versus Non-ST-Segment-Elevation Myocardial Infarction: The Atherosclerosis Risk in Communities (ARIC) Study / E.Z. Soliman, F. Lopez, W.T. O’Neal, L.Y. Chen, L. Bengtson, Z.-M. Zhang, L. Loehr, M. Cushman, A. Alonso // Circulation. — 2015. — Vol. 131. — P. 1843-1850.
11. Cardiac Catheterization Underutilization of Radial Access in Patients Undergoing Percutaneous Coronary Intervention for ST-Segment-Elevation Myocardial Infarction: Insights From the Blue Cross Blue Shield of Michigan Cardiovascular Consortium / M.J. Howe, M. Seth, A. Riba, G. Hanzel, M. Zainea, H.S. Gurm // Circ. Cardiovasc. Interv. — 2015. — 8. — doi: 10.1161/CIRCINTERVENTIONS.114.002036.
12. Coronary Interventions Activated Clotting Time and Outcomes During Percutaneous Coronary Intervention for Non-ST-Segment-Elevation Myocardial Infarction: Insights From the FUTURA/OASIS-8 Trial / G. Ducrocq, S. Jolly, S.R. Mehta, S.V. Rao, T. Patel, R. Moreno, P. Gao, P. Steg // Circ. Cardiovasc. Interv. — 2015. — 8. — doi: 10.1161/CIRCINTERVENTIONS.114.002044.
13. Myocardial Infarction Complete Versus Culprit-Only Revascularization for ST-Segment-Elevation Myocardial Infarction and Multivessel Disease: A Meta-Analysis and Trial Sequential Analysis of Randomized Trials / S. Bangalore, B. Toklu, J. Wetterslev // Circ. Cardiovasc. Interv. — 2015. — 8. — doi: 10.1161/CIRCINTERVENTIONS.114.002142.
14. Coronary Interventions Cerebrovascular Events After a Primary Percutaneous Coronary Intervention Strategy for Acute ST-Segment-Elevation Myocardial Infarction: Analysis From the –HORIZONS-AMI Trial / E. Nikolsky, R. Mehran, G.D. Dangas, K. Xu, R. Parvataneni, B. Witzenbichler, G. Guagliumi, R. Kornowski, P. Généreux, S.J. Brener, G.W. Stone // Circ. Cardiovasc. Interv. — 2015. — 8. — doi: 10.1161/CIRCINTERVENTIONS.114.002283.
15. Right Ventricular Dysfunction Predisposes to Inducible Ventricular Tachycardia at Electrophysiology Studies in Patients With Acute ST-Segment–Elevation Myocardial Infarction and Reduced Left Ventricular Ejection Fraction / J.B. Thakkar, S. Zaman, K. Byth, A. Narayan, A. Thiagalingam, C. Chow, S.P. Tho–mas, G. Sivagangabalan, D. Farlow, R. Barnett, P. Kovoor // Circ. Arrhythm. Electrophysiol. — 2014. — Vol. 7. — P. 898-905.
16. Editorial Evolution From Fibrinolytic Therapy to a Fibrinolytic Strategy for Patients With ST-Segment-Elevation Myocardial Infarction / Eric R. Bates // Circulation. — 2014. — Vol. 130. — P. 1133-1135.
17. Impact of Time of Presentation on Process Performance and Outcomes in ST-Segment-Elevation Myocardial Infarction: A Report From the American Heart Association: Mission Lifeline Program / T.W. Dasari, M.T. Roe, A.Y. Chen, E.D. Peterson, R.P. Giugliano, G.C. Fonarow, J.F. Saucedo // Circ. Cardiovasc. Qual. Outcomes. — 2014. — Vol. 7. — P. 656-663.

/91-1.jpg)
/92-1.jpg)