На сьогодні питання лікування хворих на пухлини проксимального відділу плечової кістки (ПВПК), незважаючи на поширеність уражень цієї локалізації та велику кількість способів лікування, залишається актуальним. Це пов’язано, по-перше, з тим, що верхня кінцівка є основним органом праці та її втрата або зниження функції веде до стійкої інвалідизації хворого і проблем соціальної реабілітації, а по-друге, всі розроблені методи лікування мають як позитивні, так і негативні властивості. Отже хірургічне лікування хворих на пухлини ПВПК досі залишається актуальним питанням для практичної медицини.
За даними літератури, ПВПК — одна з найчастіших локалізацій ураження пухлинами, що посідає третє місце після ділянок, які утворюють колінний суглоб, та проксимального відділу стегнової кістки [7, 9, 14, 17, 18, 20, 33]. Відповідно до нозології пухлин, за даними багатьох авторів, розподіл такий: остеосаркома, хондросаркома, злоякісна фіброзна гістіоцитома, метастатичне ураження та ін.
Найпоширеним інструментальним методом діагностики кісткової патології є рентгенологічне дослідження, яке дозволяє визначити локалізацію вогнища, його розміри, структуру, характер країв, наявність періостальної реакції та патологічного перелому.
Комп’ютерна томографія (КТ) у наш час є невід’ємною частиною діагностики пухлин скелета. КТ дозволяє визначити точні розміри пухлини, її структуру, наявність поширення пухлини каналом ураженої кістки, прорив вмісту пухлини до м’яких тканин. Комбіноване використання КТ і ангіографії допомагає не тільки чітко визначити судини, що живлять пухлину, але й візуалізувати магістральні судини кінцівки, їх стан і відстань до новоутворення.
Магнітно-резонансна томографія допомагає більш чітко визначити розміри м’якотканинного компонента та його структуру.
Остеосцинтиграфія — метод радіонуклідної діагностики, який заснований на введенні в організм пацієнта тропного до кісткової тканини радіофармацевтичного препарату і подальшої реєстрації його розподілу та накопичення у скелеті за допомогою гамма-випромінювання ізотопу, що входить до складу препарату. Реєстрацію розподілу радіофармацевтичних препаратів проводять за допомогою гамма-камери. Даний метод цікавий здатністю виявляти не структурні, а функціональні зміни в кістках скелета, що дозволяє діагностувати мультифокальні пухлинні та метастатичні ураження.
Окремо можна сказати про патоморфологічне дослідження, яке в діагностиці пухлин кісток відіграє дуже важливу роль. Гістологічне дослідження препарату пухлинного ураження, отриманого шляхом біопсії новоутворення, може не тільки точно встановити діагноз, але і показати ступінь злоякісності пухлини.
Класифікації пухлин кісток
Для більш чіткого розуміння проблеми діагностики та лікування новоутворень онкологами розроблялись, а потім вдосконалювались різноманітні класифікації пухлин: гістологічні, клінічні, хірургічні та ін.
Гістологічна класифікація пухлин кісток 3-го видання була прийнята Всесвітньою організацією охорони здоров’я (ВООЗ) у 2002 році та перелічує нозологічні форми кісткових новоутворень [41]:
— хрящові пухлини;
— остеогенні пухлини;
— фіброгенні пухлини;
— фіброгістіоцитарні пухлини;
— саркома Юїнга;
— гематопоетичні пухлини;
— гігантоклітинні пухлини;
— нотохордальні пухлини;
— судинні пухлини;
— гладком’язові, ліпогенні, нейральні та епітеліальні пухлини;
— пухлини невизначеної пухлинної природи;
— вроджені та спадкові синдроми.
Ця класифікація дуже широко висвітлює патоморфологічну природу пухлин, але для клініцистів сама по собі не є дуже ефективною, оскільки не відображає клінічну картину та поширеність патологічного процесу.
Для клінічного застосування була створена класифікация TNM (табл. 1), яку розробив і запропонував Pierre Denoix [39] у 1953 році. Структура системи TNM була прийнята Комітетом із класифікації пухлин Всесвітнього протиракового союзу (International Union Against Cancer — UICC), а перше видання було у 1968 році. Після цього класифікація декілька разів доповнювалась [12].
У 1980 році W. Enneking запропонував хірургічну класификацію злоякісних пухлин опорно-рухового апарату. Створення даної класифікації мало декілька цілей: планування обсягу лікування, надання уявлення про прогноз захворювання, допомоги в оцінці результатів лікування, сприяння зв’язків між хірургами-ортопедами в подальшому вивченні злоякісних пухлин людини (табл. 2) [27].
Використовуючи перелічені засоби діагностики та класифікації, можна чітко скласти певну картину захворювання та розробити ефективний план лікування хворого й отримати добрий онкологічний і ортопедичний результат.
Серед усіх пухлин кісток ураження ПВПК посідає третє місце, близько 15 %, а серед кісток верхньої кінцівки — перше [8, 32].
Цілями оперативного втручання є максимальне повернення хворого до звичного йому життя, соціально-побутова та психологічна реабілітація, але більшість новоутворень потребують широкої резекції проксимального відділу плечової кістки і можуть призвести до стійкої інвалідизації хворого.
Саме тому розробка нових і вдосконалення існуючих методик оперативних втручань у ділянці плечового пояса і на сьогодні є одним із пріоритетних завдань онкоортопедів.
Хірургічне лікування
Екзартикуляція на рівні плечового суглоба
Основою усіх оперативних методик на рівні плечового пояса, незалежно від заміщення післярезекційного дефекту чи без нього, є операція Тихова — Лінберга з декількома модифікаціями.
У класичному виконанні операція Тихова — Лінберга включає, окрім резекції проксимального відділу плечової кістки та тотального видалення лопатки, ще й резекцію дельтоподібного м’яза, що призводить до неможливості відведення та згинання в плечовому суглобі, тим самим знижує функціональність верхньої кінцівки.
Екзартикуляції та ампутації були стандартним методом лікування пухлин кісток у першій половині ХХ сторіччя, коли локальні видалення пухлин і широкі резекції призводили до значної кількості рецидивів, які подекуди сягали 60–90 %, а 5-річна виживаність не перебільшувала 20 %, більшість пацієнтів помирали від метастазів у легені. Розширення хірургічного втручання до екзартикуляції дало тоді змогу знизити кількість локальних рецедивів на 5–25 %. На той час ампутації та екзартикуляції дозволяли досягти локального контро-лю над пухлиною скелета, і цей вибір хірургічного лікування був заснований на клінічному досвіді та спостереженнях онкоортопедів як найбільш ефективний у лікуванні злоякісних пухлин кісток скелета.
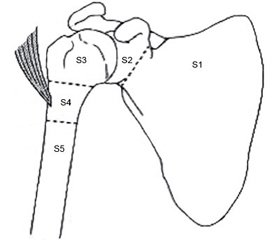
Для більш структурованого підходу до виконання цього оперативного втручання була розроблена операція Тихова — Лінберга, що включала резекцію дельтоподібного м’яза та видалення не тільки ураженої частини кітки, але й усієї лопатки; в процесі досліджень та накопичення досвіду методика резекції за Тиховим — Лінбергом доповнювалася та модифікувалася (рис. 1)
М. Малауер запропонував свою класифікацію резекцій даної локалізації, де перші три типи не включають резекцію дельтоподібного м’яза [32], що дозволяє хоча б частково зберегти функцію в плечовому суглобі (рис. 2).
Однак при порівняно добрих онкологічних результатах ампутації та екзартикуляції призводили і до цілої низки ускладнень. Серед них глибокий некроз м’яких тканин у ділянці оперативного втручання, інфекційні ускладнення, невриноми та фантомні болі в кінцівці. Окремо слід зазначити, що хворі, яким були проведені екзартикуляції на рівні плечового суглоба, мали досить серйозні психологічні проблеми, пов’язані як з косметичним дефектом, так і з соціально-побутовою реабілітацією.
Внутрішньопорожнинна резекція
Одним із поширених методів лікування пухлин проксимального відділу плечової кістки є внутрішньопорожнинна резекція (ВПР). Цей метод дозволяє зберегти анатомію ураженої кістки та максимально відновити обсяг рухів у плечовому суглобі за рахунок збереження суглобового кінця плечової кістки та мінімальної травматизації м’яких тканин навколо суглоба. Для заповнювання отриманого дефекту після ВПР у світі запропонована велика кількість як біологічних матеріалів: авто- чи алотрансплантат, демінералізований кістковий матрикс, так і синтетичні — корундова та кальцій-фосфатна кераміка [3, 6].
Найефективнішим і безпечним для пацієнта методом заміщення порожнинного дефекту є автотрансплантат, для застосування якого немає протипоказань [15], але цей метод безсилий, коли йдеться про заміщення великих дефектів, де потрібна велика кількість замісного матеріалу. Для таких цілей доцільно використовувати алокістку, що було доведено багатьма вітчизняними авторами, у тому числі О.О. Коржом у 1973 році [4].
Ще одним біологічним методом заміщення дефектів є демінералізований кістковий матрикс (ДКМ), розроблений M. Urist у 1965 році [40], що являє собою алокістку з видаленими неорганічними мінералами і залишеною колагеновою матрицею. Автор виявив, що видалення кісткового мінералу вивільнює більш біологічно активні кісткові морфогенетичні протеїни, і ці фактори росту модулюють диференціацію кліток попередників, які відповідають за формування кісток і хрящів. Внаслідок демінералізації ДКМ є більш біологічно активним, ніж звичайний алотрансплантат [24], але механічні властивості значно знижені, що не дозволяє самостійно використовувати ДКМ у зонах значного фізичного навантаження чи при великих порожнинних дефектах кісток.
Небіологічним методом заміщення дефектів є використання різноманітних видів кераміки, таких як корундова та кальцій-фосфатна. Через свою біоінертність вони не викликають несумісності з організмом, дозволяють заміщувати різноманітні за розміром і локалізацією кісткові дефекти, мають добрі остеокондуктивні властивості за рахунок їх пористості, а кальцій-фосфатна кераміка має остеоіндуктивні властивості, однак слабка міцність на відміну від корундової кераміки не дозволяє використовувати її в ділянках, що значно навантажуються [11].
При всіх перевагах ВПР та різноманітті методів заміщення кісткових порожнинних дефектів ця методика може використовуватися тільки у випадках доброякісних новоутворень та пухлиноподібних захворювань — хондрома, проста кісткова кіста, аневризмальна кісткова кіста, фіброзна дисплазія, гігантоклітинна пухлина I стадії за W.F. Ennekin та ін.
Широка резекція проксимального відділу плечової кістки без заміщення кістково-суглобового дефекту
Першочерговою метою онкоортопеда є абластичне видалення ураженої частини кістки, реконструкція кісткового дефекту ПВПК є вторинною метою, тому що навіть за наявності дефекту функція ліктьового суглоба та кисті не страждає.
Зазвичай не заміщують дефект ПВПК за декількох причин: великий м’якотканинний компонент пухлини, видалення якого призводить до втрати значної частини m. deltoideus та n. аxillaris (тип 1В за М. Малауер; рис. 2) [32], що унеможливлює активне відведення та згинання в плечовому суглобі; поганий онкологічний прогноз хворого, за якого втручання має паліативний характер; неможливість встановити імплантат за технічними або соціальними обставинами та ін. [37].
Широка резекція проксимального відділу плечової кістки із заміщенням дефекту ало- та автотрансплантатами
Одним із методів заміщення кісткових дефектів є ало- та автопластика.
Використання структурних алотрансплантатів дозволяє анатомічно заміщувати значні за розміром кісткові дефекти та достатньо відновлювати функцію плечового суглоба, а великі кісткові банки дають змогу максимально точно підбирати кісткові трансплантати будь-якого розміру незалежно від локалізації [23, 30].
При резекції ПВПК типу В, коли видаляється значна частина дельтоподібного м’яза, доволі часто за допомогою кісткових авто- чи алотрансплантатів здійснюють артродезуючі втручання, тобто замість відновлювання плечового суглоба, який не буде функціональним в умовах відсутності м’язів та зазвичай n. аxillaris, заміщують післярезекційний дефект таким чином, щоб отримати зрощення між плечовою кісткою та лопаткою й отримати торако-лопатковий суглоб. У подальшому часткові активні рухи в плечі виконуються за рахунок м’язів лопатки [2]. Для заміщення дефекту найчастіше використовують малогомілкову кістку, яка за рахунок своєї довжини та міцності дозволяє заміщувати великі дефекти [10]. Після видалення пухлини автотрансплантат проксимальної частини малогомілкової кістки заміщує дефект ПВПК кінець в кінець до опилу плечової кістки дистальним кінцем та обробленої суглобової поверхні лопатки проксимальним кінцем і фіксується Г-подібною пластиною. Інші автори віддають перевагу методу clavicula pro humero, де роль автотрансплантата відіграє ключиця [29].
Окремо треба сказати про васкуляризовані кісткові автотрансплантати. У 1905 році Т. Хантінгтон уперше замістив кістковий дефект, використавши для цього автотрансплантат малогомілкової кістки на живлячій ніжці. Мотивація цього рішення полягала в тому, що при наявності власного кровопостачання перебудова такого трансплантата буде швидшою, а зрощення з материнською кісткою — скорішим за рахунок кровопостачання обох кісток [21]. Окрім порівняно швидкої перебудови та зрощення трансплантата, зазначимо, що використання васкуляризованої кістки знижує ризик інфекційних ускладнень.
Незважаючи на складність оперативних втручань, які потребують значного досвіду і використання спеціального обладнання, значну кількість ускладнень з боку імплантата та розбіжності в поглядах у літературі, часто зустрічаються праці, присвячені заміщенню післярезекційних пухлинних дефектів ПВПК васкуляризованими трансплантатами [13].
Однак за наявності великого досвіду в цій галузі досі спостерігається велика кількість ускладнень після виконання кістково-пластичних оперативних втручань, серед яких незрощення, розсмоктування, переломи, нестабільність трансплантата та глибокі інфекції, які потребують додаткових ревізійних операцій і, нерідко, видалення трансплантата та зміни методу заміщення дефекту.
Розсмоктування трансплантата зазвичай спостерігається за 2 роки після оперативного втручання і становить до 75 % від всіх ускладнень. Деякими авторами розсмоктування пов’язується зі слабким імунологічним статусом хворого в разі злоякісної пухлини і проведення поліхіміотерапії. Ще однією причиною може бути недостатнє живлення. Зазвичай судини проростають в донорську кістку на глибину до 3 см, і за наявності великого трансплантата не відбувається його повноцінна реваскуляризація та, як наслідок, перебудова, що призводить до розсмоктування, патологічних переломів і незрощення [36].
Також із недостатньою реваскуляризацією пов’язу-ють глибокі нагноєння, що нерідко виникають за 1–1,5 року після операції. За відсутності судин у середній третині трансплантата порушується гемоциркуляція з набряком у кістковомозковому каналі та скупчення рідини, що провокує інфекційне ускладнення [5].
Окрім репараційних чинників інфекційних ускладнень є і суто хірургічні. До них можна віднести тривалість втручання, встановлення імплантата, імунологічний стан хворого (при наявності злоякісної пухлини) і його подальше комбіноване лікування, наявність гематоми в зоні втручання, дефект м’яких тканин і, як наслідок, недостатнє закриття трансплантата та ін. За даними різних авторів, глибокі інфекції сягають 20 % ускладнень після ало- чи автопластики [26].
Незважаючи на велику кількість способів заміщення післярезекційних дефектів кістковими трансплантатами, накопичений великий досвід у цьому напрямку та значний відсоток добрих результатів, кістково-пластичні методи не можуть задовольнити всіх потреб з оглядом на кількість ускладнень з боку імплантата та функціональних результатів. Ці питання спонукають онкоортопедів на пошуки нових способів заміщення кістково-суглобових дефектів.
Широка резекція проксимального відділу плечової кістки із заміщенням дефекту ендопротезом
Ендопротезування як метод заміщення великих післярезекційних дефектів сьогодні користується найбільшою популярністю. Обувлено це тим, що, використовуючи ендопротези, можна заміщувати кістково-суглобові дефекти будь-якої довжини та локалізації, пришвидшувати реабілітацію хворого, отримувати добрі функціональні результати. З огляду на те, що, за даними різних авторів, пухлини вражають кістки навколо великих суглобів у близько 85 % випадків (кістки, що утворюють колінний суглоб, проксимальний відділ стегнової кістки та проксимальний відділ плечової кістки), то використання ендопротезів є методом вибору для заміщення післярезекційних пухлинних дефектів [28].
Перше згадування про ендопротезування ПВПК датується 1893 роком, коли в Парижі французський хірург Jules E. Pean, використавши саморобний ендопротез, виготовлений з гуми та платини, замістив ним післярезекційний кістковий дефект згаданої локалізації 37-річному чоловікові, хворому на кістковий туберкульоз. Ендопротез був прикріплений до суглобового виростка лопатки та дистального відділу плечової кістки за допомогою дротів. Ендопротезування дало добрий функціональний результат, але імплантат був вимушено видалений через інфекційні ускладнення [31].
За понад 100 років ученими була розроблена та удосконалена велика кількість моделей ендопротезів, серед яких можна виділити систему MUTARS фірми Implantcast (Німеччина), за допомоги якої можна заміщувати дефекти будь-якої локалізації, а наявність модулів різної довжини допомагає в реконструкції великих кісткових дефектів. Також модульність цієї системи дозволяє за потреби виконувати ревізійні втручання, при необхідності видаляти чи замінювати деякі компоненти ендопротеза, а розроблена ними система Xpand (телескопічний модуль, що зростає) дозволяє виконувати реконструктивно-відновлювальні операції дітям із незакінченим процесом росту без необхідності постійного хірургічного втручання для подовження ендопротеза [25].
Подібні системи розроблені в США (GMRS Stryker) і Канаді (Modular Replacement System Prostheses) [19].
В Україні впроваджені власні системи для заміщення кістково-суглобових дефектів: СІМЕКС — Система Індивідуального Модульного Ендопротезування Кісток та Суглобів (Харків) та ендопротези «Інмед» (Київ) [1, 2].
При багатьох перевагах ендопротезування як сучасного методу заміщення післярезекційних дефектів кісток воно не позбавлено недоліків. Основними ускладненнями при заміщенні дефектів металевими імплантатами є інфекційні ускладнення (парапротезна інфекція), перелом ендопротеза, асептичне розхитування ніжки ендопротеза та перипротезний перелом кістки [38].
Найбільш поширеним ускладненням (понад 30 %) є парапротезна інфекція, яка, за даними різних авторів, сягає понад 70 % серед усіх ускладнень даного методу [35]. Із розвитком ендопротезування лікарі дедалі частіше стикались з інфекційними ускладненнями, що сприяло значному прогресу в лікуванні даного виду ускладнення. Основою лікування є використання антибіотиків, чутливих до мікроорганізмів, які викликали ускладнення, та місцевий вплив на вогнище запалення [34]. Основні принципи викладені багатьма авторами, серед них антибіотикотерапія з хірургічною обробкою рани без видалення імплантата; одно- чи двохетапне хірургічне лікування вогнища запалення з видаленням імплантата повторним ендопротезуванням у майбутньому; видалення імплантата та використання інших реконструктивних методик, найсучаснішою з яких є використання цементних спейсерів, насичених антибіотиками.
Асептична нестабільність ендопротеза може виникати як за 2 роки після операції (2–3 %), так і значно пізніше (22 %), при терміні спостереження хворих після ендопротезування до 10 років. Домінуючою причиною розхитування ендопротеза є резорбція кісткової тканини навколо інтрамедулярної ніжки, що призводить до послаблення структурного зв’язку між кісткою та ніжкою. Для зміцнення цього зв’язку використовують або кістковий цемент, або напилювання кераміки, що збільшує площу контакту ніжки з кісткою та стимулює остеоінтеграцію та остеоіндукцію [16].
Нерідкими є ускладнення, пов’язані із самим ендопротезом. За понад 100 років використання штучних імплантів для заміщення кістково-суглобових дефектів лікарі та інженери значно просунулись вперед. Робота велась як у напрямку вдосконалення дизайну ендопротезів, так і пошуку найбільш придатних матеріалів для їх виготовлення. Стосовно дизайну найбільш доцільним вважається використання модульних конструкцій, що дозволяють будь-які за розміром і локалізацією кісткові дефекти; щодо матеріалу для виготовлення імплантатів більш поширеним є титан, який за своїми фізичними властивостями має змогу до більшого опору деформаціям у процесі використання ендопротеза, але значні навантаження іноді спричиняють перелом інтрамедулярної ніжки в критичній зоні, тобто в місці контакту тіла ендопротеза з кісткою. При переломі імплантата хірурги вимушені виконувати ревізійні втручання, видаляти зламану ніжку, додатково обробляти канал кістки та встановлювати більшу за розмірами та довжиною, що призводить до послаблення кістки, повторної травми тканин, підвищується ризик інших ускладнень.
Отже, сьогодні найбільш популярним способом лікування хворих на пухлини кісток є ендопротезування, що дозволяє в короткий строк відновити функцію ураженої кінцівки, але, незважаючи на значний розвиток онкоортопедії, наявність великої кількості способів відновлення кістково-суглобових дефектів, відсоток ускладнень, таких як нестабільність та перелом ендопротеза, залишається доволі високим, що потребує подальшого вивчення, розробки нових та удосконалення старих методів ендопротезування та впровадження їх в практику.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Вырва О.Е. Индивидуальное эндопротезирование при опухолях проксимального отдела плечевой кости / О.Е. Вырва, Я.А. Головина, В.В. Бурлака [и др.] // Вісник ортопедії, травматології та протезування. — 2005. — № 3(46). — С. 49-53.
2. Дєдков А.Г. Органозберігаючі реконструктивні хірургічні втручання в лікуванні хворих на пухлини кісток кінцівок: дис... д-ра мед. наук: 14.01.07 / А.Г. Дєдков. — К., 2011. — 356 c.
3. Керамические материалы реконструктивно-восстановительной хирургии позвоночника / Г.Х. Грунтовский, С.В. Малышкина, И.Б. Тимченко [и др.] // Актуальные вопросы травматологии и ортопедии. — 2000. — Т. ІІ. — С. 140-144.
4. Корж А.А. Гомопластика в лечении опухолей костей / А.А. Корж, Р.Р. Талышинский. — К.: Здоров’я, 1973. — 167 с.
5. Лаврищева Г.И. Морфологические и клинические аспекты репаративной регенерации опорных органов и тканей / Г.И. Лаврищева, Г.А. Оноприенко. — М., 1996. — 207 с.
6. Новаченко Н.П. Оперативное лечение остеобластокластомы / Н.П. Новаченко // Остеобластокластома. Гигантоклеточная опухоль кости. — М.: Медицина, 1962. — С. 57-70.
7. Первичные злокачественные опухоли костей / под ред. М.Д. Алиева. — М.: Издат. группа РОНЦ, 2008. — 408 с.
8. Шугабейкер П.Х. Хирургия сарком мягких тканей и костей. Принципы и оперативная техника / П.Х. Шугабейкер, М.М. Малауэр; [пер. с англ. А.М. Авербаха, И.Г. Русакова]. — М.: Медицина, 1996. — 440 с.
9. A system for the classification of skeletal resections / W.F. Enneking, W. Dunham, M. Gebhardt [et al.] // Chir. Organi Mov. — 1990. — Vol. 75. — P. 217-240.
10. Ad-El D. Bipedicled vascularised fibula flap por proximal humerus defects in a child / D. Ad-El, A. Paizer, C. Pidhortz // Plast. Reconstr. Surg. — 2001. — Vol. 107, № 1. — P. 155-157.
11. Albrektsson T. Osteoinduction, osteoconduction and osseintegration / T. Albrektsson, C. Johansson // Eur. Spine J. — 2001. — Vol. 10 (2). — P. 96–101.
12. American Joint Committee on Cancer Staging Manual. — 6th ed. / F.L. Greene, D.L. Page, I.D. Fleming [et al.] [Eds.]. — New York: Springer, 2002.
13. Arthrodesis of the shoulder after tumor resection / B. Fuchs, M.I. O’Connor, D.J. Padgett [et al.] // Clin. Orthop. Relat. Res. — 2005. — Vol. 436. — P. 202-207.
14. Bell R.S. Treatment of axial skeleton bone metastases / R.S. Bell // Clin. Orthop. Relat. Res. — 2003. — Vol. 415. — S. 198-200.
15. Biological therapy of bone defects: the immunology of bone allo-transplantation / S.M. Graham, A. Leonidou, N. Aslam-Pervez [et al.] // Expert Opinion on Biological The-rapy. — 2010. — Vol. 10(6). — P. 885-901.
16. Branemark P.I. Osseointegrated implants in the trеаtmеnt of edentulous jaw. Experience from а 10-year period / P.I. Bra-nemark, В.О. Hansson, R. Adell // Scan. J. Plast. Reconstr. Surg. — 1977. — Vol. 16(l). — P. 1-132.
17. Endoprosthetic reconstructions for bone metastases / J.J. Eckardt, M. Kabo, C.M. Kelly [et al.] // Clin. Orthop. Relat. Res. — 2003. — Vol. 415. — S. 254-262.
18. Endoprosthetic reconstructions: long-term followup of 139 patients / J.T. Torbert, E.J. Fox, H.S. Hosalkar [et al.] // Clin. Orthop. Relat. Res. — 2005. — Vol. 438. — P. 51-59.
19. Endoprosthetic replacement of diaphyseal bone defects. Long-term results / E. Aldlyami, A. Abudu, R.J. Grimer [et al.] // Int. Orthop. — 2005. — Vol. 29(1). — Р. 25-29.
20. Experience with cemented large segment endoprostheses for tumors / S. Sharma, R.E. Turcotte, M.H. Isler, C. Wong // Clin. Orthop. Relat. Res. — 2007. — Vol. 459. — P. 54-59.
21. Fate of Vascularized and Nonvascularized autografts / J.W. Shaffer, G.A. Field, V.M. Goldberg, D.T. Davy // Clin. Orthop. — 1985. — Vol. 197. — P. 32-43.
22. Functional Laboratory Assessment After Oncolo-gic Shoulder Joint Resections / T.A. Damron, M.G. Rock, M.I. O'Connor [et al.] // Clin. Orthop. Relat. Res. — 1998. — Vol. 348. — P. 124-134.
23. Gebhardt M.C. Osteoarticular allografts for reconstruction in the proximal part of the humerus after excision of a musculoskeletal tumor / M.C. Gebhardt, Y.F. Roth, H.J. Mankin // J. Bone Joint Surg. [Am]. — 1990. — Vol. 72-A. — P. 334-345.
24. Glowacki J. Mechanisms of osteoinduction/chondroinduction by demineralized bone / J. Glowacki, S. Zhou, S. Mizuno // J. Craniofac. Surg. — 2009. — Vol. 20(1). — P. 634-638.
25. Gosheger G. MUTARS: a modular tumor and revision system. Experiences at the Munstcr Tumor Center / G. Gosheger, W. Winkelmann // Orthopade. — 2000. — Vol. 29(1). — Р. 54-55.
26. Haidukewych G. Results of treatment of infected humeral nonunions. The Mayo clinic experience / G. Haidukewych, J. Sperling // Clin. Orthop. Relat. Res. — 2003. — Vol. 414. — P. 25-30.
27. History and international developments in cancer sta-ging / M. Gospodarowicz, L. Benedet, R. V. Hutter [et al.] // Cancer Prev. Control. — 1998. — Vol. 2. — P. 262-268.
28. How long do endoprosthetic reconstructions for proximal femoral tumors last? / N.M. Bernthal, A.J. Schwartz, D.A. Oakes [et al.] // Clin. Orthop. Relat. Res. — 2010. — Vol. 468, № 11. — Р. 2867-2874.
29. Kitagawa Y. Reconstructions of the shoulder following tumour resection. / Y. Kitagawa, D.M. Thai, P.F. Choong // J. Orthop. Surg. (Hong Kong). — 2007. — Vol. 15(2). — P. 201-206.
30. Limb salvage for neoplasms of the shoulder girdle: intermediate reconstructive and functional results / M.I. O’Connor, F.H. Sim, E.Y. Chao // J. Bone Joint Surg. [Am]. — 1996. — Vol. 78-A. — P. 1872-1888.
31. Lugli T. Artificial shoulder joint by Pean (1893): the facts of an exceptional intervention and the prosthetic method / T. Lugli // Clin. Orthop. Relat. Res. — 1978. — Vol. 133. — P. 215-218.
32. Malawer M.M. Musculoskeletal Cancer Surgery. Treatment of Sarcomas and Allied Diseases / M.M. Malawer, P.H. Sugarbaker. — Washington: Kluwer Academic Publishers, 2001. — 608 p.
33. Malawer M.M. Prosthetic survival and clinical results with use of large-segment replacements in the treatment of high-grade bone sarcomas / M.M. Malawer, L.B. Chou // J. Bone Joint Surg. Am. — 1995. — Vol. 77. — P. 1154-1165.
34. One-stage exchange shoulder arthroplasty for peri-prosthetic infection / A. Ince, K. Seemann, L. Frommelt [et al.] // J. Bone Joint Surg. Br. — 2005. — Vol. 87B. — P. 814-818.
35. Periprosthetic infection in patients treated for an orthopedic oncological condition / L.M. Jeys, R.J. Grimer, S.R. Carter, K.M. Tillman // J. Bone Joint Surg. Am. — 2005. — Vol. 87. — Р. 842-849.
36. Proximal humerus reconstructions for tumors / B.K. Potter, S.C. Adams, J.D. Pitcher [et al.] // Clin. Orthop. Relat. Res. — 2009. — Vol. 467, № 4. — P. 1035-1041.
37. Reconstruction of the proximal humerus after wide resection of tumours / R.W. Rödl, G. Gosheger, C. Gebert [et al.] // J. Bone Joint Surg. [Br]. — 2002. — Vol. 84-B. — P. 1004-1008.
38. Survivorship analysis of 141 modular metallic endoprostheses at early follow-up / E.N. Zeegen, L.A. Aponte-Tinao, F.J. Hornicek [et al.] // Clin. Orthop. Relat. Res. — 2004. — Vol. 420. — P. 239-250.
39. TNM classification of malignant tumours. — 6th ed. / L.H. Sobin, Ch. Wittekind [Eds.]. — New York: Wiley-Liss, 2002. — 239 p.
40. Urist M.R. Bone: formation by autoinduction / M.R. Urist // Science. — 1965. — Vol. 150(3698). — P. 893-899.
41. World Health Organization Classification of Tumours. Pathology and Genetics of Tumours of Soft Tissue and Bone / C.D.M. Fletcher, K.K. Unni, F. Mertens [Eds.]. — Lyon: IARC Press, 2002.

/29-1.jpg)
/30-1.jpg)
/30-2.jpg)
/31-1.jpg)