Вывихи эндопротезов — вторая по частоте причина ревизионных вмешательств после асептического расшатывания компонентов эндопротезов и связанных с ним остеолиза и боли [1]. Клинически вывих обычно определяется в ранние сроки, причем около 60 % случаев приходится на первые 3 месяца [2, 12]. Закрытое вправление является терапией выбора при возникновении первичного вывиха головки эндопротеза, что доказано клиническим опытом, так как в двух третях случаев с оптимальной ориентацией компонентов этого оказывается достаточно [3]. Однако в случае нескольких повторных вывихов повышается риск повреждения имплантата, и вывих становится привычным. В таких случаях ревизия оказывается более предпочтительной. В качестве решения проблемы хронической нестабильности ревизионная хирургия не всегда успешна, при этом повторные вывихи происходят более чем в 50 % случаев, что снова требует ревизионной операции [4]. Следует учитывать, что для таких пациентов дополнительные хирургические вмешательства зачастую ограничивают. Одним из вариантов лечения является установка трехполюсного компонента, успешно сохраняющего стабильность в 93 % случаев эндопротезирования бедра [3]. Эти имплантаты имеют повышенную степень износа полиэтилена [5], уменьшают диапазон движения, что приводит к расшатыванию вертлужной впадины.
Факторы риска вывиха головки эндопротеза многочисленны и разнообразны: возраст (особенно распространен в пожилом и старческом возрасте), пол (женщины имеют больший исходный объем движений в суставе и меньшую мышечную массу), ожирение (утолщенная подкожно-жировая ткань живота уменьшает объем сгибания в т/б суставе), рост выше среднего (отмечается удлинение плеча рычага), нозология (перелом шейки, дисплазия — нарушение анатомии кости, функции мышц), предшествующие операции на суставе (деформации, дефекты, нарушения функции абдукторов), когнитивные расстройства и отказ от сотрудничества, нейромышечные расстройства (ДЦП, полиомиелит, травмы спинного мозга), гипермобильность суставов (синдром Элерса — Данлоса: нарушение синтеза коллагена III типа) [4, 6–11]. Факторы риска также связаны с геометрическим дизайном имплантата и ориентацией как бедренного, так и вертлужного компонента во время их установки. Было показано, что использование больших размеров головки бедренной кости или имплантатов с более высоким соотношением головки и шейки значительно повышает стабильность протеза в большинстве случаев [7, 13].
На сегодня выделяют следующие причины, приводящие к нестабильности головки эндопротеза тазобедренного сустава [12, 21]: пациентзависимые причины, имплантатзависимые и обусловленные ошибками хирурга.
Неправильная позиция компонентов является одной из самых частых причин вывиха. Ее обнаруживают при 40 % вывихов. Чаще встречается ретроверсия вертлужного или бедренного компонента [13].
Безопасный диапазон отклонений следующий: инклинация чашки 40–45 ± 10°, антеверсия 15 ± 10°. Основными особенностями оперативной техники при имплантации ацетабулярного компонента являются: проверка перпендикулярности позиции таза; выравнивание операционного стола во всех плоскостях; использование направителя; повторная проверка ориентиров при установке имплантата; обязательная резекция остеофитов после имплантации вертлужного компонента для ликвидации импинджмента.
Нарушение целостности мягких тканей тазобедренного сустава, безусловно, предрасполагает к риску возникновения вывиха бедренного компонента эндопротеза. Причинами нарушений могут быть укорочение бедра, обширная травма капсульно-связочного аппарата и мышц различной этиологии (в том числе и в результате операции), а также отрыв, ложный сустав или миграция большого вертела, что встречается при использовании чрезвертельного доступа [13].
Биомеханическое несоответствие имплантата суставу — наиболее сложная составляющая нестабильности головки эндопротеза. Отклонения, приводящие к данному нарушению, наиболее часто возникают при дисплазии вертлужной впадины, больших дефектах костной ткани, высокой позиции вертлужного компонента (более 1 см над центром вращения контралатерального сустава), низкой резекции шейки бедренной кости (потеря более 1 см расстояния между центром вращения и малым вертелом), имплантации слишком малых компонентов, недостаточном офсете отводящих мышц.
Уменьшение офсета — единственный статистически значимый показатель позиции бедренного компонента у пациентов, имеющих вывих, который можно определить рентгенологически. Его причинами могут быть глубокая посадка вертлужного компонента или имплантация слишком малого бедренного компонента эндопротеза.
Импинджмент (соударение рычагов) возникает при недостаточном рычаге абдукторов, при упоре большого вертела в крыло подвздошной кости, что встречается при низкой посадке эндопротеза, а также в случаях соударения нерезецированных рубцов или остеофитов с вертельной зоной или шейкой имплантата. Эту проблему чаще можно решить, установив головку большего диаметра (рис. 1).
Длинная рубашка шейки или широкая шейка имплантата могут соударяться с фланцами на впадине или с вкладышем (рис. 2). Большая задняя стенка вертлужного компонента или высокий навес, используемые для профилактики вывихов, при неправильной позиции впадины также приведут к импинджменту шейки и нестабильности головки эндопротеза (рис. 3).
Хроническая инфекция хоть и в меньшей мере, но также влияет на развитие вывихов. Воспаление препятствует рубцеванию тканей вокруг имплантата, а инфекция вызывает их некроз. Жидкость действует как баллон, который способствует вывиху головки.
Кроме перечисленных основных факторов риска возникновения вывиха головки эндопротеза бедра, следует учитывать биомеханические основы, которые тесно связаны с анатомической структурой окружающих мягких тканей и механикой здорового сустава.
Известно, что тазобедренный сустав окружен прочной фиброзной капсулой, состоящей из Y-образной lig.iliofemorale спереди (препятствует гиперэкстензии сустава), lig.pubofemorale с нижней стороны (предотвращает чрезмерное отведение бедра) и lig.ishiofemorale (ограничивает гиперфлексию сустава) [14]. Кроме связок, головка бедра удерживается в вертлужной впадине мышечным массивом и сухожилиями прикрепляющихся мышц. Устойчивость тазобедренного сустава сложна и меняется в зависимости от положения человека при ходьбе, в покое, при стрессовых нагрузках. В литературе приводятся следующие показатели нагрузки (Р — вес тела без опорной конечности) на тазобедренный сустав при разных условиях: при сгибании в исследуемом тазобедренном суставе с выпрямленным коленом нагрузка составляет 2,0 Р, с согнутым коленом — 1,0 Р, при разгибании — 2,0 Р, при отведении — 0,6 Р, в положении сидя — 0,1 Р, при опоре на обе ноги — 0,3 Р, при опоре на одну ногу — 2,4 Р, при передвижении в обычном темпе по ровной поверхности — 2,0 Р, при подъеме и спуске по наклонной плоскости — 2,5 Р, при быстрой ходьбе — 4,3 Р [15].
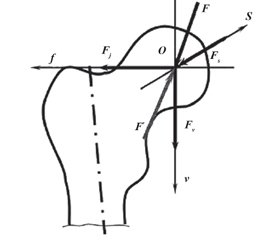
В положении стоя нагрузке подвергается вся суставная поверхность вертлужной впадины тазобедренного сустава и примерно 70–80 % головки бедренной кости находится в контакте с суставной впадиной. Только нижняя поверхность головки бедренной кости и участок вокруг fovea capituli femoris остаются ненагружаемыми, что соответствует расположению круглой связки бедра и жировой подушки в области fossa acetabuli. В литературе описан статический анализ, при котором распределение нагрузки в тазобедренном суставе может быть представлено в виде простой системы рычагов (рис. 4).
Характер изменения направления векторов нагрузки при вариантах их нормального отклонения описаны в работах R. Bombelli (рис. 5).
/39-1.jpg)
Мышечная сила складывается из действия пельвиотрохантерной группы мышц и спиннокруральной. Пельвиотрохантерная группа включает mm.gluteusmedius и minimus, m.piriformis, m.iliopsoas. Их результирующая сила находится в области большого вертела и направлена под углом 29,3° вниз и кнаружи. Спиннокруральную группу составляют m.tensorfascialata, m.rectusfemoris, m.sartorius, ее равнодействующая сила расположена в области малого вертела под углом 5,5°, направлена кзади и медиально. Общая равнодействующая мышечная сила проходит сверху вниз, изнутри наружу и образует угол 21° с вертикальной линией (Р.М. Тихилов, В.М. Шаповалов, РНИИТО им. Р.Р. Вредена, СПб.). Мышечную силу также можно представить в виде двух составляющих: сила Рm направлена вертикально вниз, а сила Qm — горизонтально в латеральном направлении. Таким образом, на центр ротации головки бедренной кости тазобедренного сустава действуют следующие силы: Рm и К — в вертикальном и каудальном направлении и Qm — в горизонтальном и латеральном.
Параллельно действующие силы К и Рm складываются, в результате чего получается результирующая сила R, которая направлена под углом 15,4° к вертикальной линии. Этой силе противостоит равная и направленная противоположно сила R1, которая вдавливает головку в вертлужную впадину. В свою очередь, косо направленная сила R1 может быть представлена двумя силами: силой втягивания головки в вертлужную впадину (Qm) и силой компрессии головки (Р). Каждой из этих сил противостоят эквивалентные, но разнонаправленные силы, составляющие результирующую силу R. Важно видеть различия между результирующими силами R и R1. Сила R направлена в центр головки и не зависит от положения и наклона вертлужной впадины тазобедренного сустава. Противостоящая ей сила R1 — это сила противодавления головки бедренной кости и вертлужной впадины, и она действует непосредственно через свод вертлужной впадины: сдавливающая сила Q направлена параллельно поверхности хряща, а сила Р — перпендикулярно этой поверхности. Их величина и направление зависят от инклинации вертлужной впадины. Только когда свод вертлужной впадины располагается горизонтально, все четыре силы находятся в равновесии. С уменьшением силы Q происходит компенсаторное увеличение силы компрессии головки Р. Именно этот дисбаланс сил приводит к постепенному подвывиху головки бедренной кости. При краниомедиальной инклинации вертлужной впадины (последствия перелома дна вертлужной впадины или ревматоидного артрита) увеличивается сила Q, направленная на смещение головки внутрь.
Кроме перечисленных факторов выделяют причины, обусловленные особенностями хирургической техники: недостаточный опыт в эндопротезировании; ошибки при предоперационном планировании; неточности в интраоперационных решениях (малый размер головки, длины шейки, выбор неверного офсета ножки эндопротеза (горизонтальное расстояние от центра головки к продольной оси диафиза бедра), состояние околосуставных мягких тканей, неучет длины ног пациента); ошибочный выбор размеров компонентов эндопротеза; недостаточное удаление остеофитов, которые могут быть причиной импинджмента; неправильное расположение пациента на операционном столе; задний оперативный доступ (при условии чрезмерного удаления капсулы тазобедренного сустава); нарушение технологии имплантации компонентов эндопротеза.
Сохранение различных структур мягких тканей во время ТЭП в значительной степени зависит от хирургического доступа.
Задний доступ, который широко используется, связан со значительно большим риском развития вывиха [7], по-видимому, из-за повреждения задних структур мягких тканей.
В связи с этим, по данным литературы, многие хирурги выступают за сохранение структур мягких тканей после операции задним доступом либо путем тщательного их восстановления, либо с помощью модифицированных хирургических техник, которые устранят необходимость значительного повреждения окружающих сустав мягких тканей [16, 17].
Многие авторы утверждают, что тщательное восстановление структур мягких тканей или сохранение этих структур с помощью модифицированных доступов значительно сокращает частоту вывихов, связанных с задним или заднебоковым хирургическим доступом. Было подсчитано, что задний доступ без восстановления мягких тканей имеет в 8,21 раза больший риск возникновения вывиха, чем при таком же доступе, но с восстановлением мягких тканей [18].
Согласно данным исследований J.M. Elkins из университета Айовы [19], развитие момента сопротивления капсулы сустава проходит в три фазы. Первая фаза — начальное постепенное натягивание капсулы. Вторая — момент соударения компонентов, действие головки бедренной кости, начинающей вытягиваться из чашки, что вызывает большие нагрузки капсулы по увеличению момента сопротивления.
Наконец, в зависимости от конкретной ситуации, толщины дефекта восстановленной капсулы головка бедренной кости впоследствии частично или полностью выскользает из чашки, позже, во время сгибания, или если вывиха не произошло, головка возвращается обратно в чашку (рис. 6).
Также в данном исследовании изучалось влияние толщины капсулы на риск развития вывиха бедренного компонента эндопротеза.
Для самой тонкой капсулы (1 мм) пиковая устойчивость к вывихам достигала всего 53 % от таковой при толщине капсулы 3,5 мм и составляла лишь 31 % от максимальной толщины капсулы — 6 мм (рис. 7).
Также установлена связь между локализацией дефекта и моментом сопротивления (рис. 8).
При дефекте капсулы в задней и заднелатеральной области как со стороны ацетабулярного так и со стороны бедренного компонента отмечается значительное снижение силы воздействия, вызывающей вывих, более чем на 50 % относительно уровня интактной капсулы. Устранение таких дефектов возвращает пиковые значения момента сопротивления в пределах 10–20 % от базового уровня.
Наложение швов даже при наиболее массивных повреждениях капсулы продольным разрезом успешно восстанавливает стабильность в пределах примерно 10 % от базового уровня (рис. 9).
Таким образом, основываясь на литературных данных относительно биомеханики патологических процессов и факторов, влияющих на них, можно определить очевидную зависимость вывиха эндопротеза от сохранности мягких тканей сустава как фактора, влияющего на нестабильность тазобедренного сустава. Особого внимания заслуживает выявление наиболее эффективных стратегий хирургического восстановления дефектов капсулы и окружающих мягких тканей сустава.
Согласно данным литературы большая часть вывихов после тотального эндопротезирования (ТЭП) бедра возникает при движениях с преобладанием сгибания; их количество значительно меньше в случаях, когда задние капсульные структуры либо не были нарушены, либо были надежно восстановлены. Данные различных авторов подтверждают необходимость тщательного восстановления задних капсульных структур в максимально возможной степени как при первичной, так и при ревизионной хирургии, чтобы максимизировать стабильность конструкции ТЭП.
Таким образом, основной причиной вывиха головки эндопротеза является неправильная позиция его компонентов, в первую очередь вертлужного имплантата. Чаще всего проблема возникает при неправильной инклинации и антеверсии чашки эндопротеза. Также случаи нестабильности встречаются при неполном восстановлении биомеханики тазобедренного сустава. В первую очередь это касается смещения центра вращения при неполном восстановлении офсета бедренной головки. В таких случаях часто возникает соударение компонентов эндопротеза или бедренной кости с костями таза, что может привести к вывиху.
Тем не менее описаны случаи вывихов при нормальных позициях имплантатов. Это встречается при ревизионных операциях и в случаях, когда проведены капсулотомия и миотомия для удлинения конечности во время операции. Примерами служат частые вывихи эндопротезов после травм и при диспластическом коксартрозе. В этих ситуациях мы часто сталкиваемся с дефицитом капсульно-связочных структур, которыми невозможно закрыть образовавшиеся дефекты. Проблема закрытия капсулы возникает также и при рецидивирующих вывихах головки эндопротеза, после ревизионных операций.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Bozic K.J., Kurtz S.M., Lau E., Ong K., Vail T.P., Berry D.J. The epidemiology of revision total hip arthroplasty in the United States // J. Bone Joint Surg. Am. — 2009.
2. Meek R., Allan D., McPhillips G., Kerr L., Howie C. Late dislocation after total hip arthroplasty // Clin. Med. Res. — 2008.
3. Patel P.D., Potts A., Froimson M.I. The dislocating hip arthroplasty: Prevention and treatment // J. Arthroplasty. — 2007.
4. Alberton G.M., High W.A., Morrey B.F. Dislocation after revision total hip arthroplasty: An analysis of risk factors and treatment options // J. Bone Joint Surg. Am. — 2002.
5. Colwell C.W., Colwell. Instability after total hip arthroplasty // Curr. Orthop. Prac. — 2009.
6. Lewinnek G.E., Lewis J.L., Tarr R., Compere C.L., Zimmerman J.R. Dislocations after total hip-replacement arthroplasties // J. Bone Joint Surg. Am. — 1978.
7. White R.E. Jr, Forness T.J., Allman J.K., Junick D.W. Effect of posterior capsular repair on early dislocation in primary total hip replacement // Clin. Orthop. Relat. Res. — 2001.
8. Sanchez-Sotelo J., Berry D.J. Epidemiology of instability after total hip replacement // Orthop. Clin. North. Am. — 2001.
9. Goldstein W.M., Gleason T.F., Kopplin M., Branson J.J. Prevalence of dislocation after total hip arthroplasty through a posterolateral approach with partial capsulotomy and capsulorrhaphy // J. Bone Joint Surg. Am. — 2001. — 83-A Suppl 2. — 2-7.
10. Barrack R.L., Butler R.A., Laster D.R., Andrews P. Stem design and dislocation after revision total hip arthroplasty: Cli-nical results and computer modeling // J. Arthroplasty. — 2001.
11. Weeden S.H., Paprosky W.G., Bowling J.W. The early dislocation rate in primary total hip arthroplasty following the posterior approach with posterior soft-tissue repair // J. Arthroplasty. — 2003.
12. Філіпенко В.А., Танькут В.О., Мезенцев В.О., Овчинніков О.М. Причини вивиху головки ендопротеза після первинного ендопротезування кульшового суглоба / Філіпенко В.А. // Травма. — 2017. — Т. 18, № 1. — С. 27-32.
13. Помилки та ускладнення ревізійного протезування у хворих з асептичною нестабільністю ацетабулярного компонента ендопротеза кульшового суглоба / Г.В. Гайко, В.П. Торчинський, О.М. Сулима, В.М. Підгаєцький, Т.І. Осадчук, О.В. Калашніков, Т.В. Нізалов, А.А. Галузинський, Р.А. Козак // Травма. — 2014. — Т. 15, № 1. — С. 74-77.
14. Usrey M.M., Noble P.C., Rudner L.J., Conditt M.A., Birman M.V., Santore R.F., Mathis K.B. Does neck/liner impingement increase wear of ultrahigh-molecular-weight polyethylene liners? // J. Arthroplasty. — 2006.
15. Лоскутов А.Е., Головаха М.Л., Габель М., Олейник А.Е. Вывихи бедра после эндопротезирования тазобедренного сустава // Ортопедия, травматология и протезирование. — 2001. — 4. — С. 61-66.
16. Fuss F.K., Bacher A. New aspects of the morphology and function of the human hip joint ligaments // Am. J. Anat. — 1991.
17. Янсон Х.А. Биомеханика нижней конечности человека / Х.А. Янсон. — Рига: Зинатне, 1975 — 324 c.
18. Kim Y.S., Kwon S.Y., Sun D.H., Han S.K., Maloney W.J. Modified posterior approach to total hip arthroplasty to enhance joint stability // Clin. Orthop. Relat. Res. — 2008.
19. Suh K.T., Park B.G., Choi Y.J. A posterior approach to primary total hip arthroplasty with soft tissue repair // Clin. Orthop. Relat. Res. — 2004.
20. Yamaguchi T., Naito M., Asayama I., Kambe T., Fujisawa M., Ishiko T. The effect of posterolateral reconstruction on range of motion and muscle strength in total hip arthroplasty // J. Arthroplasty. — 2003.
21. Elkins Jacob Matthias. Biomechanics of failure modalities in total hip arthroplasty: PhD (Doctor of Philosophy) thesis, University of Iowa, 2013.
22. Dihlmann W., Nebel G. Computed tomography of the hip joint capsule // J. Comput Assist. Tomogr. — 1983.
23. Pedersen D.R., Callaghan J.J., Brown T.D. Activity-dependence of the safe zone for impingement versus dislocation avoidance // Med. Eng. Phys. — 2005.
24. Лоскутов А.Е. К вопросу классификации асептической нестабильности бедренного компонента эндопротеза тазобедренного сустава / А.Е. Лоскутов, В.Л. Красовский, А.Е. Олейник // Теоретичні основи будівництва: Зб. наукових праць ПДАБтаА. — 2000. — № 8. — С. 475-483.
25. Bombelli R. Structure and functional in normal and abnormal hip: how to rescue mechanically jeopardized hip / R. Bombelli. — 3rd ed. — Berlin; Heidelberg; New York: Sprin-ger Verlag, 1993. — 508 p.
/38-2.jpg)

/37-1.jpg)
/38-1.jpg)
/38-2.jpg)
/39-1.jpg)
/40-1.jpg)