Системний кліщовий бореліоз більше відомий як хвороба Лайма (ХЛ, Лайм-бореліоз, Lyme disease (LD); А 69.2 за Міжнародною класифікацією хвороб 10-го перегляду). Також він носить такі назви: кліщовий менінгополіневрит, хронічна мігруюча еритема, еритемний спірохетоз, синдром Баннварта.
Хвороба Лайма — зооноз із природними осередками і трансмісивним механізмом передачі збудника, тісно пов’язаний із іксодовими кліщами і їх природними господарями. Природні вогнища ХЛ зареєстровано в країнах СНД, Австралії, Східній Європі, Канаді та США [1]. Ареали поширення ХЛ і кліщового енцефаліту є і на території України. Найбільш несприятлива ситуація в Європі щодо ХЛ склалася у Словенії, країнах Прибалтики, Чехії, Фінляндії, Угорщині, Польщі [2]. В Україні ХЛ почали реєструвати з 2000 року, вона зустрічається в усіх 23 адміністративних областях України [3]. Іксодові кліщі також є переносниками кліщового енцефаліту, моноцитарного ерліхіозу і гранулоцитарного анаплазмозу людини, бабезіозу людини і тварин, коксієльозу [4]. На території України доведено формування природних вогнищ кліщових мікст-інфекцій.
Взаємозв’язок між появою на шкірі мігруючої еритеми (МЕ) і присмоктуванням кліща встановлено Алленом Стиром (Steere Allen) [5]. В 1975 році в США, штат Коннектикут, м. Лайм, вперше були зареєстровані випадки кліщового бореліозу у групи дітей із клінікою, що нагадувала ювенільний ревматоїдний артрит. Свою назву рід Borrelia отримав від імені французького мікробіолога Амадея Борреля (Borrel А.). Рід Borrelia входить у сімейство Spirochaetaceae (порядок Spirochaetaceae), яке крім борелій включає ще два роди: Treponema і Leptospira. Самостійну видову назву Borrelia burgdorferi (рід Borrelia, сімейство Spirochaetaceae) дано збуднику хвороби в 1984 році на честь імені автора-відкривача Віллі Бургдорфера (Burgdorfer Willy), американського вченого, який народився та отримав освіту в м. Базелі (Швейцарія) [6]. Сімейство Spirochaetaceae, рід Borreliaвключає значне число збудників захворювань людини і тварин. Спірохета Borrelia burgdorferi за формою нагадує штопороподібну звиту спіраль, що складається з осьової нитки, навколо якої розташована цитоплазма. Її довжина — від 11 до 25 мкм, ширина — 0,18–0,25 мкм; розміри змінюються в різних господарів і при культивуванні. У морфологічному відношенні ці спірохети схожі з трепонемами, проте більші за них.
У даний час виділено понад 13 геномних груп, що відносяться до комплексу Borrelia burgdorferi sensu lato, з них патогенними для людини вважаються B. burgdorferi sensu stricto, B.garini, B.afzelii, B.valaisiana, B.spiel mani, B.lustianiae, B.miyamotoi, B.mayonii. Генотипи Borrelia burgdorferi sensu lato мають поверхневі білки: OspA, OspB, OspC, OspD, OspE, OspF, OspG, при цьому найбільша варіабельність виявляється у B.garinii (за OspC — 13 варіантів, за OspA — 7) і B.afzelii (за OspC — 8, за OspA — 2). Поверхневі білки визначають видову приналежність і є основними імуногенами. Встановлено й інші антигени борелій: p83/100, Р-73, Oms66 (p66), HSP60 (p60), Р58, флагеліну (Р41), BmpA (p39), р30, р21, p18, Osp17, VlsE, які нерівномірно розподілені по земній кулі. В Євразії виявлені групи B.burgdorferi sensu stricto, B.garinii, B.garinii (тип NT29), B.afzelii, B.valaisiana (група VS116), B.lusitaniae (група PotiB2), B.japonica, B.tanukii і B.turdae, а в Америці — групи Borrelia burgdorferi sensu stricto, B.andersonii (група DN127), 21038, CA55 і 25015 [7–10]. У ряді робіт були отримані відомості, що B.miyamotoi викликає захворювання, яке подібне до безеритемної форми ХЛ, але перебігає з набагато більш вираженими інтоксикаційним, гарячковим і катаральним синдромами, елевацією трансаміназ, лейко-, тромбоцитопенією [11–13]. Автори цих робіт рекомендують виділяти захворювання, викликане B.miyamotoi, окремо від класичної ХЛ, що викликається групою Borrelia burgdorferi sensu lato. Різні геновиди комплексу Borrelia burgdorferi sensu lato нерівномірно поширені в нозоареалах ХЛ. В Україні на сьогодні доведена циркуляція 5 геновидів: B.burgdorferi sensu stricto, B.afzelii, B.garinii, B.valaisiana, A14S.
Результати досліджень і клінічних спостережень останніх років дозволяють припускати, що від виду борелій може залежати характер органних уражень у пацієнта. Так, отримані дані про існування асоціації між B.garinii і неврологічними проявами, B.burgdorferi sensu stricto і Лайм-артритом, B.afzelii і хронічним атрофічним дерматитом. Отже, спостерігаються відмінності в клінічній картині перебігу ХЛ у різних нозоареалах цієї інфекції, які можуть мати в своїй основі генетичну гетерогенність комплексу B.burgdorferi. Велика кількість антигенних детермінант зовнішньої оболонки борелій схожа з іншими видами мікроорганізмів, що зумовлює наявність перехрещення в імунологічних реакціях. З огляду на всі ці факти, на даний час під терміном «хвороба Лайма» розуміють цілу групу етіологічно самостійних іксодових кліщових бореліозів. Патогенними для людини вважають тільки три види борелій: B.burgdorferi sensu stricto, B.garinii і B.аfzelii [14].
До захворювання на ХЛ схильні дорослі і діти шкільного віку. У більш рідкісних випадках хворіють діти раннього віку. Сприйнятливість людини до борелій дуже висока. Патогенез ХЛ вивчений недостатньо [15]. В організмі голодного кліща борелії знаходяться в епітелії середнього відділу кишечника, де вони розмножуються, виходять у гемолімфу, а потім — у слинні залози. Збудник передається через слину кліща людині при укусі. Після пенетрації в дерму і виходу борелій у судини починається гематогенна дисемінація спірохет. Поширення борелій також може відбуватися лімфогенно і периневрально залежно від місця присмоктування кліща. Борелії можуть приймати неактивні форми: сферопласти і L-форми, які при несприятливих умовах не мають антигенного впливу, а при сприятливих умовах для збудника мають антигенний вплив.
Динаміка патологічних процесів при ХЛ характеризується зміною запальних механізмів на початку захворювання на дегенеративно-атрофічні в міру прогресування інфекції [16, 17]. Виділяють 3 стадії захворювання [18]:
— стадія локальної інфекції з розвитком патологічного процесу в місці проникнення збудника у вигляді МЕ. У цей період захист організму забезпечується клітинними і гуморальними факторами неспецифічної резистентності;
— стадія дисемінації борелій у внутрішні органи (нервова система, серце, суглоби тощо). Активується імунна система: на ранніх етапах реалізується Т-клітинна імунна відповідь, пізніше включається В-клітинна відповідь з утворенням антитіл класу M і G;
— стадія хронічної (пізньої) інфекції, при якій уражаються органи-мішені — шкіра, нервова система, суглоби, очі.
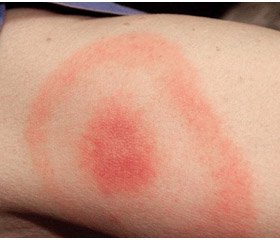
Від зараження до прояву хвороби проходить у середньому 8–12 днів. Потім у 50 % випадків з’являються ознаки загальноінфекційного синдрому, такі як анорексія, астенія, субфебрилітет, у деяких випадках — нудота і біль у животі. Для першої стадії хвороби характерна поява МЕ. МЕ — основна клінічна ознака захворювання, з’являється через 3–32 дні у вигляді червоної плями або папули на місці укусу кліща. Зона почервоніння навколо місця укусу розширюється, відмежовуючись від неураженої шкіри яскраво-червоною облямівкою. У центрі ураження інтенсивність змін виражена менше. Розміри еритем можуть бути від декількох сантиметрів до десятків (3–70 см), проте тяжкість захворювання не пов’язана з їх розмірами. У місці початкового ураження іноді спостерігається інтенсивна еритема, з’являються везикула і некроз (первинний афект). У межах зовнішньої межі можуть спостерігатися кілька червоних кілець, центральна частина яких із часом блідне. На місці колишньої еритеми часто зберігається підвищена пігментація і лущення шкіри.
У деяких хворих прояви захворювання обмежуються ураженням шкіри в місці укусу кліща і слабо вираженими загальними симптомами. У частини хворих, мабуть, гематогенно і лімфогенно, борелії можуть поширюватися на інші ділянки шкіри, виникають вторинні еритеми, але, на відміну від основної, немає первинного афекту. Можлива поява і інших шкірних симптомів: висип на обличчі, кропив’янка, скороминущі точкові і дрібні кільцеподібні висипання, кон’юнктивіт. Шкірні симптоми часто супроводжуються головним болем, ригідністю м’язів шиї, лихоманкою, остудом, мігруючими болями в м’язах і кістках, суглобах, вираженою слабкістю і стомлюваністю; рідше — генералізована лімфаденопатія, біль у горлі, сухий кашель, кон’юнктивіт, набряк яєчок. Перші симптоми захворювання зазвичай слабшають і повністю зникають протягом декількох днів (тижнів) навіть без лікування.
Другу стадію пов’язують із дисемінацією борелій від первинного вогнища в різні органи. Найчастіший прояв у цьому періоді хвороби — дисеміновані множинні еритеми. Зазвичай вони з’являються через 3–5 тижнів після укусу кліща. Вони нагадують материнську еритему, але меншу в розмірах. При безеритемних формах захворювання часто маніфестує з проявів, характерних для цієї стадії хвороби, і перебігає тяжче, ніж у хворих із еритемою: з’являються явні ознаки ураження нервової системи (синдроми серозного менінгіту, менінгоенцефаліту і синдроми ураження периферичної нервової системи: міалгії, невралгії, плексалгії, радікулоалгії, неврит лицьового нерва, мононеврити, полірадікулоневрит (синдром Баннварта), мієліт); серця (атріовентрикулярна блокада I або II ступеня, іноді — повна, внутрішньошлуночкові порушення провідності, порушення ритму, дифузні ураження серця); очей (увеїт); минущий біль у кістках, м’язах, сухожиллях, навколосуглобових сумках [19–23].
У III стадії, в терміни від декількох місяців до декількох років від початку захворювання, можуть з’являтися пізні прояви ХЛ: олігоартрит великих суглобів, хронічний енцефаломієліт, спастичні парапарези, атаксія, стерті розлади пам’яті, хронічна аксональна радикулопатія, поширений дерматит, атрофічний акродерматит і склеродермоподібні зміни шкіри, кератит, ендофтальміт.
У дітей відносно частим місцем присмоктування кліща є волосиста частина голови (65–70 %). Середня тривалість інкубаційного періоду практично не відрізняється від дорослих і становить приблизно 10–12 днів. Хлопчики хворіють порівняно частіше дівчаток.
Типова клінічна картина локальної стадії ХЛ у дітей є поєднанням мігруючої еритеми, грипоподібного синдрому і лімфаденопатії. Грипоподібний синдром спостерігається у 60–70 % дітей і більш виражений, ніж у дорослих. Лихоманка при ХЛ у дітей трапляється частіше, ніж у дорослих, і триває близько 3 днів. У 70 % випадків відзначається субфебрильна температура тіла. Підвищення температури тіла до фебрильних цифр може супроводжуватися блюванням і діареєю. МЕ у дітей при ХЛ з’являється у 70–80 % випадків. Найчастіше МЕ спостерігається на 11-й день від присмоктування кліща, розміри еритеми варіюють від 1,5 до 20 см. Збільшення регіонарних лімфовузлів трапляється більш ніж у 30 % випадків ХЛ. Інколи на початку хвороби можуть виникати мігруючі артралгії, герпетичні висипання, менінгізм. Органні ураження в гострому періоді захворювання спостерігаються в 1/3 випадків, виникають раніше, ніж у дорослих, у середньому на 7-му — 10-ту добу. Розвиток хронічної патології спостерігається у 15–20 % випадків, частіше у дітей старше 7 років. Так, у підлітків хронізація процесу відзначалася у 43 % випадків, в той час як у дітей молодшого віку — тільки у 15 %. Ураження серця з симптомами кардіопатії може розвинутися у 5–10 % дітей, при цьому виявляються ознаки порушення провідності на електрокардіограмі (ЕКГ), розширення меж серця, приглушеність серцевих тонів, систолічний шум, зниження артеріального тиску.
При залученні в патологічний процес нервової системи при ХЛ у дітей характерне ураження трійчастого і лицьового нервів, що трапляється від 5–10 до 55 % випадків ХЛ. Парезу м’язів обличчя передують парестезії, болючість у завушній ділянці, біль у тригерних зонах на орбіті, герпетичні висипання на шкірі, катаральний кон’юнктивіт. У 5–27 % із гострим перебігом ХЛ спостерігається залучення в патологічний процес мозкових оболонок із розвитком серозного менінгіту. Моно- і полінейропатії краніальних і периферичних нервів, менінгіт, менінгорадикулоневрит (синдром Баннварта), мієлополірадикулоневрит, радикулопатії становлять 70–75 % серед інших неврологічних синдромів. Рідко трапляються гострий мієліт, гострий геміпарез, атаксія. У маленьких дітей при ураженні нервової системи можуть спостерігатися неспецифічні симптоми, такі як втрата апетиту, нудота. Європейською федерацією неврологічних товариств (Federation of European Neuroscience Societies) розроблені такі критерії діагнозу «нейробореліоз» [24]: наявність неврологічної симптоматики, плеоцитозу в цереброспінальній рідині (ЦСР), інтратекальних імуноглобулінів до B.burgdorferi. За наявності 2 з 3 перерахованих вище ознак можливий нейробореліоз. Клінічні симптоми порушення опорно-рухового апарату проявляються у дітей при гострому і підгострому перебігу бореліозу з розвитком міалгій (65 %), артралгії (25 %), артритів (8,5 %). У дітей спостерігається затримка росту і статевого розвитку. Для прийняття рішення щодо ранньої антибактеріальної терапії запропонований клінічний тест для оцінки ймовірності нейробореліозу — NeBoP score, що має високу діагностичну цінність — 90 % [25].
Серологічна діагностика повинна проводиться ступенево [26]: визначення імуноглобулінів класу М (IgM) як мінімум до 2 антигенів із 3, а імуноглобулінів класу G (IgG) — як мінімум до 5 із 10 антигенів методом імуноферментного аналізу, що має більшу чутливість на першому етапі, і, якщо результат позитивний, підтвердження методом імуноблоту, що має більшу специфічність. IgM з’являються першими, на 2–4-му тижні після початку інфекції, при цьому пік продукції антитіл припадає на 3–6-й тиждень (за деякими даними — на 8–10-й тиждень), з подальшим повільним зниженням. IgG з’являються поступово після 4–6 тижнів захворювання. Пік продукції IgG приходиться на 4–6-й місяць після початку захворювання. Чутливість визначення антитіл на перших тижнях становить приблизно 50 %, зі збільшенням до 90 % у процесі перебігу захворювання. У ЦСР можуть виявлятися специфічні інтратекальні IgG і IgM. Важливим методом діагностики є визначення індексу інтратекального синтезу антитіл (antibody index, AI): співвідношення концентрації антитіл у плазмі/ЦСР. Метод має високу чутливість, особливо у дітей, але з огляду на низьку специфічність повинен оцінюватися в сукупності з іншими параметрами. Для ранньої діагностики використовують тест, де антигенною детермінантою виступає PepC10 — інваріантний фрагмент антигену OspC, а також визначають IgG до VlsE методом імуноблоту. У Росії зареєстрований спосіб серологічного визначення антитіл до борелій методом імуночопа. Результати, отримані при використанні імуночопа, корелюють із даними при діагностиці методом імуноблоту, що вказує на можливість використання даного методу в рутинній серодіагностиці ХЛ [27].
Полімеразна ланцюгова реакція (ПЛР) використовується для визначення інфікованості бореліями кліщів, однак для рутинної діагностики специфічність методу недостатня [28]. Чутливість вище при дослідженні синовіальної рідини та біоптатів шкіри. ПЛР-дослідження може бути корисним для виявлення недавно відкритих генотипів — B.miyamotoi і B.mayonii. У даний час з’являються нові методи діагностики ХЛ: визначення CXCL13 у ЦСР, enzyme-linked immunospot assay (ELISPOT), тест трасформації лімфоцитів (LTT, LTT-MELISA), визначення антигенів у сечі, популяції CD57+/CD3– клітин у крові, виявлення L-форм борелій. Однак діагностична цінність цих методів досліджена недостатньо, і вони не можуть бути рекомендовані для рутинної лабораторної діагностики.
Зміни в периферичній крові при ХЛ неспецифічні. Можливі помірний лейкоцитоз, лімфоцитоз, нормоцитоз, еозинофілія, прискорення швидкості осідання еритроцитів (ШОЕ). У біохімічному аналізі можливе підвищення аланінамінотрасферази (АЛТ), аспартат–амінотрансферази (АСТ), лактатдегідрогенази, креатинкінази. Наявність лабораторних показників активності запалення не характерна для дітей із ХЛ. У ЦСР при неврологічних проявах захворювання може визначатися невисокий лімфоцитарний плеоцитоз у межах 50–400 × 106/л, нормальна або підвищена концентрація білка (до 0,15–0,5 г/л), підвищення концентрації глюкози (вище 0,75 г/л), зниження концентрації хлоридів. Санація ліквору відбувається зазвичай за 3 тижні від початку менінгіту. Перебіг хвороби доброякісний, летальні випадки рідкісні, прогноз сприятливий. Імунітет при ХЛ нестерильний, можливо повторне зараження через 5–7 років.
Опис власного спостереження
Дівчинка А., 14 років. З анамнезу відомо, що дитина від першої вагітності. Матері на момент народження дитини було 25 років, батькові — 26 років, хронічних захворювань не мають. Вагітність, зі слів матері, перебігала без особливостей. Маса тіла при народженні становила 3150 г, довжина — 52 см, оцінка за шкалою Апгар — 6/8 балів. На грудному вигодовуванні дитина перебувала до 1 року. Мешкають у сільській місцевості, сім’я займається збором грибів, ягід, трав. Часті гострі респіраторно-вірусні інфекції (ГРВІ), ангіни, перехворіла на кір у 7 років, апендектомія — у 10 років. Фізичний та статевий розвиток відповідають віку. У 12-річному віці знаходилася на стаціонарному лікуванні в загальносоматичному відділенні зі скаргами на слабкість, запаморочення, оніміння пальців рук, лабільність настрою, сонливість, періодично блювання, підвищення температури тіла. З діагнозом «вегетосудинна дисфункція, змішана форма» виписана під спостереження дільничного педіатра. У 14 років дівчинка надійшла до гастроентерологічного відділення зі скаргами на нудоту, періодичне блювання, металевий присмак у роті, біль у правому підребер’ї. Після проведеного комплексу обстеження вставлено діагноз «функціональна диспепсія». Через 2 місяці хвора поскаржилася на рецидивуючий біль у суглобах (колінні, гомілкові), найбільш часто — у лівому колінному, після перенесеної ГРВІ тривала субфебрильна температура з періодичними підйомами до 39 °С, ліве коліно збільшилося в об’ємі, рухи обмежені. Хвора госпіталізована в кардіоревматологічне відділення.
Обстеження. Загальний аналіз крові: еритроцити — 3,9 Г/л, гемоглобін — 121 г/л, КП — 0,9, лейкоцити — 6,6 Т/л, еозинофіли — 7 %, паличкоядерні — 3 %, нейтрофіли — 55 %, лімфоцити — 29 %, моноцити — 6 %, тромбоцити — 240 Т/л, ШОЕ — 45 мм/год. С-реактивний білок — 15 г/л (норма — < 5 г/л). Загальний аналіз сечі: питома вага — 1021, білок — негативний, лейкоцити — 4–6 у полі зору. Біохімічний аналіз крові: АЛТ — 0,41 ммоль/г × л, АСТ — 0,28 ммоль/г × л, тимолова проба — 0,5 од., сечовина — 7,42 ммоль/л, креатинін — 82,2 ммоль/л, глюкоза — 5,2 ммоль/л, протромбіновий індекс — 89 %. Тести на ревматоїдний фактор та інші автоантитіла (антигерпетичні антитіла, дволанцюгова ДНК, протеїназа 3, антитіла до мієлопероксидази) показали негативні результати. Вставлено діагноз «реактивний артрит». Призначено курс нестероїдної протизапальної терапії. Стан дещо покращився. Виписана під спостереження дільничного педіатра. Через 1 місяць стан погіршився: температура тіла до 39 °С, біль у обох колінних суглобах, які збільшилися в об’ємі за рахунок набряку, обмеження рухів, міалгії, парестезії, загальна слабкість, періодично блювання, головний біль. Проведені повторні дослідження: загальні аналізи крові, сечі, біохімічні дослідження крові, печінкові проби, дослідження на автоімунний процес, антитіла до герпетичної групи вірусів, вірусів гепатиту, дослідження на гельмінти, лямблії, додатково проведено серологічні дослідження на хламідію, мікоплазму, ієрсинію, сальмонелу. Результати негативні. Визначення специфічних IgM у крові — тест негативний, IgG — тест сумнівний. Інструментальні дослідження (ЕКГ, фонокардіографія, електроенцефалографія, фіброгастродуоденоскопія) відхилень не виявили. Хвора оглянута невропатологом, окулістом, кардіологом. Специфічних відхилень не виявлено.
Пацієнтці було виконано пункцію обох колінних суглобів для одержання синовіальної рідини: 15 мл — із правого коліна, 30 мл — із лівого коліна. У пунктаті синовіальної рідини кількість лейкоцитів становила 5800 кл/мл, > 50 % клітинного складу — нейтрофіли. Методом ПЛР виділено ДНК борелій, а саме B.burgdorferi sensu stricto. На основі анамнезу (проживання в сільській місцевості, часте відвіду–вання лісу, навіть за відсутності вказівки на випадок укусу кліща та наявності патогномонічної ознаки — МЕ), перебігу хвороби, негативних результатів загальноклінічних, біохімічних, серологічних, імунологічних та на підставі позитивного ДНК-тесту (+ B.burgdorferi sensu stricto) виставлено діагноз «хвороба Лайма. Хронічний перебіг. Середній ступінь тяжкості. Лайм-артрит».
Лікування: амоксицилін по 0,5 тричі на добу впродовж 28 діб, лактовіт форте по 1 капсулі двічі на добу, лімфоміозот та траумель за схемою, потім гепабене, мульти-табс упродовж одного місяця. Стан дитини задовільний, знаходиться під спостереженням, оскільки після перенесеного бореліозу можуть зберігатися астеновегетативні реакції у вигляді порушення сну, гіпер–збудливості, емоційної лабільності. Даний стан охарактеризовано як Post-Lyme-Disease syndromes (PLDS) і за американськими та європейськими рекомендаціями не потребує лікування, якщо раніше була проведена адекватна антибактеріальна терапія [29].
Наведений клінічний випадок свідчить про те, що етіологічний діагноз виставлений пізно, тому що перебіг захворювання був без гострого періоду та за відсутності головної ознаки — мігруючої еритеми. Етіотропне лікування було розпочато пізно.
Таким чином, при досить глибокому вивченні проблеми діагностики, профілактики і лікування Лайм-бореліозу виявлено, що на сьогодні відсутня настороженість лікарів та навичка щодо діагностики даної патології, а також з окремих питань відсутній світовий консенсус, що вимагає подальшого вивчення цієї проблеми.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Uchaikin VF, Shamsheva OV. Infectious Diseases in Children. M.: Geotar-media, 2015; 387-391 (In Russ.).
2. European Union concerted action on Lyme borreliosis. 2009. Electronic resource Access: http://meduni09.edis.at/eucalb/.
3. Rogovskyy A, Batool M, Gillis DC, Holman PJ, Nebogatkin IV, Rogovska YV, Rogovskyy MS. Diversity of Borrelia spirochetes and other zoonotic agents in ticks from Kyiv, Ukraine. Ticks Tick Borne Dis. 2017 Dec 15. S1877-959X(17)30366-7. doi: 10.1016/j.ttbdis.2017.12.006.
4. Wormser G, Dattwyler R, Shapiro Е et al. The clinical assessment, treatment, and prevention of Lyme disease, human granulocytic anaplasmosis, and babesiosis: clinical practice guidelines by the infectious diseases society of America. Clin Infect Dis. 2006;43:1089-1134. doi: 10.1086/508667.
5. History of Lyme Disease 1883–2011 Squidoo.com; Electronic resource Access: http://www.squidoo.com/history-oflyme-disease.
6. Willy Burgdorfer. Who namedit? A dictionary of medical epo–nyms; Electronic resource Access: http://www.whonamedit.com/doctor.cfm/2466.htm.
7. Lyme Disease (Lyme Borreliosis, Borrelia burgdorferi Infection) / American Academy of Pediatrics. Red Book: 2012. Report of the Committee on Infectious Diseases. Ed. by LK Pickering. — 29th ed. — Elk. Grove Village IL: American Academy of Pediatrics, 2012; http://aapredbook.aappublications.org/content/1/SEC131/ SEC212.body.
8. Talaska TW, Krause A, Aberer E, Kaiser R et al. Epidemiological, biological, and ecological aspects of Lyme borreliosis. Focus on Lyme-Borreliosis. Dia Sorin, Italy. 2013: 5-25.
9. Walter KS, Carpi G, Caccone A, Diuk-Wasser MA. Genomic insights into the ancient spread of Lyme disease across North America. Nat Ecol Evol. 2017 Oct;1(10):1569-1576. doi: 10.1038/s41559-017-0282-8.
10. Yushuk ND, Vengerov YYa. Infectious Diseases, 2nd edition. M.: Geotar-media, 2011: 275-391 (In Russ.).
11. Sarksyan DS, Maleev VV, Platonov AE. Differential diagnosis of tick-borne borreliosis, caused by Borrelia miyamotoi. Infectious Diseases. 2012;4(10):41-44 (In Russ.)
12. Szulzyk T, Flisiak R. Lyme borreliosis. Annals of Parasitolo–gy. 2012;58(2):63-69.
13. Moore A, Nelson C, Molins C, Mead P et al. Current guidelines, common clinical pitfalls, and future directions for laboratory diagnosis if Lyme disease, United States. Emerging Infectious Diseases. 2016;22(7):1169-1177. doi: 10.3201/eid2207.151694.
14. Shah JS, D'Cruz I, Ward S, Harris NS, Ramasamy R. Development of a sensitive PCR-dot blot assay to supplement serological tests for diagnosing Lyme disease. Eur J Clin Microbiol Infect Dis. 2017 Dec 27. doi: 10.1007/s10096-017-3162-x.
15. Verhaegh D, Joosten LAB, Oosting M. The role of host immune cells and Borrelia burgdorferi antigens in the etiology of Lyme disease. Eur Cytokine Netw. 2017 Jun 1;28(2):70-84. doi: 10.1684/ecn.2017.0396.
16. Skripchenko NV, Balinova AA. Modern ideas about the pathogenesis of Ixodes tick-borne borreliosis. Journal Infectology. 2012;4(2):5-14 (In Russ.).
17. Cutler SJ, Rudenko N, Golovchenko M еt al. Diagnosing Borreliosis. Vector Borne Zoonotic Dis. 2017 Jan;17(1):2-11. doi: 10.1089/vbz.2016.1962.
18. Henningsson AJ. Сlinical, epidemiological and immunological aspects of Lime Borreliosis with special focus on the role of the complement system. Linköping University, Sweden, 2011: 116 p.
19. Gilson J, Khalighi K, Elmi F, Krishnamurthy M, Talebian A, Toor RS. Lyme disease presenting with facial palsy and myocarditis mimicking myocardial infarction. J Community Hosp Intern Med Perspect. 2017 Dec 14;7(6):363-365. doi: 10.1080/20009666.2017.1396170.
20. Sá MC, Moreira C, Melo C, Sousa Á, Carvalho S. Lyme disease and juvenile idiopathic arthritis — A pediatric case report. Rev Bras Reumatol Engl Ed. 2017 Nov-Dec;57(6):620-622. doi: 10.1016/j.rbre.2015.09.006.
21. Bryant Kristina A. Clinical Manifestations of Tick-Borne Infections in Children. Clin. Vaccine Immunol. 2000;7(4):523-527; http://cdli. asm.org/content/7/4/523.full. doi: 10.1128/CDLI.7.4.523-527.2000.
22. Kuimova IV, Radionova OA, Krasnova EI. Clinical features of ixodial tick-borne borreliosis in children. Lechaschi Vrach. 2014;3:55 (In Russ.).
23. Fu Md J, Bhatta L. Lyme carditis: Early occurrence and prolonged recovery. J Electrocardiol. 2017 Dec 14: S0022-0736(17)30:493-4. doi: 10.1016/j.jelectrocard.2017.12.035.
24. Mygland A, Ljostad U, Fingerle V et al. EFNS guidelines on the diagnosis and management of European Lyme neuroborreliosis. Eur. J. Neurology. 2010;17:8-16. doi: 10.1111/j.1468-1331.2009.02862.x.
25. Halperin JJ. Diagnosis and management of Lyme neuroborreliosis. Expert Rev Anti Infect Ther. 2018 Jan;16(1):5-11. doi: 10.1080/14787210.2018.1417836.
26. Deutsche Borreliose-Gesellschaft. Diagnosis and Treatment of Lyme borreliosis (Lyme disease) Guidelines of the German Borreliosis Society. Ed. 2nd (Revised) Am. Planetarium 12, D-07743 Jena, Germany, 2010: 31 р.
27. Sanchez E, Vannier E, Wormser GP, Hu LT. Diagnosis, Treatment, and Prevention of Lyme Disease, Human Granulocytic Anaplasmosis, and Babesiosis A Review. JAMA. 2016;315(16):1767-1777. doi: 10.1001/jama.2016.2884.
28. Information on infectious and parasitic diseases for January-December 2016: Russian Federal Service for Surveillance on Consumer Rights Protection and Human Wellbeing (Rospotrebnadzor), Moscow. 27.02.2017 (In Russ.).
29. Aucott JN, Rebman AW, Crowder LA, Kortte KB. Post-treatment Lyme disease syndrome symptomatology and the impact on life functioning: is there something here? Qual Life Res. 2013 Feb;22(1):75-84. doi: 10.1007/s11136-012-0126-6.