Резюме
Актуальність. Сепсис — загальноклінічна проблема, при якій має місце висока летальність і значні матеріальні витрати на лікування. У зв’язку з цим ведеться пошук біомаркерів для його ранньої діагностики. Мета. Показати чутливість і специфічність сучасних біомаркерів запалення при сепсисі та локалізованих бактеріальних інфекціях у дітей. Матеріали та методи. Досліджено 115 дітей із генералізованими та локалізованими формами бактеріальних інфекцій. Основна група (n = 47) — діти із сепсисом; група порівняння (n = 68) — діти з бактеріальною інфекцією різної локалізації. Вік дітей становив від 1 місяця до 18 років. Розподіл на групи проводився згідно з ознаками синдрому системної запальної відповіді (ССЗВ) та органної дисфункції. Група контролю — 57 практично здорових дітей. Дітям проводили кількісне визначення рівня С-реактивного білка (СРБ), тумор-некротичного фактора альфа (TNF-α), прокальцитоніну (ПКТ) і пресепсину (ПСП) у сироватці крові. Результати. Після проведених досліджень було виявлено, що концентрація СРБ у дітей із сепсисом сягала 44,7 мг/л (довірчий інтервал (ДІ) 95% 35,0–54,3). У дітей із локалізованою бактеріальною інфекцією — 28,3 мг/л (ДІ 95% 22,4–34,2) (p < 0,01), тобто зі зростанням тяжкості стану зростає концентрація СРБ, але статистично значуща різниця (p < 0,05) відзначається лише у дітей, в яких діагностували дві та більше ознаки ССЗВ. Для проведення диференційної діагностики локалізованої і генералізованої бактеріальної інфекції досліджували TNF-α, середній рівень якого у дітей основної групи становив 280,3 пг/мл (ДІ 95% 243,9–316,7), що було в 1,5 раза вище, ніж у дітей із локалізованим бактеріальним процесом, у яких середній рівень даного цитокіну був 186,5 пг/мл (ДІ 95% 163,1–209,9), та в 4,2 раза вище порівняно з дітьми групи контролю — 65,7 пг/мл (ДІ 95% 56,7–74,8). У дітей із групи порівняння рівень TNF-α був в 2,8 раза вище при порівнянні з практично здоровими дітьми. Різниця між показниками груп була статистично значуща (p < 0,01). В основній групі середній рівень ПКТ був 4,06 нг/мл (ДІ 95% 3,34–4,69), а в групі порівняння — 0,86 нг/мл (ДІ 95% 0,77–1,03); у групі контролю — 0,024 нг/мл (ДІ 95% 0,02–0,03); між групами різниця була статистично значуща (р < 0,01). В основній групі рівень ПСП дорівнював 1887,5 пг/мл (505,5–3702,5 пг/мл); у групі порівняння — 313,5 пг/мл (208–376 пг/мл). Різниця між групами за U-критерієм Манна — Уїтні була статистично значущою (р < 0,01). У здорових дітей (група контролю — n = 26) рівень ПСП — 109 пг/мл (77,5–160 пг/мл), що також статистично відрізнялось від медіани групи порівняння (р < 0,05): U-критерій Манна — Уїтні становив 15 при критичному значенні 112. Для діагностики бактеріальної інфекції у дітей чутливість ПСП була найвищою — 97 %, специфічність — 96 %. Чутливість і специфічність визначення рівня ПСП при сепсисі у дітей — 92 та 93 % відповідно. Висновки. Найбільш надійний маркер для діагностики сепсису — визначення рівня ПКТ та ПСП у сироватці крові, оскільки їх чутливість і специфічність є найвищими.
Актуальность. Сепсис — это общеклиническая проблема, при которой имеют место высокая летальность и значительные материальные затраты на лечение. В связи с этим ведется поиск биомаркеров для его ранней диагностики. Цель. Показать чувствительность и специфичность современных биомаркеров воспаления при сепсисе и локализованных бактериальных инфекциях у детей. Обследованы 115 детей с генерализованными и локализованными формами бактериальной инфекции. Основная группа (n = 47) — дети с сепсисом, группа сравнения (n = 68) — дети с бактериальной инфекцией различной локализации. Возраст детей составлял от 1 месяца до 18 лет. Распределение на группы проводилось согласно наличию признаков синдрома системного воспалительного ответа (ССВО) и органной дисфункции. Группа контроля — 57 практически здоровых детей, которым проводили количественное определение уровня С-реактивного белка (СРБ), тумор-некротического фактора альфа (TNF-α), прокальцитонина (ПКТ) и пресепсина (ПСП) в сыворотке крови. Результати. После проведенных исследований выявлено, что концентрация СРБ у детей с сепсисом достигала 44,7 мг/л (доверительный интервал (ДИ) 95% 35,0–54,3). У детей с локализованной бактериальной инфекцией — 28,3 мг/л (ДИ 95% 22,4–34,2) (p < 0,01), то есть с ростом тяжести состояния возрастает концентрация СРБ, но статистически значимое различие (p < 0,05) отмечается только у детей, у которых диагностировали 2 и больше признаков ССВО. Для проведения дифференциальной диагностики локализованной и генерализованной бактериальной инфекции исследовали уровень сыворотки крови TNF-α, средний уровень которого у детей основной группы составлял 280,3 пг/мл (ДИ 95% 243,9–316,7), что было в 1,5 раза выше у детей с локализованным бактериальным процессом, у которых средний уровень данного цитокина был 186,5 пг/мл (ДИ 95% 163,1–209,9), и в 4,2 раза выше по сравнению с детьми группы контроля — 65,7 пг/мл (ДИ 95% 56,7–74,8). У детей из группы сравнения уровень TNF-α был в 2,8 раза выше при сопоставлении с практически здоровыми детьми. Разница между показателями групп была статистически значима (p < 0,01). В основной группе средний уровень ПКТ был 4,06 нг/мл (ДИ 95% 3,34–4,69), в группе сравнения — 0,86 нг/мл (ДИ 95% 0,77–1,03), в группе контроля — 0,024 нг/мл (ДИ 95% 0,02–0,03), между группами разница была статистически значима (р < 0,01). В основной группе уровень ПСП составлял 1887,5 пг/мл (505,5–3702,5 пг/мл), в группе сравнения — 313,5 пг/мл (208–376 пг/мл). Разница между группами по U-критерию Манна — Уитни статистически значима (р < 0,01). У здоровых детей (группа контроля — n = 26) уровень ПСП — 109 пг/мл (77,5–160 пг/мл), что также статистически отличалось от медианы группы сравнения (р < 0,05): U-критерий Манна — Уитни — 15 при критическом значении 112. Для диагностики наличия бактериальной инфекции у детей чувствительность к ПСП самая высокая — 97 %, а специфичность — 96 %. Чувствительность и специфичность определения уровня ПСП при сепсисе у детей составляет 92 и 93 % соответственно. Выводы. Наиболее надежный маркер для диагностики сепсиса — определение уровня ПКТ и ПСП в сыворотке крови, поскольку их чувствительность и специфичность самие высокие.
Background. Sepsis is a general clinical problem with high mortality rate and significant material expenses for the treatment. In this regard, biomarkers are being searched for early diagnosis. Materials and methods. 115 children with generalized and localized forms of bacterial infections were examined. Main group (n = 47) — patients with sepsis, comparison group (n = 68) — persons with bacterial infection of various localization. The age of children was from 1 month to 18 years. Distribution was performed according to the presence of signs and symptoms of systemic inflammation response syndrome and organ dysfunction. Control group — 57 apparently healthy children. Patients underwent determination of С-reactive protein (CRP), tumor necrosis factor (TNF-α), procalcitonin and presepsin levels in the blood serum. Results. After the performed studies, it was found that the concentration of CRP in children with sepsis was 44.7 mg/l (95% confidence interval (CI) 35.0–54.3). In children with localized bacterial infection — 28.3 mg/l (95% CI 22.4–34.2; p < 0.01); with the increase in the severity of the state, the concentration of CRP increases, but statistically significant difference (p < 0.05) is found only in children with 2 or more signs of systemic inflammation response syndrome. For the differential diagnosis of localized and generalized bacterial infection, TNF-α was studied, its average level in children of the main group was 280.3 pg/ml (95% CI 243.9–316.7), which was 1.5 times higher than in patients with localized bacterial process, where the average level of the given cytokine was 186.5 pg/ml (95% CI 163.1–209.9), and 4.2 times higher compared to the control group (65.7 pg/ml (95% CI 56.7–74.8). In children from the comparison group, TNF-α levels were 2.8 times higher when compared with apparently healthy children. The difference between groups was statistically significant (p < 0.01). In the main group, the mean procalcitonin level was 4.06 ng/ml (95% CI 3.34–4.69), in the comparison group — 0.86 ng/ml (95% CI 0.77–1.03), and in the control group — 0.024 ng/ml (95% CI 0.02–0.03), the difference between groups was statistically significant (p < 0.01). In the main group, the presepsin level was 1887.5 pg/ml (505.5–3702.5 pg/ml); in the comparison group — 313.5 pg/ml (208–376 pg/ml). The difference between the groups according to the Mann-Whitney U test is statistically significant (p < 0.01). In healthy children (n = 26, control group), the level of presepsin was 109 pg/ml (77.5–160 pg/ml), which also statistically differed from the median of the comparison group (p < 0.05): Mann — Whitney U test — 15 at critical significance of 112. For the diagnosis of bacterial infection in children, the sensitivity of presepsin is the highest and is 97 %, specificity — 96 %. The sensitivity and specificity of presepsin levels in children with sepsis are 92 and 93 %, respectively. Conclusions. The most reliable markers for the diagnosis of sepsis are procalcitonin and presepsin levels in the blood serum, since their sensitivity and specificity are the highest.
Вступ
Сепсис — загальноклінічна проблема, при якій мають місце висока летальність і значні матеріальні витрати на лікування [1]. Щороку у світі реєструється близько 18 млн випадків сепсису, 10–30 % з них закінчуються смертельно, зокрема у новонароджених і дітей інших вікових груп [2, 3].
Щохвилини у світі помирає 14 осіб від сепсису, а щорічна летальність через розвиток останнього більша, ніж від ВІЛ-інфекції, раку простати та раку молочної залози разом узятих [4]. Упродовж останніх двох десятиліть захворюваність на сепсис зростає [5].
Ризик розвитку сепсису обернено пропорційний віку. Найбільша поширеність сепсису — серед новонароджених. У Сполучених Штатах Америки (США) вона становить 10 випадків на 1000 живонароджених [6]. Сепсис є найбільш поширеною причиною смерті в немовлят у всьому світі [7].
Рівень смертності залежить від географічного регіону — найвища у країнах, що розвиваються [8]. Згідно з даними Fran Balamuth та інших (2014), середня вартість лікування однієї дитини віком понад 2 місяці у лікарнях США становила 78,946 долара, загальні витрати на лікування сепсису на рік — 4,8 млн доларів США [9]. В Європі терапія сепсису оцінюється в 70–90 тис. доларів на одного пацієнта [10].
У вітчизняних статистичних звітах поширеність сепсису значно занижена через нечасте використання даного діагнозу. Неспецифічність клінічних проявів і відсутність специфічних уніфікованих лабораторних маркерів сепсису робить діагностику цього стану запізнілою [11].
Відповідно до міжнародного консенсусу «Сепсис-3», присвяченого визначенню понять «сепсис» і «септичний шок», сепсисом називають те, що в минулих переглядах визначалось як тяжкий сепсис, тобто наявність синдрому системної запальної відповіді (ССЗВ), доведеної або ймовірної інфекції та поліорганної недостатності [12].
Позитивна гемокультура зазвичай є ознакою сепсису, але негативні результати посіву крові не виключають наявність сепсису, оскільки в половини хворих із картиною сепсису бактеріємія відсутня. Прогресування процесу в цих випадках обумовлене тригерною дією прозапальних цитокінів [13].
Головним ланцюгом у патогенезі сепсису є патогенасоційовані молекулярні структури — pathogen associated molecular patterns (PAMPs) та їх розпізнавання рецепторами PAMP. Рецептором розпізнавання вважається СD14, який є глікопептидом на поверхні макрофагів, моноцитів і нейтрофілів.
Найбільш патогенними є ліпополісахариди грамнегативних бактерій. При проникненні у системний кровообіг вони зв’язуються з рецепторами PAMP, які взаємодіють з TLR-2-, TLR-4-рецепторами на поверхні моноцитів, нейтрофілів та інших клітин, що призводить до синтезу і секреції у кров прозапальних цитокінів, фізіологічні ефекти яких визначають клінічну картину сепсису [14].
Важливою особливістю грампозитивних бактерій є утворення потужних екзотоксинів, таких як токсин TSST-1, що виділяє S.аureus, та пірогенні екзотоксини Str.pyogenes. Летальність, викликана ними при септичному шоці, може сягати 50 %. Грампозитивні екзотоксини мають властивість суперантигенів. Вони зв’язуються з комплексом гістосумісності та рецепторами Т-лімфоцитів (TCR), викликаючи масивну Т-лімфоцитарну активацію та вивільнення прозапальних лімфокінів [15].
У відповідь на запалення розвивається синдром компенсаторної протизапальної відповіді — compensatory anti-inflammatory response syndrome (CARS), який може призвести до повного імунного паралічу з розвитком генералізації інфекційного процесу і бути тригерним фактором летального наслідку [16].
Визначальним у прогнозі є рання діагностика до початку розвитку поліорганної недостатності (ПОН) та септичного шоку, летальність при якому становить 40 % [12]. У зв’язку з цим ведеться пошук біомаркерів для ранньої діагностики генералізації інфекційного процесу та розвитку сепсису.
Модель біомаркерів педіатричного сепсису допомогає ідентифікувати дітей високого ризику смерті та тяжкого септичного шоку. Дослідження рівнів біомаркерів сепсису допомогає вчасній діагностиці і, відповідно, прийняттю правильних клінічних рішень, є критерієм якості терапії сепсису та септичного шоку, що проводиться [17].
У наш час існує понад 100 біохімічних сполук, які досліджувались при сепсисі. Найбільш важливими виявились такі: CRP (Creactive protein) — СРБ; IL-6 (Interleukine-6) — ІЛ-6; PCT (Procalcitonin) — прокальцитонін; LBP (Lipopolysacharide binding protein) — ліпополісахаридзв’язуючий білок; sCD14ST (Presepsin) — пресепсин (ПСП).
Мета: показати чутливість і специфічність сучасних біомаркерів запалення при сепсисі та локалізованих бактеріальних інфекціях у дітей.
Матеріали та методи
Для досягнення поставленої мети нами було обстежено 115 дітей віком від одного місяця до 18 років із локалізованими бактеріальними інфекціями та сепсисом, які перебували на лікуванні в реанімаційних відділеннях Хмельницької міської дитячої, Хмельницької обласної дитячої, Хмельницької міської інфекційної лікарень протягом 2009–2016 років.
Основну групу становили 47 дітей із сепсисом, середній вік яких був 7,3 року (ДІ 95% 5,5–9,0). Діагноз верифікувався при наявності доведеного бактеріального вогнища інфекції, двох і більше ознак ССЗВ, згідно з критеріями, затвердженими на міжнародній погоджувальній конференції з питань педіатричного сепсису (IPSSC, 2005) та беручи до уваги критерії «Сепсис-3», одну або більше з ознак органної дисфункції або ознак септичного шоку.
Група порівняння включала 68 дітей із локалізованою бактеріальною інфекцією з однією з ознак ССЗВ або без такої. Середній вік дітей групи порівняння становив 9,2 року (ДІ 95% 8,0–10,4).
Контрольна група — 57 дітей, середній вік яких був 10,8 року (ДІ 95 % 9,6–12,0).
Групи формували шляхом випадкової вибірки.
Діти основної групи розподілялись на підгрупи залежно від кількості ознак ССЗВ (2, 3 чи 4) та окремо діти із септичним шоком.
У дітей, включених у групи дослідження, залежно від первинної локалізації бактеріального вогнища гнійного запалення, було діагностовано такі нозологічні форми: черевна порожнина — первинний перитоніт, гангренозний і флегмонозний апендицит; грудна порожнина — тотальна пневмонія, розлитий гнійний плеврит; лор-органи — полісинусити; кістково-м’язова система та інфекції м’яких тканин — гематогенний остеомієліт, абсцеси та флегмони підшкірно-жирової клітковини; центральна нервова система — бактеріальний менінгіт, менінгококемія.
ССЗВ діагностувався при наявності мінімум 2 із 4 наведених нижче критеріїв, один серед яких обов’язково — аномальна температура тіла або кількість лейкоцитів:
1. Центральна температура вище 38,5 °С або нижче 36,0 °С.
2. Тахікардія, підвищення частоти серцевих скорочень більше ніж на 2 квадратичних відхилення від вікової норми, при відсутності зовнішніх стимулів, а у дітей віком до року — і брадикардія.
3. Середня частота дихання, яка перевищує вікову норму на 2 квадратичних відхилення, або необхідність у штучній вентиляції легень при гострому процесі.
4. Кількість лейкоцитів у периферичній крові, що підвищена або знижена відповідно до вікової норми, або вміст незрілих форм лейкоцитів понад 10 %.
Клінічне обстеження включало щоденний огляд пацієнта під час перебування у відділенні інтенсивної терапії та реанімації з оцінкою симптомів інтоксикації, ССЗВ, ознак розвитку ПОН.
Проводились загальноприйняті лабораторні дослідження: гемограма, клінічні та біохімічні аналізи крові з визначення СРБ, бактеріологічне дослідження. Відповідно до мети дослідження, додатково хворим і здоровим дітям проводилось визначення біомаркерів сепсису.
Основними матеріалами досліджень були сироватка крові дітей, цільна кров, для бактеріологічного обстеження використовували кров, уміст ранової поверхні, ліквор, плевральну рідину.
Рівень прокальцитоніну (ПКТ) сироватки крові визначався за допомогою кількісного імуноферментного аналізу (ІФА) Ray Bio Human Procalcitonin ELISA (RayBiotech, Inc. США) на аналізаторі StatFax 303 Plus, що є відкритою системою.
ПКТ — глікопротеїн, який складається із 116 амінокислотних залишків, його молекулярна маса 12 793 дальтон. Був відкритий у 1984 році як попередник кальцитоніну, що виробляється С-клітинами щитоподібної залози, однак під впливом ендотоксинів продукується поза щитоподібною залозою — в клітинах паренхіматозних органів, м’язах, жировій клітковині тощо. При розвитку інфекційного процесу бактеріальної природи в клітинах тканин і периферичних мононуклеарах починає синтезуватися мРНК, що кодує молекулу ПКТ, який згодом виділяється в кровотік, однак підвищення рівня кальцитоніну (КТ) не відбувається, тому в цьому випадку ПКТ не можна розглядати як попередник КТ. Позаклітинний циркулюючий ПКТ відрізняється від внутрішньоклітинного вкороченням на 2 амінокислотних залишки [19].
Кількісне визначення пресепсину проводилось нами на автоматичному хемілюмінесцентному імуноферментному аналізаторі Pathfast за допомогою Pathfast Presepsin (LSI Medience Corporation).
Пресепсин (sCD14-ST) — гуморальний білок із молекулярною масою 13 кДа, специфічний для фагоцитозу, який утворюється внаслідок каскаду реакцій з mCD14 — мембранного рецептора макрофагів при зв’язуванні бактерій рецептором TLR4.
Рівень пресепсину є високоспецифічним раннім біо–маркером сепсису, викликаного як грампозитивною, так і грамнегативною мікрофлорою та грибами, при вірусних інфекціях підвищення рівня ПСП не спостерігається. Може використовуватися як для діагностики, так і для моніторингу стану й ефективності терапії сепсису.
Кількісне визначення тумор-некротичного фактора альфа (TNF-α) проводили за допомогою імуноферментного аналізу із застосуванням реактивів компанії «Ордженіум Лабораторіз» (Human TNF-α ELISA Kit, Фінляндія) на аналізаторі StatFax 303 Plus.
TNF-α — білок, який складається із 157 амінокислотних залишків із молекулярною масою 17 356 дальтон, синтезується макрофагами та мононуклеарними лейкоцитами. В неактивованих клітинах синтез TNF-α не відбувається, тобто в організмі здорової людини в сироватці крові TNF-α не визначається. Активація синтезу мРНК у макрофагах і мононуклеарних лейкоцитах відбувається під впливом токсинів бактерій, вірусів, циркулюючих імунних комплексів. TNF-α належить до неспецифічних прозапальних цитокінів першої фази запалення, рівень якого починає підвищуватися в перші години від початку розвитку системного запалення.
Результати та обговорення
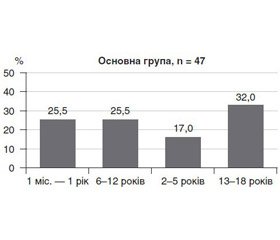
Середній вік пацієнтів основної групи становив 7,3 року (ДІ 95% 5,5–9,0). Середній вік у групі порівняння — 9,2 року (ДІ 95% 8,0–10,4). Різниця у віковому складі основної групи та групи порівняння обумовлена віковими особливостями імунної системи (фізіологічні періоди транзиторного імунодефіцитного стану у дітей віком 2–4 роки та у підлітків). У табл. 2 та рис. 1 відображено розподіл дітей із сепсисом залежно від тяжкості стану.
Понад 60 % дітей основної групи мали 4 ознаки ССЗВ або тяжкий сепсис, який діагностують при наявності, крім вогнища запалення та ССЗВ, органних дисфункцій, серед яких обов’язково має місце серцево-судинна [18].
Концентрація СРБ у дітей із сепсисом (рис. 2) сягала 44,7 мг/л (ДІ 95% 35,0–54,3). У дітей із локалізованою бактеріальною інфекцією — 28,3 мг/л (ДІ 95% 22,4–34,2) (p < 0,01), тобто зі зростанням тяжкості стану зростає концентрація СРБ, але статистично значуща різниця (p < 0,05) відмічається лише в дітей, у яких діагностували 2 та більше ознак ССЗВ.
Визначено чутливість і специфічність СРБ у дітей основної групи та групи порівняння: чутливість становить 55,3 і 46,8 %, специфічність — 63,4 і 51,5 % відповідно. Отже, невисока чутливість і специфічність не дають можливості використовувати СРБ для диференційної діагностики інфекційного та неінфекційного запального процесу, а також сепсису та локалізованого бактеріального запалення.
Для проведення диференційної діагностики локалізованої і генералізованої бактеріальної інфекції досліджували TNF-α, середній рівень якого у дітей основної групи дорівнював 280,3 пг/мл (ДІ 95% 243,9–316,7), що було в 1,5 раза вище, ніж у дітей із локалізованим бактеріальним процесом, у яких середній рівень даного цитокіну був 186,5 пг/мл (ДІ 95% 163,1–209,9), та в 4,2 раза вище порівняно з дітьми групи контролю (65,7 пг/мл (ДІ 95% 56,7–74,8)). У дітей із групи порівняння рівень TNF-α був у 2,8 раза вище при порівнянні з практично здоровими дітьми. Різниця між показниками у групах була статистично значущою (p < 0,01).
У дітей із септичним шоком рівень TNF-α був найнижчим, що можна пояснити розвитком паралічу імунної системи при даній стадії.
Чутливість рівня TNF-α виявилась низькою в дітей як основної групи, так і групи порівняння (44 та 61 % відповідно), що можна пояснити зниженням його вмісту у дітей із септичним шоком, і тому не дозволяє нам з упевненістю діагностувати сепсис або локалізовану бактеріальну інфекцію за допомогою рівнів TNF-α сироватки крові, однак більш висока специфічність (90 та 81 % при локалізованій бактеріальній інфекції та сепсисі відповідно) дає змогу при низьких рівнях TNF-α говорити про відсутність бактеріальної інфекції за умови відсутності ознак шоку. На рис. 3 відображено рівні TNF-α в усіх групах дітей.
Крім СРБ і TNF-α, у дітей із сепсисом та локалізованими бактеріальними інфекціями досліджували вміст ПКТ, який, як відомо, є прогормоном — попередником кальцитоніну, що синтезується парафолікулярними С-клітинами щитоподібної залози і справляє гіпокальціємічний ефект. При бактеріальному інфекційному процесі синтез ПКТ індукується ендотоксинами, і даний прогормон починають виробляти тканини різних органів [19].
За референтні значення для розрахунку брали загальноприйняті показники — 0,5–2 нг/мл свідчать про локалізовану бактеріальну інфекцію, вище 2 нг/мл — про сепсис.
В основній групі середній рівень ПКТ (рис. 4) був 4,06 нг/мл (ДІ 95% 3,34–4,69), у групі порівняння — 0,86 нг/мл (ДІ 95% 0,77–1,03), у групі контролю — 0,024 нг/мл (ДІ 95% 0,02–0,03), між групами різниця була статистично значущою (р < 0,01).
Чутливість ПКТ при локалізованій бактеріальній інфекції становить 83 %, при сепсисі — 87 %. Специфічність — 84 і 90 % відповідно, тому може бути хорошим індикатором тяжкості бактеріальної інфекції.
Однак є поодинокі роботи, які свідчать, що рівень ПКТ може короткочасно підвищуватись при масивній загибелі клітин, але при відсутності їх інфікування, а при розвитку сепсису підвищення вмісту ПКТ відбувається із затримкою і не відображає чітко його динаміку [20]. Тому нами був досліджений ще один новий біомаркер бактеріальної інфекції — пресепсин. Це — фрагмент розпаду мембранних рецепторів макрофагів, який утворюється внаслідок каскаду реакцій під впливом патогенасоційованих молекулярних структур (PAMPs) після їх зв’язування з TLR4. Раніше і швидше відображує динаміку сепсису, перспективний маркер для наукових досліджень, спрямованих на вияснення факторів, що діють на фагоцитоз [21].
В основній групі рівень ПСП (рис. 5) становив 1887,5 пг/мл (505,5–3702,5 пг/мл); у групі порівняння — 313,5 пг/мл (208–376 пг/мл). Різниця між групами за U-критерієм Манна — Уїтні статистично значуща (р < 0,01). У здорових дітей (група контролю — n = 26) рівень пресепсину — 109 пг/мл (77,5–160 пг/мл), що також статистично відрізнялось від медіани групи порівняння (р < 0,05): U-критерій Манна — Уїтні — 15 при критичному значенні 112.
У табл. 3 відображено діагностичну цінність та прогностичне значення біомаркерів сепсису у дітей.
Для діагностики наявності бактеріальної інфекції у дітей чутливість пресепсину найвища і становить 97 %, а специфічність — 96 %. Чутливість та специфічність визначення рівня пресепсину при сепсисі у дітей дорівнює 92 та 93 % відповідно.
Висновки
1. СРБ і TNF-α є чутливими маркерами запалення, але їх специфічність низька для проведення диференційної діагностики між інфекційним і неінфекційним процесом, локалізованою чи генералізованою бактеріальною інфекцією.
2. Прокальцитонін і пресепсин на сьогодні є надійними маркерами діагностики бактеріального запалення, однак пресепсин є найбільш специфічним і чутливим біомаркером і може використовуватись для проведення диференційної діагностики локалізованого та бактеріального процесу та сепсису, оскільки збільшення його рівнів індукується тільки ендо- й екзотоксинами бактерій.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Torio CM, Moore BJ. National inpatient hospital costs: the most expensive conditions by payer, 2013: statistical brief# 204. PMID:27359025
2. Koloskova KO, Bezrukov LO, Kolyubakіna LV, Vlasova OV. Diagnostic role of some immunological marker sinearly neonatal verification of sepsis International Journal of Pediatrics, Obstetrics and Gynecology 2016;9(3);58-64. (in Ukrainian)
3. Plunkett A, Tong J. Sepsis in children. BMJ 2015;351:h3704. doi: https://doi.org/10.1136/bmj.h3017
4. Gupta K, Singh RP, Pandey A, Pandey A. Photocatalytic antibacterial performance of TiO2 and Ag-doped TiO2 against S. aureus. P.aeruginosa and E.coli. Beilstein journal of nanotechnology. 2013;4:345. doi:10.3762/bjnano.4.40
5. de Souza DC, Barreira ER, Faria LS. The epidemiology of sepsis in childhood. Shock. 2017 Jan 1;47(1S):2-5.doi: 10.1097/SHK.0000000000000699
6. Orban C. Diagnostic criteria for sepsis in burn patients. Chirurgia (Bucur). 2012 Nov 1;107(6):697-700.
7. ShunkoYeYe, Tyshkevych VM, Kostjuk OO, KrasnovaYuYu, Tkachuk OO. Organizing that perspective in the development of perinatal care in Ukraine. Neonatologija, hirurgija tapery natal'na medycyna 2013;ІІІ, 3(9):5-13. (in Ukrainian)
8. Seker Kockara A, Kayatas M. Sepsis and the kidney: New developments in pathogenesis and treatment. Turkish Nephrol Dial Transplant. 2013;22:16-29.
9. Balamuth F, Weiss SL, Neuman MI, Scott H, Brady PW et al., Pediatric severe sepsis in US children’s hospitals. Pediatr Crit Care Med 2014;15:798-805. doi: 10.1097/PCC.0000000000000225
10. Simmons ML, Durham SH, Carter CW. Pharmacological management of pediatric patients with sepsis. AACN advanced critical care. 2012 Oct 1;23(4):437-48.
11. Dubrov SO, Sorokina OJu, Dubrova KA, Slavuta GB. Actuality of the problem of sepsis in the world and in Ukraine. Gostri ta nevidkladni stany u praktyci likarja. 2017;4(67):32-35. (in Ukrainian)
12. Singer M., Deutschman C.S., Seymour C.W., et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA 2016;23(315):801-810. doi:10.1001/jama.2016.0287
13. Pulatova R. Etiological characteristics and clinical features of sepsis in early age children in different variants of mediator imbalance of the immune system. Medical and Health Science Journal. 2011;7б:128-132.
14. Mossie A. Pathophysiology of sepsis. World journal of medicine and medical science. 2013;1(8):159-68.
15. Cohen J. The immunopathogenesis of sepsis. Nature. 2012 Dec 19;420(6917):885. doi:10.1038/nature01326
16. Faix JD. Biomarkers of sepsis. Critical reviews in clinical laboratory sciences. 2013 Jan 1;50(1):23-36. https://doi.org/10.3109/10408363.2013.764490
17. Wong HR, Salisbury S, Xiao Q, Cvijanovich NZ, Hall M, Allen GL, Thomas NJ, Freishtat RJ, Anas N, Meyer K, Checchia PA. The pediatric sepsis biomarker risk model. Critical care. 2012 Oct;16(5):R174. https://doi.org/10.1186/cc11652
18. Goldstein B, Giroir B, Randolph A. International pediatric sepsis consensus conference: Definitions for sepsis and organ dysfunction in pediatrics. Pediatr. Crit. Care Med. 2005;6(1),2-8. DOI: 10.1097/01.PCC.0000149131.72248.E6
19. Nakamura, M., Kono, R., Nomura, S., & Utsunomiya, H. (2013). Procalcitonin: Mysterious protein in sepsis. Journal of Basic and Clinica lMedicine, 2(1).
20. Soreng K, Levy HR. Procalcitonin: an emerging biomarker of bacterial sepsis. Clinical microbiology newsletter. 2011 Nov 15;33(22):171-8. doi:https://doi.org/10.1016/j.clinmicnews. 2011.10.004
21. Zou Q, Wen W, Zhang XC. Presepsin as a novel sepsis biomarker. World journal of emergency medicine. 2014;5(1):16. doi:10.5847/wjem.j.issn.1920-8642.2014.01.002

/52-1.jpg)
/53-1.jpg)