Вступ
Однією з проблем, що стоять перед педіатричної нефрологією, є ренальна артеріальна гіпертензія (АГ) [1]. У цілому поширеність клінічної АГ у дітей та підлітків становить близько 3,5 %, при цьому майже 20 % педіатричної АГ пов’язують з хронічною хворобою нирок (ХХН) [2]. У кожної другої дитини або підлітка ХХН перебігає з АГ [2]. Необхідно також відзначити, що АГ при хронічному пієлонефриті (ХПН), навіть при ще збереженій функції нирок, спостерігається у 2–4 рази частіше, ніж у загальній популяції, і в 12–20 % випадків має зло–якісний перебіг [3]. Взаємодія патологічних процесів з боку серцево-судинної системи й нирок становить кардіоренальний континуум [4]. Виникнення АГ на будь-якому етапі хронічного запального процесу в нирках, зокрема ХПН, погіршує його прогноз, прискорюючи прогресування нефросклерозу, що супроводжується зменшенням кількості функціонуючих нефронів і гіпоксією паренхіми, та ниркової недостатності [4–9]. Тобто зв’язок нефросклерозу й АГ двосторонній і взаємно обумовлений: при нефросклерозі формується АГ, а АГ, у свою чергу, сприяє розвитку й прогресування нефросклерозу [7, 9, 10]. Підвищений артеріальний тиск (АТ) є основним предиктором прогресування ХХН та підвищення рівня смертності серед цього контингенту дітей [11–14]. Зміни з боку серцево-судинної системи супроводжують початок ХХН [12]. Розвиток склеротичних змін у нирках у результаті запального процесу супроводжується закономірним залученням інтраренальних судин [14]. Але також є деякі підтвердження того, що ранні серцево-судинні зміни оборотні [15]. Це підкреслює важливість своєчасного виявлення та можливість корегування змін з боку серцево-судинної системи. На сьогодні одним із сучасних неінвазивних методів ранньої діагностики змін з боку серцево-судинної системи є добове моніторування АТ (ДМАТ). Порівняно з випадковим вимірюванням артеріального тиску ДМАТ є значно об’єктивнішим щодо виявлення маскованої гіпертонії, оцінки адекватності контролю АТ і прогнозування гіпертрофії лівого шлуночка в дітей із ХХН [7, 13, 16]. Рівень АТ у дітей і підлітків більшою мірою, ніж у дорослих, залежить від вегетативного впливу центральної нервової системи, тому проведення ДМАТ є діагностично більш чутливим і прогностично значущим для виявлення АГ [16, 17].
У свою чергу, рання діагностика гіпертонії за допомогою ДМАТ і визначення субклінічних серцево-судинних змін забезпечують вікно для втручання, що дозволяє впливати на ранні прояви змін з боку серцево-судинної системи, тим самим відстрочуючи проведення діалізу, покращувати прогноз серцево-судинного ускладнення [7, 15].
Проблема порушення ренальної гемодинаміки як патогенетичної ланки при запальних процесах у нирках є надзвичайно актуальною [8, 18]. Адже відомо, що функція нирок значною мірою визначається ефективністю кровообігу в них [8]. Високоінформативним неінвазивним методом діагностики стану внутрішньониркової гемодинаміки серцево-судинної системи у дітей із ХПН, ХХН є ультразвукова допплерографія (УЗДГ) судин нирок, яка завдяки своїй високій роздільній здатності та візуалізації найдрібніших судин, аж до системи мікроциркуляторного русла, дає змогу досконало оцінити внутрішньоорганну гемодинаміку [8, 9]. УЗДГ дозволяє визначити ступінь компенсації артеріального й венозного судинного тонусу — найбільш ранній і прогностично більш значимий, ніж підвищення АТ, критерій дисциркуляторних розладів [8].
Мета дослідження: визначити прогностичне значення ультрасонографічної симптоматики порушень ниркової гемодинаміки та показників добового артеріального тиску в дітей із хронічним пієлонефритом.
Матеріали та методи
Усього було обстежено 137 дітей віком від 3 до 17 років, із них 107 дітей, які хворіють на хронічний пієлонефрит, увійшли в основну групу, а 30 клінічно здорових дітей становили контрольну групу. Групи обстежених було сформовано за нозологічним принципом. За розподілом дітей за віком та статтю дослідна та контрольна групи статистично не відрізнялися (р > 0,1). Діагноз ХПН встановлювався дітям, якщо ознаки запалення в нирках мали місце понад 3 місяці або були наявні 2–3 рецидиви пієлонефриту протягом 1 року від початку захворювання.
Латентний перебіг запального процесу було встановлено в 47 (43,9 %) осіб, рецидивуючий — у 60 хворих (56,1 %). Серед обстежених хворих найменшою була частка дітей із первинним пієлонефритом — 19,6 % випадків. Розвитку вторинного пієлонефриту сприяли уропатії, пов’язані з аномаліями сечовивідних шляхів (АСВШ), — 27,1 % усіх випадків (синдром Фролея, гідронефроз, мегауретер, нефроптоз, міхурово-сечовідний рефлюкс тощо), нейрогенними дисфункціями сечового міхура — 20,6 %, а також дисметаболічними нефропатіями — 32,7 %. У всіх обстежених ХПН не супроводжувався порушенням азотовидільної функції нирок і зниженням швидкості клубочкової фільтрації.
Добове моніторування артеріального тиску проводилося за допомогою програмно-апаратного комплексу «Кардиотехника-04-АД-1» («Инкарт», м. Санкт-Петербург, РФ). При аналізі даних ДМАТ оцінювалися такі параметри: середні значення систолічного АТ (САТ) і діастолічного АТ (ДАТ) за добу, день і ніч; максимальні й мінімальні значення АТ у різні періоди доби; показники навантаження тиском (індекс часу (ІЧ) й індекс площі (ІП) гіпертензії) за добу, день і ніч; тривалість гіпотонічних епізодів (індекс часу та індекс площі гіпотензії) в різні періоди доби; розрахунковий показник коефіцієнт варіації (КВ) денний (КВд) і нічний (КВн), ранковий підйом АТ (величина й швидкість ранкового підйому АТ); варіабельність АТ; добовий індекс (ДІ). Усі параметри ДМАТ аналізували окремо за САТ і ДАТ для кожного часу доби (день — САТд/ДАТд; ніч — САТн/ДАТн) та в сукупності за добу. Індекс часу гіпертензії (гіпотензії), або частка підвищеного (зниженого) артеріального тиску, дозволяв оцінити час підвищення (зниження) АТ протягом доби. Індекс часу гіпертензії, що перевищував 25 % для САТ, однозначно розглядався як патологічний. У цьому випадку встановлювався діагноз АГ. При стабільній АГ ІЧ гіпертензії наближався до 100 % і втрачав свою інформативність. У даному випадку визначали індекс площі або навантаження тиском. ІП відображав гіпертонічне навантаження, що діє на організм пацієнта, тобто протягом якого часу за 24 години (або за день, ніч) і в середньому на яку величину артеріальний тиск перевищував верхню допустиму межу. Діагностика й верифікація АГ у роботі ґрунтувалась на рекомендаціях Європейського товариства з питань гіпертензії (ESH, 2016) і Європейського товариства кардіологів (ESC, 2014).
З метою оцінки стану регіонарної гемодинаміки всім дітям проводили ультразвукове допплерографічне дослідження ниркової гемодинаміки на ультразвуковому апараті Honda Electronics Co (Japan) у режимі кольорового допплерівського картування в положенні лежачи на спині, на лівому та правому боці з використанням конвексного датчика з частотою від 4 до 7 МГц. У режимі кольорового допплерівського картування проводили послідовну локацію ниркових артерій у ділянці воріт нирок, а також сегментарних і інтерлобарних артерій. Якщо в однієї дитини вдавалося отримати допплерограми на кількох судинах одного рівня, то враховувалися середні значення показника.
Як числові характеристики артеріального ренального кровотоку використовували кількісні кутозалежні параметри, а саме: максимальну швидкість кровотоку в систолу, мінімальну швидкість кровотоку в діастолу, усереднену за часом максимальну швидкість кровотоку впродовж усього серцевого циклу. За зазначеними параметрами обчислювали відносні показники: систоло-діастолічне співвідношення (S/D), пульсаційний індекс (PI), індекс резистентності (IR).
З урахуванням значного об’єму первинної інформації, отриманої при виконанні обстежень та в результаті її постобробки, на етапі планування дослідження була створена єдина база даних на основі інструментального середовища Microsoft Office Excel 2007.
Математичне та статистичне опрацювання цифрового матеріалу проводилося на персональній електронно-обчислювальній машині за допомогою параметричних та непараметричних методів, рекомендованих для медичних досліджень. Застосовано критерії варіаційного, дисперсного, альтернативного й кореляційного статистичного аналізу. Порівняння сукупностей за кількісними показниками проводилося за допомогою дисперсного аналізу та розрахунку критерію Стьюдента (t). Для виявлення зв’язку між досліджуваними параметрами розраховували показник лінійної кореляції Пірсона або показник рангової кореляції Кендалла.
Результати та обговорення
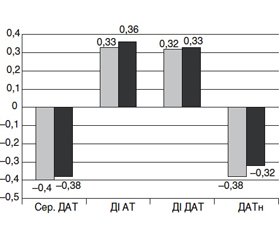
Спочатку було проведено кореляційний аналіз показників УЗДГ на рівні стовбурової ниркової артерії. При визначенні парної кореляції між показниками УЗДГ і ДМАТ у дітей із хронічним пієлонефритом у цілому найбільш сильний кореляційний зв’язок був виявлений між індексом периферичного опору PI на рівні стовбурової ниркової артерії та показниками ДМАТ (рис. 1).
На рівні стовбурової ниркової артерії в дітей, які хворіють на хронічний пієлонефрит, був виявлений виражений прямий кореляційний зв’язок між індексами периферичного опору IR і PI та ДІ (АТ, САТ, ДАТ), а з ІЧ, ІП, середнім ДАТ, ДАТн та КВн — негативний кореляційний зв’язок. Показник S/Д мав помірний прямий кореляційний зв’язок з КВн і ДІ (АТ, ДАТ) та зворотний — з показниками ІЧ, ІП, середнім ДАТ, ДАТн.
Аналіз кореляційних відношень показників УЗДГ на рівні сегментарних артерій нирки з –індексами периферичного опору IR і PI та показниками ДМАТ (ДІ (АТ, ДАТ), ІЧ, ІП, середній ДАТ, ДАТн та КВн) виявив їх статистично вірогідний виражений кореляційний зв’язок (рис. 2).
Виражений прямий кореляційний зв’язок був виявлений між індексами периферичного опору IR і PI та ДІ (АТ, ДАТ), а з ІЧ, ІП, середній ДАТ, ДАТн і КВн — негативний помірно виражений кореляційний зв’язок. Між систоло-діастолічним індексом (S/D) на рівні сегментарних артерій нирки та ДІ АТ був помірно виражений прямий кореляційний зв’язок при r = 0,33. Кореляційні взаємозв’язки між S/D та іншими показниками ДМАТ у дітей із ХПН були статистично невірогідними.
Кореляційні зв’язки між УЗДГ-показниками ниркової гемодинаміки та ДМАТ на рівні інтерлобарних ниркових артерій у дітей із ХПН були статистично невірогідними (рис. 3).
Порівняльний аналіз коефіцієнтів кореляції УЗДГ нирок та показників ДМАТ у хворих із хронічним пієлонефритом на фоні АСВШ та без АСВШ, отриманих при проведенні парної кореляції, виявив їх розбіжність (табл. 1).
У групі хворих із хронічним пієлонефритом на фоні АСВШ виявлено найбільш виражені статистично вірогідні кореляційні зв’язки між РІ і ДІ (АТ, САТ, ДАТ), КВд, середнім ДАТ та ПАТ, ДАТн і ДАТд; IR і ІЧ, ДІ (АТ, ДАТ), КВд та КВн, середнім ДАТ та ПАТ, ДАТд; S/D і КВн, ІП, ДІ (АТ, САТ, ДАТ) на рівні стовбурової ниркової артерії. На рівні сегментарної артерії різнилися коефіцієнти кореляції між РІ і ДІ (АТ, ДАТ), середнім ДАТ та ДАТд; IR і ІЧ, ДІ ДАТ та КВн; S/D і КВн і ДАТд.
При оцінці парної кореляції між показниками ДМАД і УЗДГ у групі хворих на ХПН на тлі АСВШ найбільш сильний зв’язок був виявлений між індексами периферичного опору PI та RI на рівні стовбурової ниркової артерії та показниками ДМАТ (рис. 4).
Помірно виражений кореляційний взаємозв’язок показників ультрасонографії та ДМАТ нирок був виявлений на рівні сегментарної ниркової артерії. Індекси периферичного опору PI та ІR вірогідно корелювали з показниками ДІ АТ, ДІ ДАТ, КВн, середнім ДАТ, ІП та ДАТн (r = 0,52 і r = 0,48; r = 0,56 і r = 0,61; r = –0,48 і r = –0,46; r = –0,6 і r = –0,63; r = –0,43 і r = –0,38; r = –0,59 і r = –0,62, p < 0,01 відповідно).
Показник S/Д мав помірний кореляційний зв’язок з КВн і ДАТд на рівні стовбурової ниркової й сегментарної артерій: S/Д і ДАТд — r = –0,5 і r = –0,36, p < 0,01 відповідно; S/Д і КВн — r = 0,53, та r = 0,38, p < 0,01 відповідно.
Кореляційні зв’язки між показниками ниркової гемодинаміки та ДМАТ на рівні інтерлобарної ниркової артерії в дітей із ХПН на фоні АСВШ мали також помірну вираженість та були статистично вірогідними (рис. 5).
/28-1.jpg)
При визначенні парної кореляції між показниками СМАД і УЗДГ у дітей із хронічним ПН без АСВШ статистично вірогідні зв’язки були виявлені між індексом периферичного опору IR на рівні стовбурової та сегментарної ниркових артерій та показниками ДМАТ (рис. 6). Показник РІ мав помірний кореляційний зв’язок із КВн, ДАТд, ДАТн, ІЧ, ІП та середнім АТ на рівні стовбурової ниркової й сегментарної артерій: РІ і ДАТд — r = –0,34 і r = –0,32, p < 0,01 відповідно; РІ і КВн — r = –0,39 та r = –0,36, p < 0,01 відповідно; РІ і ДАТн — r = –0,39 і r = –0,41, p < 0,01 відповідно; РІ і ІЧ — r = –0,43 і r = –0,36, p < 0,01 відповідно; РІ і ІП — r = –0,46 і r = –0,41, p < 0,01 відповідно; РІ і середній АТ — r = 0,33 і r = 0,34, p < 0,01 відповідно. Кореляційні зв’язки між показниками ниркової гемодинаміки та ДМАТ на рівні інтерлобарної ниркової артерії в дітей із ХПН без АСВШ були статистично невірогідними.
/29-1.jpg)
Отже, кореляційний аналіз показників УЗДГ і ДМАТ у дітей у фазі ремісії хронічного пієлонефриту виявив сильний і статистично вірогідний зв’язок між показниками PI, IR, S/D і ДІ (АТ, САТ, ДАТ), КВн, середнім ДАТ та ДАТн на рівні стовбурової й сегментарних артерій нирки.
Висновки
1. Діти з хронічним пієлонефритом на тлі аномалій сечовивідних щляхів мали найбільші гемодинамічні зрушення показників ниркової гемодинаміки, що проявлялись у зниженні швидкісних показників кровотоку в нирках, збільшенні індексів судинного опору ниркової артерії й переважанні нічної діастолічної гіпертензії за даними добового моніторування артеріального тиску. Це дозволило визначити пріоритетність використання цих показників для характеристики ренальної гемодинаміки й прогнозування розвитку артеріальної гіпертензії в дітей із хронічним пієлонефритом.
2. Парний кореляційний аналіз найбільш значущих показників ультрасонографії судин нирок і добового моніторування артеріального тиску в дітей із хронічним пієлонефритом виявив зниження регіо–нарної ниркової гемоциркуляції на рівні стовбурової й сегментарних артерій нирки.
3. Найбільшу прогностичну значимість в оцінці функціонального стану ренальної гемодинаміки та прогресування артеріальної гіпертензії в дітей із хронічним пієлонефритом мали допплерографічні кутозалежні показники ниркового кровотоку (PI, RI і S/D) на рівні сегментарних та стовбурової ниркових артерій.
4. Для раннього виявлення порушень ренального кровотоку при хронічному пієлонефриті в дітей у комплекс інструментальних досліджень необхідно включати ультразвукове дослідження нирок з визначенням кутозалежних показників ниркового кровотоку (PI, RI і S/D) на рівні сегментарних та стовбурової ниркових артерій, що мають найбільшу прогностичну значимість в оцінці функціонального стану ренальної гемодинаміки та прогресування артеріальної гіпертензії в дітей із хронічним пієлонефритом.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Рецензенти: Кривопустов С.П., д.м.н., професор кафедри педіатрії № 2 НМУ ім. О.О. Богомольця; Макєєва Н.І., д.м.н., професор, зав. кафедри педіатрії № 2 ХНМУ.
Список литературы
1. Савенкова Н.Д. Нефрогенная артериальная гипертензия у детей и подростков: причины, классификация, диагностика / Н.Д. Савенкова // Рос. вестн. перинатол. и педиатр. — 2017. — № 62(4). — С. 43-48. doi: 10.21508/1027-4065-2017-62-4-43-48.
2. Flynn J.T. Subcommittee on screening andmanagement of high blood pressure in children. Clinical Practice Guideline for Screening and Management of High Blood Pressure in Children and Adolescents / J.T. Flynn, D.C. Kaelber, C.M. Baker-Smith et al. // Pediatrics. — 2017. — № 140(3). pii: e20171904. doi: 10.1542/peds.2017-1904.
3. Ермолаева Ю.А. Суточный профиль артериального давления у детей с пузырно-мочеточниковым рефлюксом / Ю.А. Ермолаева, С.Н. Иванов, О.П. Харина и др. // Сибирский медицинский вестник. — 2008. — № 2. — С. 5-9.
4. Макєєва Н.І. Ренокардіальний континуум у дітей із хронічним захворюванням нирок: «традиційні» та «нетрадиційні» чинники ризику формування кардіоваскулярних ускладнень / Н.І. Макєєва // Педіатрія, акушерство та гінекологія. — 2013. — № 1(455). — С. 20-24.
5. Иванов Д.Д. Следующий шаг в лечении хронической болезни почек / Д.Д. Иванов // Почки. — 2016. — № 2(16). — С. 10-13.
6. Shaikh N. Identification of Children and Adolescents at Risk for Renal Scarring After a First Urinary Tract Infection. A Meta-analysis With Individual Patient Data / N. Shaikh, J.C. Craig, M.M. Rovers et al. // JAMA Pediatr. — 2014. — № 168(10). — Р. 893-900. doi:10.1001/jamapediatrics.2014.637
7. Hooman N. The prevalence of hypertension in children with renal scars / N. Hooman, R. Isa-Tafreshi, S.H. Mostafavi et al. / Minerva Pediatr. — 2017. — № 69(3). — Р. 200-205. doi: 10.23736/S0026-4946.16.04217-1. — https://www.ncbi.nlm.nih.gov/pubmed/28452212
8. Аверченко М.В. Допплерографические показатели ренальной гемодинамики у детей с хроническим обструктивным пиелонефритом / М.В. Аверченко // Ультразвуковая и функциональная диагностика. — 2012. — № 5. —
С. 68-78.
9. Mohammadjafari H. Doppler Ultrasonography as a Predictive Tool for Permanent Kidney Damage Following Acute Pyelonephritis Comparison With Dimercaptosuccinic Acid Scintigraphy / Н. Mohammadjafari, A. Aalaee, E.Salehifaret al. // Iranian Journal of Kidney Diseases. — 2011. — Vol. 5, № 6. — Р. 386-391.
10. Park Y.S. Renal scar formation after urinary tract infection in children / Y.S. Park // Korean J. Pediatr. — 2012. — № 55(10). — Р. 367-370. doi: 10.3345/kjp.2012.55.10.367. Epub 2012 Oct. — https://www.ncbi.nlm.nih.gov/pubmed/23133482
11. Safder O. Pediatric CKD and cardiovascular disease / O. Safder, Al.S. Sharif, J.A. Kari // Cardiovasc. Hematol. Disord. Drug Targets. — 2014. — № 14(3). — P. 177-84. — https://www.ncbi.nlm.nih.gov/pubmed/24720458
12. Tian J. Cardiovascular risks in chronic kidney disease pediatric patients / J. Tian, L. Niu, X. An // Exp. Ther. Med. — 2017. — № 14(5). — Р. 4615–4619. doi: 10.3892/etm.2017.5117. — https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5704347/
13. Gupta D. Role of 24-h ambulatory blood pressure monitoring in children with chronic kidney disease / D. Gupta, S. Chaturvedi, S. Chandy, I. Agarwal // Indian J. Nephrol. — 2015. — № 25(6). — Р. 355-361. doi: 10.4103/0971-4065.148305. — https://www.ncbi.nlm.nih.gov/pubmed/26664211
14. Warady B.A. Predictors of rapid progression of glomerular and nonglomerular kidney disease in children and adolescents: The chronic kidney disease in children (CKiD) cohort / B.A. Warady, A.G. Abraham, G.J.Schwartz et al. // Am. J. Kidney Dis. — 2015. — № 65. — Р. 878-888. doi: 10.1053/j.ajkd.2015.01.008. — https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4578873/
15. Vidi S.R. Role of hypertension in progression of chro–nic kidney disease in children / S.R. Vidi // Curr. Opin. Pediatr. — 2018. — № 30(2). — Р. 247-251. doi: 10.1097/MOP.0000000000000595. — https://www.ncbi.nlm.nih.gov/pubmed/29517980
16. Іванов Д.Д. Артеріальна гіпертензія у дітей та підлітків: нефрологічний аспект // Дитячий лікар. — 2009. — № 2(2). — С. 22-25.
17. Безрук В.В. Нефрологічні аспекти артеріальної гіпертензії у дітей та підлітків / В.В. Безрук // Клінічна та експериментальна патологія. — 2013. — Т. 12, № 4(46). — С. 133-13.
18. Зорин И.В. Значение нарушений внутрипочечной гемодинамики в формировании и прогрессировании тубулоинтерстициального поражения почек у детей / И.В. Зорин, А.А. Вялкова, Л.В. Ванюшина // Лечащий врач. — 2016. — № 1. — https://www.lvrach.ru/2016/01/15436384/

/25-1.jpg)
/26-1.jpg)
/27-1.jpg)
/28-2.jpg)
/28-1.jpg)
/29-1.jpg)