Хронічна гранулематозна хвороба (ХГХ) є рідкісним, спадковим захворюванням імунної системи, основою якої є дефект фагоцитів, що призводить до неефективного знищення бактеріальної і грибкової флори. Саме тому хворі на ХГХ спри–йнятливі до серйозних, потенційно небезпечних для життя бактеріальних і грибкових інфекцій та мають нормальний імунітет до вірусних інфекцій.
Біохімічні основи ХГХ. До основних порушень, що лежать в основі ХГХ, відносяться зміни процесу окисного метаболізму і вироблення окислювальних реактивних радикалів під час фагоцитозу. У хворих НАД і НАДФ присутні в фагоцитуючих клітинах, однак в процесі фагоцитозу активність цих коферментів не збільшується. Це відбувається через відсутність одного з компонентів НАДФН-оксидази, яка каталізує утворення супероксиду, попередника генерації потужних сполук-окислювачів шляхом трансмембранного проходження електронів від НАДФН-оксидази на молекулярний кисень [1].
Захворюваність і поширеність ХГХ. Точна частота поширення ХГХ невідома. За даними літератури, поширеність ХГХ становить від 1 : 4 000 000 в США до 8,5 : 1 000 000 населення Великої Британії та Ірландії. Незважаючи на існуючу антибактеріальну і протигрибкову профілактику у цих хворих на сучасному етапі, захворюваність на тяжкі інфекційні ускладнення залишається високою. За ретроспективними даними, зібраними у 2001 р., можливість виживання до 30 років становила 50 %. Враховуючи досягнення сучасної медицини в галузі ранньої діагностики і кращого лікування, ці показники будуть поліпшуватися з кожним роком. При підозрі на ХГХ важливим є направлення хворого до спеціалізованого імунологічного центру для подальшого специфічного лабораторного дослідження, генетичного тестування та консультації усіх членів сім’ї. Серед особливостей успадкування ХГХ слід зазначити, що дефекти, зчеплені з Х-хромосомою, найчастіше зустрічаються у західних країнах, на відміну від країн Близького Сходу, де частіше спостерігається автосомно-рецесивна форма захворювання [1–3]. Поширеність генетичних дефектів і тип успадкування наведено в табл. 1.
/148-1.jpg)
Клінічні прояви. Відмінною рисою клінічних проявів є рецидивні інфекції, що перебігають на поверхні епітелію при безпосередньому контакті з чинниками навколишнього середовища, саме тому найпоширенішими є інфекції шкіри, легенів і кишечника. Інфекції цих органів, що повторюються та тяжко піддаються лікуванню, повинні викликати підозру на імунний дефіцит, у тому числі ХГХ. Ознаки та симптоми спочатку спостерігаються як і при звичайних інфекціях, і мають незначно виражені клінічні прояви, але особливістю цих клінічних змін є прогресування та резистентність до звичайної терапії. У носіїв гена ХГХ з формою, зчепленою з Х-хромосомою, також можуть виникати рецидивні інфекційні захворювання.
Серед особливостей клінічних проявів носіїв гена ХГХ з Х-зчепленим дефектом слід зазначити схильність до розвитку низки симптомів, що клінічно нагадують системний червоний вовчак, особливо з ураженням шкіри. За опублікованими даними, у носіїв гена ХГХ результати тестування на системний червоний вовчак можуть бути негативними, але гіподіагностика у цьому випадку може привести до необоротних змін, тому до симптомів у таких хворих необхідно ставитися дуже уважно. Носії гена ХГХ з афтозними виразками, висипаннями на шкірі, болями у суглобах повинні бути направлені до відповідних фахівців для лікування вовчакоподібних симптомів незалежно від результатів тесту на системну червону вовчанку [10, 11].
Більшість хворих на ХГХ мають клінічні прояви з раннього віку, захворювання найчастіше діагностується у віці до 2 років. Враховуючи гіподіагностику, такі пацієнти можуть залишатися невиявленими до дорослого життя, незважаючи на ранній початок симптомів. Типові ураження у вигляді абсцесів шкіри, періанальних абсцесів, пневмонії, абсцесів печінки, остеомієліту, сепсису, діареї, лімфаденітів є ознакою імунодефіцитного стану у дитини і потребують подальшого імунологічного та генетичного дослідження.
Треба звернути увагу, що щоденна антибактеріальна і протигрибкова профілактика є єдиним фактором для підтримки хворих на ХГХ та ключовим моментом скорочення числа і тяжкості інфекцій. У той же час ця терапія не дає 100% гарантії захисту від інфекцій, з якими зустрічається хворий.
Бактеріальними збудниками, які найчастіше зустрічаються у хворих на ХГХ, є Staphylococcus aureus та грамнегативна флора: Enterobacteriaceae, включаючи Salmonella, Klebsiella, Aerobacter та Serratia. Усе частіше як важливі патогени при ХГХ визначаються Pseudomonas (Burkholderia) cepacia, Actinomyces і Nocardia. Каталазанегативні бактерії, такі як стрептококи, рідко викликають інфекційні захворювання у цих хворих. Серед представників грибкової флори найчастішою причиною грибкової інфекції є Aspergillus fumigatus, також поширені A.nidulans, Scedosporium apiospermum і Chrysosporium zonatum. Грибкові інфекції за клінічними ознаками дуже складно відрізнити від бактеріальних інфекцій, але цей фактор завжди слід враховувати в цій групі пацієнтів, якщо вони не відповідають на емпіричну антибактеріальну терапію [7, 8].
Діагностика. Діагноз встановлюється на підставі клінічної картини і підтверджується виявленням зниженої активності киснезалежної бактерицидної функції нейтрофілів, за допомогою НСТ-тесту та дослідженням оксидації дигідрородаміну-1, -2, -3 методом проточної цитометрії, який також дає змогу виявити носіїв мутації [4–6].
Профілактична терапія. Для зменшення частоти тяжких інфекцій усім пацієнтам профілактичну антибактеріальну терапію необхідно розпочинати з ко-тримоксазолу, який має широку активність щодо патогенних мікроорганізмів, які зустрічаються, і не впливає на анаеробну флору кишечника.
Рекомендовані дози ко-тримоксазолу наведено у табл. 2.
Протигрибкова профілактика всім пацієнтам повинна розпочинатися ітраконазолом (з розрахунку 5 мг/кг за добу), який має хорошу активність щодо Aspergillus. Ураховуючи побічні ефекти протигрибкової терапії, такі як підвищення ферментів печінки, можливість виникнення периферичної нейропатії та синдрому Стівенса — Джонсона, необхідний динамічний контроль рівня ферментів печінки до початку лікування, а потім кожні 6 місяців. Зазвичай ітраконазол добре переноситься хворими на ХГХ та, за даними різних досліджень, є ефективним у зниженні захворюваності на грибкову інфекцію.
Важливим серед запобіжних заходів у повсякденному житті є розуміння профілактики інгаляційного зараження грибковими інфекціями, до яких відноситься уникання хворими перебування у коморах, печерах з підвищеною вологістю та іншого контакту з побутовою цвіллю.
Антибактеріальна терапія рекомендована хворим на ХГХ за необхідності проведення всіх інвазивних процедур, у тому числі колоноскопії, езофагоскопії, бронхоскопії, біопсії печінки/легень та ін. Профілактичне використання ципрофлоксацину (і додавання метронідазолу, якщо інвазивне дослідження стосується органів черевної порожнини) повинне розпочинатися до процедури і продовжувати протягом не менше 24 годин після нього. При хірургічному втручанні можуть знадобитися більш тривалі курси з різною комбінацією антибіотиків [1].
Необхідність регулярної стоматологічної допомоги низці пацієнтів обумовлена постійними гінгівітами і виразками ротової порожнини. Слід підкреслити важливість у хворих на ХГХ доброї зубної гігієни порожнини рота та необхідність обов’язкового чищення зубів два рази на день. Додаткову терапію антибактеріальними препаратами слід призначити хворим перед стоматологічною процедурою, через 12 і 24 години після втручання у вигляді ципрофлоксацину перорально із разрахунку (7,5 мг/кг/разово) [9].
Лікування гострих інфекцій у хворих на ХГХ. Препаратами вибору при лікуванні гострих інфекцій у хворих на ХГХ (та будь-якого захворювання, що супроводжується лихоманкою) є антибактеріальні препарати, швидке призначення яких та своєчасна необхідність внутрішньовенного введення можуть запобігти розвитку тяжких інфекцій. Надмірне використання антибіотиків може викликати певне занепокоєння з приводу суперечливості питання про неналежне лікування вірусних інфекцій у таких хворих, але необхідність основних профілактичних патогенетичних моментів у терапії є обов’язковою тактикою ведення хворих з уродженими дефектами фагоцитозу. Спектр бактерій, які викликають інфекції при ХГХ, завжди слід брати до уваги при розгляданні питання вибору антибактеріальних препаратів. Використання ципрофлоксацину як антибактеріального препарату першої лінії при ХГХ пов’язано з широким спектром його активності та здатності проникати внутрішньоклітинно. Переваги використання ципрофлоксацину у дітей переважують ризики розвитку артропатії. Дозування ципрофлоксацину для лікування гострих інфекцій у дітей із розрахунку 7,5 мг/кг кожні 12 годин пер–орально.
Добрим вибором для терапії першої лінії при тяжкому сепсисі є тейкопланін і ципрофлоксацин з додаванням метронідазолу, якщо інфекція підозрюється в органах черевної порожнини. Якщо діагностовано ізольований стафілококовий інфекційний процес, можуть використовуватися флуклоксацилін і фуцидин (або інші антистафілококові антибактеріальні препарати, наприклад кліндаміцин і кларитроміцин). Грибкові інфекції завжди слід розглядати в диференціальній діагностиці будь-якого синдрому сепсису, особливо якщо швидка реакція (протягом 7–10 днів) на антибактеріальну терапію не отримана.
Імунізація. Рекомендована планова імунізація дітей, хворих на ХГХ, окрім вакцинації БЦЖ, яка протипоказана цим хворим у зв’язку з можливістю виникнення генералізованої БЦЖ-інфекції. Ураховуючи можливі вторинні бактеріальні ускладнення грипу, щорічна вакцинація проти грипу є одним із профілактичних заходів.
Запальні ускладнення при ХГХ включають розвиток хронічного захворювання легенів, коліту, перикардиту, гінгівіту, пневмоніту, хоріоретиніту. Важливо відзначити, що пневмоніт при ХГХ має швидкий, блискавичний перебіг та вимагає лікування антимікотичними препаратами і глюкокортикостероїдами.
Гранулематозне ураження травного тракту. Тривале спостереження хворих на ХГХ показало, що з використанням профілактичної терапії збільшилась можливість виживання хворих і тривалість життя. При цьому гранулематозні обструктивні ураження являють собою надлишкову запальну реакцію на незначні подразнюючі стимули, такі як персистування умовно-патогенної флори, і у більшості випадків не пов’язані з гострим запальним інфекційним процесом. Це підтверджується дослідженнями, які виявили підвищення швидкості осідання еритроцитів (ШОЕ) та зниження гемоглобіну навіть у хворих без клінічних проявів гострого інфекційного процесу, що пов’язано з наявністю субклінічного запалення.
Гранулематозне ураження травного тракту, що має клініку коліту, є найбільш поширеним запальним ускладненням ХГХ. При гістологічному дослідженні виявляють виснаження нейтрофілів, еозинофільну інфільтрацію і макрофаги. Гранульоми можуть бути присутніми або відсутніми. Саме тому коліт при ХГХ неправильно діагностується як хвороба Крона, що має схожі клінічні симптоми. При підозрі на ураження травного тракту необхідно проводити не тільки ендоскопічне дослідження, але і біопсію, тому що макроскопічний зовнішній вигляд може бути неінформативним.
Корисними препаратами першої лінії в лікуванні коліту при ХГХ є препарати 5-аміносаліцилової кислоти (такі як сульфасалазин і месалазин). Кортико–стероїди та інші імунодепресанти, такі як азатіоприн, можуть бути використані у тому випадку, коли препарати 5-аміносаліцилової кислоти не змогли викликати або підтримувати ремісію. Проте ці препарати слід використовувати з обережністю особливо у тих хворих, у яких є інша супутня грибкова інфекція. При поєднанні цих препаратів з ко-тримоксазолом клінічний аналіз крові треба контролювати щомісяця протягом перших 3 місяців і кожні 3 місяці після цього у зв’язку з потенційним ризиком формування патологічних змін крові [1, 12–14].
Розвиток непрохідності травного тракту або сечовивідних шляхів внаслідок гранулематозного запалення у хворих на ХГХ може клінічно проявлятися як труднощі при ковтанні при непрохідності стравоходу, блювання при обструкції шлунка, болі в животі при непрохідності кишечника або труднощі при сечовипусканні при обструкції сечоводу. Все це є показанням до проведення кортикостероїдної терапії. Перед застосуванням кортикостероїдів необхідно виключити інфекційну причину, у тому числі і грибкову інфекцію.
Трансплантація стовбурових клітин. Ураховуючи, що використання антибактеріальної і протигрибкової профілактики протягом усього життя підвищує тривалість і якість життя пацієнтів, а лікування кортикостероїдними препаратами і аміносаліцилатами призводить до зниження запальних ускладнень, ці терапевтичні дії не змінюють основний генетичний дефект. Трансплантація стовбурових клітин є одним із методів корекції, завдяки якому профілактичне лікування може бути припинено у більшості хворих. Виживання і ефективність лікування на даному етапі досягає 85–90 %. Конкретні терміни для проведення трансплантації відсутні, але слід зазначити, що найгірші результати пересадки спостерігаються у пацієнтів з рефрактерною інфекцією або значними запальними ураженнями. Необхідність проведення трансплантації стовбурових клітин в ранні терміни після встановлення діагнозу не викликає сумнівів [17–20].
Генна терапія. Суттєвою проблемою транс–плантації кісткового мозку є HLA-сумісність. Це обумовлює ризик відторгнення. На відміну від трансплантації кісткового мозку основною стратегією генної терапії є виправлення дефектів власного кісткового мозку пацієнта, використовуючи віруси, що транспортують функціонуючий ген в стовбурові клітини замість дефектного. Ця методика є перспективною і для лікування хворих на ХГХ, бо дозволяє власному кістковому мозку хворого виробляти нормально функціонуючі клітини-нейтрофіли. Багато досліджень показали ефективність цього методу не тільки в лабораторних умовах, але і в клініці. Навіть короткострокова корекція дефекту у хворих на ХГХ призвела до позбавлення їх від інфекцій, загрозливих для життя, які були стійкі до інших засобів лікування. Проте ця технологія є відносно новою. Клінічні випробування з використанням сучасних генетичних технологій для лікування пацієнтів з ХГХ у минулі роки та розпочаті у 2012 році сприяють перевірці і підтвердженню принципу дії і відкривають шлях до реалістичної та безпечної альтернативної терапії для пацієнтів [1, 21, 22].
Диспансерне спостереження. Клінічний моніторинг включає диспансерне спостереження у педіатра й імунолога. Регулярне амбулаторне обстеження кожні 6 місяців, якщо пацієнт має добре контрольований перебіг захворювання. Рекомендується регулярно проводити аналізи крові (клінічні і імунологічні), функціональні печінкові тести кожні 6 місяців. Рівень С-реактивного протеїну і ШОЕ слід проводити в плановому порядку і щоразу, коли пацієнт має погіршення стану. Мікроцитарна, гіпохромна анемія, що виявляється у хворих на ХГХ, дуже часто залишається рефрактерною до терапії залізом.
Одним із ускладнень у хворих і носіїв гена ХГХ є хоріоретиніт, етіологія якого у наш час залишається неясною. Тому офтальмологічне обстеження рекомендовано кожні 1–2 роки. Особам, які не мають ураження на момент встановлення діагнозу, очне дно необхідно обстежувати кожні 2–3 роки [15, 16].
Харчування і фізичний розвиток. У деяких дітей з ХГХ відмічається зниження темпів фізичного розвитку порівняно з однолітками, відмічається затримка в досягненні статевої зрілості. Порушення у фізичному розвитку пов’язано з мультифакторними причинами. Наявність постійних бактеріальних і грибкових інфекцій, які зазвичай мають хронічний перебіг, постійна антибактеріальна та протигрибкова терапія, курси кортикостероїдної терапії, недостатнє споживання поживних речовин, необхідність їх збільшення в умовах субклінічного запального процесу впливають на фізичний розвиток дитини. Тому при кожному огляді лікар повинен оцінювати фізичний розвиток та раціон дитини, з подальшою корекцією виявлених змін.
Емоційний вплив ХГБ. ХГХ спричиняє безліч проблем для пацієнтів і їх близьких, що включають не тільки фізичні зміни стану дитини, а також і психологічні проблеми, які, з одного боку, пов’язані з подоланням складних умов перебігу захворювання, а з іншого — з намаганням зберегти психологічний комфорт у сім’ї та підвищити якість життя хворого.
Необхідність психологічної підтримки не тільки хворого, але й інших членів сім’ї дозволяє не тільки сформувати терапевтичний комплайєнс, але сприяє також встановленню найкращого психологічного контакту, необхідного для одужання хворого.
Незважаючи на ранній початок клінічних симптомів, гіподіагностика цього захворювання є значною проблемою. Наведений випадок клінічного спостереження відображає складність диференціальної діагностики інфекційних процесів у цієї категорії хворих.
Хлопчик Н., 15 років, народився від першої вагітності, на тлі гестозу першої половини вагітності, анемії. Пологи в строк. Маса при народженні 3300 г. Асфіксія легкого ступеня. Вакцинований БЦЖ у пологовому будинку. Період новонародженості був без особливостей.
Спадковий анамнез хворого був обтяжений: у 2 молодших братів хворого діагностовано первинний імунодефіцит, дефект фагоцитозу. Молодший брат помер у 8-місячному віці від ускладнень пневмонії, мав клінічні прояви імунодефіциту: у 2 міс. — наполегливі попрілості, у 3 міс. — отит, у 4 міс. — стрептостафілодермію, у імунолога дитина не спостерігалась.
У віці 1 рік переніс абсцедуючий фурункул привушної ділянки, отит, ларингіт, стрептодермію, рецидивуючий абсцедуючий підщелепний лімфаденіт. У 2 роки при рецидиві абсцедуючого підщелепного лімфаденіту при проведенні біопсії і гістологічного дослідження діагностовано туберкульоз лімфатичних вузлів. Проведена терапія протитуберкульозними препаратами. У 4-річному віці діагностовано первинний імунодефіцит, дефект фагоцитозу. Генералізована БЦЖ-інфекція з ураженням підщелепних, шийних, підключичних і внутрішньогрудних лімфовузлів, хронічний перебіг. У 5-річному віці гнійний блефарокон’юнктивіт, абсцедуючий лімфаденіт справа привушної ділянки.
У 6-річному віці дитина лікувалася з приводу туберкульозу внутрішньогрудних лімфовузлів, деструктивної фази інфільтрації, туберкульозу правого нижньодолевого бронха, ускладненого ателектазом S8, S9.
У 7-річному віці проходив лікування з приводу туберкульозу внутрішньогрудних лімфовузлів, туберкульозу правого нижньочасточкового бронха з залишковими явищами у вигляді пневмосклерозу S8, S9. При рентгенологічному дослідженні легень справа в базальному відділі посилення легеневого рисунка з нечіткими контурами, корінь подовжений, деформований, в нижньозовнішньому відділі лінійна тінь костальної плеври. У синусі спайка, зліва без інфільтративних змін. У пахвовій ділянці лімфовузол із звапнінням. Проведена протитуберкульозна терапія.
У 9 років стан дитини знову погіршився, відзначалося підвищення температури тіла, зрідка кашель, була проведена рентгенографія органів грудної клітки та діагностована позагоспітальна первинна лівостороння пневмонія. При проведенні комп’ютерної томографії: лівостороння пневмонія, постзапальний фіброз правої легені. Проведено курс антибактеріальної (цефалоспорини, фторхінолони, карбапенеми, нітроімідазоли), протигрибкової терапії. Проведена контрольна рентгенографія, при якій встановлене повне розсмоктування інфільтрації.
У 11-річному віці при огляді дільничним лікарем з приводу підвищення температури тіла до 39,0 °С, сухого нав’язливого кашлю діагностована правостороння вогнищева нижньочасткова пневмонія. Для подальшого лікування дитина направлена в Регіональний центр дитячої імунології обласної дитячої клінічної лікарні № 1 м. Харкова, де проведена антибактеріальна та протигрибкова терапія.
При контрольній рентгенографії органів грудної клітини — повне розсмоктування пневмонічної інфільтрації.
У 12 років проведена торакоскопія, розтин абсцесу легені. При бактеріологічному дослідженні матеріалу з порожнини абсцесу легені: Mуcobacterium tuberculosis і Ps.aeruginosa. Проведена традиційна протитуберкульозна терапія.
Призначена постійна профілактична антибактеріальну терапія ко-тримоксазолом та ітраконазолом, у зв’язку з чим протягом 2 років стан дитини залишався задовільним, респіраторні захворювання не мали ускладнень.
Останнє погіршення з’явилося у 14-річному віці у вигляді лихоманки 39,0 °С, малопродуктивного кашлю. При рентгенологічному дослідженні під час вступу: зліва в середньому відділі визначається великих розмірів ділянка інфільтрації легеневої тканини. Лівостороння зливна пневмонія S3, S6. Враховуючи відсутність позитивної рентгенологічної динаміки, незважаючи на використання курсу антибактеріальної (цефалоспорини, фторхінолони, карбапенеми, нітроімідазоли), протигрибкової терапії препаратами широкого спектра дії, проведена комп’ютерна томографія (КТ), де встановлена лівостороння деструктивна пневмонія 4-го, 6-го, 9-го сегментів.
У клінічному аналізі крові анемія легкого ступеня тяжкості, лейкоцитоз. ВІЛ-інфекцію було виключено неодноразово.
При імунологічному дослідженні крові показники субпопуляцій лімфоцитів відповідали віковій нормі, при вивченні показників гуморальної ланки встановлено підвищення рівнів IgM та IgG: лейкоцити — 5,9 • 109/л (норма — 4,0–7,6 • 109/л), лімфоцити — 37 % (норма — 19–37 %), лімфоцити — 2,18 • 109/л (норма — 1,76–2,8 • 109/л), CD3+-лімфоцити — 68 % (норма — 66–76 %); CD3+-лімфоцити — 1,48 • 109/л (норма — 1,4–2,0 • 109/л), CD4+-лімфоцити — 39 % (норма — 33–41 %); CD4+-лімфоцити — 0,85 • 109/л (норма — 0,7–1,1 • 109/л), CD8+-лімфоцити — 28 % (норма — 27–35 %); CD8+-лімфоцити — 0,61 • 109/л (норма — 0,6–0,9 • 109/л), CD16+-лімфоцити — 14 % (норма — 9–16 %); CD16+-лімфоцити — 0,30 • 109/л (норма — 0,2–0,3 • 109/л), CD22+-лімфоцити — 17 % (норма — 11–20 %); CD22+-лімфоцити — 0,37 • 109/л (норма — 0,28–0,58 • 109/л), CD25+-лімфоцити — 40 % (норма — 32–41 %); CD25+-лімфоцити — 0,87 • 109/л (норма — 0,24–1,11 • 109/л), IgA — 1,12 г/л (норма — 1,48 ± 0,63 г/л); IgM — 0,94 г/л (норма — 0,59 ± 0,20 г/л); IgG — 10,93 г/л (норма — 9,46 ± 1,24 г/л), комплемент СН50 — 59 (норма — 40–80).
Необхідно зазначити, що виявлене зниження показників бактеріальної і фагоцитарної активності є патогенетичними маркерами захворювання: НСТспонт — 3 % (норма — 9,34–0,4 %), ІАН, од. — 0,04 (норма — 0,130 ± 0,006), НСТстим — 12 % (норма — 40–80 %), ІАН, од. — 0,16 (норма — 0,5 ± 1,5); фагоцитоз з латексом — 55 % (норма — 60–80 %). Також визначалися рівні ЛКБ, од. — 1,22 (норма — 1,23–0,015), підвищення рівня ЦІК — 3,5 %, ПЕГ — 15,3 (норма — 10 ± 2), СРП — 24, РФ — негативний.
При спірографічному дослідженні встановлені легкі рестриктивні порушення: ЖЄЛ — 70 % (норма — 79–112 %), ФЖЄЛ — 72 % (норма — 78–113 %), ПШВ — 91 % (норма — 72–117 %), МОШ25 — 92 % (норма — 73–117 %), МОШ50 — 87 % (норма — 73–117 %), МОШ75 — 105 % (норма — 61–124 %), ОФВ1 — 78 % (норма — 78–113 %), тест Тіффно — 111 % (норма — 84–110 %).
При дослідженні білкової фракції сироватки крові: загальний білок — 74 г/л (норма — 65–85 г/л), альбумін — 53,6 % (норма — 50–65 %), глобуліни: α1 — 5,5 % (норма — 3–6 %), α2 — 11,5 % (норма — 6–12 %), β — 6,8 % (норма — 8–12 %), γ — 22,6 % (норма — 15–20 %), А/Г коеф. — 1,15 (норма — 1,5–2,3 %).
Враховуючи наявність у хворого хронічного стоматиту, неодноразово проводилося дослідження на флору з афт у ротовій порожнині: виявлено Staphylococcus aureus. При бактеріологічному дослідженні слизу зіву та носа — Streptococcus spp • 104; Staphylococcus epidermidis • 104.
Результати імунофлюоресцентного аналізу носоглоткового змиву антигенів вірусів грипу та респіраторних вірусів — не знайдено.
При клінічному аналізі мокротиння ознаки запального процесу: лейкоцити — на 1/4 поля зору (п/з), еритроцити — 0–3 клітини у п/з, елементи епітелію бронхів — на 1/4 п/з, альвеолярні клітини — на 0–3 п/з, Mуcobacterium tuberculosis не виявлена.
При клінічному дослідженні промивних вод бронхів встановлені запальні зміни: лейкоцити — на 3/4 п/з, еритроцити — 20 клітин у п/з, елементи епітелію бронхів — на 1/4 п/з, кристали — місцями, Mуcobacterium tuberculosis не виявлена.
При бактеріологічному дослідженні лаважу бронхіального дерева виявлений рост Mуcobacterium tuberculosis, у зв’язку з чим дитині проводилася протитуберкульозна терапія.
Останнє погіршення стану через 2 місяці пов’язано з малоінтенсивним кашлем, болем у грудній клітці, підвищенням температури до фебрильних цифр, наростанням задухи. При рентгенологічному дослідженні: у середньому та нижніх відділах з обох сторін визначалися великих розмірів ділянки інфільтрації легеневої тканини.
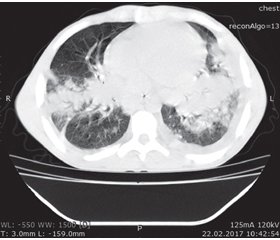
Враховуючи, що на фоні профілактичної антибактеріальної, протигрибкової та протитуберкульозної терапії у хворого з’явилися інфільтративні зміни в легенях, необхідність проведення додаткових методів дослідження для диференціальної діагностики інфекційних ускладнень при ХГХ зростала. Неефективне знищення грибкової флори у цієї групи пацієнтів є одним із патогенетичних моментів захворювання, схожа клінічна симптоматика при ураженні легенів ускладнює діагностичний процес між бактеріальними і грибковими інфекціями. Ранніми ознаками аспергільозу при проведенні комп’ютерної томографії легенів є дрібні (< 2 см), пов’язані з судинами округлі вогнища, зазвичай розташовані субплеврально, симптом «ореолу», а також ущільнення трикутної форми, що примикають підставою до плеври. При прогресуванні захворювання при КТ легенів визначають пізні ознаки: вогнища деструкції, а також порожнини з вмістом і прошарком повітря (симптом «півмісяця»). Початкові легеневі зміни на серіях томограм, що виконані у спірографічному режимі томографічним шагом 5 мм, наведено на рис. 1, 2.
/152-1.jpg)
Прогресуючі клінічні зміни, наростання ознак дихальної недостатності потребувало лікування хворого у відділенні реанімації та інтенсивної терапії. При повторній комп’ютерній томографії встановлена негативна динаміка (рис. 3, 4).
Остаточним специфічним дослідженням для підтвердження аспергільозу є виявлення збудника при мікроскопії та посіві мокротиння чи лаважу з бронхіального дерева. При повторному дослідженні мокротиння хворого виявлені Aspergillus fumigatus. Комплекс лікувальних заходів включав внутрішньовенну антифунгальну терапію. Стан хворого покращився, відмічалася позитивна динаміка.
Враховуючи відсутність на сучасному етапі патогенетичної терапії, що коректувала б імунну відповідь, даний клінічний випадок підтверджує складність виявлення збудників інфекційних процесів у хворих на ХГХ. Від своєчасного встановлення етіології інфекційних ускладнень залежить тактика ведення хворого, що, у свою чергу, обумовлює прогноз захворювання.
Висновки
Кожне клінічне спостереження дитини з рідкісною патологією в національних умовах (відмінності у протоколах лікування, можливостях профілактичної терапії, наявність туберкульозної інфекції) є важливим з наукової точки зору.
Поширеність знань щодо ексвізитних клінічних форм має практичне значення для лікарів загальної практики, педіатрів щодо покращення ранньої діагностики.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Chronic granulomatous disorder: a guide for medical professionals. — UK, London, 2015. — Доступ до електронної версії: www.cgdsociety.org.
2. Special article: chronic granulomatous disease in the United Kingdom and Ireland: a comprehensive national patient-based re–gistry / Jones L.B., McGrogan P., Flood T.J., Gennery A.R. et al. // Clinical and Experimental Immunology. — 2008. — № 152(2). — Р. 211-18.
3. Chronic granulomatous disease: the European experience / Van den Berg J.M., van Koppen E., Ahlin A., Belohradsky B.H. // The Public Library of Science One. — 2009. — № 4(4). — P. 5234.
4. Modern management of chronic granulomatous di–sease / Seger R.A. // British Journal of Haematology. — 2008. — № 140(3). — P. 255-66.
5. Chronic granulomatous disease: complications and management / Rosenzweig S.D. // Expert Review of Clinical Immunology. — 2009. — № 5(1). — P. 45-53.
6. Chronic granulomatous disease / Holland S.M. // Clinical Reviews in Allergy and Immunology. — 2010. — № 38(1). — P. 3-10.
7. Invasive aspergillosis in chronic granulomatous disease / Segal B.H., Romani L.R. // Medical Mycology. — 2009. — № 47(1). — P. 282-290.
8. Epidemiology and outcome of invasive fungal diseases in patients with chronic granulomatous disease: a multicenter study in France / Beaute J., Obenga G., Le Mignot L., Mahlaoui N. // Pediatric Infectious Disease Journal. — 2011. — № 30(1). — P. 57-62.
9. The NADPH oxidase NOX2 plays a role in periodontal pathologies / Giannopoulou C., Krause K.H., Müller F. // Seminars in Immunopathology. — 2008. — № 30(3). —P. 273-278.
10. Abnormal apoptosis in chronic granulomatous disease and autoantibody production characteristic of lupus /Sanford A.N., Suriano A.R., Herche D., Dietzmann K. // Rheumatology. — 2006. — № 45(2). — P. 178-81.
11. Cutaneous and other lupus-like symptoms in carriers of X-linked chronic granulomatous disease: incidence and autoimmune serology / Cale C.M., Morton L., Goldblatt D. // Clinical and Experimental Immunology. — 2007. — № 148(1). — Р. 79-84.
12. Inflammatory bowel disease in CGD reproduces the clinicopathological features of Crohn’s disease / Marks D.J., Miyagi K., Rahman F.Z., Novelli M. // American Journal of Gastroenterology. — 2009. — № 104(1). — P. 117-24.
13. Overlap, common features, and essential differences in pediatric granulomatous inflammatory bowel disease / Damen G.M., Krieken J.H., Hoppenreijs E., van Os E. // Journal of Pediatric Gastroenterology and Nutrition. — 2010 Dec. — № 51(6). — Р. 690-7.
14. Gastrointestinal involvement in chronic granulomatous di–sease / Marciano B.E., Rosenzweig S.D., Kleiner D.E., Anderson V.L. // Paediatrics. — 2004. — № 114(2). — Р. 462-8.
15. Chorioretinal lesions in patients and carriers of chronic granulomatous disease / Goldblatt D., Butcher J., Thrasher A.J., Russell-Eggitt I. // Journal of Pediatrics. — 1999. — № 134(6). — P. 780-3.
16. Chorioretinal lesions in patients with chronic granulomatous disease / Kim S.J., Kim J.G., Yu Y.S. // Retina. — 2003. — № 23(3). — P. 360-5.
17. Successful low toxicity hematopoietic stem cell transplantation for high-risk adult chronic granulomatous disease patients / Güngör T., Halter J., Klink A., Junge S. // Transplantation. — 2005. — № 79(11). — P. 1596-606.
18. Unrelated donor and HLA-identical sibling haematopoietic stem cell transplantation cure chronic granulomatous disease with good long-term outcome and growth / Soncini E., Slatter M.A., Jones L.B., Hughes S. // British Journal of Haematology. — 2009. — № 145(1). — P. 73-83.
19. Hematopoietic stem cell transplantation for chronic granulomatous disease / Seger R.A. // Immunology and Allergy Clinics of North America. — 2010. — № 30(2). — P. 195-208.
20. Excellent survival after sibling or unrelated donor stem cell transplantation for chronic granulomatous disease / Martinez C.A., Shah S., Shearer W.T., Rosenblatt H.M. // Journal of Allergy and Clinical Immunology. — 2012. — № 129(1). — P. 176-83.
21. Gene therapy of chronic granulomatous disease: the engraftment dilemma / Grez M., Reichenbach J., Schwäble J., Seger R. // Molecular Therapy. — 2011. — № 19(1). — Р. 28-35.
22. Gene therapy matures in the clinic / Seymour L., Thra–sher A.J. // Nature Biotechnology. — 2012. — № 30(7). — P. 588-93.

/148-1.jpg)
/149-1.jpg)
/152-1.jpg)
/153-1.jpg)