Острый коронарный синдром (ОКС) — это совокупность симптомов, которые позволяют заподозрить развитие острого инфаркта миокарда (ИМ). Настоящая классификация ОКС основана на простом клиническом признаке (наличие элевации сегмента ST на электрокардиограмме (ЭКГ)), однако позволяет разделить всех пациентов на две большие группы, характеризующиеся особенностями развития, клинического течения заболевания, кратковременного и длительного прогноза. В основе ОКС с элевацией сегмента ST лежит полное закрытие коронарной артерии тромбом, которое, как правило, приводит к развитию острого инфаркта миокарда с зубцом Q. Лечение этой категории пациентов в первую очередь состоит в скорейшей реваскуляризации миокарда (открытие инфаркт-обусловливающей коронарной артерии) механически (ангиопластика) или путем введения медикаментов (фибринолитическая терапия). Затем проводится профилактика и лечение осложнений острого инфаркта миокарда. Пациенты без стойкой элевации сегмента ST на электрокардиограмме представляют собой более разнородную категорию пациентов — от нестабильной стенокардии до инфаркта миокарда с зубцом Q. В основе ОКС без элевации сегмента ST также зачастую лежит повреждение атеросклеротической бляшки с последующим тромбообразованием и частичным закрытием просвета коронарной артерии. В то же время чаще, чем у пациентов с элевацией ST, в патогенезе заболевания имеют значение спазм коронарных артерий, микроваскулярные нарушения коронарного кровотока, а также вторичное повреждение миокарда в результате несоответствия между потребностью миокарда в кислороде и возможностью его обеспечения (анемия, тахиаритмии, стрессовая ситуация на фоне значимого коронарного атеросклероза и т.п.). Нередко с диагнозом ОКС без элевации сегмента ST госпитализируют пациентов с высоким функциональным классом стабильной стенокардии, а также пациентов с болью в грудной клетке для проведения дифференциальной диагностики. Поэтому неудивительно, что пациенты без элевации сегмента ST по статистике составляют примерно две трети от общего количества больных, госпитализированных по поводу ОКС. Подходы к ведению этой категории пациентов основываются на определении степени риска развития осложнений. В настоящее время выделяют четыре категории риска (очень высокий, высокий, промежуточный и низкий). Категория риска определяет необходимость и сроки проведения ангиографии, а также подходы к антитромботической и антиангинальной терапии. Рассмотрим принципы ведения пациентов с ОКС без элевации ST на клиническом примере.
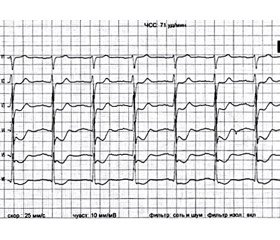
Пациент, 74 лет, поступил из поликлиники с жалобами на боли за грудиной, умеренную одышку, слабость. При поступлении артериальное давление 134/80 мм рт.ст., частота сердечных сокращений (ЧСС) 71/мин, сатурация кислорода по данным пульсоксиметрии (без ингаляции кислорода) 96 %. Дополнительные тоны и шумы при аускультации сердца не выслушивались. В легких жесткое дыхание, хрипы, которые перемещаются при изменении положения тела (острая левожелудочковая недостаточность (ОЛЖН) по Killip II). В анамнезе хроническая ишемическая болезнь сердца с сопутствующей артериальной гипертензией. Десять лет назад пациент перенес острый с зубцом Q инфаркт миокарда в области задней стенки левого желудочка (ЛЖ), в последнее время — стенокардия напряжения на уровне 2–3-го функционального класса. Два года назад перенес острое нарушение мозгового кровообращения по ишемическому типу (без значимой остаточной клинически неврологической симптоматики). Явное прогрессирование ангинозных болей отмечает в течение последних суток после интенсивной физической нагрузки. Боли носят волнообразный характер и появляются при минимальной нагрузке, два приступа боли в покое длительностью более 30–40 минут. Приступ боли ангинозного характера развился во время транспортировки пациента из поликлиники. На электрокардиографии при поступлении на фоне болевого синдрома (рис. 1) отмечается депрессия сегмента ST в отведениях I, II, aVL, V2–V6 c максимумом до 5–6 мм, минимальный подъем ST до 1 мм в aVR, признаки перенесенного ранее Q ИМ в области задней стенки ЛЖ.
/125-1.jpg )
Таким образом, пациент был госпитализирован с диагнозом ОКС без стойкой элевации сегмента ST. Болевой синдром был купирован после сублингвального приема нитроглицерина. Пациент помещен под мониторное наблюдение, после катетеризации периферической вены налажена внутривенная инфузия нитратов. Уже на догоспитальном этапе пациент получил нагрузочную дозу клопидогреля 300 мг и аспирина 160 мг. Дополнительно при поступлении пациент получил 80 мг аторвастатина, введено 2,5 мг фондапарина подкожно и 20 мг пантопразола с целью профилактики желудочно-кишечного кровотечения на фоне проводимой антитромботической терапии. Для оценки выраженности нарушений сегментарной сократимости, систолической и диастолической функции ЛЖ, а также поиска возможных других причин развития ОЛЖН (Killip II) пациенту проведена трансторакальная эхокардиография. По данным исследования выявлена дилатация полостей сердца, выраженные нарушения систолической функции ЛЖ (фракция выброса 34 %) за счет нарушений сегментарной сократимости в области боковой, задней и апикальных отделов передней стенки ЛЖ. Диастолическая функция соответствовала рестриктивному типу нарушений, гемодинамически значимых клапанных проблем выявлено не было.
К этому времени были готовы результаты лабораторных анализов крови, взятых при поступлении. Выявлено повышение уровня кардиоспецифических ферментов (креатинфосфокиназы (КФК), МВ-фракции КФК, тропонина Т), повышение уровня глюкозы до 13,6 ммоль/л (ранее сахарный диабет не диагностировался), умеренный лейкоцитоз и снижение расчетной скорости клубочковой фильтрации до 45 мл/мин/1,73 м2 (табл. 1).
/126-1.jpg )
Таким образом, пациент был отнесен к категории высокого риска развития осложнений (повышение уровня тропонина, динамические изменения ЭКГ, 194 балла по шкале GRACE). Стабильное состояние центральной гемодинамики, отсутствие жизнеопасных нарушений сердечного ритма, явной клинической симптоматики острой сердечной недостаточности и рецидивирования болей ангинозного характера на фоне проводимой терапии (признаки очень высокого риска) позволило запланировать проведение ангиографии на следующее утро (в пределах 24 часов). В связи с этим был поставлен вопрос об оптимальном медикаментозном ведении данного пациента перед, во время и после проведения реваскуляризации.
В соответствии с рекомендациями Европейского общества кардиологов, Американской ассоциации сердца, Ассоциации кардиологов Украины, а также на основании унифицированного клинического протокола пациенты с ОКС без элевации сегмента ST из группы промежуточного и высокого риска должны получать двойную антитромбоцитарную терапию, причем в дополнение к аспирину предпочтительнее использовать тикагрелор. Клопидогрель рекомендовано назначать только в случае невозможности использования тикагрелора. Тикагрелор — это синтетический препарат, который стал родоначальником новой группы антитромбоцитарных препаратов-триазолопиримидинов. Механизм действия препарата заключается в блокировании Р2Y12-рецепторов тромбоцитов [6], что приводит к ингибированию воздействия на них аденозиндифосфата и снижает связывание фибриногена с гликопротеиновыми рецепторами IIв/IIIа, следствием чего является торможение I и II фаз агрегации тромбоцитов [2, 3]. В отличие от препаратов группы тиенопиридинов (клопидогреля, тиклопидина, прасугреля) тикагрелор является не пролекарством, а метаболически активным препаратом. Существенным также является тот факт, что блокада тромбоцитарных рецепторов на фоне применения тикагрелора имеет обратимый характер, что обусловливает постепенное восстановление функции Р2Y12-рецепторов тромбоцитов после отмены препарата. Благодаря этим свойствам тикагрелор начинает действовать быстрее, чем клопидогрель, после приема нагрузочной дозы, а при отмене препарата наблюдается более быстрое восстановление функции тромбоцитов [4]. Клиническая эффективность препарата у пациентов с ОКС изучалась в исследовании PLATO, в которое было включено более 18,5 тысячи пациентов. Применение тикагрелора (по сравнению с клопидогрелем) в комбинации с аспирином в течение года после ОКС позволяло достоверно снизить вероятность развития комбинации «смерть от сердечно-сосудистых причин/ИМ/инсульт (первичная конечная точка)» на 16 % (95% доверительный интервал (ДИ) 0,77–0,92; р < 0,001). Прием тикагрелора также приводил к существенному уменьшению вероятности развития нефатального ИМ (отношение шансов (OR) 0,84; 95% ДИ 0,75–0,95; p = 0,005), смерти от сердечно-сосудистых причин (OR 0,79; 95% ДИ 0,69–0,91; p = 0,001) и смерти от всех причин (OR 0,78; 95% ДИ 0,69–0,89; p < 0,001) без значимого увеличения общего количества больших кровотечений (OR 1,04; 95% ДИ 0,95–1,13; p = 0,43). В то же время в исследовании было показано, что прием тикагрелора как более сильного антитромбоцитарного препарата сопровождался увеличением количества спонтанных (в том числе больших спонтанных) кровотечений. После изменения клинических рекомендаций в ряде стран Европы тикагрелор занял лидирующие позиции в лечении пациентов с ОКС, и результаты исследования PLATO нашли подтверждение в реальной клинической практике. Преимущества тикагрелора в плане снижения сердечно-сосудистых осложнений у больных с ОКС были подтверждены в ряде одноцентровых, многоцентровых и национальных регистров на большом количестве пациентов (SWEDEHEART — 45 073 пациента, SHEFFIELD RWE — 10 793 пациента, Western Denmark Heart Registry — 2335 пациентов, ESTATE — 928 пациентов и др.). Анализ имеющихся данных показал, что тикагрелор одинаково эффективен как у пациентов с элевацией, так и без элевации сегмента ST, причем в последней подгруппе препарат демонстрировал свою эффективность независимо от тактики ведения (инвазивная или консервативная).
Помимо тромботического риска, перед назначением антитромботической терапии необходимо оценивать и возможные риски кровотечений. Оценку геморрагического риска у пациента с ОКС рекомендовано проводить по шкале CRUSADE. Наш пациент по этой шкале набрал 51 балл (учитывался также сахарный диабет, который был заподозрен анамнестически и по исходному уровню глюкозы, в последующем подтвержден в ходе дальнейшей лабораторной диагностики), что соответствует категории очень высокого риска, а вероятность развития большого кровотечения составляет в среднем 12,8 % в течение госпитального периода заболевания.
Таким образом, наш пациент имеет высокий тромботический и геморрагический риски, которые во многом обусловлены возрастом, наличием сопутствующей почечной дисфункции, сахарного диабета и перенесенного острого нарушения мозгового кровообращения. По данным исследования PLATO, эффективность и безопасность тикагрелора не зависели от возраста пациентов и сохранялись у больных старших возрастных групп. В одном из субанализов исследования PLATO также была подтверждена безопасность и эффективность приема тикагрелора у пациентов после перенесенного нарушения мозгового кровообращения. Более того, у пациентов с острым инсультом в исследовании SOCRATES безопасность тикагрелора была сравнима с аспирином. Тикагрелор эффективно преду–преждал сердечно-сосудистые осложнения также у пациентов с почечной дисфункцией и сахарным диабетом без существенного увеличения риска кровотечений, хотя данные относительно применения препарата при клиренсе креатинина ниже 30 мл/мин ограниченны. Особенно эффективным был прием тикагрелора (по сравнению с клопидогрелем) в подгруппе пациентов с исходным уровнем гликированного гемоглобина более 6 %. Было показано, что гипергликемия повышает реактивность тромбоцитов за счет увеличения экспрессии P-селектина, изменения текучести клеточных мембран с повышением адгезии тромбоцитов и активации протеина C. Помимо гипергликемии, существенную роль в развитии протромбогенного состояния на фоне сахарного диабета играют также резистентность к инсулину, метаболические нарушения, эндотелиальная дисфункция и воспаление. При этом антитромбоцитарный эффект клопидогреля у этой категории пациентов в среднем снижен. Среди возможных причин подобной тромборезистентности рассматривают снижение активности цитохрома Р450 в печени и, соответственно, более медленное образование активного метаболита клопидогреля. Определенное значение имеют также повышение сигнальной активности P2Y12-рецепторов и ускорение образования новых тромбоцитов (рецепторы которых не блокированы клопидогрелем).
Таким образом, несмотря на нагрузочную дозу клопидогреля 300 мг на догоспитальном этапе, было принято решение о переводе пациента на прием тикагрелора с нагрузочной дозы 180 мг и последующим приемом 90 мг каждые 12 часов. Тиенопиридины и тикагрелор имеют разные точки взаимодействия с P2Y12-рецепторами тромбоцитов, поэтому использование клопидогреля на постоянной основе или прием его нагрузочной дозы на предшествующих этапах оказания медицинской помощи не является противопоказанием для назначения тикагрелора. Клиническая безопасность применения тикагрелора на фоне клопидогреля была подтверждена в исследовании PLATO, в котором около половины пациентов получили клопидогрель до рандомизации. В качестве антитромботической терапии пациенту также рекомендовано продолжать прием аспирина (при приеме тикагрелора важно, чтобы поддерживающая доза аспирина не превышала 100 мг) и фондапарина. По результатам исследования OASIS-5, у пациентов с ОКС без элевации сегмента ST фондапарин имел преимущества перед эноксапарином в первую очередь за счет снижения количества кровотечений, что в последующем реализовалось в улучшение выживания у данной категории пациентов. Эти данные впоследствии были подтверждены и в реальной клинической практике (анализ более 40 тысяч пациентов с ИМ без элевации сегмента ST). Причем первоначально отмеченное увеличение случаев тромбоза катетера при проведении интервенционных процедур на фоне антикоагулянтной терапии фондапарином легко предупредить путем дополнительного введения нефракционированного гепарина во время процедуры. Пациенту также продолжен прием аторвастатина, пантопразола, назначены бета-блокатор, ингибитор ангиотензинпревращающего фермента и эплеренон (учитывая наличие ОЛЖН, систолическую дисфункцию ЛЖ, сопутствующий сахарный диабет). Проводимая медикаментозная терапия позволила стабилизировать состояние пациента: боли ангинозного характера не рецидивировали, явления ОЛЖН нивелировались, что позволило отменить внутривенное введение нитратов. На следующий день в плановом порядке пациент был переведен в отдел интервенционной кардиологии для проведения коронаровентрикулографии.
По данным коронаровентрикулографии (рис. 3) выявлено множественное поражение коронарных артерий с окклюзией передней межжелудочковой ветви в среднем сегменте. Пациенту рекомендовано проведение аортокоронарного шунтирования (АКШ). Учитывая относительную стабилизацию состояния пациента (прекращение болей ангинозного характера, отсутствие признаков сердечной недостаточности), высокий риск проведения вмешательства в ранние сроки ОИМ, а также развитие у пациента сопутствующей застойной пневмонии, совместно с кардиохирургами было принято решение о переносе сроков оперативного вмешательства на 3–4 недели. В связи с этим возник вопрос о назначении оптимальной терапии (в первую очередь антитромботической), которая позволила бы –безопасно довести этого пациента до оперативного вмешательства.
/128-1.jpg )
Операция АКШ после рандомизации была проведена у 1899 (около 10 %) пациентов, включенных в исследование PLATO. В течение последних 7 дней до вмешательства хотя бы одну дозу исследуемого препарата (тикагрелора или клопидогреля) получил 1261 пациент, включенный в последующий анализ. Относительное снижение риска развития событий первичной конечной точки (сердечно-сосудистая смерть/инфаркт миокарда/инсульт) на фоне приема тикагрелора в этой подгруппе пациентов было сравнимо с общей группой (соотношение рисков (HR) 0,84; 95% ДИ 0,60–1,16; p = 0,29). Более того, прием тикагрелора сопровождался практически двукратным снижением риска общей (HR 0,49; 95% ДИ 0,32–0,77; p < 0,01), сердечно-сосудистой (HR 0,52; 95% ДИ 0,32–0,85; p < 0,01) и некардиоваскулярной (HR 0,35; 95% ДИ 0,11–1,11; p = 0,07) смерти у этой категории пациентов. При этом общее количество больших АКШ-обусловленных кровотечений в обеих группах не отличалось. Последующий анализ выявил, что, кроме снижения смерти от сердечно-сосудистых причин, успех терапии тикагрелором у пациентов, которым проводили АКШ, был обусловлен уменьшением риска смерти от кровотечений и инфекционных осложнений. Снижение риска фатальных кровотечений связывают с обратимым связыванием P2Y12-рецепторов тромбоцитов при приеме тикагрелора и, таким образом, более быстрым восстановлением функции тромбоцитов после отмены препарата перед операцией. Точная причина снижения количества смертей от инфекционных осложнений при приеме тикагрелора неизвестна, однако в качестве возможных механизмов рассматриваются модуляция участия тромбоцитов в формировании воспалительного ответа, а также наличие у тикагрелора дополнительных аденозиновых механизмов действия (повышение концентрации эндогенного аденозина за счет снижения его обратного захвата). Таким образом, описанные выше данные послужили основанием для продолжения двойной антитромбоцитарной терапии тикагрелором и аспирином у нашего пациента. Антикоагулянтная терапия фондапарином была отменена на 7-е сутки от развития ОКС, когда пациент уже самостоятельно передвигался в пределах отделения и готовился к переводу в отделение реабилитации.
Очень важным является вопрос периоперационного назначения антитромботической терапии. В настоящее время рекомендовано у большинства пациентов, которым планируется проведение АКШ, терапию аспирином продолжать до оперативного вмешательства (аспирин отменяется за 3–5 дней только у пациентов с очень высоким риском кровотечений или у пациентов, которым по тем или иным причинам невозможно переливание крови). Клопидогрель и тикагрелор рекомендовано отменить за 5 суток до вмешательства, а прасугрель — за 7. В инструкции к тикагрелору препарат рекомендовано отменять за семь суток до предполагаемого АКШ (максимальный срок, который анализировался в PLATO). В то же время по результатам исследования PLATO было показано, что тикагрелор безопасно отменять за 72 часа перед операцией. Эти данные в последующем были подтверждены и в шведском регистре ОКС. Восстанавливать антитромбоцитарную терапию рекомендуют как можно раньше: аспирин — в течение первых 24 часов (желательно 6 часов) после вмешательства, а блокаторы P2Y12-рецепторов — после контроля кровотечения (после прекращения геморрагического отделяемого по дренажам). Длительность двойной антитромбоцитарной терапии после ОКС не зависит от вида реваскуляризации и на сегодняшний день составляет минимум 12 месяцев. Зачастую периоперационно таким пациентам назначают низкомолекулярные гепарины, хотя эффективность такого подхода для предупреждения артериальных тромбозов не доказана. В нашем случае пациенту был отменен тикагрелор за 5 суток до вмешательства. Аспирин в кардиохирургическом стационаре пациенту отменили за 3 суток до АКШ, а периоперационно были назначены профилактические дозы эноксапарина.
Таким образом, рациональное использование антитромботической терапии на разных этапах оказания помощи пациенту с ОКС без стойкой элевации сегмента ST с высоким ишемическим и геморрагическим риском (аспирин, тикагрелор, фондапарин — острый период, стабилизация состояния пациента; аспирин, тикагрелор — поддерживающая терапия до вмешательства; эноксапарин — периоперационно) позволило стабилизировать состояние пациента, предупредить развитие сердечно-сосудистых осложнений до проведения оперативного вмешательства и безопасно провести реваскуляризацию миокарда. Впоследствии пациенту было рекомендовано продолжать прием двойной антитромбоцитарной терапии.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Angiolillo D.J., Jakubowski J.A., Ferreiro J.L., Tello-Montoliu A., Rollini F., Franchi F., Ueno M., Darlington A., Desai B., Moser B.A., Sugidachi A., Guzman L.A., Bass T.A. Impaired responsiveness to the platelet P2Y12 receptor antagonist clopidogrel in patients with type 2 diabetes and coronary artery disease // J. Am. Coll. Cardiol. — 2014. — № 64. — Р. 1005-1014. — doi: 10.1016/j.jacc.2014.06.1170.
2. Becker R.C., Bassand J.P., Budaj A., Wojdyla D.M., James S.K., Cornel J.H., French J., Held C., Horrow J., Husted S., Lopez-Sendon J., Lassila R., Mahaffey K.W., Storey R.F., Harrington R.A., Wallentin L. Bleeding complications with the P2Y12 receptor antagonists clopidogrel and ticagrelor in the PLATelet inhibition and patient Outcomes (PLATO) trial // Eur. Heart J. — 2011. — № 32. — Р. 2933-44.
3. Chen I.C., Lee C.H., Fang C.C., Chao T.H., Cheng C.L., Chen Y. et al. Efficacy and safety of ticagrelor versus clopidogrel in acute coronary syndrome in Taiwan: a multicenter retrospective pilot study // J. Chin. Med. Assoc. — 2016. — № 79. — Р. 521e30.
4. Gosling R., Yazdani M., Parviz Y., Hall I.R., Grech E.D., Gunn J.P. Comparison of P2Y12 inhibitors for mortality and stent thrombosis in patients with acute coronary syndromes: Single center study of 10 793 consecutive ‘real-world’ patients // Platelets. — 2017. — Р. 1-7.
5. Hansson E.C., Jideus L., Aberg B. еt al. Coronary artery bypass grafting-related bleeding complications in patients treated with ticagrelor or clopidogrel: a nationwide study // Eur. Heart J. — 2016. — № 37. — Р. 189-197.
6. Held C., Asenblad N., Bassand J.P. et al. Ticagrelor versus clopidogrel in patients with acute coronary syndrome sundergoing coronary artery bypass surgery: results from the PLATO (Platelet Inhibition and Patient Outcomes) trial // J. Am. Coll. Cardiol. — 2011. — № 57(6). — Р. 672-684.
7. Husted S. et al. Ticagrelor versus clopidogrel in elderly patients with acute coronary syndromes: a substudy from the prospective randomized Platelet Inhibition and Patient Outcomes (PLATO) trial // Circ. Cardiovasc. Qual. Outcomes. — 2012. — № 5. — Р. 680-688.
8. James S.K. et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes and a history of stroke or transient ische–mic attack // Circulation. — 2012. — № 125. — Р. 2914-2921.
9. James S. et al. Ticagrelor versus clopidogrel in acute coro–nary syndromes in relation to renal function: results from the Platelet Inhibition and Patient Outcomes (PLATO) trial // Circulation. — 2010. — № 122. — Р. 1056-1067.
10. James S. et al. Ticagrelor vs. clopidogrel in patients with acute coronary syndromes and diabetes: a substudy from the Platelet Inhibition and Patient Outcomes (PLATO) trial // Eur. Heart J. — 2010. — № 31. — Р. 3006-3016.
11. Johnston S.C., Amarenco P., Albers G.W., Denison H., Easton J.D., Evans S.R., Held P., Jonasson J., Minematsu K., Molina C.A., Wang Y., Wong K.S.; SOCRATES Steering Committee and Investigators. Ticagrelor versus aspirin in acute stroke or transient ischemic attack // N. Engl. J. Med. — 2016. — № 375. — Р. 35-43.
12. Levine G.N., Bates E.R., Bittl J.A., Brindis R.G., Fihn S.D., Fleisher L.A., Granger C.B., Lange R.A., Mack M.J., Mauri L., Mehran R., Mukherjee D., Newby L.K., O’Gara P.T., Sabatine M.S., Smith P.K., Smith S.C. Jr. 2016 ACC/AHA guideline focused update on duration of dual antiplatelet therapy in patients with coronary artery disease: a report of the American college of Cardiology/American heart association task force on clinical practice guidelines // J. Am. Coll. Cardiol. — 2016. — № 68. — Р. 1082-1115.
13. Lindholm D., Varenhorst C., Cannon C.P., Harrington R.A., Himmelmann A., Maya J., Husted S., Steg P.G., Cornel J.H., Storey R.F., Stevens S.R., Wallentin L., James S.K. Ticagrelor vs. clopidogrel in patients with non-ST-elevation acute coronary syndrome with or without revascularization: results from the PLATO trial // Eur. Heart J. — 2014. — № 35. — Р. 2083-2093.
14. Gurbel P.A., Bliden K.P., Butler K. et al. Randomized double-blind assessment of the ONSET and OFFSET of the antiplatelet effects of ticagrelor versus clopidogrel in patients with stable coronary artery disease: the ONSET/OFFSET study // Circulation. — 2009. — № 120(2009). — Р. 2577-2585.
15. Roffi M., Patrono C., Collet J.-P. et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC) // Eur. Heart J. — 2016. — № 37(3). — Р. 267-315.
16. Sahlen A., Varenhorst C., Lagerqvist B., Renlund H., Omerovic E., Erlinge D., Wallentin L., James S.K., Jernberg T. Outcomes in patients treated with ticagrelor or clopidogrel after acute myocardial infarction: experiences from SWEDEHEART registry // Eur. Heart J. — 2016. — № 37(44). — Р. 3335-3342.
17. Sousa-Uva M., Storey R., Huber K. Et al. ESC Wor–king Groupon Cardiovascular Surgery and ESC Working Groupon Thrombosis. Expert positi on paperon the management of antiplatelet therapy in patients undergoing coronary artery bypass graft surgery // Eur. Heart J. — 2014. — № 35(23). — Р. 1510-1514.
18. Stent Thrombosis with Ticagrelor versus Clopidogrel after Percutaneous Coronary Intervention and Ticagrelor or Clopidogrel in Patients with Acute Coronary Syndromes in a Real World Setting / Christian O. Fallesen, Per Thayssen, Knud Erik Pe–dersen, Anders Junker, Knud N. Hansen, Henrik S. Hansen, Karsten T. Veien, Lisette Okkels Jensen // JACC. — 2014. — Vol. 64(11, Suppl. B).
19. Subherwal S., Bach R.G., Chen A.Y., Gage B.F., Rao S.V., Newby L.K., Wang T.Y., Gibler W.B., Ohman E.M., Roe M.T., Pollack C.V. Jr, Peterson E.D., Alexander K.P. Baseline risk of major bleeding in non-ST-segment-elevation myocardial infarction: the CRUSADE (Can Rapid risk stratification of Unstable angina patients Suppress ADverse outcomes with Early implementation of the ACC/AHA guidelines) bleeding score // Circulation. — 2009. — № 119. — Р. 1873-1882.
20. Szummer K., Oldgren J., Lindhagen L., Carrero J.J., –Evans M., Spaak J. et al. Association between the use of fondaparinux vs low-molecular-weight heparin and clinical outcomes in patients with non-ST-segment elevation myocardial infarction // JAMA. — 2015. — № 313. — Р. 707-16.
21. Varenhorst C., Alstrоm U., Scirica B.M., Hogue C.W., Asenblad N., Storey R.F., Steg P.G., Horrow J., Mahaffey K.W., Becker R.C., James S., Cannon C.P., Brandrup-Wognsen G., Wallentin L., Held C. Factors contributing to the lower mortality with ticagrelor compared with clopidogrel in patients undergoing coronary artery bypass surgery // J. Am. Coll. Cardiol. — 2012. — № 60. — Р. 1623-1630.
22. Wallentin L., Becker R.C., Budaj A. et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes // N. Engl. J. Med. — 2009. — № 361. — Р. 1045-57.
23. Yusuf S., Mehta S.R., Chrolavicius S. et al. Comparison of fondaparinux and enoxaparin in acute coronary syndromes // N. Engl. J. Med. — 2006. — № 354. — Р. 1464-76.
24. Уніфікований клінічний протокол екстреної, первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги та медичної реабілітації «Гострий коронарний синдром без елевації сегмента ST».

/125-1.jpg )
/126-1.jpg )
/128-1.jpg )