Введение
Рассеянный склероз (РС) является наиболее распространенным аутоиммунным заболеванием центральной нервной системы (ЦНС), приводящим к нетравматической неврологической инвалидности лиц молодого трудоспособного возраста. Естественное течение данного заболевания весьма вариабельно: с одной стороны, может отмечаться доброкачественное течение с редкими мягкими обострениями, а с другой — регистрируются случаи агрессивного, труднокурабельного течения с быстрым прогрессированием инвалидизации, а в некоторых случаях и летальный исход. В настоящее время к агрессивному РС принято относить быстропрогрессирующий РС, высокоактивный РС и злокачественный РС [1, 2]. К быстропрогрессирующему РС относят ремиттирующий РС (РРС) с быстрым нарастанием инвалидизации за счет повторных тяжелых обострений с короткими периодами ремиссий. Высокоактивный РС характеризуется как РРС с высокой активностью по данным магнитно-резонансной томографии (МРТ) и/или частыми обострениями. Быстропрогрессирующий и высокоактивный РС отмечаются примерно у 24 % больных. К злокачественному РС относят потенциально фульминантные формы РС, характеризующиеся быстрым ухудшением состояния, практически монофазным течением с высоким риском летального исхода в течение короткого промежутка времени: вариант Марбурга, концентрический склероз Бало, лейкоэнцефалит Шильдера и псевдотуморозный РС. Согласно данным международных публикаций, злокачественный РС отмечается примерно в 7 % случаев. Ранее диагностика злокачественных форм РС производилась в основном посмертно, но активное внедрение МРТ позволяет проводить диагностику прижизненно. В последние 20 лет это повлекло за собой появление в литературе описаний клинических случаев с положительной динамикой на фоне применяемой терапии. Однако единого утвержденного протокола по медикаментозному лечению больных с диагностированными фульминантными формами РС к настоящему времени нет, что связано с малочисленностью наблюдений. В подтверждение курабельности данной категории больных при своевременной правильной постановке диагноза приводим собственный клинический случай. Пациентка наблюдается на базе межокружного отделения РС ГБУЗ «ГКБ № 24 ДЗМ» и в отделении лучевой диагностики ФГБНУ «Научный центр неврологии».
Клиническое наблюдение
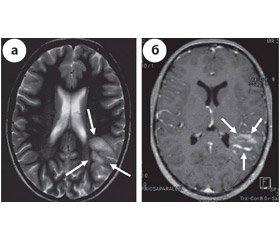
Пациентка П., 1982 года рождения. В конце декабря 2006 года на фоне абсолютного соматического здоровья отметила появление головной боли и нечеткости речи с постепенным в течение недели присоединением нарушения письма и счета, в связи с чем была госпитализирована. При осмотре в неврологическом статусе были выявлены: парафазии, дисграфия, дискалькулия, анизорефлексия, симптом Бабинского справа. На МРТ головного мозга в левом полушарии большого мозга была выявлена зона неправильной формы с частичным накоплением контрастного вещества, а также участком линейной формы, которую можно трактовать как венозную ангиому (рис. 1). Для уточнения выявленных изменений на следующий день была выполнена компьютерная томография (КТ) головного мозга с контрастным усилением (рис. 2), при которой было подтверждено наличие венозной ангиомы, окруженной, вероятно, зоной ишемии. Спустя несколько дней в неврологическом статусе отмечается присоединение гомонимной правосторонней гемианопсии. На основании проведенного обследования был поставлен диагноз: острое нарушение мозгового кровообращения по ишемическому типу, венозная ангиома левой теменной доли головного мозга (область зоны Вернике). Проводился курс сосудисто-метаболической терапии, на фоне которого отмечалось нарастание неврологического дефицита в виде акустико-мнестической афазии, буквенной агнозии, алексии, аграфии, акалькулии, нижнего правостороннего умеренного монопареза. При повторной КТ головного мозга через два месяца выявлена отрицательная динамика в виде увеличения вышеописанной зоны в левом полушарии большого мозга (рис. 3). Данная КТ картина была интерпретирована как объемное образование (глиального характера) левой теменно-затылочной области, мозолистого тела. Была назначена дегидратационная, противосудорожная и симптоматическая терапия. Для уточнения изменений, выявленных при КТ, выполнена очередная МРТ головного мозга, по данным которой также наблюдается отрицательная динамика в виде увеличения вышеописанной зоны в левом полушарии большого мозга в размерах, а также вовлечения мозолистого тела и появления изменений в противоположном полушарии большого мозга (рис. 4). Таким образом, учитывая МРТ-динамику, необходимо проводить дифференциальную диагностику между демиелинизирующим процессом и внутримозговой опухолью. Для уточнения диагноза 25 января 2007 года была проведена стереотаксическая биопсия (СТБ), при которой были выявлены изменения, характерные для демиелинизирующего процесса, в виде массивной макрофагальной инфильтрации, гибели аксонов, выраженного отека, участков некроза, присутствия гипертрофированных гигантских астроцитов. Патологоанатомический диагноз — острое очаговое демиелинизирующее заболевание. Иммунологическое исследование крови на цитомегаловирус, вирус простого герпеса, вирус краснухи отрицательные.
/113-1.jpg)
/113-2.jpg)
/114-1.jpg)
Через неделю после СТБ повторно была проведена МРТ головного мозга, на которой отмечается продолжающаяся отрицательная динамика в виде увеличения зоны в правом полушарии большого мозга в размерах, которая стала распространяться апикально, а также наблюдается появление нового очага в левых отделах варолиева моста (рис. 5). Таким образом, с учетом МРТ-динамики относительно старых очагов и появления нового очага инфратенториально данная МРТ-картина трактуется как демиелинизирующий процесс, атипичное течение. Для уточнения масштаба вовлечения ЦНС в демиелинизирующий процесс была выполнена МРТ спинного мозга — очаговых изменений не выявлено. Учитывая массивность поражения белого вещества головного мозга характерным демиелинизирующим процессом с вовлечением ствола, а также исключение другой возможной этиологии, поставлен диагноз: атипичный рассеянный склероз, вариант Марбурга. Проведена гормональная пульс-терапия (суммарная доза метилпреднизолона 7 г) с последующим переводом на таблетированный преднизолон с постепенным снижением по схеме. При отмене таблетированного преднизолона у пациентки отмечается ухудшение состояния в виде нарастания неустойчивости при ходьбе, снижения зрения, появления слабости в правой руке, вестибулярный синдром, нарастание балла по шкале EDSS до 7,0. Спустя 3 месяца проводится очередная МРТ головного мозга, на которой вновь наблюдается отрицательная динамика в виде увеличения в размерах зоны в правом полушарии большого мозга, а также появления и значительного увеличения зон инфратенториальной локализации в обеих средних мозжечковых ножках и нарастания степени их деструкции (рис. 6).
/115-1.jpg)
С учетом отрицательной динамики клинически и по данным МРТ принято решение о проведении повторного курса гормональной пульс-терапии совместно с 3 сеансами плазмафереза и последующим проведением иммуносупрессии препаратом митоксантрон 10 мг. На фоне проведенной терапии отмечалась положительная динамика в виде частичного регресса неврологического дефицита до 5,0 балла по шкале EDSS. Начата терапия препаратом интерферон бета-1b 250 мкг подкожно через день. Повторный курс иммуносупрессии препаратом митоксантрон 10 мг проведен еще через месяц. Итого с мая 2007 года по апрель 2008 года пациентке была проведена терапия препаратом митоксантрон в суммарной дозе 100 мг. В мае 2008 года отмечается ухудшение состояния в виде нарастания атаксии, EDSS = 7,0 балла. По данным МРТ головного мозга наблюдается положительная динамика в виде значительного уменьшения в размерах очагов инфратенториальной локализации в обоих полушариях большого мозга, а также значительное расширение ликворных пространств, непосредственно прилежащих к участкам демиелинизации (за счет атрофии и ранее наблюдавшихся зон деструкции) (рис. 7). Проводилась гормональная пульс-терапия с положительным эффектом и регрессом неврологического дефицита до EDSS до 6,5 балла.
/116-1.jpg)
С 2009 года и по настоящее время обострений и нарастания неврологического дефицита не отмечается. Пациентке постоянно проводятся курсы реабилитационного лечения, и к 2012 году неврологический дефицит регрессировал до 5,5 балла по шкале EDSS, пациентка стала передвигаться с односторонней поддержкой. По данным МРТ головного мозга от 2009, 2011, 2015, 2016 гг. отрицательной динамики выявлено не было. Также в 2009 году при повторном проведении МРТ шейного отдела спинного мозга очаговых изменений не выявлено.
Обсуждение
В настоящее время вариант Марбурга характеризуется как редкая, острая, монофазная и крайне агрессивная форма РС, ведущая к быстрой и тяжелой инвалидизации или летальному исходу в срок от нескольких недель до нескольких месяцев [3, 4]. Одной из причин развития данного варианта РС является именно одновременное сочетание гуморальных и клеточных механизмов аутоиммунного воспаления. При проведении МРТ головного мозга выявляются множественные, различных размеров очаги демиелинизации с перекрывающими друг друга зонами, в том числе и в стволе мозга. Именно локализация очагов в стволе мозга является одной из характерных особенностей при варианте Марбурга, с чем и связывают высокую смертность таких больных. В отличие от классического РС поражение происходит одновременно во многих участках головного мозга (большие полушария, ствол) в виде больших сливных очагов демиелинизации. Достаточно часто наблюдается типичный паттерн контрастного усиления очагов по типу колец и незамкнутых колец. Также по данным МРТ отмечается быстрое развитие очагов с некротическим распадом в центральной части (деструкция), увеличение размеров очагов и их количества. Именно в связи с атипичными клиническими и рентгенологическими признаками и возникают трудности в своевременной постановке диагноза.
При проведении гистологического исследования отмечается весьма характерная обширная демиелинизация с массивной макрофагальной инфильтрацией, гибелью аксонов, выраженным отеком, участками некроза, присутствием гипертрофированных гигантских астроцитов [5–7]. Воспалительная клеточная инфильтрация выявляется не только в периваскулярных областях, но и встречается повсеместно в белом веществе мозга. Выявленные изменения в очагах при варианте Марбурга идентичны таковым в очагах при классическом РС в период обострения. Еще одним интересным наблюдением является то, что данный вариант течения РС может наблюдаться не только с самого дебюта, но и на фоне уже диагностированного типичного РС.
Прижизненная диагностика фульминантных форм РС, в том числе и варианта Марбурга, заставляет задуматься о тактике медикаментозной терапии данной категории больных. Однако из-за малочисленности наблюдений к настоящему времени каких-либо разработанных и утвержденных протоколов не существует. Согласно имеющимся в настоящее время данным, в острый период в качестве первой линии необходимо проводить гормональную пульс-терапию, а в качестве второй линии — плазмаферез [8, 9]. При выявленной неэффективности в индивидуальном порядке рассматривается возможность применения цитостатической терапии препаратами митоксантрон, циклофосфамид и азатиоприн [4, 10]. По мнению ряда специалистов, при наличии критериев диссеминации в пространстве и времени (выполнение критериев постановки диагноза РС) для профилактики возможных обострений заболевания необходимо применять препараты, изменяющие течение РС [11]. Однако данная точка зрения пока не подкреплена результатами рандомизированных исследований. В ряде публикаций описаны случаи применения высокодозных бета-интерферонов и натализумаба при концентрическом склерозе Бало и псевдотуморозном РС с положительным эффектом, что, вероятно, можно применить к варианту Марбурга, учитывая то, что все три варианта относятся к фульминантным формам [12–15]. Также уже имеются единичные данные и по успешному применению препарата алемтузумаб у больного с болезнью Марбурга [16].
В настоящее время вариант Марбурга, безусловно, относится к атипичным формам демиелинизирующего заболевания ЦНС с характерными рентгенологическими и клиническими особенностями. Благодаря активному внедрению в практику МРТ случаи данного заболевания стало возможно диагностировать прижизненно, что способствует увеличению показателя выживаемости из-за применения своевременной адекватной терапии. Однако, учитывая малочисленность наблюдений из-за редкой частоты встречаемости, остается много неясного в отношении возможной терапии больных. Единственно возможным решением данной проблемы может стать именно создание международных регистров (как ретроспективных, так и проспективных) больных с фульминантными формами РС, в том числе и вариантом Марбурга. При помощи данных регистров в дальнейшем возможно было бы разработать единый протокол по лечению таких больных.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Wattamwar P., Baheti N., Kesavadas C., Nair M., Radhakrishnan A. Evolution and long term outcome in patients presenting with large demyelinating lesions as their first clinical event // Journal of the Neurological Sciences. — 2010. — 297(1–2). — 29-35. doi: 10.1016/j.jns.2010.06.030.
2. Freedman M., Rush C. Severe, Highly Active, or Aggressive Multiple Sclerosis // Continuum: Lifelong Learning in Neurology. — 2016. — 22(3). — 761-784. doi: 10.1212/con.0000000000000331.
3. Masdeu J., Quinto C., Olivera C., Tenner M., Leslie D., Visintainer P. Open-ring imaging sign: Highly specific for atypical brain demyelination // Neurology. — 2000. — 54(7). — 1427-1433. doi: 10.1212/wnl.54.7.1427.
4. Jeffery D., Lefkowitz D., Crittenden J. Treatment of Marburg Variant Multiple Sclerosis with Mitoxantrone // Journal of Neuroima–ging. — 2004. — 14(1). — 58-62. doi: 10.1177/1051228403259393.
5. Oreja-Guevara C., Gómez-Pinedo U., García-López J. et al. Inhibition of neurogenesis in a case of Marburg variant multiple sclerosis // Multiple Sclerosis and Related Disorders. — 2017. — 18. — 71-76. doi: 10.1016/j.msard.2017.09.024.
6. Suzuki M., Kawasaki H., Masaki K. et al. An Autopsy Case of the Marburg Variant of Multiple Sclerosis (Acute Multiple Sclerosis) // Internal Medicine. — 2013. — 52(16). — 1825-1832. doi: 10.2169/internalmedicine.52.0425.
7. Nunes J., Radbruch H., Walz R. et al. The most fulminant course of the Marburg variant of multiple sclerosis — autopsy fin–dings // Multiple Sclerosis Journal. — 2014. — 21(4). — 485-487. doi: 10.1177/1352458514537366.
8. Masuda H., Mori M., Katayama K., Kikkawa Y., Kuwabara S. Anti-Aquaporin-4 Antibody-Seronegative NMO Spectrum Disorder with Balo’s concentric Lesions // Internal Medicine. — 2013. — 52(13). — 1517-1521. doi: 10.2169/internalmedicine.52.9330.
9. Brown J., Coles A., Jones J. First use of alemtuzumab in Balo’s concentric sclerosis: a case report // Multiple Sclerosis Journal. — 2013. — 19(12). — 1673-1675. doi: 10.1177/1352458513498129.
10. Nozaki K., Abou-Fayssal N. High dose cyclophosphamide treatment in Marburg variant multiple sclerosis // Journal of the Neurological Sciences. — 2010. — 296(1-2). — 121-123. doi: 10.1016/j.jns.2010.05.022.
11. Grooters G., Visser L., Barkhof F., van der Knaap M.,
van Asseldonk J. Mystery Case: Balo concentric sclerosis // Neuro–logy. — 2013. — 80(7). — e71-e72. doi: 10.1212/wnl.0b013e3182824e7d.
12. Chitnis T., Hollmann T. CADASIL mutation and Balo concentric sclerosis: A link between demyelination and ische–mia? // Neurology. — 2012. — 78(3). — 221-223. doi: 10.1212/wnl.0b013e31823fcd3c.
13. Berghoff M., Schlamann M., Maderwald S. et al. 7 Tesla MRI demonstrates vascular pathology in Baló’s concentric sclerosis // Multiple Sclerosis Journal. — 2012. — 19(1). — 120-122. doi: 10.1177/1352458512445302.
14. Попова Е.В., Брюхов В.В., Бойко А.Н., Кротенкова М.В., Коновалова О.Е., Шаранова С.Н. Атипичный рассеянный склероз — концентрический склероз Бало: два клинических наблюдения и обзор // Журнал неврологии и психиатрии им. C.C. Корсакова. — 2017. — 117. — 2(2). — 50-53. doi: 10.17116/jnevro20171172250-53.
15. Брюхов В.В., Попова Е.В., Кротенкова М.В., Бойко А.Н.
Радиологически изолированный синдром (МРТ-критерии и тактика ведения больного) // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2016. — 116. — 10(2). — 47-52. doi: 10.17116/jnevro201611610247-52
16. Gobbin F., Marangi A., Orlandi R. et al. A case of acute fulminant multiple sclerosis treated with alemtuzumab // Multiple Sclerosis and Related Disorders. — 2017. — 17. — 9-11. doi: 10.1016/j.msard.2017.06.007.
17. Евтушенко С.К., Москаленко М.А. Рассеянный склероз у детей. — К., 2010. — 253 с.

/113-1.jpg)
/113-2.jpg)
/114-1.jpg)
/115-1.jpg)
/116-1.jpg)