Международный неврологический журнал №2 (96), 2018
Лечение пациентов с центрогенной лихорадкой с применением препаратов для устранения митохондриальной дисфункции
Авторы: Никонов В.В., Курсов С.В., Белецкий А.В., Иевлева В.И., Феськов А.Э.
Харьковская медицинская академия последипломного образования, г. Харьков, Украина
КУЗ «Харьковская городская клиническая больница скорой и неотложной медицинской помощи им. проф. А.И. Мещанинова», г. Харьков, Украина
Рубрики: Неврология
Разделы: Справочник специалиста
Резюме
Центрогенна лихоманка — лихоманка неінфекційного походження, що ускладнює перебіг захворювань центральної нервової системи. Механізми її розвитку зв’язують із порушенням функції гіпоталамуса, що розглядають як центр терморегуляції. Центрогенна лихоманка асоційована з активацією катаболічних реакцій, несприятливим перебігом основного патологічного процесу та важко усувається за допомогою традиційних лікувальних заходiв, що включають використання нестероїдних протизапальних засобів (НПЗЗ). Дослідження присвячене порівняльному вивченню ефективності усунення центрогенної лихоманки в постраждалих iз тяжкою черепно-мозковою травмою та мозковими інсультами за допомогою НПЗЗ і комплексу вітамінів та антиоксидантів, що сприяють покращенню сполученостi процесів мітохондріального окислення та фосфорилювання. Зміцнення цiєї сполученостi забезпечує зростання синтезу аденозинтрифосфату i обмежує розповсюдження вільної енергії в організмі у вигляді тепла. У кожну із груп, що вивчалися, включено по 14 пацієнтів із тяжкими пошкодженнями центральної нервової системи та ознаками центрогенної лихоманки. Знайдено достовірну перевагу схеми лікування, що включала комбіноване застосування бурштинової кислоти, інозину, нікотинаміду, рибофлавіну і тіаміну, перед традиційно використовуваною схемою лікування, яка ґрунтується на першочерговому застосуванні НПЗЗ.
Центрогенная лихорадка — лихорадка неинфекционного происхождения, осложняющая течение заболеваний центральной нервной системы. Механизм ее развития связывают с нарушением функции гипоталамуса, который рассматривается в качестве центра терморегуляции. Центрогенная лихорадка ассоциирована с активацией катаболических реакций, неблагоприятным течением основного патологического процесса и трудно устраняется с помощью традиционных лечебных мероприятий, включающих применение нестероидных противовоспалительных средств (НПВС). Исследование посвящено сравнительному изучению эффективности устранения центрогенной лихорадки у пострадавших с тяжелой черепно-мозговой травмой и мозговыми инсультами при помощи НПВС и комплекса витаминов и антиоксидантов, способствующих улучшению сопряженности процессов митохондриального окисления и фосфорилирования. Увеличение этой сопряженности обеспечивает увеличение синтеза аденозинтрифосфата и ограничение распространения свободной энергии в организме в виде тепла. В каждую из изучаемых групп включено по 14 пациентов с тяжелыми повреждениями центральной нервной системы и признаками центрогенной лихорадки. Обнаружено достоверное преимущество схемы лечения, включающей комбинированное применение янтарной кислоты, инозина, никотинамида, рибофлавина и тиамина, перед традиционно используемой схемой лечения, основанной на первоочередном применении НПВС.
Cental fever — fever of infectious origin, complicating diseases of the central nervous system. Mechanisms of development are related to the dysfunction of the hypothalamus, which is considered as the center of thermoregulation. Central fever is associated with activation of catabolic reactions, adverse course of underlying pathological process and is hard to control using traditional therapeutic measures, including the use of non-steroidal anti-inflammatory drugs (NSAIDs). The research deals with the comparative study on the efficiency of central fever control in victims with severe traumatic brain injury and cerebral strokes using NSAIDs and a complex of vitamins and antioxidants, which help to improve the processes of association of mitochondrial oxidation and phosphorylation. Increase of this association provides the growth in the synthesis of adenosine triphosphate and inhibits the spread of free energy in the body as a heat. Each of the studied groups included 14 patients with severe injuries of the central nervous system and symptoms of central fever. There was found a significant advantage of treatment regimen that included the combined use of succinic acid, inosine, nicotinamide, riboflavin and thiamine over the commonly used treatment regimen based on the priority use of NSAIDs.
Ключевые слова
центрогенна лихоманка; окислювальне фосфорилювання; мітохондріальна дисфункція; нестероїдні протизапальні засоби; тяжка черепно-мозкова травма; мозковий інсульт
центрогенная лихорадка; окислительное фосфорилирование; митохондриальная дисфункция; нестероидные противовоспалительные средства; тяжелая черепно-мозговая травма; мозговой инсульт
central fever; oxidative phosphorylation; mitochondrial dysfunction; non-steroidal anti-inflammatory drugs; severe traumatic brain injury; cerebral stroke
Введение
Одним из тяжелых осложнений при поражениях головного мозга различной этиологии является острый диэнцефальный катаболический синдром (гипоталамический синдром, верхнестволовой, острый мезэнцефало-гипоталамический синдром, острый мезэнцефальный гиперметаболический синдром). Он проявляется повышением тонуса симпатоадреналовой системы с развитием тахикардии, гипергликемии, преобладанием катаболических процессов с формированием гипопротеинемии, азотемии, парезом желудочно-кишечного тракта с ограничением усвоения энергетических субстратов, дегидратацией, гиповолемией, а также упорной лихорадкой, плохо поддающейся лечению нестероидными противовоспалительными средствами (НПВС) [1–3]. Проблема устранения центрогенной лихорадки занимает одно из важных мест в структуре мероприятий интенсивной терапии у больных с тяжелой черепно-мозговой травмой (ТЧМТ), геморрагическими и обширными ишемическими инсультами и привлекает все больше внимания отечественных и зарубежных специалистов [4–6]. Следует отметить, что в англоязычных литературных источниках термин «острый диэнцефальный катаболический синдром», как и перечисленные аналоги, используется крайне редко. Вместо него применяется термин «центрогенная лихорадка» (central fever) [5–7].
Для купирования центрогенной лихорадки при неэффективности НПВС используют методику создания глубокого охранительного торможения центральной нервной системы (ЦНС) с применением барбитуратов, бензодиазепинов, оксибутирата натрия, пропофола [3, 8, 9]. В наиболее тяжелых случаях используют опиоиды в условиях контролируемой искусственной вентиляции легких (ИВЛ) [10–12]. Имеются сообщения об успешном купировании центрогенной лихорадки у отдельных пациентов с помощью антиадренергических препаратов (пропранолол, клонидин и др.) [13–15]. Уменьшения симпатоадреналовой активности пытаются добиться через угнетение высвобождения кортикотропина дофаминергическими агонистами [16–18]. В последнее время появились сообщения об эффективном лечении пациентов с центрогенной лихорадкой баклофеном [19–21]. Но в большинстве случаев на фоне терапии НПВС и нейровегетативной блокады используются методы физического охлаждения [5, 12, 22].
Механизмы терморегуляции в организме человека чрезвычайно многочисленны и сложны [23–25]. Однако во всех случаях в виде тепла в организме рассеивается энергия, образовавшаяся в результате окислительных процессов, не сопряженных с фосфорилированием. Усиление связи между окислением и фосфорилированием способствует увеличению образования аденозинтрифосфата и ограничивает рассеивание тепла. Активируют фосфорилирующее окисление α-токоферол, тиамин, рибофлавин, цианокобаламин, убихинон, карнозин, глутатион, ацетилхолин, производные аденозина, коэнзим А, ионы калия, магия, марганца. К разобщителям окисления и фосфорилирования относят продукты превращения адреналина (адренохром), паратгормон, прогестерон, соматотропин и аргинин-вазопрессин, аскорбиновую кислоту, длинноцепочечные жирные кислоты, билирубин, ионы гидроксония, цинка и меди, а также свободные радикалы. Классическими ингибиторами (традиционно используются в экспериментальных моделях) окислительного фосфорилирования являются ротенон, амитал, антимицин А, цианиды, монооксид углерода, азид, 2,4-динитрофенол, пентахлорфенол и олигомицин [26–28].
Целью исследования стало изучение эффекта купирования центрогенной лихорадки у пациентов с ТЧМТ и мозговым инсультом с помощью комплекса витаминов и антиоксидантов, способствующих улучшению процессов окислительного фосфорилирования путем усиления их сопряженности за счет активации ферментов митохондриального дыхательного комплекса, а также путем ограничения продукции свободных радикалов.
Материалы и методы
В исследование включено 28 пациентов с синдромом острой церебральной недостаточности, сформировавшимся на фоне ТЧМТ (n = 12) и мозгового инсульта (n = 16; в 14 случаях — геморрагический и в 2 — обширный ишемический инсульт). У этих больных в процессе наблюдения и лечения в отделении интенсивной терапии (ОИТ) обнаружены признаки центрогенной лихорадки. Инфекционное происхождение лихорадки было исключено в основном посредством рентгенографического исследования органов грудной клетки, при котором не было обнаружено признаков инфильтрации легочной ткани.
При оценке состояния почек и мочевыводящих путей исключалось наличие пиурии. С первых суток поступления в ОИТ пациентам назначалась антибактериальная терапия цефтриаксоном, проводилась ежедневная санация трахеи, бронхов и полости рта, промывание мочевого пузыря растворами антисептиков. В дальнейшем выполнено исследование гемокультуры. Центрогенная лихорадка проявлялась уже в первые 48 часов после начала заболевания с учетом указаний родных и близких пациентов, а также врачей экстренной медицинской помощи. Больные находились на лечении в ОИТ общего профиля и в блоке интенсивной терапии отделения политравмы. В последнем обследовались и лечились пациенты, у которых доминирующим повреждением была ТЧМТ.
Сформировано 2 группы исследования, в каждую из которых вошло по 8 пострадавших с ТЧМТ и 6 пациентов с мозговым инсультом. Для рандомизации распределение больных в группы исследования было строго поочередным в отношении и ТЧМТ, и мозгового инсульта: 1-я группа — 2-я группа — 1-я группа и т.д. Температуру тела измеряли в аксиллярной впадине 12 раз в сутки (каждые 2 часа). О наличии гипертермии говорили в случаях повышения температуры тела более 37,8 °С (100 °F) [29]. Состояние всех пациентов в этот период времени расценивалось как крайне тяжелое. Оценка глубины комы по шкале Глазго находилась в пределах 4–6 баллов. У всех пациентов проводилась контролируемая механическая ИВЛ через интубационную эндотрахеальную трубку.
У пациентов 1-й группы для борьбы c лихорадкой использовали НПВС (метамизол натрия или парацетамол), а также средства для внутривенной анестезии (тиопентал натрия, оксибутират натрия, диазепам). Метамизол натрия применяли внутривенно трижды в сутки в разовой дозе не более 1000 мг и суточной, которая никогда не превышала 3000 мг. Парацетамол использовался в дозе 500–1000 мг внутривенно капельно 3–4 раза в сутки. Суточная доза также не превышала 3000 мг. Тиопентал натрия применялся в суточной дозе 2000–3000 мг, а оксибутират натрия — 16–20 г в сутки. Доза диазепама составляла 60–80 мг в сутки. Строгие соотношения между дозами средств для внутривенной анестезии не соблюдались.
У пациентов 2-й группы не позже чем через 24 часа после поступления в клинику обеспечивали введение комплекса витаминов и антиоксидантов для улучшения функции митохондрий и увеличения сопряженности между окислением и фосфорилированием. Предшествующая методика уменьшения тяжести лихорадки была разработана в Украинском институте усовершенствования врачей на кафедре анестезиологии и реаниматологии под руководством В.А. Аркатова. Она включала внутривенное введение никотинамида в суточной дозе до 400–600 мг и тиамина в суточной дозе 100–200 мг. Методика успешно использовалась в клинической практике, однако была забыта в связи с прекращением производства никотинамида для парентерального введения.
Мы использовали комбинированный препарат с содержанием в одной ампуле (10 мл) 1000 мг янтарной кислоты, 100 мг никотинамида, 200 мг инозина и 20 мг рибофлавина мононуклеотида. Препарат вводился только внутривенно капельно медленно (60 капель в 1 минуту) 2 раза в сутки в дозе 10 мл в разведении на 200 мл физиологического раствора [30]. Одновременно больным назначался тиамин в дозе 200 мг внутривенно, который также использовали 2 раза в сутки. Введения НПВС максимально избегали. В случаях недостаточного эффекта купирования лихорадки предпочтение отдавалось введению парацетамола. Его доза достигала не более 2000 мг в сутки. Для создания и поддержания нейровегетативной блокады использовали оксибутират натрия и диазепам, избегая применения барбитуратов, угнетающих процессы митохондриального окисления [31].
Мониторинг температуры тела проводился в течение 10 суток. Представлены результаты расчета среднесуточной температуры тела. Результаты исследования обработаны с помощью признанных методов современной математической статистики с использованием программы MedStat (Украина, № 10858) и представлены в виде М ± σ (значение средней статистической величины ± стандартное отклонение). Выборки проверяли на нормальность распределения для определения достоверности различия результатов. При нормальном распределении (стартовые данные, 1-е, 2-е, 3-и и 10-е сутки наблюдения) использовался Т-критерий Стьюдента. При отличии одного или двух распределений от нормального (5-е и 7-е сутки наблюдения) — непараметрический W-критерий Вилкоксона.
Результаты и обсуждение
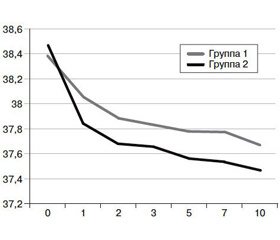
Результаты динамики среднесуточного уровня температуры тела у пациентов с центрогенной лихорадкой, осложнившей течение ТЧМТ и мозгового инсульта, приводятся в табл. 1.
Динамика среднесуточной температуры тела представлена на рис. 1.
/120-2.jpg)
Из приведенных данных видно, что терапия, направленная на уменьшение тяжести митохондриальной дисфункции у пациентов с лихорадкой центрогенного происхождения, уже с первого дня приносила достоверно лучшие результаты, чем традиционное использование НПВС. Достоверность различий сохранялась на протяжении всего периода исследования. Успешное уменьшение тяжести лихорадки было ассоциировано со снижением перспирационных потерь жидкости из организма, уменьшением тяжести катаболизма, выражавшейся в регрессировании гипопротеинемии, азотемии и потерь азота с мочой. При назначении указанного витаминно-антиоксидантного комплекса быстрее восстанавливалась моторика кишечника и улучшалась эффективность зондового энтерального питания. В итоге отмечались более быстрые положительные изменения в неврологическом статусе. Таким образом, несмотря на определенное увеличение стоимости лечения за счет введения витаминно-антиоксидантного комплекса, затраты на лечение уменьшались за счет снижения потребности в жидкости и необходимости проведения дорогостоящего парентерального питания, введения растворов альбумина для устранения гипопротеинемии.
Выводы
1. Одним из механизмов повышения температуры тела является нарушение сопряженности между окислением и фосфорилированием, в результате чего значительная часть энергии, образовавшаяся при окислении энергетических субстратов, распространяется в организме в виде тепла. Мероприятия, способствующие уменьшению тяжести митохондриальной дисфункции и увеличению сопряженности между процессами окисления и фосфорилирования, обусловливают кумуляцию энергии, уменьшают ее потери, что приводит к нормализации температуры тела.
2. Эффективным методом уменьшения тяжести центрогенной лихорадки является применение витаминно-антиоксидантного комплекса, включающего янтарную кислоту, инозин, никотинамид, рибофлавин и тиамин.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Впервые опубликовано в журнале
«Медицина неотложных состояний» № 7 (78), 2016
Список литературы
1. Cooper P.E. Neuroendocrinology / P.E. Cooper, S.H.M. van Uum // Bradley’s Neurology in Clinical Practice, 7th ed.; Ch. 52; Ed. by R.B. Daroff. — London, New York, Oxford, Philadelphia, St Louis, Sydney, Toronto: Elsevier, 2016. — P. 696-712.
2. Михневич К.Г. Кетонал в лечении нейрохирургических больных / К.Г. Михневич, С.В. Курсов, Ю.В. Волкова // Медицина невідкладних станів. — 2008. — № 2(15). — С. 55-57.
3. Изменения углеводного обмена как диагностический тест гипоталамического синдрома при тяжелой черепно-мозговой травме / В.М. Кузнецова, М.Л. Борщаговский, В.Е. Райхинштейн [и др.] // Журнал невропатологии и психиатрии имени С.С. Корсакова. — 1990. — Т. 90, № 2. — С. 9-14.
4. Галушко О.А. Лихоманка при гострому інсульті: проблеми діагностики та лікування / О.А. Галушко // Медицина невідкладних станів. — 2016. — № 5(76). — С. 11-17.
5. Central Fever in Patients with Spontaneous Intracerebral He–morrhage: Predicting Factors and Impact on Outcome / A. Honig, S. Michael, R. Eliahou [et al.] // BMC Neuro–logy. — 2015. — Vol. 15. — P. 6. BioMed Central, BMC Neurology [Электронный ресурс]. Published: 4 February 2015. Режим доступа: http://bmcneurol.biomedcentral.com/articles/10.1186/s12883-015-0258-8
6. Indicators of Central Fever in the Neurologic Intensive Care Unit / S.E. Hocker, L. Tian, G. Li [et al.] // JAMA Neurology. — 2013. — Vol. 70, № 12. — P. 1499-1504.
7. Recovery of Central Fever After GH Therapy in a Patient with GH Deficiency Secondary to Posttraumatic Brain Injury / H.U. Tuhan, A. Anik, G. Catli [et al.] // ESPE (European Society of Pediatric Endocrinology) Abstracts. — 2014. — Vol. 82. — P-D-3-2-831.
8. Effect of a Fever Control Protocol-Based Strategy on Ventilator-Associated Pneumonia in Severely Brain-Injured Patients / Y. Launey, N. Nesseler, A. Le Cousin [et al.] // Critical Care. — 2014. — Vol. 18, № 6. — P. 689.
9. Lemke D.M. Sympathetic Storming After Severe Traumatic Brain Injury / D.M. Lemke // Critical Care Nurse. — 2014. — Vol. 27. — P. 30-37.
10. Mendieta Zeron H. Remission of Central Fever with Morphine post Traumatic Brain Injury / H. Mendieta Zeron, J.C. Arriaga Garcia Rendon // Lebanese Medical Journal. — 2014. — Vol. 62, № 1. — P. 57-61.
11. Ali S. Analgesia and Sedation / S. Ali, R.J. Azocar // Surgical Intensive Care Medicine; Ch. 11; Ed. by J.M. O’Donnell, F.E. Nácul. — New York, London: Kluwer Academic Publishers, 2001. — P. 119-130.
12. Neurological and Neurosurgical Intensive Care; 4th ed. / D.R. Gress, M.N. Diringer, D.M. Green et al.; Ed. by A.H. Ropper. — Philadelphia, Baltimore, New York, London, Buenos Aires, Hong Cong, Sydney, Tokyo: Lippincott Williams & Wilkins, 2004. — 380 p.
13. Oh S.J. Paroxysmal Autonomic Dysregulation with Fever that was Controlled by Propranolol in a Brain Neoplasm Patient / S.J. Oh, Y.K. Hong, E.K. Song // Korean Journal of Internal Medicine. — 2007. — Vol. 22, № 1. — P. 51-54.
14. Meythaler J.M. Fever of Central Origin in Traumatic Brain Injury Controlled with Propranolol / J.M. Meythaler, A.M. Stinson // Archives of Physical Medicine and Rehabilitation. — 1994. — Vol. 75, № 7. — P. 816-818.
15. α2 Adrenergic Receptor-Mediated Inhibition of Thermoge–nesis / Ch.J. Madden, D. Tupone, G. Cano [et al.] // Journal of Neuroscience. — 2013. — Vol. 33, № 5. — P. 4701-4712.
16. Delayed Central Hyperthermia Responsive to Bromo–criptine / R. Albadareen, S. Belliston, K. Husmann [et al.] // Neurology. — 2015. — Vol. 84, № 14 (Suppl.). — P. 290.
17. Effectively Managing Intractable Central Hyperthermia in a Stroke Patient by Bromocriptine: a Case Report / K.W. Yu, Y.H. Huang, C.L. Lin [et al.] // Neuropsychiatric Disease and Treatment. — 2013. — Vol. 9. — P. 605-608. Dove Press: Open Access to Scientific and Medical Research [Электронный ресурс]. Published 3 May 2013. Режим доступа: https://www.dovepress.com/effectively-managing-intractable-central-hyperthermia-in-a-stroke-pati-peer-reviewed-article-NDT
18. Effects of Bromocriptine and Cyproheptadine on Basal and Corticotropin-Releasing Factor (CRF)-Induced ACTH Release in a Patient with Nelson’s Syndrome / Y. Hirata, H. Nakashima, M. Uchihashi [et al.] // Endocrinologia Japonica. — 1984. — Vol. 31, № 5. — P. 619-626.
19. Central Hyperthermia Treated with Baclofen for Patient with Pontine Hemorrhage / H.Ch. Lee, J.M. Kim, J.K. Lim [et al.] // Annals of Rehabilitation Medicine. — 2014. — Vol. 38, № 2. — P. 269-272.
20. Flower O. Fever in a Spinal Patient / O. Flower // Life in the Fastlane [Электронный ресурс] July 12, 2010. Режим доступа: http://lifeinthefastlane.com/microbial-mystery-005/
21. Baclofen Successfully Abolished Prolonged Central Hyperthermia in a Patient with Basilar Artery Occlusion / Y.S. Huang, M.Ch. Hsiao, M. Lee [et al.] // Acta Neurologica Taiwanica. — 2009. — Vol. 18, № 2. — P. 118-122.
22. Scaravilli V. Fever Management in SAH / V. Scaravilli, G. Tinchero, G. Citerio // Neurocritical Care [Электронный ресурс]. Published Online 14 July 2011. Режим доступа:
http://www.mc.vanderbilt.edu/documents/NeuroICU/files/SAH%20and%20Fever.pdf
23. Tansey E.A. Recent Advances in Thermoregulation / E.A. Tansey, Ch.D. Johnson // Advances in Physiology Education. — 2015. — Vol. 39, № 3. — P. 139-148.
24. Morrison S.F. Central Neural Pathways for Thermoregulation / S.F. Morrison, K. Nakamura // Frontiers in Bioscience. — 2011. — Vol. 16, № 1. — P. 74-104.
25. Seebacher F. Responses to Temperature Variation: Integration of Thermoregulation and Metabolism in Vertebrates / F. Seebacher // Journal of Experimental Biology. — 2009. — Vol. 212. — P. 2885-2891.
26. Cooper J.M. The Cell A Molecular Approach. — 7th ed. / J.M. Cooper, R.E. Hausman. — Sunderland: Sinauer Associates, 2016. — 769 p.
27. King M.W. Mitochondrial Functions and Biological Oxidations / M.W. King // The Medical Biochemistry Page [Электронный ресурс]. Last modified: February 9, 2016. Режим доступа: http://themedicalbiochemistrypage.org/oxidative-phosphorylation.php
28. Bhagavan N.V. Essentials of Medical Biochemistry: with Clinical Cases; 2nd ed. / N.V. Bhagavan, Ch.E. Ha. — Amsterdam, Boston, Heidelberg, London, New York, Oxford, Paris, San Diego, San Francisco, Singapore, Sydney, Tokyo: Elsevier, 2016. — 715 p.
29. Epidemiology and Outcomes of Fever Burden among Patients with Acute Ischemia Stroke / M.S. Phipps, R.A. Desai, C. Witra [et al.] // Stroke. — 2011. — Vol. 42, № 12. — P. 3357-3362.
30. Клочева Е.Г. Применение препарата Цитофлавин в неврологии / Е.Г. Клочева / MEDI.Ru подробно о лекарствах [Электронный ресурс]. Дата документа: июль 2009. Режим доступа: http://medi.ru/doc/a210302.htm
31. Cottrell J.E. Cottrell and Patel’s Neuroanesthesia; 6th ed. / J.E. Cottrell, P. Patel. — Edinburgh, London, New York, Oxford, Philadelphia, St Louis, Sydney, Toronto: Elsevier, 2017. — 240 р.

/120-1.jpg)
/120-2.jpg)