Вступ
Сучасна тактика ведення пацієнтів із хронічною хворобою нирок (ХХН) включає, по-перше, лікування самої патології нирок, а по-друге — зниження кардіоваскулярних ризиків [1], що покращує прогноз цієї категорії хворих. У разі хронічного пієлонефриту (ХПН) у дитини важливим є як запобігання формуванню нефросклерозу шляхом ефективної етіотропної терапії та профілактики рецидивів, так і проведення своєчасної корекції гемодинамічних розладів як складової нефропротекції. Оскільки в педіатричних пацієнтів характер кардіоренальних взаємозв’язків змінюється під час прогресування хронічного захворювання нирок (ХЗН) до розвитку ХХН [2], ранні серцево-судинні порушення можуть мати обернений розвиток [3, 4].
Функціональний стан нирок як основний регулятор об’єму крові має вирішальне значення для підтримки артеріального тиску (АТ). Сьогодні існує безліч досліджень, що демонструють взаємодію між наявністю ХХН та артеріальною гіпертензією (АГ), причому АГ, наімовірніше, прискорює прогресування ХХН [1, 8, 10–13, 17]. Особливо це важливо для пацієнтів педіатричного профілю, у яких АГ нерідко йде невизначеною — маскується або є недостатньо контрольованою [5–8]. Відомо, що ХХН і гіпертензія є внутрішньопов’язаними [8], остання є незалежним фактором ризику ХХН у дітей [3]. Поширеність АГ серед дітей із ХХН у десять разів вища, ніж у загальній педіатричній популяції, і збільшується через етапи прогресування ХЗН до ХХН [9]. Таким чином, зниження функції нирок може бути безпосередньо пов’язаним із підвищеним АТ. Вирішення проблеми АГ може цілком запобігти або скасувати це зниження функції нирок і тому стає обов’язковою в управлінні ХХН, особливо в дитячому віці [11].
На сьогодні не викликає сумніву, що інгібітори ангіотензинперетворюючого ферменту (ІАПФ) становлять основу ренопротективної терапії [12]. Передумовою для розробки сучасної стратегії нефропротекції, заснованої на фармакологічному пригніченні ренін-ангіотензин-альдостеронової системи (РААС), стали уявлення про значення ангіотензину II в прогресуванні склерозування ниркової тканини. Установлено, що ІАПФ сприяють гальмуванню експериментального нефросклерозу, що пояснюється, зокрема, нормалізацією внутрішньониркової гемодинаміки [14]. Але спектр дії ІАПФ на організм людини набагато ширший і здійснюється шляхом реалізації цілої низки терапевтичних ефектів: кардіо- й ангіопротективного, гемодинамічного, нейрогуморального, зменшення ендотеліальної дисфункції тощо [15]. Нейрогуморальні ефекти ІАПФ здійснюються шляхом не тільки зниження активності РААС (за рахунок зниження рівня ангіотензину II, альдостерону), а й зниження активності симпатоадреналової системи (за рахунок зниження рівня норадреналіну, вазопресину) [15], що особливо важливо в педіатричних пацієнтів. Гемодинамічні ефекти ІАПФ реалізує за рахунок артеріальної і венозної вазодилатації (зниження після- і переднавантаження на міокард), зниження АТ (без розвитку тахікардії) і загального периферичного опору; зменшення тиску наповнення лівого шлуночка; поліпшення регіонарного (коронарного, церебрального, ниркового, м’язового) кровообігу [15].
Зниження АТ супроводжується покращанням мікроциркуляції в периферичних тканинах, і, таким чином, ІАПФ покращують прогноз у пацієнтів із ХЗН, зменшуючи ризик кардіоваскулярних подій [11].
Нефропротекторну дію ІАПФ реалізують шляхом цілої низки ефектів — це і зниження внутрішньоклубочкового тиску за рахунок дилатації здебільшого еферентних артеріол, і гальмування проліферації і гіпертрофії мезангіальних та епітеліальних клітин ниркових канальців і фібробластів, і зменшення синтезу компонентів мезангіального матриксу, і, нарешті, збільшення кровотоку в мозковому шарі нирок та зменшення проникності клубочкового фільтра [15].
Відомо, що нефропротекторна доза ІАПФ знач–но перевищує антипротеїнуричну та ще більше — антигіпертензивну [16–18]. Таким чином, призначаючи високі дози ІАПФ для інтенсивного контролю артеріального тиску, отримуємо додатковий корисний ефект у вигляді уповільнення прогресування хронічного захворювання нирок у дітей, а цілеспрямоване регулювання артеріального тиску до низького діапазону нормальних рівнів за рахунок високих доз ІАПФ надає ренопротекторну дію [17]. Вирішальне значення для запобігання або уповільнення прогресування до кінцевої стадії ниркової недостатності має вибір антигіпертензивних стратегій із найвищим нефропротекторним ефектом [20]. Оцінка ефективності терапії ІАПФ обґрунтовує використання цієї групи лікарських препаратів як заходів профілактики прогресування ХХН, доводячи можливість її оберненого розвитку в дітей на ранніх стадіях захворювання [14].
Мета дослідження: оцінити ефективність нефропротекторної терапії в дітей із хронічним пієлонефритом на основі аналізу стану ниркової гемодинаміки.
Матеріали та методи
Було проведено аналіз клінічних і параклінічних даних у 93 дітей віком від 4 до 17 років, які хворіють ХПН та перебувають у періоді ремісії з давністю захворювання від 3 до 7 років. Контрольну групу становили 30 здорових дітей аналогічного віку. Групи обстежених було сформовано за нозологічним принципом. Розподіл дітей за віком та статтю в основній (n = 93) та контрольній групах (n = 30) статистично не відрізнявся (р > 0,1). Діагноз ХПН встановлювався дітям, якщо ознаки запалення в нирках тривали більше ніж 3 місяці або за наявності 2–3 рецидивів пієлонефриту протягом 1 року від початку захворювання. У всіх обстежених ХПН не супроводжувався порушенням азотовидільної функції нирок.
Ниркову гемодинаміку вивчали на рівні ниркових артерій у ділянці воріт нирок, сегментарних й інтерлобарних артерій методом ультразвукового дослідження в режимі допплерографії ниркових судин (УЗДГ) за допомогою ультразвукового апарата Honda Electronics Co (Японія), визначаючи максимальну швидкість кровотоку в систолу ( Vmax, м/с), мінімальну — в діастолу ( Vmin м/с), усереднену за часом максимальну швидкість кровотоку впродовж усього серцевого циклу (TAMx, м/с), систолодіастолічне відношення (S/D), пульсаційний індекс (PI), індекс резистентності (IR). Ці індекси дозволяли оцінити стан периферичного опору судин. Підвищення значення цих індексів спостерігається при стенозах і спазмах судин, зниження — при вазодилатації й артеріовенозному шунтуванні. Систолодіастолічне відношення або систолічний індекс (S/D) — співвідношення пікової систолічної і кінцевої діастолічної швидкості. S/D був непрямим показником еластичності судинної стінки. Обчислювання проводили автоматично під час обробки допплерівських кривих.
Усім дітям здійснювалося добове моніторування АТ (ДМАТ) з оцінкою: середнього значення АТ (систолічного (САТ), діастолічного (ДАТ)), індексу часу; добового індексу за допомогою програмно-апаратного комплексу «Кардиотехника-04-АД-1» (ИНКАРТ, м. Санкт-Петербург, РФ). Всі параметри ДМАТ аналізували окремо за САТ і ДАТ для кожного часу доби (день, ніч) та в сукупності за добу. Діагностика і верифікація АГ у роботі ґрунтувались на Клінічних рекомендаціях скринінгу та лікування високого артеріального тиску в дітей та підлітків (2017) [21].
Упродовж 2–3 років всі пацієнти постійно отримували ІАПФ еналапріл, доза якого титрувалась індивідуально до максимально дозволеної та переносимої з урахуванням віку, ваги, частоти серцевих скорочень, рівня К у сироватці крові, індивідуальної переносимості препарату. Контроль стану проводився кожні 3–6 міс.
Математичне та статистичне опрацювання цифрового матеріалу здійснювалося на ПЕОМ за допомогою параметричних та непараметричних методів, що рекомендовані для медичних досліджень. Статистична обробка матеріалу проведена шляхом обчислення середньої арифметичної (М), помилки середньої (m) за допомогою біометричних методів аналізу. Порівняння сукупностей за кількісними показниками здійснювалося за допомогою дисперсного аналізу та розрахунку критерію Стьюдента (t) із подальшим визначенням рівня вірогідності відмінностей (р) за таблицями. Вірогідною вважали відмінність при р < 0,05.
Результати та обговорення
Аналіз показників ниркової гемодинаміки за даними УЗДГ у групі хворих на ХПН
Були виявлені виражені зміни ниркового кровотоку на рівні стовбурової і сегментарних артерій нирки. Порушення гемодинаміки на рівні стовбурової ниркової артерії проявлялись у вірогідному зниженні порівняно зі здоровими швидкісних показників Vmax в основ–ній та контрольній групах відповідно: 0,85 ± 0,04 і 1,15 ± 0,05, Vmin в основній та контрольній групах відповідно: 0,27 ± 0,04 і 0,37 ± 0,03, а також у зниженні індексів периферичного опору — вірогідному зниженні IR < 0,6 ум.од., PI < 1,2 ум.од. у 54,8 % дітей і показника S/D < 2,5 ум.од. у 42,5 % обстежених дітей, що може свідчити про включення механізму артеріовенозного шунтування (табл. 1).
Оцінюючи стан кровотоку на рівні сегментарної ниркової артерії, ми виявили статистично вірогідні відмінності між групами в зниженні індексів периферичного опору. У 40,8 % дітей основної групи відзначалося зниження S/D менше 2,5 ум.од., що свідчило про зниження судинного тонусу.
При допплерографічному дослідженні ниркового кровотоку на рівні інтерлобарної ниркової артерії статистично вірогідних відмінностей у показниках ниркового кровотоку в обстежених основної групи порівняно з групою контролю виявлено не було.
У катамнестичному спостереженні при аналізі середніх показників ниркового кровотоку було виявлено такі особливості. Під час лікування ІАПФ зміни насамперед відбувалися на рівні сегментарної артерії нирки, що виявлялось у вірогідному збільшенні показника Vmax, що становив 0,480 ± 0,007 та 0,60 ± 0,09 (р < 0,05) відповідно до та після лікування, показника S/D: 2,29 ± 0,01 та 2,42 ± 0,04 (р < 0,05) відповідно. Показник Vmin мав тенденцію до збільшення: 0,21 ± 0,03 та 0,20 ± 0,03 (р > 0,1) відповідно. Статистично вірогідних відмінностей у динаміці показників PI, IR та TAMХ на рівні сегментарної артерії нирки не зареєстровано (рис. 1).
На рівні стовбурової артерії нирки швидкісні показники Vmax та Vmin мали аналогічні зміни: так, Vmax після лікування вірогідно збільшувався (0,85 ± 0,04 та 0,99 ± 0,04; р < 0,05 відповідно до та після лікування), Vmin мав тенденцію до збільшення (0,27 ± 0,02 та 0,33 ± 0,06; р > 0,1 відповідно). Показник S/D вірогідно збільшувався (2,39 ± 0,04 та 2,71 ± 0,08; р < 0,05 відповідно) (рис. 2). Значення PI і IR, що на рівні стовбурової артерії нирки до лікування були вірогідно нижчими за норму (1,02 ± 0,03 та 0,60 ± 0,04), на початку лікування еналаприлом (через 6 місяців) були вірогідно вищими від норми, у динаміці (через 2–3 роки) набували тенденції до зниження і становили 1,28 ± 0,06 та 0,71 ± 0,03 відповідно. Такі зміни індексів можуть свідчити про зниження периферичної компенсаторної вазодилатації в нирках у відповідь на гіпоксію та розцінюватись як прогностично сприятлива ознака.
/49-1.jpg)
Виявлені зміни параметрів ниркової гемодинаміки при ХПН у дітей можуть свідчити про процеси ремоделювання судин у нирках у перебігу захворювання. За літературними даними, під час пристосування до ішемії, пов’язаної із запальним процесом у нирках, відбувається рефлекторне скорочення стінок ниркових артерій, та ємність даного відділу ренального кровоносного русла знижується, що, з одного боку, захищає його від перевантаження кров’ю, а з іншого — забезпечує адекватний режим живлення ренальної паренхіми й строми, а також кровонаповнення клубочків. З часом, незважаючи на включення ряду механізмів адаптації, що коригують порушений реальний кровоток, у нирках виникають і наростають патологічні зміни. Стінки ниркових артерій і вен піддаються склерозу, а іноді й гіалінозу, що призводить до зношування ренальних судин.
Аналіз показників ДМАТ у групі хворих на ХПН
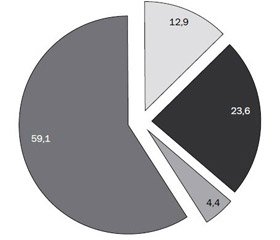
Більше ніж у половини пацієнтів (59,1 %) АТ знаходився в межах вікової норми. Підвищений АТ виявлений у 12,9 % пацієнтів, АГ — у 27,9 % випадків (рис. 3), за рахунок переважання АГ І ступеня — 23,6 %. Прихована АГ виявлялася в 17,2 % хворих. Артеріальна гіпотензія (значення АТ нижче 5-го перцентиля) у спостережуваних випадках не реєструвалася.
/49-2.jpg)
За даними результатів ДМАТ, добові профілі АТ хворих на ХПН загалом характеризувалися станом стійкої гіпертензії під час нічного періоду доби. Для 39,8 % обстежених були притаманні порушення циркадних ритмів АТ — відсутність належного зниження або навіть підвищення впродовж нічного періоду АТ порівняно з денними рівнями, переважно за типами non-dipper i night-peaker. Перевага ДАТ над САТ була відзначена під час виникнення епізодів раптових стрімких підвищень АТ, як правило, впродовж передранкових годин. Останні дані свідчать про більшу «агресивність» добового ритму ДАТ, що слугує критерієм несприятливого перебігу гіпертензивного синдрому у хворих на ХПН дітей. Ступінь порушень циркадних ритмів АТ у такої категорії хворих визначався ступенем АГ.
У катамнезі на фоні прийому ІАПФ у дітей із ХПН спостерігалось вірогідне зниження частоти і вираженості синдрому артеріальної гіпертензії за даними ДМАТ щодо початкових проявів із 27,9 до 6,9 % загалом (p < 0,05) (рис. 4).
Середній АТ продовжував зменшуватися протягом 3-річного періоду досліджень та досягнув цільового значення (< 50-го процентиля) у 79,6 % пацієнтів із ХПН. Інтенсивне регулювання АТ із цільовими 24-годинними рівнями в низькому діапазоні нормальних дає значну користь щодо функції нирок у дітей із ХПН. Досягнення цільового АТ є важливим незалежним предиктором затримки прогресування захворювання нирок.
Висновки
1. Хронічний пієлонефрит у дітей супроводжується поступовим розвитком порушень як центрального, так і периферичного кровообігу, ішемічних та гемодинамічних змін у паренхімі нирок, що можуть починатися досить рано і потребують проведення корекції.
2. Порушення ниркової гемодинаміки характеризуються переважно змінами ниркового кровотоку на рівні стовбурової і сегментарних артерій у вигляді зниження швидкісних показників та індексів периферичного опору більше ніж у половини пацієнтів (54,8 %).
3. Характерними особливостями добового моніторування артеріального тиску в пацієнтів із хронічним пієлонефритом є порушення циркадних ритмів артеріального тиску — 39,8 % дітей та артеріальної гіпертензії — 27,9 %.
4. Виявлені порушення гемодинаміки потребують своєчасного призначення нефропротекторної терапії. Препаратом вибору є ІАПФ еналаприл, включення в терапію якого супроводжувалося позитивною динамікою в більшості пацієнтів (75,2 %).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Иванов Д.Д. Следующий шаг в лечении хронической болезни почек / Д.Д. Иванов // Почки. — 2016. — № 2(16). — С. 10-13.
2. Макєєва Н.І. Ренокардіальний континуум у дітей з хронічним захворюванням нирок: «традиційні» та «нетрадиційні» чинники ризику формування кардіоваскулярних ускладнень / Н.І. Макєєва // Педіатрія, акушерство та гінекологія. — 2013. — № 1(455). — С. 20-24.
3. Vidi S.R. Role of hypertension in progression of chronic kidney disease in children / S.R. Vidi // Curr. Opin. Pediatr. — 2018. — № 30(2). — Р. 247-251. doi: 10.1097/MOP.0000000000000595. Режим доступа: https://www.ncbi.nlm.nih.gov/pubmed/29517980.
4. Hooman N. The prevalence of hypertension in children with renal scars / N. Hooman, R. Isa-Tafreshi, S.H. Mostafavi, F. Hallaji, A. Tavasoli, Н. Otukesh // Minerva Pediatr. — 2017. — № 69(3). — Р. 200-205. doi: 10.23736/S0026-4946.16.04217-1. Режим доступа: https://www.ncbi.nlm.nih.gov/pubmed/28452212.
5. Halbach S. Treatment of hypertension in children with chronic kidney disease / S. Halbach, J. Flynn // Curr. Hypertension Rep. — 2015. — № 17(1). — Р. 503. doi: 10.1007/s11906-014-0503-3. Режим доступа: https://www.ncbi.nlm.nih.gov/pubmed/25432895.
6. Flynn J.T. Blood pressure in children with chronic kidney di–sease: a report from the Chronic Kidney Disease in Children study / J.T. Flynn, M. Mitsnefes, С. Pierce et al. // Hypertension. — 2008. — № 52(4). — Р. 631-637. doi: 10.1161/HYPERTENSIONAHA.108.110635. Режим доступа: https://www.ncbi.nlm.nih.gov/pubmed/18725579.
7. Mitsnefes M. Masked hypertension associates with left ventricular hypertrophy in children with CKD / M. Mitsnefes, J. Flynn, S.Cohn et al. // J. Am. Soc. Nephrol. — 2010. — № 21(1). — Р. 137-144. doi: 10.1681/ASN.2009060609.https://www.ncbi.nlm.nih.gov/pubmed/19917781.
8. Tian J. Cardiovascular risks in chronic kidney disease pediatric patients / J. Tian, L. Niu, X. An. // Exp. Ther. Med. — 2017 Nov. — 14(5). — Р. 4615-4619. doi: 10.3892/etm.2017.5117. Режим доступа: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5704347.
9. Gallibois C.M. Hypertension in pediatric patients with chronic kidney disease: management challenges // Int. J. Nephrol. Renovasc. Dis. — 2017, Jul 26. — 10. — Р. 205-213. doi: 10.2147/IJNRD.S100891. Режим доступа: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5538700.
10. ESCAPE Trial Group, Wühl E. Strict blood-pressure control and progression оf renal failure in children / ESCAPE Trial Group, Е. Wühl, А. Trivelli, S. Picca et al. // N. Engl. J. Med. — 2009. — № 361(17). — Р. 1639-1650. doi: 10.1056/NEJMoa0902066. Режим доступа: https://www.ncbi.nlm.nih.gov/pubmed/19846849.
11. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease // Kidney Іnter. — 2013. — № 3. — Р. 1-150.
12. Иванов Д.Д. Блокаторы ренин-ангиотензин-альдостероновой системы: хроническая болезнь почек и сердечно-сосудистый риск / Д.Д. Иванов, А.В. Курята, И.П. Гармиш // Почки. — 2018. — № 2. — С. 13-21. doi: 10.22141 /2307-1257.7.2.2018.127393.
13. Horowitz B. Epidemiology of hypertension in CKD / B. Horo–witz, D. Miskulin, P. Zager // Adv. Chronic. Kidney Dis. — 2015. — № 22(2). — Р. 88-95. doi: 10.1053/j.ackd.2014.09.004. Режим доступа: https://www.ncbi.nlm.nih.gov/pubmed/25704344.
14. Зорин И.В. Профилактика прогрессирования хронической болезни почек у детей с рефлюкс-нефропатией / И.В. Зорин, А.А. Вялкова // Лечащий врач. — 2015. — № 1. — Режим доступа: http://www.lvrach.ru/2015/01/15436145.
15. Нагорная Н.В. Ингибиторы АПФ. Возможность применения в педиатрической практике / Н.В. Нагорная, С.А. Паршин // Здоровье ребенка. — 2010. — № 3(24). — Режим доступа: http://www.mif-ua.com/archive/article_print/13000.
16. Іванов Д.Д. Нефрологія в практиці сімейного лікаря: Навчально-методичний посібник. — 2-ге вид., переробл. / Д.Д. Іванов, О.М. Корж. — Донецьк: Видавець Заславський О.Ю., 2012. — 400 с.
17. Ruggenenti P. Achieving remission of proteinuria in childhood CKD / P. Ruggenenti, P. Cravedi, А. Chianca, М. Caruso, G. Remuzzi // Pediatr. Nephrol. — 2017. — № 32(2). — Р. 321-330. doi: 10.1007/s00467-016-3495-1. Режим доступа: https://www.ncbi.nlm.nih.gov/pubmed/27704256.
18. Webb N.J. Losartan and enalapril are comparable in reducing proteinuria in children / N.J. Webb, S. Shahinfar, T.G. Wells et al. // Lam. C. Kidney Int. — 2012. — № 82(7). — Р. 819-26. doi: 10.1038/ki.2012.210. Epub 2012, Jun 27. Режим доступа: https://www.ncbi.nlm.nih.gov/pubmed/22739977.
19. Зайцев И.И. Ренопротективный эффект ингибитора ангиотензинпревращающего фермента при патологии почек у детей / И.И. Зайцев, Д.А. Александров // Медицинский журнал. — 2013. — № 2. — С. 87-89.
20. Cravedi P. Which antihypertensive drugs are the most nephroprotective and why? / P. Cravedi, P. Ruggenenti, G. Remuzzi // Expert Opin. Pharmacother. — 2010. — № 11(16). — Р. 2651-2663. doi: 10.1517/14656566.2010.521742. Режим доступа: https://www.ncbi.nlm.nih.gov/pubmed/20977400.
21. Flynn J.T. Clinical Practice Guideline for Screening and Management of High Blood Pressure in Children and Adolescents / J.T. Flynn, D.C. Kaelber, C.M. Baker-Smith et al. // Pediatrics. — 2017. — V. 140, № 3. — Р. 1-72. e20171904. Режим доступа: http://pediatrics.aappublications.org/content/pediatrics/early/2017/08/21/peds.2017-1904.full.pdf.

/48-1.jpg)
/49-1.jpg)
/49-2.jpg)
/50-1.jpg)