Введение
22 мая 2016 года в рамках Американской гастроэнтерологической недели, которая состоялась в городе Сан-Диего (США), произошло событие, которое ведущими гастроэнтерологами мира сразу же было названо «самой ожидаемой гастроэнтерологической новостью» последних лет: были уточнены и пересмотрены Римские критерии диагностики, то есть состоялась презентация так называемого Римского консенсуса IV. Необходимость пересмотра критериев функциональных нарушений, существовавших ранее, назрела достаточно давно и была очевидна всем специалистам в области гастроэнтерологии, и основанием для подобного пересмотра послужили результаты множественных исследований, которые проводились на протяжении десяти лет в разных странах мира.
Само понятие функциональных гастроинтестинальных расстройств (ФГР) много раз менялось в зависимости от общественных взглядов на природу различных заболеваний, уровня развития научных знаний, имеющихся научных доказательств, уровня подготовки и квалификации клиницистов: у нас существует множество определений ФГР, от классического определения D. Drossman (1994), в котором говорилось о том, что ФГР представляют собой «разнообразную комбинацию гастроинтестинальных симптомов без структурных или биохимических нарушений», до определения, которое предлагал нам предыдущий, III Римский консенсус. Приходится признать, что уязвимость всех определений ФГР заключается в их зависимости от текущего уровня наших знаний и возможностей методов исследования, которые, возможно, не позволяют выявить те или иные структурные или другие нарушения, заставляя ученых время от времени пересматривать свои взгляды на природу ФГР. И благодаря тому, что в последние десятилетия изучение функциональных гастроинтестинальных расстройств в значительной мере проводили с позиций нейрогастроэнтерологии и на основании исследований, проведенных в этой области, удалось уточнить данные о значении ЦНС и периферической нервной системы как в функционировании, так и в регуляции моторики органов желудочно-кишечного тракта (ЖКТ). Римский консенсус IV пересмотра, благодаря тому багажу знаний, который появился на сегодняшний день, произвел наиболее принципиальную реформу — реформу самого подхода к функциональной патологии, результатом чего стало практически полное исключение слова «функциональный» из медицинской терминологии. Согласно последним рекомендациям, с 2016 года корректным будет использование термина «нарушения цереброинтестинального взаимодействия» или «центральноопосредованного взаимодействия», т.е. с недавних пор подчеркивается преимущественный вклад нарушений со стороны ЦНС в формирование симптомов гастроинтестинальных расстройств [1].
В связи с новой расстановкой акцентов экспертам, участвовавшим в формулировании Римского консенсуса IV, пришлось пойти на не очень популярные среди практикующих врачей меры — пересмотреть названия и определения как ФГР в целом, так и многих вполне конкретных распространенных функциональных расстройств. Обновленная классификация ФГР, предложенная Римским консенсусом IV, содержит 33 нозологические единицы, описанные для взрослых пациентов, и 20 расстройств, наблюдающихся в педиатрической практике (полностью все материалы Римских критериев IV опубликованы в большом двухтомном руководстве, а основные статьи — в специализированном выпуске журнала «Gastroenterology» (Vol. 150, № 6, May 2016)) [2]. Однако все изменения и поправки, описанные для педиатрической практики, не коснулись группы, рассматривающей функциональные расстройства, характерные для новорожденных и детей младшего возраста, так называемой группы G. Ни одно терминологическое изменение не было внесено в эту группу, сохранили свою легитимность определения всех семи ФГР, среди которых есть и привычные «функциональная диарея» (G5) и «функциональный запор» (G7). Это было, безусловно, осознанное и оправданное решение; эксперты, участвовавшие в формулировании Римского консенсуса IV, вне всяких сомнений, осознавали всю неспецифичность данных определений, но в данном случае употребление термина «функциональный» позволяет разграничить расстройства, имеющие сходные симптомы, но протекающие с явными структурными нарушениями.
Действительно, одной из наиболее частых жалоб родителей как в периоде новорожденности, так и в любом другом возрастном периоде являются жалобы на нарушения или затруднения актов дефекации, наиболее частым из которых является запор. За первое десятилетие XXI века только в США частота запоров среди всего населения увеличилась в 4 раза, наибольшее число обращений к врачу зафиксировано у детей в возрасте до 15 лет; пациентам с диагнозом «запор» было выписано 5,4 миллиона рецептов, что свидетельствует о растущей актуальности данной проблемы для детей всего мира [3].
Причины развития диареи и запора многообразны и не обязательно связаны с патологией пищеварительной системы. В результате практический врач зачастую назначает курс лечения исключительно симптоматически, исходя из факта существования диареи или запора, но без учета механизмов их развития и особенностей действия лекарственного препарата. Такое лечение в лучшем случае неэффективно, а в худшем — может нанести существенный вред здоровью больного. Какова бы ни была причина диареи или запора, каким бы заболеванием они ни были вызваны, нутрициологические аспекты — универсальный ключ к решению проблемы функциональных гастроинтестинальных расстройств.
Наши многолетние наблюдения за детьми, страдающими нарушениями акта дефекации, подтверждают, что в подавляющем большинстве случаев хронические запоры у детей раннего возраста носят алиментарный характер и связаны с нарушениями моторно-эвакуаторной функции толстой кишки в результате дискоординации тонических и пропульсивных сокращений стенки кишечника [4]. Такая дискоординация может быть как спастической (протекать по типу гипермоторной дискинезии, т.е. сопровождаться появлением фрагментированного, плотного, «овечьего» кала и схваткообразными болями в животе), так и гипокинетической (гипомоторная дискинезия, сопровождающаяся формированием фекаломы большого размера, значительно превышающей по диаметру размеры анального сфинктера, и ноющими болями разлитого характера). Факторы риска развития функциональных запоров у детей раннего возраста различны и чаще всего, в случаях естественного вскармливания, связаны с неправильным режимом и характером питания кормящей матери, а в случаях искусственного вскармливания — с недостаточным питьевым режимом, быстрым одномоментным переходом на искусственное вскармливание, форсированным переходом с одной смеси на другую и использованием молочных смесей с малоадаптированным жировым компонентом [4].
Безусловно, материнское молоко считается лучшим вариантом детского питания [5]. На сегодняшний день накоплена масса доказательств того, что грудное молоко содержит множество биологически активных веществ, регулирующих функцию желудочно-кишечного тракта и иммунной системы, а также принимающих непосредственное участие в развитии мозга. Таким образом, грудное молоко является уникальнейшей биологической жидкостью, необходимой для оптимального роста и развития младенцев. В недавно проведенных исследованиях также было продемонстрировано, что грудное молоко обладает программирующим действием, предупреждающим развитие некоторых тяжелых метаболических патологий у взрослых (в частности, ожирения и диабета второго типа) [6].
Всемирная организация здравоохранения рекомендует исключительно грудное вскармливание в течение первых шести месяцев жизни [7]. Американская академия педиатрии также рекомендует кормить грудью не менее 12 месяцев [8]. В недавно обновленной миссии ВОЗ идет речь о том, что исключительно грудное вскармливание обеспечивает оптимальное питание и защиту здоровья в течение первых шести месяцев жизни, а после шести месяцев (по меньшей мере до 12 месяцев) при введении продуктов прикорма является идеальным кормлением для младенцев [5]. В дополнение к своему питательному преимуществу грудное вскармливание является удобным и недорогим, а также обладающим протективными свойствами, в том числе и в профилактике развития ФГР, способом питания.
При этом, согласно статистическим данным ВОЗ (2014), распространенность грудного вскармливания до 6 месяцев в Украине вследствие различных причин составляет только 20 %. Поэтому при невозможности естественного вскармливания необходимо использование адаптированной смеси. Наиболее часто при искусственном вскармливании используют смеси на основе коровьего молока. Однако, несмотря на широкое использование коровьего молока в питании детей, особый интерес издавна привлекало к себе козье молоко. Около 20 лет назад в различных странах начали производить смеси для детей на основе козьего молока. Были проведены исследования, указывающие на возможность использования смесей на основе козьего молока в питании детей раннего возраста в качестве альтернативы смесям на основе коровьего молока [9, 10].
Данные литературы свидетельствуют о том, что более 70 % произведенного молока составляет козье, поэтому оно широко используется в различных регионах мира [11]. Козье молоко в течение многих веков используется для лечения больных анемией, рахитом, туберкулезом. Козы, в отличие от коров, реже болеют и не страдают такими инфекционными болезнями, как туберкулез и бруцеллез. Свежевыдоенное молоко козы, благодаря своим бактерицидным свойствам, длительно сохраняется свежим и не скисает. Подобно женскому молоку, козье молоко имеет апокриновый тип секреции, характеризующийся частичным разрушением клетки и проникновением в молочные протоки клеточного содержимого с биологически активными веществами. Для коровьего молока характерен мерокриновый тип секреции с сохраняющимися клетками молочных протоков. За счет этих особенностей в козьем молоке содержится больше биологически активных веществ (нуклеотиды, аминокислоты, факторы роста, лизоцим и др.), которые нормализуют функциональное состояние слизистой оболочки желудочно-кишечного тракта [12].
Выявлена некоторая схожесть белковых составляющих козьего и грудного молока. Козье и коровье молоко относятся к так называемым казеиновым видам молока. При наличии примерно одинакового соотношения казеина и сывороточного белка их фракционный состав различается. Основной казеиновый белок козьего молока — β-казеин, коровьего — α-s1-казеин; сывороточный белок козьего молока — α-лактальбумин, а коровьего — β-лактоглобулин. Белковый состав козьего молока способствует образованию в желудке меньшего по размерам и менее плотного сгустка. Козье молоко содержит большое количество незаменимых аминокислот с преобладанием треонина, валина, изолейцина, но меньше лейцина, чем коровье и женское молоко [13–15].
Жиры козьего молока также отличаются от жиров коровьего молока: жировые глобулы их более мелкие, чем коровьи, и не слипаются, что способствует хорошему пищеварению. В жирах козьего молока высокое содержание эссенциальных жирных кислот и повышена концентрация среднецепочечных жирных кислот, поэтому они могут проникать в кровеносное русло и хорошо усваиваются детьми с различными функциональными нарушениями желудочно-кишечного тракта [16, 17].
Основным углеводом козьего молока является лактоза и небольшое количество олигосахаридов. Олигосахариды не расщепляются и не усваиваются в верхних отделах ЖКТ, но ферментируются микрофлорой толстого кишечника и стимулируют ее рост и жизнедеятельность в козьем молоке в 10 раз интенсивнее, чем в коровьем [18–21].
Витаминный состав козьего молока отличается от коровьего большим количеством витаминов А, D и РР и меньшим — фолиевой кислоты. Микроэлементный состав характеризуется большим количеством Са, К, Fe, однако уровень усвоения железа козьего молока уступает его усвоению в женском молоке.
Вышеперечисленные преимущества козьего молока позволяют использовать его в качестве основы для создания адаптированных молочных смесей — современных заменителей женского молока. Благодаря технологическим особенностям производства смеси «Нэнни» удается сохранить все наиболее важные компоненты натурального козьего молока и максимально приблизить смеси к грудному молоку [18].
Данная смесь является сбалансированным заменителем грудного молока и содержит полноценный белок цельного козьего молока со всем спектром незаменимых и заменимых аминокислот, максимально приближенных к составу женского молока; жир с большим количеством среднецепочечных жирных кислот, жирорастворимых витаминов и пальмитата. В смеси имеется оптимальное соотношение молочного жира и высококачественных растительных масел без добавления пальмового масла. Смеси «Нэнни» также дополнительно обогащены витаминами, микро- и макроэлементами, полиненасыщенными жирными кислотами (ω-3 и ω-6) и другими важными биологически активными компонентами. Наряду с комплексом пищевых волокон-пребиотиков они содержат длинноцепочечные полиненасыщенные жирные кислоты, способствующие снижению активности воспалительных процессов.
Особенно актуальными вышеозначенные особенности состава заменителя грудного молока (ЗГМ) становятся тогда, когда речь идет о детях, имеющих те или иные функциональные гастроинтестинальные расстройства, — в данном случае речь идет о функциональном запоре. Крайне важным вопросом в плане профилактики функциональных запоров также являются особенности жирового компонента, представленного в смесях. Известно, что и в грудном молоке, и в его заменителях примерно 45–50 % энергии аккумулировано именно в жирах, которые в современных смесях содержатся в таком же количестве, как и в грудном молоке, но существенно отличаются от последнего профилем содержащихся жирных кислот. В грудном молоке основная насыщенная жирная кислота — пальмитиновая кислота — находится в физиологичной бета-позиции прикрепления к молекуле триглицерида, тогда как обычные смеси часто содержат пальмитиновую кислоту в альфа-позиции, что имеет существенное значение для переваривания, абсорбции и последующего метаболизма жира. Если пальмитиновая кислота находится в альфа-позиции, то в кишечнике под действием панкреатической липазы она высвобождается, связывает кальций и образует нерастворимые жирнокислые мыла, которые в последующем выводятся из организма вместе с калом. При этом существенно уменьшается всасывание жиров, снижается энергетическая ценность смеси, уменьшается всасывание кальция, что приводит к нарушению минерализации костей, а кроме того, кальциевые мыла жирных кислот меняют консистенцию испражнений, существенно уплотняя и «цементируя» последние, что нарушает перистальтику и часто приводит к формированию функциональных запоров. В то же время пальмитиновая кислота, эстерифицированная в бета-позиции молекулы глицерина, эффективно увлекается энтероцитами слизистой оболочки кишок как моноглицерид без предварительного расщепления, не меняет консистенцию испражнений, способствует повышенному всасыванию кальция, необходимого для минерализации костей, и используется как важный энергетический субстрат детского питания [4].
Козье молоко само по себе является источником натурального пальмитата в β-положении (таком же, в котором пальмитиновая кислота находится и в грудном молоке), что способствует естественной профилактике запоров, в том числе и у детей грудного и младшего возраста. Технология производства смесей «Нэнни» позволяет сохранить в них молочный жир, который хорошо усваивается незрелым ЖКТ ребенка, что обусловлено небольшим размером жировых глобул козьего молока, содержанием среднецепочечных жирных кислот и наличием достаточного количества β-пальмитата, что, безусловно, является неоспоримым преимуществом данного ЗГМ по сравнению со стандартными формулами, особенно тогда, когда речь идет о коррекции функционального запора и функциональной дишезии.
Также на сегодняшний день хорошо известно, что особенно благоприятное воздействие на детей, склонных к запору, производят смеси, обогащенные пребиотиками, — галактоолигосахаридами и фруктоолигосахаридами. Помимо того что пребиотические волокна вносят существенный вклад в формирование здоровой кишечной микрофлоры, улучшая трофику эпителиоцитов, они благоприятствуют нормализации перистальтической активности ЖКТ и способствуют формированию регулярного мягкого стула. Эксперты комитета ESPGHAN (Европейского общества педиатрической гастроэнтерологии, гепатологии и нутрициологии) в своем систематическом обзоре, посвященном изучению эффективности и безопасности дополнительного включения в состав молочных смесей пребиотиков (2011), отметили, что молочные смеси, обогащенные пребиотиками, достоверно снижают рН каловых масс, повышают частоту опорожнения кишечника, смягчают каловые массы, увеличивают количество бифидобактерий и лактобацилл в составе кишечной микрофлоры, поэтому введение их в рацион ребенка, страдающего запорами функционального происхождения, должно начинаться с момента рождения [4]. Таким образом, пребиотический комплекс Orafti® Synergy-1, включенный в состав смесей «Нэнни», способствует восстановлению нормального баланса микрофлоры, стимулируя рост бифидо- и лактобактерий, и улучшению функции пищеварительной системы, способствуя размягчению стула, уменьшая частоту запоров, метеоризм и снижая рН кала, что приводит к облегчению дефекации и снижению заболеваемости кишечными инфекциями [22].
Цель работы: оценить клиническую эффективность смеси «Нэнни-1» с пребиотиками у детей первого полугодия жизни с функциональными запорами.
Материалы и методы
Под наблюдением пребывало 64 ребенка обоих полов в возрасте от 1 до 6 месяцев с функциональными запорами, которые в силу различных причин находились на искусственном вскармливании. Дети были распределены на 2 группы: 32 ребенка получали адаптированную смесь на основе козьего молока «Нэнни-1» с пребиотиками (1-я группа) и 32 ребенка получали смесь на основе коровьего молока с пребиотиками (2-я группа). Длительность приема смеси составила 1 месяц. Группа контроля включала 15 детей, находящихся на грудном вскармливании (ГВ).
Критериями включения детей в исследование были:
— наличие функционального запора (согласно Римским критериям IV);
— нахождение детей на искусственном вскармливании к моменту начала исследования;
— добровольное информированное согласие родителей;
— отсутствие антибиотикотерапии на момент начала исследования.
Критерии невключения:
— наличие прикорма в рационе ребенка, введенного ранее 6 месяцев;
— наличие подтвержденной органической патологии;
— продолжающаяся антибиотикотерапия на момент начала исследования.
Критерии исключения:
— наличие у детей верифицированной органической патологии толстой кишки;
— наличие острых кишечных инфекций во время проведения клинического наблюдения;
— применение других медикаментов, влияющих на кишечный транзит и консистенцию кала;
— желание родителей прекратить свое участие в исследованиях;
— несоблюдение родителями правил участия в исследованиях, переход на другую смесь;
— наличие вторичного запора.
Клиническую эффективность смеси оценивали по общеклиническим признакам переносимости (наличие аппетита и объемы съедаемой смеси).
Еженедельно проводилась оценка динамики массы и роста ребенка. В начале и в конце исследования оценивали нервно-психическое развитие ребенка, состояние кожных покровов и придатков кожи. Были проведены лабораторные исследования: анализ крови клинический, копрологическое исследование, посев кала на микрофлору. Ежедневно регистрировали наличие функциональных гастроинтестинальных расстройств. В начале исследования все дети были практически здоровы, их масса тела и рост соответствовали возрастным нормам. Прикорм дети обеих групп не получали. Отставание в физическом развитии было выявлено в 1-й группе у одного ребенка, избыточная масса тела — у 2 пациентов 2-й группы.
Результаты и обсуждение
Переход на новую смесь производили постепенно, увеличивая до необходимого объема. Все дети хорошо переносили адаптированные смеси, отказа от приема питания не было.
У пациентов обеих групп в возрасте от 1 до 4 месяцев отмечалось стабильное увеличение массы тела в течение первых 2 недель на 190–210 г, затем на 200–220 г в последующие 2 недели; прибавка в росте составляла 2,5–3 см в месяц. У детей от 4 до 6 месяцев прибавка массы тела составила 170–190 г в неделю, прибавка в росте — 2–2,5 см в месяц. Различий массоростовых показателей в 1-й и 2-й группах детей не выявлено. У детей контрольной группы прибавка массы тела была несколько выше, однако достоверных различий выявлено не было.
Функциональные гастроинтестинальные расстройства (колики, метеоризм, срыгивания или их сочетания) в начале исследования имели место более чем у половины пациентов из наблюдаемых групп. Проявления и атопического и себорейного дерматита в виде зуда, умеренной сухости и шелушения кожных покровов и себорейных корочек волосистой части головы выявлены у четырех детей из группы, получающей смесь «Нэнни-1» с пребиотиками, и пяти детей второй группы.
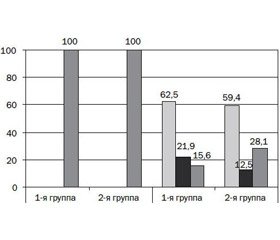
Частота функциональных гастроинтестинальных нарушений в начале исследования была примерно одинаковой в обеих группах детей: кишечные колики у 68,8 и 71,2 %, срыгивания у 59,4 и 56,3 %, метеоризм у 59,4 и 62,5 % соответственно (рис. 1). Группа детей, находящихся на естественном вскармливании, была сопоставима по наличию функциональных гастроинтестинальных нарушений: срыгивания отмечены у 9 детей (60 %), кишечные колики у 10 (66,7 %), метеоризм у 9 (60 %) детей, периодические запоры отмечались у всех младенцев.
Через 1 месяц после приема смеси «Нэнни-1» с пребиотиками снизилась частота функциональных нарушений пищеварения у младенцев первой группы — метеоризм с 59,4 до 15,6 %, срыгивания с 59,4 до 21,9 % случаев, кишечные колики с 68,8 до 18,8 % случаев. Проявления запоров исчезли на 7-е сутки у 12 детей, на 14 сутки — еще у 9 детей, через 1 месяц запоры сохранялись у 5 пациентов (15,6 %) (р < 0,05).
У детей, получавших смесь на основе коровьего молока с пребиотиками, проявления метеоризма уменьшились с 62,5 до 25,0 %, срыгиваний — с 56,3 до 37,5 % случаев, кишечных колик — с 71,9 до 25,0 %; запоры по окончании наблюдения сохранялись у 9 (28,1 %) младенцев.
Число детей с положительной динамикой гастроинтестинальных расстройств, получавших смесь на основе коровьего молока, было меньше, чем в 1-й группе. Положительная динамика наблюдения в группе детей на ГВ соответствовала динамике первой группы.
Следует отметить исчезновение элементов дерматитов у 3 детей, получавших смесь «Нэнни-1» с пребиотиками, что соответствует данным о протективном составе этого ЗГМ и данным литературы [23–26].
Исследование показателей крови клинических не выявило отклонений от возрастной нормы, но у 3 детей из 1-й группы и 2 из 2-й группы выявлена эозинофилия более 5 %. Показатели крови детей из контрольной группы находились в пределах возрастных величин.
При макроскопической оценке стула до начала исследования у большинства детей каловые массы имели плотную, замазкообразную (реже мягкую) консистенцию, зеленовато-желтый или зеленый цвет, иногда присутствовали непереваренные комочки. Акт дефекации сопровождался натуживанием и беспокойством ребенка. У большинства младенцев при употреблении смеси на основе козьего молока с содержанием пребиотического комплекса происходило регулярное мягкое опорожнение кишечника, улучшилась консистенция стула (чаще кашицеобразная) (78,1 %), количество дефекаций составило 1–3 в сутки у большинства детей (84,4 %) к концу исследования, у 5 детей из этой группы (15,6 %) сохранялись запоры. В группе получавших смесь на основе коровьего молока мягкая консистенция кала отмечена в 56,3 % случаев, частота дефекаций до 1–2 раз в сутки отмечена у 59,3 % детей, до 3 раз в сутки — у 12,5 %. Запоры сохранились у 9 младенцев (28,1 %) (рис. 2, 3).
/22-1.jpg)
При проведении копрологического исследования было выявлено преобладание стеатореи II типа (жирные кислоты, мыла), реже выявлена стеаторея I типа (нейтральный жир), отмечено наличие слизи, крахмала, йодофильной флоры в обеих группах (рис. 4).
В целом же копрологическое исследование не выявило достоверных различий между двумя группами. У детей контрольной группы данные копрологического исследования практически не отличались от данных детей 1-й и 2-й групп.
При исследовании кишечного биоценоза определялось незначительное снижение количества лакто- и бифидобактерий, E.coli (типичные, лактозонегативные), выявляли грибы рода Candida у детей обеих групп (табл. 1).
Выявленные изменения количества кишечной микрофлоры могут косвенно свидетельствовать о наличии транзиторного дисбиоза (у детей первых месяцев жизни). При повторном исследовании выявлено улучшение показателей микробиоценоза кишечника. Сниженное количество бифидобактерий сохранялось у 11 детей первой группы и 12 — второй группы, лактобактерий — у 6 детей первой группы и 10 — второй группы.
Выводы
На сегодняшний день накоплено уже достаточное количество научных фактов, подтверждающих тесную взаимосвязь между едой и здоровьем, в том числе и долговременным [27–29]. Появились полноценные многокомпонентные и многофункциональные заменители грудного молока, которые позволяют предупреждать формирование затрудненного акта дефекации или способствуют смягчению и учащению стула при уже имеющихся функциональных запорах.
Данные проведенного наблюдения свидетельствуют о хорошей переносимости смеси «Нэнни-1» с пребиотиками. Ее использование в питании грудных детей обеспечивает потребности детей в основных пищевых веществах, стабильную прибавку массы тела, сопоставимую с развитием детей на грудном вскармливании, что несомненно свидетельствует о нормальном физическом развитии наблюдаемой группы. Отмечено, что применение смеси «Нэнни-1» с пребиотиками улучшает консистенцию и характеристики стула, способствует уменьшению частоты функциональных запоров и других гастроинтестинальных нарушений.
Конфликт интересов. Не заявлен.
Список литературы
1. Ткач С.М. Римские критерии IV функциональных гастроинтестинальных расстройств: что нового в последней версии / С.М. Ткач // Сучасна гастроентерологія. — 2016. — № 4. — С. 116-122.
2. Hyman P.E., Milla P.J., Benninga M.A. et al. Childhood Functional Gastrointestinal Disorders: Neonate/Toddler // Gastroenterology. — 2016. — 130 (5). — 1519-1526.
3. Everhart J.E., Ruhl C.E. Burden of digestive diseases in the United States part II: lower gastrointestinal diseases // Gastroenterology. — 2009. — 136. — 741-754.
4. Белоусова О.Ю. Современный взгляд на функциональные запоры у детей раннего возраста: особенности вскармливания и принципы немедикаментозной коррекции // Здоровье ребенка. — 2015. — № 1 (60). — С. 140-153.
5. Lessen R., Kavanagh K. Position of the academy of nutrition and dietetics: Promoting and supporting breastfeeding // J. Acad. Nutr. Diet. — 2015. — 115. — 444-449. doi: 10.1016/j .jand. 2014. 12.014. [PubMed][Cross Ref]
6. Savino F., Bebetti S., Lignori S.A., Sorrenti M., Cordero D., Montezemolo L. Advances on human milk hormones and protection against obesity // Cell. Mol. Biol. — 2013. — 59. — 89-98. [PubMed]
7. Eidelman A.I., Schanler R.J., Johnston M., Landers S., Noble L., Szucs K., Viehmann L. Breastfeeding and the use of human milk // Pediatrics. — 2012. — 129. — e827-e841.
8. Kozhimannil K.B., Jou J., Attanasio L.B., Joarnt L.K., McGovern P. Medically complex pregnancies and early breastfeeding behaviors: A retrospective analysis // PLoS ONE. — 2014. — 9. — 279. doi: 10.1371/journal.pone.0104820. [PMC free article] [PubMed] [Cross Ref]
9. Боровик Т.Э. и др. Опыт применения детской адаптированной смеси на основе козьего молока в питании здоровых детей первого полугодия жизни // Вопросы современной педиатрии. — 2014. — № 13 (2). — С. 44-54.
10. Войтова Е.В., Микульчик Н.В. Использование козьего молока и новых формул на его основе в питании детей раннего возраста // Международные обзоры: клиническая практика и здоровье. — 2015. — № 3. — С. 18-37.
11. Булатова Е.М., Шестакова М.Д., Пирцхелева Т.Л. Эффективность использования специализированных продуктов на основе козьего молока для вскармливания детей раннего возраста: Метод. рекомендации. — СПб., 2006. — 20 с.
12. Маланичева Т.Г. Рациональное питание ребенка первого года жизни, заболевания желудочно-кишечного тракта, билиарной системы и органов дыхания. Часть 1. — Казань, 2013. — С. 69.
13. К вопросу о возможности использования козьего молока и адаптированных смесей на его основе в детском питании / Т.Э. Боровик, Н.Н. Семенова, О.Л. Лукоянова, Н.Г. Звонкова, В.А. Скворцова, И.Н. Захарова, Т.Н. Степанова // Вопросы современной педиатрии. — 2013. — № 1. — С. 8-16.
14. Тутельян В.А. Детское питание: Руководство для врачей. — М.: МИА, 2015. — С. 309-311.
15. Haenlein G.F.H. Goat milk in human nutrition // Small Ruminant Research. — 2004. — № 51. — С. 155-63.
16. Скидан И.Н. Жировые глобулы как детерминанты пищевой и биологической ценности козьего молока // Вопросы питания. — 2015. — 84 (2).
17. Zou X., Huang J., Jin Q., Guo Z., Lin Y., Cheong L., Xu X., Wang X. Lipid composition analysis of milk fats from different mammalian species: Potential for use as human milk fat substitutes // J. Agric. Food Chem. — 2013. — 61. — 7070-7080. doi: 10.1021/jf401452y. [PubMed] [Cross Ref]
18. Проссер К. Состав детских формул на основе козьего молока, результаты клинической эффективности и безопасности их применения у детей // Рос. вестн. перинатол. и педиатр. — 2013. — № 5. — С. 15-22.
19. Albrecht S., Lane J.A., Marino K., Al Busadah K.A., Carrington S.D., Hickey R.M., Rudd P.M. A comparative study of free oligosaccharides in the milk of domestic animals // Br. J. Nutr. — 2014. — 111. — 1313-1328. doi: 10.1017/S0007114513003772. [PubMed] [Cross Ref]
20. Musilova S., Rada V., Vlkova E., Bunesova V. Beneficial effects of human milk oligosaccharides on gut microbiota // Benef. Microbes. — 2014. — 5. — 273-283. doi: 10.3920/BM2013.0080. [PubMed] [Cross Ref]
21. Oozeer R., Van Limpt K., Ludwig T., Ben Amor K., Martin R., Wind R.D., Boehm G., Knol J. Intestinal microbiology in early life: Specific prebiotics can have similar functionalities as human-milk oligosaccharides // Am. J. Clin. Nutr. — 2012. — 98. — 561S-571S. doi: 10.3945/ajcn.112.038893. [PubMed][Cross Ref]
22. Казначеев К.С. и др. Влияние молочной смеси с пребиотиками на основе новозеландского козьего молока на формирование здорового пищеварения у детей первого года жизни // Лечащий врач. — 2015. — № 9. — С. 37-41.
23. Michaelsen K.F., Greer F.R. Protein needs early in life and long-term health // Am. J. Clin. Nutr. — 2014. — 99. — 718S-722S. doi: 10.3945/ajcn.113.072603. [PubMed] [Cross Ref]
24. Hochwallner H., Schulmeister U., Swoboda I., Spitzauer S., Valenta R. Cow’s milk allergy: From allergens to new forms of diagnosis, therapy and prevention // Methods. — 2014. — 66. — 22-33. doi: 10.1016/j.ymeth.2013.08.005. [PMC free article] [PubMed] [Cross Ref]
25. Nowak-Wegrzyn A., Kate Y., Soneil Mehr S., Koletzkon S. Non-lgE-mediated gastrointestinal food allergy // J. Allergy Clin. Immunol. — 2015. — 135. — 1114-1124. doi: 10.1016/j.jaci.2015.03.025. [PubMed][Cross Ref]
26. EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA); Scientific Opinion on the suitability of goat milk protein as a source of protein in infant formulae and in follow on formulae // EFSA J. — 2012. — № 10 (3). — P. 2603.
27. Camilia R. Martin, Pei-Ra Ling, George L. Blackburn. Review of Infant Feeding: Key Features of Breast Milk and Infant Formula // Nutrients. — 2016. — 8 (5). — 279. Published online 2016 May 11. doi: 10.3390/nu8050279. PMCID: PMC4882692
28. Марушко Ю.В., Московенко О.Д. Использование молочных смесей на основе козьего молока для вскармливания детей первого года жизни // Современная педиатрия. — 2017. — № 3 (83). — С. 76-82.
29. Turck D. Cow’s milk and goat’s milk // World Rev. Nutr. Diet. — 2013. — 108. — 56-62. PMID: 24029787 DOI:10,1159 / 000351485[PubMed]

/21-1.jpg)
/22-1.jpg)
/23-1.jpg)