Вступ
Основною групою лікарських засобів, що застосовуються в медичній практиці при лікуванні болю й запалення будь-якого генезу, особливо у хворих з ураженням опорно-рухового апарату, є нестероїдні протизапальні препарати (НПЗП). НПЗП є основним засобом для лікування болю в пацієнтів з остеоартрозом (ОА), болем у нижній частині спини, ревматоїдним артритом, анкілозивним спондилітом, реактивними артритами, а також після операційних втручань.
Особливе місце серед НПЗП посідає німесулід, він має ряд переваг, серед яких — слабка кумуляція в організмі, селективне пригнічення активності циклооксигенази-2 (ЦОГ-2), мультифакторний вплив на запалення, антирадикальна активність, антибрадикініновий та антигістамінний ефекти тощо. Саме ці ефекти, а також хіміко-фізичні характеристики німесуліду забезпечують йому специфічність дії й чітко визначають місце застосування [15].
Одна з таких характеристик — фізико-хімічна структура, що обумовлює фармакокінетику, у тому числі рівень шлунково-кишкової абсорбції, захоплення запаленими синовіальними клітинами й проникнення в синовіальну рідину. Німесулід — похідне сульфонаніліду, має оригінальну структуру, що складається з 2 ароматичних кілець і метилсульфонілової групи, які визначають відносно високу константу іонізації (рКа 6,5) і помірну ліпофільність препарату. Саме кислотність є запорукою шлунково-кишкової безпеки німесуліду.
Те, що однією з головних переваг німесуліду є знач-но менший ризик розвитку серйозних ускладнень з боку шлунково-кишкового тракту (не менше ніж у 2 рази) порівняно з традиційними НПЗП, показано неодноразово. За даними добре відомого популяційного дослідження [7], проведеного в Північній Італії, ускладнення з боку шлунково-кишкового тракту у хворих, які приймали німесулід, стали причиною подібних повідомлень у 10,4 % випадків, на той час як при застосуванні диклофенаку — в 21,2 %, кетопрофену — в 21,7 %, а піроксикаму — у 18,6 %. Це одна з головних переваг німесуліду, оскільки розвиток патології травної системи є, безумовно, головним лімітуючим фактором при використанні НПЗП.
Іншою важливою фармакокінетичною особливістю німесуліду є дуже швидке досягнення максимальних концентрацій і короткий період напіввиведення [17]. Так, максимальна концентрація німесуліду в плазмі становить від 2,86 до 6,50 мг/л і досягається протягом 1,22–2,75 год після перорального прийому. Середній період напіврозпаду становить від 1,8 до 4,7 год, але при дворазовому призначенні препарату лейкоцитарна ЦОГ-2 пригнічується протягом 8 годин. Період напіввиведення становить від 1,8 до 4,73 год; у сечі й фекаліях німесулід визначається в мінімальних концентраціях, основний шлях його елімінації з організму — це метаболічна трансформація з утворенням 4'-гідроксипохідних, які також мають протизапальні й аналгетичні властивості, але меншою мірою.
Короткий період напіврозпаду німесуліду також дозволяє призначати його пацієнтам похилого віку з порушеннями функції нирок без ризику акумуляції в організмі [2]. Німесулід може застосовуватися у хворих з кліренсом креатиніну від 30 до 80 мл/хв без корекції дози. Повторний прийом препарату протягом 7 днів практично не викликає його кумуляції.
Швидкість настання аналгетичного ефекту в німесуліду заслужено вважається визначною — через 15–20 хв після прийому оральних форм. Це було яскраво доведено при широкому спектрі патологічних станів. Деякі автори обґрунтовано вважають, що німесулід своїми унікальними властивостями, які мають попит у клінічній практиці, більшою мірою зобов’язаний своїй фармакокінетиці й додатковим ефектам пригнічення ЦОГ-2 [9]. Не викликає сумнівів, що саме завдяки фармакокінетиці німесулід зарекомендував себе як препарат для швидкого усунення болю: німесулід швидко й повністю абсорбується у верхніх відділах шлунково-кишкового тракту, при цьому пік плазмової концентрації спостерігається вже до першої години після прийому ентеральних форм.
Німесулід пригнічує гіпералгезію в короткі для нестероїдних протизапальних засобів (і не тільки) терміни. Усі НПЗП викликають зменшення гіпералгезії, однак ефект німесуліду перевершує такий у рофекоксибу при порівняно однаковій ефективності з диклофенаком і целекоксибом [4]. Це дає підставу призначати німесулід перед оперативним втручанням і після нього.
У синовіальній рідині максимальна концентрація досягається аналогічно до концентрації в крові. Після прийому препарату протягом тижня в дозі 200 мг на добу німесулід затримується в синовіальній рідині протягом 12 год [9].
У 1994 р. була продемонстрована здатність німесуліду пригнічувати ЦОГ-2 при значно меншому впливі на ЦОГ-1, яка в подальшому була неодноразово підтверджена в дослідженнях in vitro [8, 9], ex vivo, а також in vivo [8]. Німесулід є переважно селективним препаратом щодо ЦОГ-2: у терапевтичних концентраціях він пригнічує 88 % активності ЦОГ-2 і 45 % активності ЦОГ-1 [17]. Саме таке співвідношення блокади ізоформ ЦОГ обумовлює швидке настання клінічного ефекту й низький ризик побічних ефектів. У даному випадку помірна селективність може бути перевагою порівняно з високою селективністю. Передбачається, що німесулід пригнічує ЦОГ-1 саме в вогнищі запалення і болю, що може мати особливу терапевтичну перевагу при відсутності впливу на ЦОГ-1 у шлунку й нирках [9].
Запалення супроводжується гіперпродукцією інтерлейкінів (ІЛ) 1 і 6, фактора некрозу пухлини альфа (ФНП-α); накопичені в ділянці тканинного запалення лімфогістіоцитарні клітини виділяють агресивні ферменти (матриксні металопротеїнази) й перекисні продукти, що ушкоджують клітини синовії, хряща й субхондральної кістки. Утворені при цьому алгогени стимулюють периферичні больові рецептори, а цитокіни й простагландини різко підвищують їх чутливість до больового порушення, що на піку запальної активності, яка припадає на другу половину ночі й ранні ранкові години, призводить до появи типового запального болю в пацієнтів із ревматичними захворюваннями суглобів.
Німесулід є препаратом з мультифакторним механізмом дії, яка не обмежується лише пригніченням ЦОГ-2 [15]. Численні різнопланові ефекти впливу німесуліду на механізми болю й запалення отримали наз-ву ЦОГ-незалежних ефектів [10, 19].
Так, німесулід пригнічує:
— агрегацію й міграцію нейтрофілів;
— продукцію й вивільнення гістаміну;
— утворення токсичних форм кисню;
— активність індуцибельної NO-синтетази (NOS);
— продукцію фактора активації тромбоцитів (PAF);
— синтез металопротеїназ (MMPs);
— вивільнення цитокінів (ІЛ-6);
— синтез і вивільнення субстанції Р;
— транслокацію епсилон-протеїнкінази С у сенсорних нейронах.
Особливо значущим ЦОГ-незалежним ефектом німесуліду є пригнічення активності NO-синтетази і, відповідно, утворення окису азоту й пероксинітриту (ОNOO-), які є ключовими медіаторами в процесі руйнування клітин організму. Під час досліджень було виявлено, що при остеоартрозі в хондроцитах збільшується утворення оксиду азоту (NO). З одного боку, це гальмує синтез матриксу й підсилює його деградацію. З іншого — взаємодія NO з гідроксильними радикалами й супероксид-аніоном призводить до утворення іншого радикала кисню — пероксинітриту (ONOO•), що підсилює ушкодження клітин й підвищує чутливість хондроцитів до цитокін-індукованого апоптозу [19]. Німесулід запобігає розвитку NO-індукованого ушкодження тканин двома способами. По-перше, препарат пригнічує активність NO-синтази, що призводить до зменшення утворення NO [16, 17]. По-друге, німесулід та його основний метаболіт захоплюють пероксинітрит, зменшуючи його шкідливу дію на клітини.
Німесулід пригнічує також активність 5-ліпоксигенази, знижуючи таким чином ризик виникнення запалення й виразок у шлунково-кишковому тракті, що додатково підвищує його гастроінтестинальну безпеку [12].
Важлива перевага німесуліду над іншими нестероїдними протизапальними засобами — здатність пригнічувати вивільнення гістаміну тучними клітинами [6]. Цей ефект має величезне значення, оскільки спектр дії гістаміну надзвичайно широкий, і вплив на його вироблення в ряді ситуацій може мати додаткове значення. Так, на відміну від індометацину, німесулід виявився здатним знижувати скорочення ізольованої
бронхіальної мускулатури людини у відповідь на вплив гістаміну. Крім того, у дослідах на свинях він зменшував бронхоконстрикцію, викликану ацетальдегідом [18]. Отже, німесулід є препаратом вибору за наявності у хворого астми, а також алергічних реакцій на інші НПЗП.
J. Pelletier і співавт. (1999) [13] продемонстрували, що в терапевтичних концентраціях німесулід, на відміну від напроксену, індукував внутрішньоклітинне фосфорилювання й активацію глюкокортикоїдних рецепторів, що приводить до зміни експресії глюкокортикоїдних генів-мішеней. Отже, одним із механізмів протизапальної активності німесуліду може бути також і вплив на глюкокортикоїдні рецептори.
Унікальною властивістю, що виділяє німесулід з усіх НПЗП, вважається його антицитокіновий ефект. За останніми даними встановлено, що німесулід пригнічує in vivo вивільнення ФНП-α й продукцію активного кисню — два ефекти, які роблять суттєвий внесок в протизапальну та аналгетичну дії препарату [9]. Саме ФНП-α є ключовим тригером у стимуляції утворення інших цитокінів гіпералгезії. На культурі синовіальних фібробластів у хворих на остеоартроз німесулід у терапевтичних концентраціях знижував синтез інтерлейкіну-6 та урокінази при підвищенні продукції інгібітору активатора плазміногену. Аналогічну дію мав і напроксен, однак для цього були потрібні більш високі дози препарату [14]. Такі особливості німесуліду, як активація синтезу інгібітору тканинного активатора плазміногену, блокування синтезу тромбоцит-активуючого фактора, є надзвичайно важливими для ортопедо-травматологічної групи хворих для запобігання післяопераційним тромбоемболічним ускладненням, що має особливе значення для пацієнтів із супутніми кардіоваскулярними захворюваннями [5].
Німесулід усуває пригнічувальний вплив інтерлейкіну-1 на синтез протеогліканів [16]. На відміну від індометацину, що значно ушкоджує хрящ, німесулід in vitro навіть у високих дозах не порушував синтез протеогліканів хондроцитами. Було також показано пригнічення виділення еластази та інших маркерів нейтрофільної дегрануляції, які підтримують деструкцію хряща при остеоартрозі.
Ці експериментальні дані знайшли підтвердження в клінічних дослідженнях, у яких призначення терапевтичних доз німесуліду призводило до значного зниження рівня матриксних металопротеїназ (ММП) у сироватці крові, зокрема матриксної металопротеїнази-3 (або стромелізину) [11]. Дослідження М. Bevilacqua і співавт. (2004) [3] також підтвердило, що у хворих знижується концентрація матриксної металопротеїнази-3 та гіалурону в сироватці крові при застосуванні німесуліду на відміну від хворих, які приймали ібупрофен. Отже, проведені дослідження свідчать про те, що німесулід знижує вміст MMП-2, MMП-3, MMП-8, MMП-9,
PAI-1, гіалуронату, COMP у плазмі крові або культурах суглобових клітин, що вказує на його здатність підтримувати нормальну анатомію та фізіологію хряща в пацієнтів з остеоартрозом. Ці факти в поєднанні з низьким ризиком розвитку ускладнень з боку шлунково-кишкового тракту є підставою для застосування німесуліду при остеоартрозі.
Поєднання таких властивостей німесуліду, як протизапальна, аналгетична й хондропротективна, є особливо важливим для ефективної боротьби з хронічними захворюваннями суглобів і опорно-рухового апарату в цілому.
Враховуючи наявність на ринку України оригінального німесуліду та його генериків, а також появу німесуліду вітчизняного виробника, ми вирішили порівняти ефективність деяких з них в однорідних клінічних групах.
Мета дослідження: оцінити ефективність та безпечність застосування препарату Німедар (курс 14 днів) порівняно з препаратом Німесил у системі лікування хворих на ранніх стадіях остеоартрозу колінного суглоба, остеохондрозу поперекового відділу хребта та в ранньому післяопераційному періоді після ендоскопічних втручань на колінному суглобі.
Матеріали та методи
За дизайном дане клінічне дослідження було проспективним. З метою оцінки ефективності препарату були сформовані клінічні групи хворих, ідентичних за характером та стадією захворювання, які за інформованою згодою включалися в дослідження. Дослідження проведено в центрі ортопедії, травматології та спортивної медицини клінічної лікарні «Феофанія» в грудні 2017 року.
Дослідження проведено за участю 70 пацієнтів. 30 хворих становили контрольну групу, 30 — дослідну групу, 10 — ретроспективну групу. Хворі контрольної групи отримували препарат німесил по 1 саше 2 рази на добу після прийому їжі, хворі дослідної групи отримували препарат Німедар по 1 саше 2 рази на добу після прийому їжі протягом 14 днів, хворі ретроспективної групи не отримували вказані препарати.
Кожна група була поділена на три підгрупи таким чином.
Першу підгрупу становили 10 хворих жіночої статі віком 40–50 років з остеоартрозом колінного суглоба 1-ї стадії та незначним синовітом.
Другу підгрупу становили 10 хворих чоловічої статі з остеохондрозом поперекового відділу хребта, наявністю больового синдрому без неврологічної симптоматики (перша група згідно з класифікацією захворювань хребта Квебекської спеціальної комісії) [11].
Третю підгрупу становили 10 хворих чоловічої статі віком 30–40 років із парціальним пошкодженням заднього рогу медіального меніска, яким була проведена артроскопічна резекція пошкодженої частини меніска. У дослідження включені лише хворі з клаптеподібним пошкодженням заднього рогу медіального меніска, що було діагностоване артроскопічно.
Ще 10 хворих чоловічої статі віком 30–40 років із парціальним пошкодженням заднього рогу медіального меніска, яким була проведена артроскопічна резекція пошкодженої частини меніска, становили ретроспективну групу для оцінки кількості введень знеболюючих препаратів після операції. Вони не отримували ні німесил, ні Німедар.
Пацієнти не мали інших системних захворювань, а також гострих патологічних процесів з боку печінки, нирок, серцево-судинної, ендокринної та нервової систем.
Перед включенням у групу дослідження, з метою визначення та уточнення діагнозу, всім хворим проводилися загальноклінічні лабораторні обстеження, що дало можливість провести диференціальну діагностику зі специфічними й неспецифічними запальними захворюваннями суглобів (ревматоїдний артрит, реактивний артрит тощо).
Усім хворим першої підгрупи (остеоартроз) виконували рентгенографію колінного суглоба в корональній, сагітальній та аксіальній проекціях, рентгенографію в корональній проекції з навантаженням, рентгенографію в проекції Розенберга та магнітно-резонансну томографію (МРТ) суглоба. Це дало можливість виключити з дослідження всіх хворих із підозрою на травматичні й дистрофічні зміни в суглобі.
Усім хворим другої підгрупи (остеохондроз поперекового відділу хребта) також виконували рентгенографію поперекового відділу хребта в корональній та сагітальній проекціях, функціональні рентгенограми в сагітальній проекції, МРТ поперекового відділу хребта. Це дало змогу виключити з дослідження хворих із наявністю спондилоартрозу, спондильозу й протрузіями міжхребцевих дисків.
Усім хворим третьої підгрупи (парціальне пошкодження заднього рогу медіального меніска) виконували рентгенографію колінного суглоба в корональній, сагітальній та аксіальній проекціях, рентгенографію в корональній проекції з навантаженням, рентгенографію в проекції Розенберга та МРТ суглоба. Це дало можливість виключити з дослідження всіх хворих із підозрою на дистрофічні зміни в суглобі та інші травматичні ушкодження.
Отже, ми сформували максимально однорідні підгрупи хворих у контрольній та досліджуваних групах.
Клінічне спостереження за хворими проводили в динаміці: до початку лікування та через 20–25 діб після початку лікування. Функціональний результат був тим кращим, чим меншою була вираженість ранкової скутості та функціональних розладів колінного суглоба у хворих 1-ї та 2-ї підгруп, чим нижчою була суб’єктивна оцінка больового синдрому за візуально-аналоговою шкалою (ВАШ) [20]. Візуально-аналогова шкала — метод суб’єктивної оцінки болю. Пацієнта просять відмітити на неградуйованій лінії довжиною 10 см точку, що відповідає ступеню вираженості болю. Ліва межа лінії відповідає визначенню «болю немає», права — «найгірший біль, який можна собі уявити». Як правило, використовують паперову, картонну або пластмасову лінійку довжиною 10 см. Зі зворотного боку лінійки нанесено сантиметрові поділки, за якими лікар відзначає отримане значення й заносить у лист спостереження. До безумовних переваг цієї шкали відносять її простоту й зручність. При динамічній оцінці зміни інтенсивності болю вважають об’єктивними й істотними, якщо значення ВАШ відрізняється від попереднього більше ніж на 13 мм.
Також оцінювали потребу в знеболювальних препаратах після операції у хворих третьої підгрупи.
Оцінювали появу небажаних реакцій у хворих. До небажаних побічних реакцій були включені: головний біль, порушення сну, безсоння, запаморочення, відчуття нудоти, біль і дискомфорт в епігастральній ділянці, метеоризм, діарея, запор, алергічні реакції.
Результати та обговорення
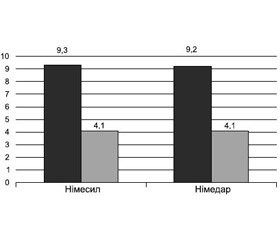
У першій підгрупі (жінки з ОА колінного суглоба 1-ї стадії) інтенсивність болю (за ВАШ) змінилась після прийому німесилу з 9,3 до 4,1 бала (різниця становила 5,2 бала). Після прийому Німедару інтенсивність болю (за ВАШ) змінилась з 9,2 до 4,1 бала, різниця становила 5,1 бала. Побічна реакція спостерігалась у вигляді нудоти в однієї пацієнтки, яка приймала Німедар.
У другій підгрупі (чоловіки з остеохондрозом поперекового відділу хребта) інтенсивність болю за ВАШ змінилась після прийому німесилу з 8,4 до 4,0 бала (різниця становила 4,4). Після прийому Німедару інтенсивність болю за ВАШ змінилась з 8,3 до 4,1 бала, різниця становила 4,2 бала. Побічні реакції не спостерігались у жодного хворого.
У третій підгрупі (чоловіки з парціальним пошкодженням заднього рогу медіального меніска, яким була проведена артроскопічна резекція пошкодженої частини меніска) інтенсивність болю за ВАШ зменшилася після прийому німесилу з 9,4 до 2,2 бала (різниця становила 7,2 бала). Після прийому Німедару інтенсивність болю за ВАШ зменшилася з 9,3 до 2,2 бала, різниця становила 7,1 бала. Побічні реакції у хворих цієї підгрупи також не спостерігались.
Хворим даної підгрупи менше вводилось знеболюючих препаратів, у тому числі й опіоїдів. Так, кількість введень знеболюючих препаратів у перші три дні після операції становила 1,4 на добу в обох підгрупах, а кількість введення опіоїдів становила 0,3 на добу на одного оперованого хворого. На той час як у хворих ретроспективної групи кількість введень знеболюючих становила 1,6 на добу, з них опіоїдів — 0,6.
Оцінюючи появу небажаних побічних реакцій, таких як головний біль, порушення сну, безсоння, запаморочення, відчуття нудоти, біль і дискомфорт в епігастральній ділянці, метеоризм, діарея, запор, алергічні реакції, ми виявили лише один випадок появи нудоти після прийому Німедару у хворої першої підгрупи, що була скорегована прийомом препарату. Тобто частота небажаних побічних реакцій після прийому німесилу становила 0 %, а після прийому Німедару — 0,3 %.
Висновки
Результати проведеного проспективного клінічного дослідження засвідчили ефективність застосування препарату Німедар — німесулід 100 мг/2 г у гранулах виробництва ПрАТ «Фармацевтична фірма «Дарниця» при лікуванні хворих з 1-ю стадією остеоартрозу колінного суглоба та остеохондрозу поперекового відділу хребта без неврологічних ознак. При спостереженні встановлено суттєве зменшення больового синдрому за ВАШ від сильного болю до його відсутності. У системі мультимодальної анестезії застосування препарату Німедар також привело до зменшення кількості введень анестетиків після проведення артроскопічних втручань та позитивної динаміки больового синдрому. Отриманий ефект від застосування препарату Німедар не поступався ефекту від застосування препарату німесил.
Характер та частота виникнення побічних реакцій у групі спостереження засвідчили, що при застосуванні Німедару спорадичні випадки побічних ефектів повністю усувалися корекцією режиму застосування та дієтою й не потребували припинення лікування, що підтверджує безпечність застосування даного препарату у хворих на остеоартроз із наявністю коморбідних станів.
На підставі отриманих результатів можна зробити висновок, що препарат Німедар виявляє ефективну знеболювальну та протизапальну дію, має високий профіль безпеки, що дозволяє застосовувати його в системі лікування та профілактики дегенеративно-дистрофічних захворювань хребта й суглобів та системі мультимодальної анестезії після ендоскопічних операцій на суглобах.
Застосування препарату Німедар у системі мультимодальної анестезії після інших ортопедо-травматологічних операцій вимагає подальших досліджень.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Bennet A., Villa G. Nimesulide: an NSAID that preferentially inhibits COX-2, and has various unique pharmacological activities // Exp. Opin. Pharmacother. — 2000. — 1. — 277-286.
2. Bernareggi A. Clinical pharmacokinetics of nimesulide // Clin. Pharmacokinet. — 1998. — 35(4). — 247-274.
3. Bevilacqua M., Devogelaer J.P., Righini V., Famaey J.P., Manicourt D.H. Effect of nimesulide on the serum levels of hyaluronan and stromelysin-1 in patients with osteoarthritis: a pilot study // Int. J. Clin. Pract. Suppl. — 2004. — 144. — 13-19.
4. Bianchi M., Ferrario P., Balzarini P., Broggini M. Plasma and synovial fluid concentrations of nimesulide and its main metabolite after a single or repeated oral administration in patients with knee osteoarthritis // J. Int. Med. Res. — 2006. — 34. — 348-354.
5. Bloodsworth A., O’Donnell V.B., Freeman B.A. Nitric oxide regulation of free radical and enzyme mediated lipid and lipoprotein oxidation // Aterioscler. Thromb. Vasc. Biol. — 2000. — 20(7). — 1707-1715.
6. Casolaro V., Meliota S., Marino O. et al. Nimesulide, a sulfonanilide nonsteroidal anti-inflammatory drug, inhibits mediator release from human basophils and mast cells // J. Pharmacol. Exp. Ther. — 1993. — 267(3). — 1375-85.
7. Conforti A., Leone R., Moretti U., Mozzo F., Velo G. Adverse drug reactions related to the use of NSAIDs with a focus on nimesulide: results of spontaneous reporting from a Northern Italian area // Drug Saf. — 2001. — 24(14). — 1081-1090.
8. Famaey J.P. In vitro and in vivo pharmacological evidence of selective cyclooxygenase-2 inhibition by nimesulide: an overview // Inflamm. Res. — 1997. — 46. — 437-46.
9. Grossman C.J., Wiseman J., Lucas F.S. et al. Inhibition of constitutive and inducible cyclo-oxygenase activity in human platelets and mononuclear cells by NSAIDs and COX 2 inhibitors // Inflam. Res. — 1995. — 44. — 253-7.
10. Henrotin Y.E., Labasse A.H., Simonis P.E. et al. Effects of nimesulide and sodium diclofenac on interleukin-6, interleukin-8, proteoglycans and prostaglandin E2 production by human articular chondrocytes in vitro // Clin. Exp. Rheumatol. — 1999. — 17. — 151-160.
11. Kullich W.C., Niksic F., Klein G. Effect of nimesulide on metalloproteinases and matrix degradation in osteoarthritis: a pilot clinical study // Int. J. Clin. Pract. Suppl. — 2002. — 128. — 24-29.
12. Laporte J.R., Ibanez L., Vidal X. et al. Upper gastrointestinal bleedings, associated with the use of NSAIDs: newer versus older agents // Drug. Saf. — 2004. — 27(6). — 411-420.
13. Pelletier J.P., Di Battista J.A., Zhang M. et al. Effect of nimesulide on glucocorticoid receptor activity in human synovial fibroblasts // Rheumatology. — 1999. — 38 (Suppl. 1). — 11-13.
14. Pelletier J.P., Mineau F., Fernandes J.C. et al. Two NSAIDs, nimesulide and naproxen, can reduce the synthesis of urokinase and IL-6 while increasing PAI-1, in human OA synovial fibroblasts // Clin. Exp. Rheumatol. — 1997. — 15. — 393-398.
15. Rainsford K. and Members of the Consensus Report Group on Nimesulide. Nimesulide — a multifactorial approach to inflammation and pain: scientific and clinical consensus // Current Medical Research and Opinion. — 2006. — 22(2). — 1161-1170.
16. Rainsford K.D. Nimesulide: overview of properties and applications // Drugs of Today. — 2001. — 37 (Suppl. B). — 3-7.
17. Rainsford K.D. Relationship of nimesulide safety to its pharmacokinetics: assessment of adverse reactions // Rheumatol. (Oxford). — 1999. — 38 (Suppl. 1). — 4-10.
18. Rossoni G., Berti F., Buschi A. et al. New data concer-ning the antianaphylactic and antihistaminic activity of nimesulide // Drugs. — 1993. — 46 (Suppl. 1). — 22-28.
19. Scher J.U., Pillinger M.H., Abramson S.B. Nitric oxide synthases and osteoarthritis // Curr. Rheumatol. Rep. — 2007. — 9(1). — 9-15.
20. Кузьменко В.В., Фокин В.А., Маттис Э.Р., Соков Е.Л., Бармотин Г.В., Назарова Т.Б. Психологические методы количественной оценки боли // Советская медицина. — 1986. — 10. — С. 44-48.
21. Atlas S.J. The Quebec Task Force classification for Spinal Disorders and severity,treatment and outcomes of shiatica and lumbar spinal stenosis / S.J. Atlas, R.A. Deyo, D.L. Patrick et al. // Spine. — 1996. — Vol. 21. — P. 2885-2892.

/43-1.jpg)